Агрегатное состояние металлов при комнатной температуре
Обновлено: 18.05.2024
Учитель: Металлов в периодической системе Д.И. Менделеева гораздо больше чем неметаллов, их 88, они расположены ниже диагонали B-At и четные ряды больших периодов.
В периодах, с ростом заряда атомных ядер металлические свойства убывают, так как растет число электронов на внешнем энергетическом уровне, радиус атомов уменьшается и следовательно металлические свойства убывают, как мы уже ранее отмечали.
В главных подгруппах с ростом зарядов атомных ядер растет число энергетических уровней и усиливаются металлические свойства.
И так, большинство встречающихся в природе простых веществ- металлы. Мы их встречаем в повседневной жизни: автомобили, металлические конструкции зданий, сооружений (мостов), самолето- и ракетостроение, сельскохозяйственные машины, в быту, ювелирные украшения и т.д.
Демонстрируем коллекцию металлов.
Познакомимся с физическими свойствами металлов, которые позволяют их использовать в народном хозяйстве:
- агрегатное состояние- твердые кроме ртути, при обычных условиях- это жидкость;
- твердые;
- гибкость, ковкость, пластичность (демонстрирую гибкость Al фольги);
- tпл.- различны;
- тепло-электропроводимость;
- пластичность.
Запишем выводы по физическим свойствам.
И еще, металлы звенят- это свойство используется для изготовления колокольчиков и колоколов. Самые звонкие- Ag; Au; Cu (серебро, золото, медь). Cu (медь) звенит густым, гудящим звоном, “ малиновым”. Это образное выражение произошло не от названия ягоды, а в честь голландского города Малина, откуда доставляли первые церковные колокола.
Демонстрируем звон Cu-Sn (валдайского колокольчика); Au - (обручального кольца) золота, стального колокольчика.
Потом русские мастера стали лить колокола свои, даже лучшего качества. Некоторые металлы (Ni ; Na; K; Ca; Ba) не хранят на открытом воздухе, так как они очень активные. Их хранят по особому - в керосине в стеклянной баночке, асбестовой крошке, в жестяной банке в сейфе под замком. Для металлов характерно явление аллотропии.
Демонстрируем “оловянную чуму”: оловянная проволока заранее подготовленная в холодильнике.
Незнание и непонимание химии привело к гибели экспедицию Р.Скотта на Южном полюсе, который потерял все горючее, так как оно хранилось в баках, запаянных оловом.
Способность элемента образовывать несколько простых веществ при определенных условиях называется “аллотропией”, а простые вещества - аллотропными модификациями.
- Sn (олово) - пограничный металл, его аллотропные модификации ярко показывают насколько условно деление элементов на металлы и неметаллы.
- B-Sn (белое олово) - типичный металл.
- L-Sn (серое олово) - неметалл, серый порошок
- При комнатной температуре металлы - твердые вещества, за исключением ртути (она жидкая)
- Большинство металлов серебристо-серого цвета с разными оттенками, за исключением золота, меди.
- Все металлы имеют характерный блеск, называемый металлическим блеском.
- Металлы хорошо проводят тепло и электричество.
- Металлы различаются по твердости и сильно различаются по температуре плавления.
- Металлы гибкие и ковкие.
- Металлы значительно различаются по плотности, например: плотность натрия 0,97 г/см 3 ,а плотность платины 21,45 г/см 3
- Упражнения для закрепления.
Упражнение 1. Заполните пропуски, используя нужные слова и выражения.
- При комнатной температуре металлы находятся в…… агрегатном состоянии, за исключением…………;
- Они ………, за исключением……… и меди;
- Они обладают характерным…………;
- Они хорошо проводят……….. и электричество.
Упражнение 2. Какой металл обладает серебристо-белым цветом и используется для изготовления кастрюль и пищевой фольги (железо, цинк, серебро, алюминий)?
Упражнение 3. Благодаря какому свойству медь можно использовать для изготовления электрических проводов?
- красно-коричневый цвет;
- металлический блеск;
- ковкость;
- электропроводность
Упражнение 4. Какие из приведенных ниже свойств позволяют нам классифицировать вещество как металл?
АГРЕГАТНОЕ СОСТОЯНИЕ ВЕЩЕСТВ
Агрегатное состояние – это состояние вещества в определенном интервале температур и давлений, характеризуется свойствами: способностью (твердое тело) или неспособностью (жидкость, газ) сохранять объем и форму; наличием или отсутствием дальнего (твердое тело) или ближнего (жидкость) порядка и другими свойствами.
Вещество может находиться в трех агрегатных состояниях: твердом, жидком или газообразном, в настоящее время выделяют дополнительно плазменное (ионное) состояние.
В газообразном состоянии расстояние между атомами и молекулами вещества велико, силы взаимодействия малы и частицы, хаотично перемещаясь в пространстве, обладают большой кинетической энергией, превышающей потенциальную энергию. Материал в газообразном состоянии не имеет ни своей формы, ни объема. Газ заполняет все доступное пространство. Это состояние свойственно для веществ с малой плотностью.
В жидком состоянии сохраняется лишь ближний порядок атомов или молекул, когда в объеме вещества периодически возникают отдельные участки с упорядоченным расположением атомов, однако взаимная ориентация этих участков также отсутствует. Ближний порядок неустойчив и под действием тепловых колебаний атомов может либо исчезать, либо возникать вновь. Молекулы жидкости не имеют определенного положения, и в то же время им недоступна полная свобода перемещения. Материал в жидком состоянии своей формы не имеет, сохраняет лишь объем. Жидкость может занимать только часть объема сосуда, но свободно перетекать по всей поверхности сосуда. Жидкое состояние обычно считают промежуточным между твердым телом и газом.
В твердом веществе порядок расположения атомов становится строго определенным, закономерно упорядоченным, силы взаимодействия частиц взаимно уравновешены, поэтому тела сохраняют свою форму и объем. Закономерно упорядоченное расположение атомов в пространстве характеризует кристаллическое состояние, атомы образуют кристаллическую решетку.
Твердые тела имеют аморфное или кристаллическое строение. Для аморфных тел характерен только ближний порядок в расположении атомов или молекул, хаотичное расположение атомов, молекул или ионов в пространстве. Примерами аморфных тел являются стекло, пек, вар, внешне находящиеся в твердом состоянии, хотя на самом деле они медленно текут, подобно жидкости. Определенной температуры плавления у аморфных тел, в отличие от кристаллических, нет. Аморфные тела занимают промежуточное положение между кристаллическими твердыми телами и жидкостями.
Большинство твердых тел имеет кристаллическое строение, которое отличается упорядоченным расположением атомов или молекул в пространстве. Для кристаллической структуры свойственен дальний порядок, когда элементы структуры периодически повторяются; при ближнем порядке такое правильное повторение отсутствует. Характерной особенностью кристаллического тела является способность сохранять форму. Признаком идеального кристалла, моделью которого служит пространственная решетка, является свойство симметрии. Под симметрией понимается теоретическая способность кристаллической решетки твердого тела совмещаться самой с собой при зеркальном отражении ее точек от некоторой плоскости, называемой плоскостью симметрии. Симметрия внешней формы отражает симметрию внутренней структуры кристалла. Кристаллическую структуру имеют, например, все металлы, для которых характерны два типа симметрии: кубическая и гексагональная.
В аморфных структурах с неупорядоченным распределением атомов свойства вещества в разных направлениях одинаковы, т. е стеклообразные (аморфные) вещества изотропны.
Для всех кристаллов характерна анизотропия. В кристаллах расстояния между атомами упорядочены, но в разных направлениях степень упорядоченности может быть неодинаковой, что приводит к различию свойств вещества кристалла в разных направлениях. Зависимость свойств вещества кристалла от направления в его решетке называют анизотропией свойств. Анизотропия проявляется при измерении как физических, так и механических и других характеристик. Существуют свойства (плотность, теплоемкость), не зависящие от направления в кристалле. Большинство же характеристик зависит от выбора направления.
Измерить свойства возможно у объектов, имеющих определенный материальный объем: размеры – от нескольких миллиметров до десятков сантиметров. Эти объекты со строением, идентичным кристаллической ячейке, называются монокристаллами.
Анизотропия свойств проявляется в монокристаллах и практически отсутствует в поликристаллическом веществе, состоящем из множества мелких хаотично ориентированных кристаллов. Поэтому поликристаллические вещества называют квазиизотропными.
Кристаллизация полимеров, молекулы которых могут располагаться упорядоченно с образованием надмолекулярных структур в виде пачек, клубков (глобул), фибрилл и пр., происходит в определенном интервале температур. Сложное строение молекул и их агрегатов определяет специфику поведения полимеров при нагреве. Они не могут перейти в жидкое состояние с низкой вязкостью, не имеют газообразного состояния. В твердом виде полимеры могут находиться в стеклообразном, высокоэластическом и вязкотекучем состояниях. Полимеры с линейными или разветвленными молекулами при изменении температуры могут переходить из одного состояния в другое, что проявляется в процессе деформации полимера. На рис. 9 приведена зависимость деформации от температуры.
Рис. 9 Термомеханическая кривая аморфного полимера: tc, tт, tр – температуры стеклования, текучести и начала химического разложения соответственно; I - III – зоны стеклообразного, высокоэластического и вязкотекучего состояния соответственно; Δl – деформация.
Пространственная структура расположения молекул определяет только стеклообразное состояние полимера. При низких температурах все полимеры деформируются упруго (рис. 9, зона I). Выше температуры стеклования tc аморфный полимер с линейной структурой переходит в высокоэластическое состояние (зона II), и его деформация в стеклообразном и высокоэластическом состояниях обратима. Нагрев выше температуры текучести tт переводит полимер в вязкотекучее состояние (зона III). Деформация полимера в вязкотекучем состоянии необратима. Аморфный полимер с пространственной (сетчатой, сшитой) структурой не имеет вязкотекучего состояния, температурная область высокоэластического состояния расширяется до температуры разложения полимера tр. Такое поведение характерно для материалов типа резин.
Температура вещества в любом агрегатном состоянии характеризует среднюю кинетическую энергию его частиц (атомов и молекул). Эти частицы в телах обладают в основном кинетической энергией колебательных движений относительно центра равновесия, где энергия минимальна. При достижении некоторой критической температуры твердый материал теряет свою прочность (устойчивость) и расплавляется, а жидкость превращается в пар: кипит и испаряется. Этими критическими температурами являются температуры плавления и кипения.
При нагреве кристаллического материала при определенной температуре молекулы двигаются настолько энергично, что жесткие связи в полимере нарушаются и кристаллы разрушаются – переходят в жидкое состояние. Температура, при которой кристаллы и жидкость находятся в равновесии, называется точкой плавления кристалла, или точкой затвердевания жидкости. Для иода эта температура равна 114 о С.
Каждый химический элемент обладает индивидуальной температурой плавления tпл, разделяющей существование твердого тела и жидкости, и температурой кипения tкип, соответствующей переходу жидкости в газ. При этих температурах вещества находятся в термодинамическом равновесии. Изменение агрегатного состояния может сопровождаться скачкообразным изменением свободной энергии, энтропии, плотности и других физических величин.
Для описания различных состояний в физике используется более широкое понятие термодинамической фазы. Явления, описывающие переходы из одной фазы в другую, называют критическими.
При нагревании вещества претерпевают фазовые превращения. Медь при плавлении (1083 о С) превращается в жидкость, в которой атомы имеют только ближний порядок. При давлении 1 атм медь кипит при 2310 о С и превращается в газообразную медь с беспорядочно расположенными атомами меди. В точке плавления давления насыщенного пара кристалла и жидкости равны.
Материал в целом представляет собой систему.
Система – группа веществ, объединенных физическими, химическими или механическими взаимодействиями. Фазой называют однородную часть системы, отделенную от других частей физическими границами раздела (в чугуне: графит + зерна железа; в воде со льдом: лед + вода). Составные части системы – это различные фазы, образующие данную систему. Компоненты системы – это вещества, образующие все фазы (составные части) данной системы.
Материалы, состоящие из двух и более фаз, представляют собой дисперсные системы. Дисперсныесистемы разделяют на золи, поведение которых напоминает поведение жидкостей, и гели с характерными свойствами твердых тел. В золях дисперсионной средой, в которой распределено вещество, является жидкость, в гелях преобладает твердая фаза. Гелями являются полукристаллический металл, бетон, раствор желатина в воде при низкой температуре (при высокой температуре желатин переходит в золь). Гидрозолем называют дисперсию в воде, аэрозолем – дисперсию в воздухе.
Диаграммы состояния.
В термодинамической системе каждая фаза характеризуется такими параметрами, как температура Т, концентрация с и давление Р. Для описания фазовых превращений используется единая энергетическая характеристика – свободная энергия Гиббса ΔG (термодинамический потенциал).
Термодинамика при описании превращений ограничивается рассмотрением состояния равновесия. Равновесное состояние термодинамической системы характеризуется неизменностью термодинамических параметров (температуры и концентрации, так как в технологических обработках Р = const) во времени и отсутствием в ней потоков энергии и вещества – при постоянстве внешних условий. Фазовое равновесие – равновесное состояние термодинамической системы, состоящей из двух или большего числа фаз.
Для математического описания условий равновесия системы существует правило фаз, выведенное Гиббсом. Оно связывает число фаз (Ф) и компонентов (К) в равновесной системе с вариантностью системы, т. е. числом термодинамических степеней свободы (С).
Число термодинамических степеней свободы (вариантность) системы – это число независимых переменных как внутренних (химический состав фаз), так и внешних (температура), которым можно придавать различные произвольные (в некотором интервале) значения так, чтобы не появились новые и не исчезли старые фазы.
Уравнение правила фаз Гиббса:
В соответствии с этим правилом в системе из двух компонентов (К = 2) возможны следующие варианты степеней свободы:
- для однофазного состояния (Ф = 1) С = 2, т. е. можно менять температуру и концентрацию;
- для двухфазного состояния (Ф = 2) С = 1, т. е. можно менять только один внешний параметр (например, температуру);
- для трехфазного состояния число степеней свободы равно нулю, т. е. нельзя менять температуру без нарушения равновесия в системе (система нонвариантна).
Например, для чистого металла (К = 1) во время кристаллизации, когда имеются две фазы (Ф = 2), число степеней свободы равно нулю. Это означает, что температура кристаллизации не может быть изменена, пока не закончится процесс и не останется одна фаза – твердый кристалл. После окончания кристаллизации (Ф = 1) число степеней свободы равно 1, поэтому можно менять температуру, т. е. охлаждать твердое вещество, не нарушая равновесия.
Поведение систем в зависимости от температуры и концентрации описывается диаграммой состояния. Диаграмма состояния воды — система с одним компонентом H2O, поэтому наибольшее число фаз, которые одновременно могут находиться в равновесии, равно трем (рис. 10). Эти три фазы — жидкость, лед, пар. Число степеней свободы в этом случае равно нулю, т.е. нельзя изменить ни давление, ни температуру, чтобы не исчезла ни одна из фаз. Обычный лед, жидкая вода и водяной пар могут существовать в равновесии одновременно только при давлении 0,61 кПа и температуре 0,0075°С. Точка сосуществования трех фаз называется тройной точкой (O).
Кривая ОС разделяет области пара и жидкости и представляет собой зависимость давления насыщенного водяного пара от температуры. Кривая ОС показывает те взаимосвязанные значения температуры и давления, при которых жидкая вода и водяной пар находятся в равновесии друг с другом, поэтому она называется кривой равновесия жидкость — пар или кривой кипения.
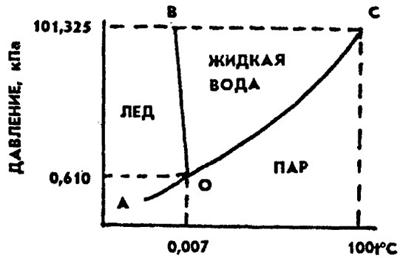
Рис 10 Диаграмма состояния воды
Кривая ОВ отделяет область жидкости от области льда. Она является кривой равновесия твердое состояние — жидкость и называется кривой плавления. Эта кривая показывает те взаимосвязанные пары значений температуры и давления, при которых лед и жидкая вода находятся в равновесии.
Кривая OA называется кривой сублимации и показывает взаимосвязанные пары значений давления и температуры, при которых в равновесии находятся лед и водяной пар.
Диаграмма состояния — наглядный способ представления областей существования различных фаз в зависимости от внешних условий, например от давления и температуры. Диаграммы состояния активно используются в материаловедении на разных технологических этапах получения изделия.
Жидкость отличается от твердого кристаллического тела малыми значениями вязкости (внутреннего трения молекул) и высокими значениями текучести (величина, обратная вязкости). Жидкость состоит из множества агрегатов молекул, внутри которых частицы расположены в определенном порядке, подобно порядку в кристаллах. Природа структурных единиц и межчастичного взаимодействия определяет свойства жидкости. Различают жидкости: моноатомные (сжиженные благородные газы), молекулярные (вода), ионные (расплавленные соли), металлические (расплавленные металлы), жидкие полупроводники. В большинстве случаев жидкость является не только агрегатным состоянием, но и термодинамической (жидкой) фазой.
Жидкие вещества чаще всего представляет собой растворы. Раствор однороден, но не является химически чистым веществом, состоит из растворенного вещества и растворителя (примеры растворителя – вода или органические растворители: дихлорэтан, спирт, четыреххлористый углерод и др.), поэтому представляет собой смесь веществ. Пример – раствор спирта в воде. Однако растворами также являются смеси газообразных (например, воздух) или твердых (сплавы металлов) веществ.
При охлаждении в условиях малой скорости образования центров кристаллизации и сильного увеличения вязкости может возникнуть стеклообразное состояние. Стекла – это изотропные твердые материалы, получаемые переохлаждением расплавленных неорганических и органических соединений.
Известно много веществ, переход которых из кристаллического состояния в изотропное жидкое осуществляется через промежуточное жидкокристаллическое состояние. Оно характерно для веществ, молекулы которых имеют форму длинных стержней (палочек) с асимметричным строением. Такие фазовые переходы, сопровождаемые тепловыми эффектами, вызывают скачкообразное изменение механических, оптических, диэлектрических и других свойств.
Жидкие кристаллы, подобно жидкости, могут принимать форму удлиненной капли или форму сосуда, обладают высокой текучестью, способны к слиянию. Они получили широкое применение в разных областях науки и техники. Их оптические свойства сильно зависят от небольших изменений внешних условий. Эта особенность используется в электрооптических устройствах. В частности, жидкие кристаллы применяют при изготовлении электронных наручных часов, визуальной аппаратуры и др.
К числу основных агрегатных состояний относится плазма – частично или полностью ионизированный газ. По способу образования различают два вида плазмы: термическую, возникающую при нагревании газа до высоких температур, и газообразную, образующуюся при электрических разрядах в газовой среде.
Плазмохимические процессы заняли прочное место в ряде отраслей техники. Они применяются для резки и сварки тугоплавких металлов, синтеза разных веществ, широко используют плазменные источники света, перспективно применение плазмы в термоядерных энергетических установках и пр.
Чем в химии отличаются металлы и неметаллы, есть ли разница – сравнение
Химики делят все простые вещества на металлы и неметаллы. Они имеют большую разницу. При этом далеко не всем известно, чем конкретно отличаются металлы от неметаллов. Разница касается структуры, физических характеристик и химических свойств. Многие вещества удается определить визуально. Однако этот метод сложно назвать достоверным. Чтобы не допустить ошибку, стоит опираться на четкие признаки, характерные для рассматриваемых веществ.
Определение неметаллов
Под этим термином понимают элементы, которые принимают электроны на внешний энергетический уровень. Они могут обладать различными агрегатными состояниями. Так, кислород и азот представляют собой газы, а бром – жидкость. Твердыми веществами являются углерод, бор, мышьяк.
Понятие металлов
В это понятие входят элементы, которые отдают электроны с внешнего энергетического уровня. Чаще всего они представлены в твердом агрегатном состоянии. Единственным исключением считается ртуть. При нормальных условиях она представляет собой жидкость.
Как отличить металл от неметалла в химии?
Важным различием между рассматриваемыми элементами считается положение в таблице Менделеева. Чтобы определить разновидность вещества, стоит провести диагональную линию от бора до астата.
Элементы, которые находятся выше черты, считаются неметаллами, а ниже – металлами. При этом все химические вещества побочных подгрупп представляют собой только металлы. Таким образом, можно увидеть, что количество металлических элементов в таблице значительно больше.
В основной подгруппе первой группы присутствуют щелочные металлы. К ним относят литий, рубидий, натрий. Также туда входят калий, фраций, цезий, калий. Эти элементы получили такое название, поскольку при растворении в воде они формируют щелочи. При этом образуются растворимые гидроксиды.
Для щелочных металлов характерна электронная конфигурация внешнего энергетического уровня ns1. Это означает, что на наружной оболочке присутствует один валентный электрон. Отдавая его, вещества проявляют восстановительные характеристики.
В основную подгруппу второй группы входят щелочноземельные металлы. К ним относятся магний, радий, барий. Также в эту группу входят стронций, бериллий, кальций. Эти вещества отличаются серым окрасом. При комнатной температуре они имеют твердую консистенцию. На внешнем энергетическом уровне эта разновидность металлов отличается электронной конфигурацией ns2.

Вещества, которые входят в побочные подгруппы, считаются переходными металлами. В атомах этих элементов присутствуют валентные электроны, которые располагаются на d-орбиталях и f-орбиталях.
Для переходного подтипа характерны переменные уровни окисления. В низших степенях они проявляют основные характеристики, в промежуточных – амфотерные, а в высших – кислотные.
В верхнем правом углу периодической системы Менделеева находятся неметаллы. На внешнем энергетическом уровне атомы этих элементов содержат много электронов. Потому им выгоднее принимать дополнительные электроны, нежели отдавать свои собственные.
Во втором периоде находятся вещества от бора до неона, в третьем – от кремния до аргона. Четвертый период включает элементы от мышьяка до криптона. К пятому периоду относятся йод, ксенон и теллур, к шестому – радон и астат. Гелий и водород тоже считаются неметаллами.
Важным отличием рассматриваемых веществ считается строение их атомов. При этом стоит учитывать количество электронов на внешнем энергетическом уровне. У атомов металлов оно составляет от 1 до 3. Обычно для них характерен больший радиус. Атомы металлов беспрепятственно отдают наружные электроны, поскольку отличаются выраженными восстановительными характеристиками.
Неметаллы отличаются большим числом электронов на внешнем уровне. С этим связана их окислительная активность. Неметаллы притягивают электроны, которых им не хватает. Как следствие, энергетический уровень полностью заполняется. Наиболее выраженные окислительные свойства характерны для неметаллов второго и третьего периода шестой и седьмой групп.
Для полного энергетического уровня характерно 8 электронов. Наибольшей окислительной способностью отличаются галогены, которые имеют валентность I. Лидирующие позиции среди них занимает фтор, поскольку это вещество лишено свободных орбиталей.
Рассматриваемые вещества отличаются по структуре. На физические свойства элементов влияет порядок размещения элементарных частиц. Если условно соединить их воображаемыми линиями, удастся получить структуру, которая называется кристаллической решеткой. В ней могут присутствовать разные элементы – молекулы или атомы. Также в структуру входят ионы, которые представляют собой заряженные частицы.
У отдельных неметаллов образуется атомная кристаллическая решетка. Ее частицы соединяются ковалентными связями. Вещества с такой структурой бывают твердыми и нелетучими. К ним, в частности, относят кремний, графит, фосфор.
Для молекулярной кристаллической решетки характерна более слабая связь между элементарными частицами. Как правило, такие неметаллы представлены в виде газа или жидкости. Иногда это могут быть твердые легкоплавкие неметаллы.

При этом часть атомов любых металлов теряет наружные электроны. Этот процесс сопровождается их превращением в катионы, которые представляют собой положительно заряженные частицы. Они опять соединяются с электронами и формируют нейтрально заряженные элементы. Таким образом, в металлической решетке одновременно присутствуют атомы, электроны и катионы.
Отличаются и физические свойства рассматриваемых веществ. Основной характеристикой считается агрегатное состояние. Традиционно все металлы представляют собой твердые вещества. Исключением является лишь ртуть, которая является тягучей серебристой жидкостью. Ее пары считаются токсичным веществом, которое провоцирует интоксикацию организма.
Еще одной отличительной особенностью таких веществ считается металлический блеск. Это обусловлено тем, что поверхность металла отражает свет. Также для этих веществ характерна тепло- и электропроводность. Эта особенность связана с наличием в металлических решетках свободных электронов. В электрическом поле они начинают направленное движение. Ток и тепло лучше всего проводит ртуть. При этом наименьшие показатели характерны для серебра.
Металлическая связь делает вещества ковкими и пластичными. По этим параметрам лидирующие показатели занимает золото. Из него удается раскатать пластину, толщина которой не превышает человеческий волос.
Чаще всего металлы и неметаллы обладают противоположными физическими свойствами. Так, для неметаллов характерны невысокие параметры электро- и теплопроводности. К тому же они отличаются отсутствием металлического блеска.
В обычных условиях неметаллы имеют жидкое или газообразное состояние. Твердые вещества всегда отличаются хрупкостью и легкоплавкостью. Это связано с молекулярным строением веществ. Кремний, алмаз и красный фосфор считаются нелетучими и тугоплавкими элементами, которые характеризуются немолекулярным строением.

Сравнительная таблица
Ключевые особенности веществ сведены в таблицу:
| Свойства | Металлы | Неметаллы |
| Агрегатное состояние при комнатной температуре | Твердое, кроме ртути | Твердое, жидкое, газообразное |
| Цвет | Серебристо-белый или серебристо-серый, кроме меди и золота | Разный – желтый, желто-зеленый, красно-бурый |
| Блеск | Металлический | Отсутствует |
| Ковкость | Хорошая | Отсутствует |
| Теплопроводность | Хорошая | Только углерод |
| Электропроводность | Хорошая | Только углерод и черный фосфор |
Выводы
Металлы и неметаллы имеют много отличий. Они затрагивают строение кристаллической решетки, физические характеристики и химические свойства.

Закончила Национальный университет кораблестроения, специальность "Экономика предприятия"
Читайте также:
