Агрессивные среды для металлов
Обновлено: 17.05.2024
В отличие от механических нагрузок на конструкции инженерных сооружений, определяемых по правилам строительной механики с достаточной степенью точности, «нагрузки» от физико-химических воздействий, или, точнее, вызываемые ими внутренние напряжения в материале могут быть оценены только весьма приближенно. Происходит это потому, что физико-химические воздействия чрезвычайно разнообразны и изменчивы. К тому же агрессивность таких воздействий, наибольшая в месте непосредственного контакта конструкции со средой, обычно резко падает с удалением от поверхности в глубь конструкции и не может быть усреднена. Расчеты же вероятной стойкости материалов в различных средах делаются только на основе огромного количества опытных данных. Более детально разработаны лишь теоретические основы коррозии металлов.
Между тем даже такие воздействия, как насыщенный влагой воздух, могут относительно быстро — за 10—15 лет — приводить целые здания в аварийное состояние. Многие конструктивные элементы зданий — фундаменты под кислотные насосы, некоторые участки полов и т. п. — требуют ремонта или восстановления ежегодно, а иногда и чаще.
Воздействия среды на материал могут быть:
1) агрессивными, т. е. рано или поздно приводящими материал к разрушению. Вещества или явления (например, повышение температуры), способствующие протеканию разрушающих (коррозионных) процессов, называют стимуляторами коррозии;
2) стабилизирующими, т. е. способствующими сохранению конструкции на более или менее длительный срок; вещества или явления, затрудняющие или замедляющие процессы коррозии, называются пассиваторами или ингибиторами коррозии;
3) упрочняющими или способствующими упрочнению, уплотнению и повышению стойкости материала.
Понятия об агрессивности или пассивности отдельных компонентов среды не имеют универсального характера, т. е. воздействие одного и того же реагента на разные материалы может быть или агрессивным или упрочняющим. Так, например, теплый влажный воздух весьма агрессивен по отношению к незащищенной стали, но он же упрочняет цементный бетон.
Часто действие одного и того же вещества в начальный период носит упрочняющий характер, а затем становится агрессивным. Таково, например, действие слабых кислот или кислых газов на бетон. В зависимости от концентрации аналогично действуют и некоторые другие вещества. Так, небольшие добавки к цементу сернокислого кальция регулируют скорость схватывания цементного теста и способствуют ускорению его твердения, а повышенные добавки той же соли могут вызвать снижение прочности и разрушение цементного камня в бетоне или растворе.
Пассивирующее или замедляющее действие на процессы коррозии очень часто оказывают продукты взаимодействия материала и среды, образующиеся на поверхности их раздела. Защитное действие этих новообразований, часто выделяющихся в виде пленок, будет тем больше, чем большей плотностью и стойкостью в данной среде характеризуются они сами и чем выше их сцепление с поверхностью непрокорродировавшего материала. Общеизвестна, например, защитная роль тончайшей пленки окиси алюминия и отсутствие такой защитной функции у пленок окислов железа, образующихся на поверхности этих металлов в атмосферных условиях.
Очень важна устойчивость (в частном случае действия водной среды — малая растворимость) продуктов взаимодействия материала и среды.
Агрегатное состояние среды имеет существенное значение для развития коррозионных процессов.
Действующая на конструкции среда может быть:
1) газообразной в виде смеси воздуха, газов, водяных паров и паров других летучих веществ;
2) жидкой в виде технологических растворов, конденсированной воды, смывных, технологических и грунтовых вод;
3) твердой в виде сыпучих или кусковых технических продуктов, грунта, льда и т. п.
В большинстве случаев действующая на конструкции среда является многофазной. Так, например, воздух промышленных помещений, а часто и заводских площадок содержит взвешенные капельки жидкой фазы (туманы) и твердые частицы (дым, пыль).
Коррозионные процессы чаще всего протекают в жидкой фазе, реже в газообразной; твердая фаза обычно выступает в виде тормозящей среды, через которую фильтруется или диффундирует агрессивная жидкая фаза.
Виды агрессивных воздействий среды на материал
Поведение металлов в агрессивных средах.
Под агрессивной средой мы должны понимать: 1) воду; 2) растворы кислот: а) кислоты-неокислители; б) кислоты-окислители; 3) растворы щелочей.
Металлы в агрессивных средах могут проявлять только свойства восстановителя, т.к. Ме 0 находится в низшей степени окисления:
Соответственно среда содержит окислитель.
Термодинамическим условием осуществления любого химического процесса служит уменьшение энергии Гиббса (ΔG). При отрицательном значении величины ΔG , процесс идет самопроизвольно в данных условиях.
где n – число электронов, участвующих в реакции,
ΔE – ЭДС окислительно-восстановительного процесса,
F – электрохимическая константа (число Фарадея).
Отсюда видно, что термодинамическим условием осуществления такого окислительно-восстановительного процесса является положительное значение электродвижущей силы (ЭДС), возникающей за счет различия окислительно-восстановительных потенциалов окислителя и восстановителя:
Взаимодействие металла с водой и кислотой-неокислителем
Схема процесса взаимодействия металла с водой:
Ме 0 + H2O → Me(OH)x + H2
Схема процесса взаимодействия металла с кислотой-неокислителем (HCl, H2SO4разб.):
Ме 0 + HxAn → MexAny + H2
Окислительное действие воды и кислот-неокислителей осуществляется за счет ионов водорода, стандартный окислительно-восстановительный потенциал которого принят равным 0 (Е 0 н/н=0В). Отсюда следует, что ЭДС окислительно-восстановительного процесса взаимодействия металла с водой и кислотой-неокислителем – положительно в тех случаях, когда стандартный окислительно-восстановительный потенциал металла (Е 0 Ме/Ме) больше нуля.
Практическое осуществление подобных реакций возможно, если при взаимодействии металла, стоящего в ряду напряжения до водорода, с водой или кислотой-неокислителем образуются соответственно растворимый гидроксид или растворимая соль.
ПРИМЕР 5: Оцените термодинамическую возможность взаимодействия в системе ЦИНК И ВОДА. Проанализируйте практическую возможность взаимодействия в стандартных условиях, учитывая растворимость продукта реакции. Если реакция практически возможна, составьте уравнение реакции.
Решение. Окислительное действие воды осуществляется за счет ионов водорода, стандартный окислительно-восстановительный потенциал которого принят равным 0. Стандартный окислительно-восстановительный потенциал восстановителя Е 0 (Zn 2+ /Zn) = -0,76В.
ЭДС = Еокисл. – Евосст. = Е 0 (Н + /Н) - Е 0 (Zn 2+ /Zn) = 0 – (-0,76) = +0,76В.
ЭДС больше нуля значит с термодинамической точки зрения реакция взаимодействия цинка с водой при обычных условиях осуществима.
Однако, реальная возможность любого процесса определяется не только термодинамическим факторам, но и образованием растворимых или нерастворимых продуктов взаимодействия. При действии воды на металл в качестве такого продукта образуются гидроксиды металлов. Гидроксид цинка Zn(OH)2 малорастворим и при образовании пленки этого продукта на поверхности цинка реакция практически прекращается. При обычных условиях цинк в воде не растворим.
ПРИМЕР 6: Оцените термодинамическую возможность взаимодействия в системе ЦИНК И СОЛЯНАЯ КИСЛОТА. Проанализируйте практическую возможность взаимодействия в стандартных условиях, учитывая растворимость продукта реакции. Если реакция практически возможна, составьте уравнение реакции.
Решение. Окислительное действие соляной кислоты (кислота-неокислитель) осуществляется за счет ионов водорода, стандартный окислительно-восстановительный потенциал которого принят равным 0. Стандартный окислительно-восстановительный потенциал восстановителя Е 0 (Zn 2+ /Zn) = -0,76В.
ЭДС больше нуля, значит с термодинамической точки зрения реакция взаимодействия цинка с соляной кислотой при обычных условиях осуществима.
Однако, реальная возможность любого процесса определяется не только термодинамическим факторам, но и образованием растворимых или нерастворимых продуктов взаимодействия. При действии кислоты-неокислителя на металл в качестве такого продукта образуются соли. Хлорид цинка ZnCl2 растворим и при обычных условиях цинк взаимодействует с соляной кислотой.
восстановитель 1| Zn – 2e = Zn 2+ ; процесс окисления
окислитель 1| 2H + + 2e = H2; процесс восстановления
Взаимодействие металла с кислотой-окислителем
Схема процесса взаимодействия металла с кислотой-окислителем:
Ме 0 + HxЭОу → соль + продукт восстановления + H2O
К кислотам-окислителям (окислительные свойства проявляет анион кислотного остатка) относятся НСlO4, HClO3, HNO3, Н2SO4 (только концентрированная), царская водка (смесь соляной и азотной кислот). Для определения термодинамической возможности растворения металлов в подобных кислотах необходимо вычислить ЭДС реакции как разность между стандартными окислительно-восстановительными потенциалами для процессов восстановления ее анионов (или недиссоциированных молекул) и окисления металла.
Продуктами восстановления сульфат-ионов SO4 2- могут быть оксид серы (IV) SO2, нейтральная сера S или сероводород H2S, а нитрат-ионов NO3 — – оксид азота (IV) NO2, оксид азота (II) NO, оксид азота (I) NO, молекулярный азот N2, аммиак NH3 или нитрат аммония NH4NO3. Состав продукта восстановления зависит от условий протекания реакции: от концентрации кислоты, степени чистоты металла, однородности его структуры, наличии примесей и т.п.
4.Поведение железа и его сплавов в агрессивных средах
Потенциал железа при активной коррозии близок к потенциалу процесса Fe→ Fe 2+ +2e, т.е. Е 0 =–0,44В. В окислительных условиях железо имеет более положительный электрохимический потенциал в связи с его пассивацией. Однако по своей склонности к пассивации железо находится примерно в середине ряда пассивности
Ряд возрастания степени пассивности не будет соответствовать ряду повышения коррозионной стойкости металлов, так как коррозионная стойкость зависит не только от пассивности, т.е. анодного торможения, но и от катодного торможения, термодинамической устойчивости металла в данных условиях.
Повышение доступа окислителей к поверхности железа ведет к облегчению пассивации и повышению коррозионной стойкости. При повышении концентрации кислорода в воде до 16 см 3 /л коррозия железа резко возрастает, а затем, проходя через максимум в атмосфере кислорода, снижается до малых значений. Увеличение скорости коррозии объясняется действием кислорода как катодного деполяризатора, а снижение – наступающей пассивацией железа. Однако повышение температуры или присутствие в растворе F − , Cl - , Br - активирует железо в окислительных средах.

Рис. 6 . Зависимость логарифма скорости коррозии железа
от концентрации HNO3 при 20 °С[2].
Как видно из рис. 6, максимальная скорость коррозии наблюдается в 35%-ной HNO3. В области концентраций 50-90 масс.% железо практически устойчиво. На нем устанавливается потенциал, близкий к потенциалу платинового электрода. Повышение скорости растворения железа с увеличением концентрации HNO3 свыше 90% объясняется возможностью образования более растворимых оксидов железа(V1), т.е. процессом его перепассивации. Максимальная скорость коррозии железа наблюдается в 50%-ной H2SO4. В более концентрированных растворах 70-100% идет снижение скорости коррозии, что объясняется окислительным пасссивирующим действием H2SO4 (конц). Это позволяет применять железные емкости для хранения и транспортировки концентрированной H2SO4 и олеума.
5.Влияние кислотности среды на коррозию
Влияние концентрации ионов водорода в коррозионной среде на скорость коррозии металлов определяется их непосредственным участием в электродном процессе или их способностью влиять на растворимость продуктов коррозии, или возможностью образовывать защитные оксидные
пленки при изменении рН раствора. Увеличение концентрации ионов водорода влияет на скорость коррозии особенно сильно в том случае, когда процесс коррозии контролируется не диффузией, а процессом разряда ионов водорода.
Скорость коррозии железа (рис. 7, кривая 1) в области значений рН от 4 до 10 не зависит от концентрации водородных ионов. В этом интервале рН скорость коррозии железа в неперемешиваемых электролитах определяется скоростью диффузии кислорода к поверхности металла. В указанной области поверхность железа находится в контакте с раствором, насыщенным гидратированным гидроксидом железа (II), рН которого составляет 9,5. При рН10 скорость коррозии снижается в результате пассивации железа в щелочных растворах, а затем при рН>13 наступает некоторое увеличение скорости коррозии из-за растворения пассивной оксидной пленки на железе в концентрированной щелочи. Каждый металл характеризуется определённой зависимостью скорости коррозии от рН раствора (рис. 7).

Рис. 7. Влияние рН раствора на характер зависимости скорости коррозии для различных металлов: 1 – железа; 2 – благородных; 3 – цинка и алюминия; 4 – никеля и кадмия [3].
Независимость скорости коррозии благородных металлов (платина, золото, серебро), устойчивых в кислых и в щелочных средах, от рН выражается прямой 2, параллельной оси абсцисс. Цинк и алюминий неустойчивы в кислотах и в щелочах. В сильно кислых средах образуются аквакатионы Zn 2+ и А1 3+, а в щелочах – гидроксокомплексы и анионы ZnO2 2− и AlO2 −-, поэтому на кривой 3 наблюдаются подъемы в кислой и щелочной областях. Никель и кадмий устойчивы в нейтральном и щелочном растворах и корродируют в кислом растворе (кривая 4). Подобные зависимости скорости коррозии имеют место при отсутствии окислителей и других ионов, образующих защитные слои на металлах.
6. Методы защиты металлов от коррозии
Возможные методы противокоррозионной защиты разделяются на три группы: 1) изменение свойств коррозионной среды; 2) изменение свойств корродирующего металла или сплава; 3) отделение металла от коррозионной среды ( защитные покрытия). Для первой группы методов характерно стремление уменьшить концентрацию деполяризаторов в среде ( О2, Н + , SO3, NO2 и др. окислителей ), удалить из нее стимуляторы ( активаторы) коррозии (F − , CI – , Br – ,HS − , S 2− , SO3 2– и др. ) или ввести в среду добавки ( до 1% ) веществ, замедляющих коррозию ( ингибиторов). Применение ингибиторов– эффективный, универсальный и экономически целесообразный способ противокоррозионной защиты металлов в различных агрессивных средах. Эффективность защитного действия ингибиторов оценивают ингибиторным эффектом ( γ ) или степенью защиты (Z ). Ингибиторный эффект показывает, во сколько раз ингибитор уменьшает скорость коррозии и вычисляется по формуле
= (13)
где K, Kо – скорость коррозии соответственно в присутствии ингибитора и без него.
Степень защиты, или защитное действие вычисляется по формуле
Z = · 100%. (14 )
Механизм действия ингибиторов заключается в физической или химической адсорбции их на поверхности металла и последующем торможении катодных и анодных процессов. Характер адсорбции ингибиторов определяется природой активных функциональных групп ингибитора и зарядом поверхности металла. Анодные ингибиторы тормозят растворение металла путем образования на анодных участках защитных пленок( фосфаты, силикаты) или путем перевода металла в пассивное состояние ( хроматы, молибдаты, нитраты, нитриты).Анодные ингибиторы являются «опасными», так как при недостаточной концентрации могут вызвать питтинговую коррозию. Катодные ингибиторы понижают скорость коррозии за счет повышения перенапряжения катодного процесса ( выделения водорода, поглощения кислорода) или образования адсорбционных и фазовых пленок.
В зависимости от условий эксплуатации ингибиторы делятся на следующие группы: 1) ингибиторы атмосферной коррозии( карбонат аммония, смесь уротропина с нитритом натрия, бензоат натрия и др.); 2) ингибиторы для нейтральных и водно- солевых систем ( хроматы натрия или калия, нитрат, силикат или молибдат натрия и др.); 3) ингибиторы кислотной коррозии ( на основе органических веществ); 4) масло- растворимые ингибиторы( ароматические амины, фенолы и др.), вводимые в масла и смазки.
Значительное повышение коррозионной стойкости достигается при легировании металла или сплава специальными добавками, вызывающими торможение катодного или анодного процессов. В качестве катодных легирующих добавок ( до 1% ) используются медь, никель, вольфрам, палладий, платина и др. Торможение анодных процессов связано с уменьшением площади анодных участков или с пассивированием сплава ( при легировании сталей хромом, титаном, молибденом или кремнием).
Защитные покрытия разделяются по ГОСТ 9.301−86 на металлические и неметаллические ( краски, лаки, эмали, смазки и др.). По способу нанесения различают гальванические (электролитическим осаждением цинка, кадмия, никеля, хрома, олова и др.), диффузионные ( насыщением поверхностного слоя металла алюминием, хромом, титаном, кремнием и др.), металлизационные ( распылением жидких металлов), химические (путем химической или электрохимической обработки – оксидирование, фосфатирование, анодирование ) и механотермические покрытия.
Металлические защитные покрытия могут быть анодные и катодные(рис.8). Анодные покрытия имеют электродный потенциал более отрицательный, чем потенциал защищаемого металла (например, цинковое покрытие на железе Zn 2+ /Zn = – 0,76 B, Е o При нарушении анодного покрытия разрушение основного металла не происходит, так как пеоследний является катодом коррозионного элемента. Схема работы коррозионного элемента в этом случае может быть представлена в виде
|¯¯¯¯¯¯¯¯↓ |¯¯¯( – ) A Zn / Zn 2+ Fe O2/ OH – K (+). ( 15 )
An −
Катодными называют покрытия, электродный потенциал которых в данной среде имеет более положительное значение, чем потенциал основного металла, например никель (олово, медь) на стали (железе). При нарушении катодного покрытия основной металл будет анодом и начнет корродировать, а металл покрытия – катодом. Схема работы микрогальванических элементов в этом случае следующая:
|¯¯¯¯¯¯¯↓|¯¯¯( – ) A Fe / Fe 2+ Ni O2/ OH – K (+). (16 )
|______
Рис. 8 . Схема коррозии металла в кислом растворе при нарушении металлических покрытий:
а - катодного, б - анодного; 1– раствор, 2 – покрытие, 3 –основной металл,
4 –дефект в покрытии.
В местах обнажения основного металла коррозия усиливается. Следовательно, необходимо, чтобы в катодных покрытиях было минимальное количество пор..
В коррозионных средах с хорошей электропроводностью применяют электрохимическую защиту (протекторную, катодную и анодную защиту, электродренаж). Протекторная защита состоит в создании макрогальванического элемента, в котором защищаемый металл является катодом, а анодом (протектором) служит более активный металл или сплав (алюминий, цинк, их сплавы). Эффективность протекторной защиты зависит от электропроводности среды, разности потенциалов между протектором и защищаемой конструкцией , от площади контакта и способа размещения протектора.
При катодной защите конструкцию искусственно делают катодом путем присоединения к отрицательному полюсу внешнего источника тока, к положительному полюсу присоединяют чугунный или стальной лом, графит. Катодная защита успешно применяются для защиты морских сооружений (шлюзов, эстакад), трубопроводов, судов, изделий из стали, меди и алюминия.
Сущность анодной защиты состоит в создании на поверхности защищаемой конструкции пассивирующей пленки путем анодной поляризации от внешнего источника постоянного тока. Присутствие галогенидных ионов в коррозионной среде делает невозможным применение анодной защиты сплавов на основе железа из-за опасности развития питтинговой коррозии. До уровня промышленного применения доведена анодная защита стальных емкостей для хранения и перевозки кислот и щелочей, а также защита автоклавов из углеродистой стали при щелочной варке целлюлозы.
Для защиты подземных сооружений от разрушения блуждающими токами используют электродренаж (соединение металлическими проводниками анодных участков сооружений с источником блуждающих электрических токов.
Гребнов В.С., Гребнова А.Б., Зубков Е.М., Данилов Ю.П. "Влияние внешних воздействий на металлические конструкционные элементы"
Проводится анализ внешних воздействий (нагрузок, температуры, различных физических полей, агрессивных сред) на развитие коррозионных процессов протекающих в конструкционных элементах технических устройств, зданий и сооружений на опасных производственных объектах.
При обследованиях, техническом диагностировании, экспертизе промышленной безопасности технических устройств, а также конструктивных элементов зданий и сооружений на опасных производственных объектах (ОПО), нередко анализируется только статическое состояние исследуемого объекта, без учёта внешних воздействий. Такой подход не позволяет произвести достоверную и полную оценку фактического технического состояния объекта, а также спрогнозировать возможность и срок его дальнейшей безопасной эксплуатации. Объективные данные можно получить только при комплексном анализе всех воздействий на обследуемый объект, рассматривая при этом как статическое состояние объекта, так и динамику внешних воздействий на него.
Под внешними воздействиями понимают действие нагрузок, температуры, различных физических полей, агрессивных сред.
Силы, действующие на конструкции, разделяют на внешние и внутренние. В случае если элемент конструкции рассматривается изолированно от других узлов и деталей, то действие последних заменяется силами, которые называются внешними или нагрузками. Силы взаимодействия между частями отдельного конструктивного элемента называются внутренними.
Внешние силы можно условно разделить на три группы: сосредоточенные, распределительные и объёмные (массовые) силы.
Сосредоточенные – силы, действующие на участках поверхности, соизмеримых с полной поверхностью конструктивного элемента (например, давление жидкости в сосуде).
Объёмные силы приложены к каждой частице материала (силы тяжести, силы инерции).
При построении модели нагружения внешние нагрузки схематизируются, т. е. приводятся к этим группам сил. Чаще всего на конструкцию действуют не все нагрузки сразу, а некоторые, наиболее вероятные их комбинации и сочетания. В инженерных расчётах обычно учитывают только опасные сочетания нагрузок.
По характеру изменения во времени нагрузки делятся на статические и переменные.
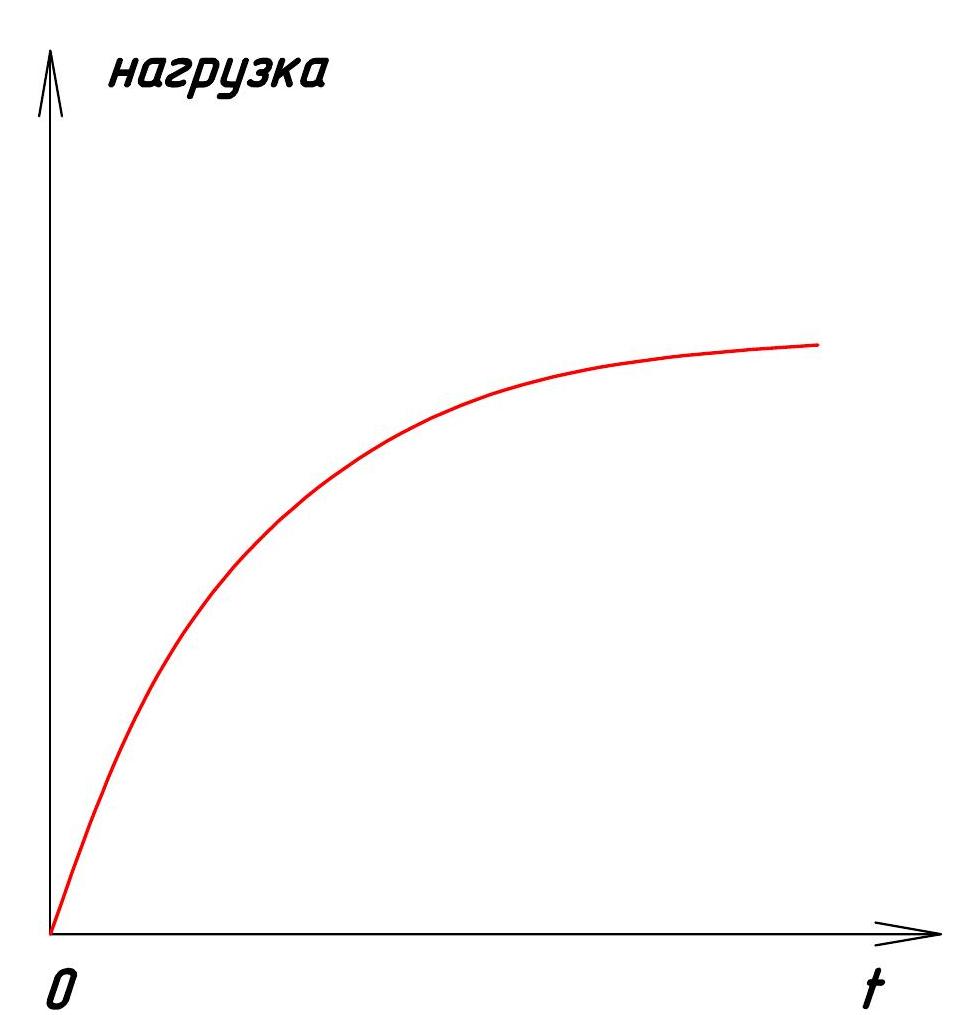
Статической называют нагрузку, которая медленно возрастает от нуля до своего номинального значения и остаётся неизменной в процессе работы конструкции (рис. 1). Например, нагружение строительных конструкций весом зданий.
Переменной называют нагрузку, периодически меняющуюся во времени (рис.2). Наиболее важный класс переменных нагрузок – циклические нагружения.
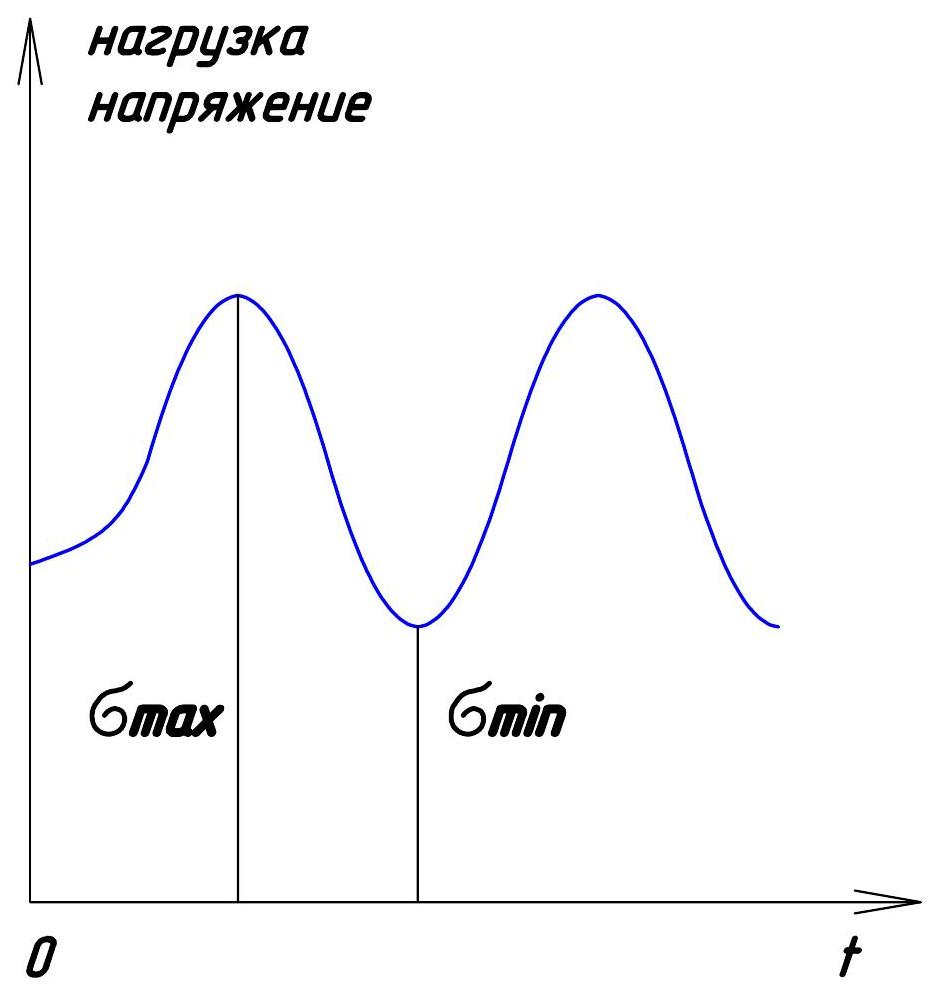
Различают малоцикловое нагружение, характерное для элементов конструкций и деталей машин, циклы работы которых набираются за счёт запуска и остановки машин. Число таких циклов обычно составляет 10 4 … 10 5 , в этом случае нагружение называют многоцикловым.
Иногда встречается динамическое ударное нагружение (взрыв, землетрясение и т.п.) характеризующиеся высокой скоростью возрастания нагрузки.
Для и конструктивных элементов технических устройств, зданий и сооружений, особенно применяемых на опасных производственных объектах (ОПО) в химической и нефтехимической промышленности, кроме статических и динамических нагрузок характерно воздействие температурного поля и агрессивных сред.
Действие температуры проявляется двояким образом. В первую очередь, понижение или повышение температуры приводит к изменению механических характеристик материалов и даже к изменению механизма деформирования. Например, при высоких температурах главенствующую роль может занять процесс ползучести или релаксации.
При неравномерном нагреве тела создаются температурные напряжения, величина которых может оказаться опасной. Для учёта теплового расширения предполагается, что полная деформация состоит из двух частей:
где e сил. – деформация, вызванная действием внешних нагрузок;
e тепл. - деформация, вызванная действием температуры, причём e тепл. = ɑ ΔТ, где:
ɑ - коэффициент линейного расширения;
ΔТ - изменение температуры.
Исходя из закона Гука:
где δ – напряжение;
Е – модуль упругости.
для линейно упругой модели материала можно записать:
Учёт температурных нагрузок особенно важен на объектах теплоэнергетики, особенно на котлоагрегатах большой мощности и трубопроводах пара и горячей воды I и II категорий, работающих с температурами среды выше 400 о С. В результате температурных воздействий не исключены структурные изменения металла, и при определении возможности дальнейшей эксплуатации таких объектов необходимо проводить металлографические исследования структуры металла.
Под влиянием агрессивных сред изменяются многие свойства материала, как кратковременные, так и длительные. Прежде всего, многие константы, характеризующие поведение материалов в нейтральной среде, становятся функциями, причём степень их изменения оказывается разной для различных точек объекта. Следовательно, воздействие агрессивной среды приводит к появлению наведённой и изменяющейся с течением времени неоднородности механических свойств по объёму конструктивного элемента.
Воздействие сред может вызывать обратимое или необратимое изменение свойств материалов. При обратимом влиянии после удалении агрессивной среды исходные механические свойства восстанавливаются, а при необратимом не восстанавливаются. По влиянию на механические свойства материалов среды классифицируются следующим образом:
· коррозионно-агрессивные среды, вызывающие химическую и электро-химическую коррозию;
· среды абсорбирующиеся объёмом материала и этим изменяющие его механические свойства (например, водород), а также растворяющие материалы, образующие твёрдые растворы с ним;
· среды, образующие с конструкционным материалом химические соединения;
· среды, влияющие на конструктивный материал радиационно, механически.
Коррозионные поражения металла агрессивной средой разрушают металл, выводят из строя элементы конструкций, детали машин и аппаратов. На фото 1. показано измерение ультразвуковым прибором остаточной толщины металлической опорной стойки, имеющей значительные коррозионные повреждения в результате воздействия паров серной кислоты.

При газовой коррозии фото 2. на поверхности металла в результате взаимодействия с агрессивной средой появляется новое химическое соединение в виде слоя. Стойкость этого слоя (окалины) зависит от его механических свойств, а также от сил сцепления между окалиной и металлом. Газовая коррозия может быть атмосферной (т.к. около 80% всего металла в виде элементов конструкций и деталей машин используется в атмосфере), грунтовой, морской [1].
По характеру воздействия она может быть равномерной или локальной.

Весьма опасна коррозия в сочетании с действием механических напряжений. Коррозия под напряжением обычно вызывает коррозионное растрескивание (коррозионную статическую усталость) металла. Это явление имеет место при обязательном действии растягивающих напряжений либо от внешних нагрузок, либо от остаточных деформаций. Коррозионному растрескиванию подвержены большинство металлов и сплавов.
Влияние внешних воздействий на объекты необходимо учитывать в течение всего срока их эксплуатации – при разработке графиков и объёмов технического обслуживания, текущих и капитальных ремонтов, при реконструкции и техническом перевооружении.
Требования Федерального закона «О промышленной безопасности опасных производственных объектов» [2] определяющего правовые, экономические и социальные основы обеспечения безопасной эксплуатации опасных производственных объектов в первую очередь предполагают необходимость всестороннего анализа условий безопасной эксплуатации технических устройств и строительных конструкций на производственных объектах, представляющих повышенную опасность, с целью организации содержания оборудования и строительных конструкций в работоспособном и безопасном состоянии, в рамках действующего законодательства с учётом индивидуальных особенностей производства.
Правила, устанавливающие порядок проведения экспертизы промышленной безопасности [3] также определяют необходимость индивидуального анализа условий эксплуатации объекта при определении возможности его дальнейшей эксплуатации.
Для достоверной оценки состояния строительных конструкций и конструктивных элементов технических устройств с целью прогнозирования возможности и допустимых сроков их дальнейшей безопасной эксплуатации необходимо анализировать весь спектр существующих и возможных воздействий на объекты, исходя из условий и режима их работы.
Список литературы:
1. Овчинников И.Г., Хадеев В.М. Учебное пособие. Расчёт конструкций подверженных коррозионному износу. Иваново, 1991-102 с.
2. О промышленной безопасности опасных производственных объектов: федер. закон от 21 июля 1997 г. № 116-ФЗ: принят Гос. Думой 20 июня 1997 г.: в действующей редакции от 13.07.2015. М.: ЗАО НТЦ ПБ, 2015, 56 стр.
3. Правила проведения экспертизы промышленной безопасности: федер. нормы и правила в обл. пром. безопасности: утв. приказом Ростехнадзора от 14 нояб. 2013 г. № 538// Рос. газ. 2013, № 6272, 31 дек.
Читайте также:
