Активные металлы это металлы
Обновлено: 24.04.2024
алюминий — элемент подгруппы IIIa.
Щелочные и щелочно-земельные металлы получили свое название благодаря тому, что их гидроксиды растворяются в воде, то есть являются щелочами.
Электронное строение активных металлов характеризуется наличием на внешней электронной оболочке одного, двух или трех электронов, относительно слабо связанных с ядром. В результате химических реакций металлы легко отдают эти электроны, проявляя свои постоянные степени окисления и валентности:
Благодаря своей активности щелочные и щелочно-земельные металлы, равно как и алюминий, встречаются в природе не в чистом виде, а в составе многочисленных химических соединений — минералов. Минералы представляют собой кристаллические вещества, как правило оксиды или соли. У многих из них в кристаллической решетке содержатся молекулы воды: такие соединения называются кристаллогидратами. Например в глаубе́ровой соли на один фрагмент сульфата натрия приходится десять молекул воды; он имеет формулу и название декагидрат сульфата натрия (по-гречески дека — десять).
- NaCl — поваренная соль, или галит (рис. 1),
- Na2CO3·10H2O — натрит, или сода (именно от слова сода произошло англоязычное название натрия — Sodium),
- NaHCO3 — питьевая сода, или накхолит,
- Na2SO4·10H2O — глауберова соль, или мирабилит,
- KCl — сильвин,
- твердый раствор KCl и NaCl в мольном отношении 1:1 — сильвинит; его формулу можно записать как KCl·NaCl,
K2CO3 — поташ (отсюда происходит англоязычное название калия — Potassium) и др.
- CaCO3 — кальцит, основной компонент мела и мрамора (рис. 2),
- CaSO4·2H2O — гипс,
- CaF2 — флюорит,
Основные запасы алюминия сконцентрированы в глинозёмах и полевых шпатах — соединениях кремния, кислорода, алюминия и других металлов, — а также в некоторых минералах: корунде (Al2O3), бокситах (Al2O3·H2O) и др. Алюминий — самый распространенный металл в земной коре.
Получение активных металлов
Промышленное производство алюминия основано на электролизе глинозёмов в расплаве криолита (Na3AlF6).
Химические свойства активных металлов
а калий, рубидий и цезий — надпероксиды, или супероксиды:
Щелочно-земельные металлы и алюминий также образуют оксиды; при комнатной температуре их поверхность покрывается оксидной пленкой, при нагревании происходит интенсивное самовозгорание:
Так, посуда, провода, детали машин и механизмов и прочие изделия из алюминия покрыты тонкой пленкой Al2O3. Эта пленка не пропускает ни воздух, ни влагу, предотвращая тем самым дальнейшее окисление металла, иначе срок службы алюминиевых изделий не превышал бы нескольких минут. Однако, если потравить (т. е. обработать химически агрессивной средой) поверхность такого изделия, то несколько мгновений можно будет наблюдать характерный блеск чистого алюминия (рис. 3).
Исключением является реакция алюминия с водородом, которая не идет даже при нагревании.
Видеоролик поочередно демонстрирует взаимодействие лития, натрия, калия, рубидия и цезия с водой. Можно заметить, что в этом ряду активность металлов возрастает
Однако, следует иметь в виду, что если щелочной или щелочно-земельный металл попадет в разбавленный раствор кислоты, то начинают протекать две конкурирующие реакции — с кислотой и водой:
Образующаяся в результате второй реакции щелочь впоследствии также вступает во взаимодействие с кислотой; в итоге все равно образуется нейтральное соединение — соль:
Такие металлургические процессы, сопровождающиеся обычно выделением большого количества тепла, объединяют под общим названием металлотермия.
Применение активных металлов и их соединений
Упомянутая выше металлотермия — основная область применения всех активных металлов, которые являются отличными восстановителями.
Щелочные металлы имеют высокую теплопроводность, но в то же время достаточно низкую температуру плавления (натрий — +98 °С, калий — +64 °С). Эти свойства обуславливают применение щелочных металлов и их сплавов в качестве эффективных теплоносителей, например в атомных реакторах.
Небольшие добавки щелочных и щелочно-земельных металлов в сплавы алюминия, меди, свинца придают им пластичность и стойкость к коррозии.
Газоразрядные лампы, заполненные пара́ми натрия, дают яркий желто-оранжевый свет и широко применяются в уличном освещении (рис. 5).
Среди соединений щелочных и щелочно-земельных металлов наибольшее применение находят непосредственно щелочи, а также оксиды, фториды, хлориды, карбонаты и некоторые другие. Гидроксиды лития, натрия и калия используются для приготовления электролитов щелочных батарей, а оксид лития — один из основных компонентов литий-ионных аккумуляторов, которыми снабжаются большинство современных сотовых телефонов, ноутбуков, цифровых фотоаппаратов и других мобильных устройств.
Фториды кальция и бария применяются в изготовлении оптических приборов — объективов, линз и призм.
Неорганические соединения калия и кальция (K2CO3, KNO3, Ca(OH)2 и др.) широко используются в качестве минеральных удобрений.
Алюминий и его сплавы — легкие, прочные и коррозионно-устойчивые, — применяются для изготовления корпусов всевозможных механизмов (рис. 6), деталей электронных устройств, проводов, посуды и пр.
Непосредственно алюминий и некоторые его соединения, в том числе органические, используются в качестве высокоэффективного ракетного топлива.
Активные металлы

Среди всех металлов некоторые отличаются тем, что они очень легко вступают в восстановительные реакции. Такие металлы имеют много схожих свойств и объединяются в класс активных металлов.
Положение активных металлов в таблице Менделеева
К активным металлам относятся три группы элементов:
- щелочные металлы;
- щелочноземельные металлы;
- алюминий.
Щелочные металлы находятся в первой группе таблицы Менделеева, то есть занимают в ней крайнее левое положение. В частности щелочными металлами являются:
- литий (Li);
- натрий (Na);
- калий (K);
- рубидий (Rb);
- цезий (Cs);
- франций (Fr).
Щелочноземельные металлы находятся во второй группе, то есть правее щелочных металлов. К ним относятся:
В целом активные металлы отличаются тем, что имеют один или два валентных электрона, поэтому они легко отдают эти электроны в ходе химических реакций, выступая в качестве восстановителей. Степень активности металла можно оценить по его расположению в электрохимическом ряде активности металлов. Чем левее там находится металл, тем сильнее выражены его восстановительные свойства. Крайнее левое положение в ряде занимает литий. В вот крайне правое положение в ряду занимает золото, именно поэтому оно почти не окисляется кислотами.

Электрохимический ряд напряжений металлов
Алюминий – это так называемый постпереходный металл, по своим свойствам он находится где-то между активными и среднеактивными металлами. Разные ученые придерживаются различного мнения о том, стоит ли считать алюминий активным металлом.
Активные металлы не встречаются в природе в чистом виде, так как они быстро вступают в химические реакции с другими элементами. Чаще всего в природе они присутствуют в виде оксидов. Например, даже если алюминий получен в чистом виде, то на воздухе он быстро покрывается оксидной пленкой.
Свойства щелочных металлов
Цвет всех щелочных металлов – белый, с серебристым оттенком. Исключением является цезий, имеющий серебристо-желтый цвет. Щелочные металлы можно резать простым скальпелем, так как у них низкая твердость. Также они имеют малую плотность – от 534 кг/м 3 у лития до 1900 кг/м 3 у цезия. Литий, калий и натрий настолько легкие, что они плавают в воде, но построить корабль из них не получится, так как вода быстро окисляет и разрушает эти металлы. Франций и цезий плавятся уже при комнатной температуре, а самый тугоплавкий щелочной металл – это литий, плавящийся при 180,6°С.
Для защиты щелочных металлов от воздуха и волы их хранят в керосине. При реагировании лития с водой выделяется водород, а натрий и особенно калий просто взрываются в воде. При взаимодействии с кислородом образуются оксиды.
Свойства щелочноземельных металлов
Щелочноземельные металлы значительно тверже щелочных, их нельзя просто взять и разрежать ножом. Также они тяжелее – их плотность колеблется от 1550 кг/м 3 у кальция до 5500 кг/м 3 у радия. Цвет щелочноземельных металлов – серый. Температуры плавления этих элементов находятся в диапазоне 650-840°С. Исключение – бериллий, плавящийся лишь при 1278°С.
Чем больше порядковый номер щелочноземельного металла в таблице Менделеева, тем выше его химическая активность. Например, бериллий вообще не взаимодействует с кислородом и по своим свойствам напоминает алюминий. Наиболее активные стронций, барий и радий приходится хранить в керосине, также как и щелочные металлы.
Подведение итогов
Активные металлы отличаются тем, что имеют лишь один-два валентных электрона, которые они легко отдают. Поэтому эти элементы очень быстро вступают в химические реакции, а в природе в чистом виде не встречаются.

Металлы, легко вступающие в реакции, называются активными металлами. К ним относятся щелочные, щелочноземельные металлы и алюминий.
Положение в таблице Менделеева
Металлические свойства элементов ослабевают слева направо в периодической таблице Менделеева. Поэтому наиболее активными считаются элементы I и II групп.
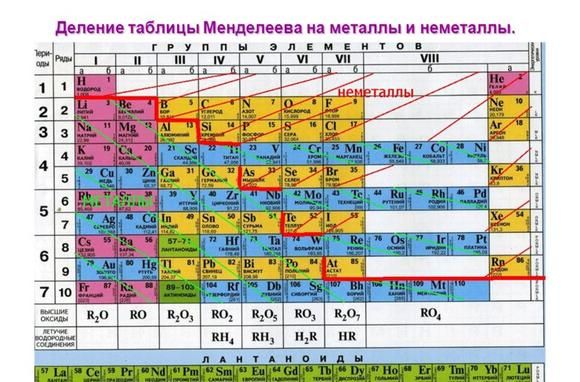
Рис. 1. Активные металлы в таблице Менделеева.
Все металлы являются восстановителями и легко расстаются с электронами на внешнем энергетическом уровне. У активных металлов всего один-два валентных электрона. При этом металлические свойства усиливаются сверху вниз с возрастанием количества энергетических уровней, т.к. чем дальше электрон находится от ядра атома, тем легче ему отделиться.
Наиболее активными считаются щелочные металлы:
- литий;
- натрий;
- калий;
- рубидий;
- цезий;
- франций.
К щелочноземельным металлам относятся:
- бериллий;
- магний;
- кальций;
- стронций;
- барий;
- радий.
Узнать степень активности металла можно по электрохимическому ряду напряжений металлов. Чем левее от водорода расположен элемент, тем более он активен. Металлы, стоящие справа от водорода, малоактивны и могут взаимодействовать только с концентрированными кислотами.

Рис. 2. Электрохимический ряд напряжений металлов.
К списку активных металлов в химии также относят алюминий, расположенный в III группе и стоящий левее водорода. Однако алюминий находится на границе активных и среднеактивных металлов и не реагирует с некоторыми веществами при обычных условиях.
Свойства
Активные металлы отличаются мягкостью (можно разрезать ножом), лёгкостью, невысокой температурой плавления.
Основные химические свойства металлов представлены в таблице.
Реакция
Уравнение
Исключение
Щелочные металлы самовозгораются на воздухе, взаимодействуя с кислородом
Литий реагирует с кислородом только при высокой температуре
Щелочноземельные металлы и алюминий на воздухе образуют оксидные плёнки, а при нагревании самовозгораются
Реагируют с простыми веществами, образуя соли
Алюминий не вступает в реакцию с водородом
Бурно реагируют с водой, образуя щёлочи и водород
Реакция с литием протекает медленно. Алюминий реагирует с водой только после удаления оксидной плёнки
Реагируют с кислотами, образуя соли
Взаимодействуют с растворами солей, сначала реагируя с водой, а затем с солью
Активные металлы легко вступают в реакции, поэтому в природе находятся только в составе смесей – минералов, горных пород.

Рис. 3. Минералы и чистые металлы.
Что мы узнали?
К активным металлам относятся элементы I и II групп – щелочные и щелочноземельные металлы, а также алюминий. Их активность обусловлена строением атома – немногочисленные электроны легко отделяются от внешнего энергетического уровня. Это мягкие лёгкие металлы, быстро вступающие в реакцию с простыми и сложными веществами, образуя оксиды, гидроксиды, соли. Алюминий находится ближе к водороду и для его реакции с веществами требуются дополнительные условия – высокие температуры, разрушение оксидной плёнки.
Химические свойства металлов

Металлы – активные восстановители с положительной степенью окисления. Благодаря химическим свойствам металлы широко используются в промышленности, металлургии, медицине, строительстве.
Активность металлов
В реакциях атомы металлов отдают валентные электроны и окисляются. Чем больше энергетических уровней и меньше электронов имеет атом металла, тем легче ему отдавать электроны и вступать в реакции. Поэтому металлические свойства увеличиваются сверху вниз и справа налево в таблице Менделеева.
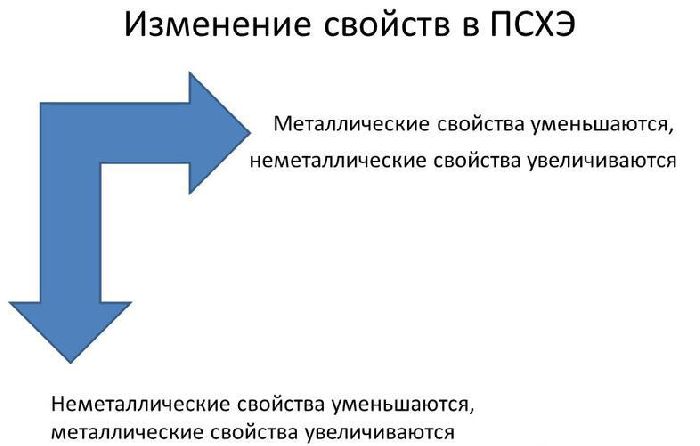
Рис. 1. Изменение металлических свойств в таблице Менделеева.
Активность простых веществ показана в электрохимическом ряду напряжений металлов. Слева от водорода находятся активные металлы (активность увеличивается к левому краю), справа – неактивные.
Наибольшую активность проявляют щелочные металлы, находящиеся в I группе периодической таблицы и стоящие левее водорода в электрохимическом ряду напряжений. Они вступают в реакцию со многими веществами уже при комнатной температуре. За ними идут щелочноземельные металлы, входящие во II группу. Они реагируют с большинством веществ при нагревании. Металлы, находящиеся в электрохимическом ряду от алюминия до водорода (средней активности) требуют дополнительных условий для вступления в реакции.

Некоторые металлы проявляют амфотерные свойства или двойственность. Металлы, их оксиды и гидроксиды реагируют с кислотами и основаниями. Большинство металлов реагирует только с некоторыми кислотами, замещая водород и образуя соль. Наиболее ярко выраженные двойственные свойства проявляют:
- алюминий;
- свинец;
- цинк;
- железо;
- медь;
- бериллий;
- хром.
Каждый металл способен вытеснять стоящий правее него в электрохимическом ряду другой металл из солей. Металлы, находящиеся слева от водорода, вытесняют его из разбавленных кислот.
Особенности взаимодействия металлов с разными веществами представлены в таблице химических свойств металлов.
Особенности
Большинство металлов образует оксидные плёнки. Щелочные металлы самовоспламеняются в присутствии кислорода. При этом натрий образует пероксид (Na2O2), остальные металлы I группы – надпероксиды (RO2). При нагревании щелочноземельные металлы самовоспламеняются, металлы средней активности – окисляются. Во взаимодействие с кислородом не вступают золото и платина
При комнатной температуре реагируют щелочные, при нагревании – щелочноземельные. Бериллий не вступает в реакцию. Магнию дополнительно необходимо высокое давление
Только активные металлы. Литий вступает в реакцию при комнатной температуре. Остальные металлы – при нагревании



Рис. 1. Активные металлы в таблице Менделеева.

Рис. 2. Электрохимический ряд напряжений металлов.
Алюминий
Алюминий представляет собой серебристо-белого цвета. Основные физические свойства алюминия – легкость, высокая тепло- и электропроводность. В свободном состоянии при пребывании на воздухе алюминий покрывается прочной пленкой оксида Al2O3, которая делает его устойчивым к действию концентрированных кислот.
Алюминий относится к металлам p-семейства. Электронная конфигурация внешнего энергетического уровня – 3s
. В своих соединениях алюминий проявляет степень окисления равную «+3».
Алюминий получают электролизом расплава оксида этого элемента:
Однако из-за небольшого выхода продукта, чаще используют способ получения алюминия электролизом смеси Na3 и Al2O3. Реакция протекает при нагревании до 960С и в присутствии катализаторов – фторидов (AlF3, CaF2 и др.), при этом на выделение алюминия происходит на катоде, а на аноде выделяется кислород.
Алюминий способен взаимодействовать с водой после удаления с его поверхности оксидной пленки (1), взаимодействовать с простыми веществами (кислородом, галогенами, азотом, серой, углеродом) (2-6), кислотами (7) и основаниями (8):
- бериллий (Be);
- магний (Mg);
- кальций (Ca);
- стронций (Sr);
- барий (Ba);
- радий (Ra).

Активные металлы в таблице Менделеева

Алюминий – это так называемый постпереходный металл, по своим свойствам он находится где-то между активными и среднеактивными металлами. Разные ученые придерживаются различного мнения о том, стоит ли считать алюминий активным металлом.
Читайте также:
