Al металл или неметалл
Обновлено: 05.07.2024
Элементы главной подгруппы III группы периодической системы:
бор (В), алюминий (Аl), галлий (Ga), индий (In) и таллий (Тl).
Открытие металлов главной подгруппы III группы
Бор представляет собой неметалл. Алюминий — переходный металл, а галлий, индий и таллий — полноценные металлы. Таким образом, с ростом радиусов атомов элементов каждой группы периодической системы металлические свойства простых веществ усиливаются.
Рассмотрим подробнее свойства алюминия.
1. Положение алюминия в таблице Д. И. Менделеева. Строение атома, проявляемые степени окисления.
Элемент алюминий расположен в III группе, главной «А» подгруппе, 3 периоде периодической системы, порядковый номер №13, относительная атомная масса Ar(Al) = 27. Его соседом слева в таблице является магний – типичный металл, а справа – кремний – уже неметалл. Следовательно, алюминий должен проявлять свойства некоторого промежуточного характера и его соединения являются амфотерными.
Al 0 – 3 e - → Al +3 Алюминий проявляет в соединениях степень окисления +3:
2. Физические свойства алюминия
Алюминий в свободном виде — серебристо-белый металл, обладающий высокой тепло- и электропроводностью. Температура плавления 650 о С. Алюминий имеет невысокую плотность (2,7 г/см 3 ) — примерно втрое меньше, чем у железа или меди, и одновременно — это прочный металл.
3. Нахождение в природе
По распространённости в природе занимает 1-е среди металлов и 3-е место среди элементов, уступая только кислороду и кремнию. Процент содержания алюминия в земной коре по данным различных исследователей составляет от 7,45 до 8,14 % от массы земной коры.
В природе алюминий встречается только в соединениях (минералах).
Некоторые из них:
4. Химические свойства алюминия и его соединений
Алюминий легко взаимодействует с кислородом при обычных условиях и покрыт оксидной пленкой (она придает матовый вид).
Её толщина 0,00001 мм, но благодаря ней алюминий не коррозирует. Для изучения химических свойств алюминия оксидную пленку удаляют. (При помощи наждачной бумаги, или химически: сначала опуская в раствор щелочи для удаления оксидной пленки, а затем в раствор солей ртути для образования сплава алюминия со ртутью – амальгамы).
I. Взаимодействие с простыми веществами - неметаллами
Алюминий уже при комнатной температуре активно реагирует со всеми галогенами, образуя галогениды.
при нагревании он взаимодействует с серой (200 °С) 2Аl + 3S = Аl 2 S 3 (сульфид алюминия),
азотом (800 °С) 2Аl + N 2 = 2АlN (нитрид алюминия),
фосфором (500 °С) Аl + Р = АlР (фосфид алюминия)
углеродом (2000 °С) 4Аl + 3С = Аl 4 С 3 (карбид алюминия)
с йодом в присутствии катализатора - воды (видео) 2Аl + 3I 2 = 2 AlI 3 (йодид алюминия)
Все эти соединения полностью гидролизуются с образованием гидроксида алюминия и, соответственно, сероводорода, аммиака, фосфина и метана:
Al 2 S 3 + 6H 2 O = 2Al(OH) 3 + 3H 2 S
Al 4 C 3 + 12H 2 O = 4Al(OH) 3 + 3CH 4
В виде стружек или порошка он ярко горит на воздухе, выделяя большое количество теплоты:
4Аl + 3O 2 = 2Аl 2 О 3 + 1676 кДж.
II. Взаимодействие алюминия со сложными веществами
Взаимодействие с водой:
2Al + 6H 2 O = 2 Al(OH) 3 + 3H 2 без оксидной пленки!!
Взаимодействие с оксидами металлов:
Алюминий – хороший восстановитель, так как является одним из активных металлов. Стоит в ряду активности сразу после щелочно-земельных металлов. Поэтому восстанавливает металлы из их оксидов . Такая реакция – алюмотермия – используется для получения чистых редких металлов, например таких, как вольфрам, ваннадий и др.
3 Fe 3 O 4 + 8Al = 4Al 2 O 3 + 9Fe +Q
Термитная смесь Fe3O4 и Al (порошок) –используется ещё и в термитной сварке.
Сr 2 О 3 + 2Аl = 2Сr + Аl 2 О 3
Взаимодействие с кислотами, например с раствором серной кислоты с образованием соли и водорода:
2 Al + 3 H 2 SO 4 = Al 2 (SO 4 ) 3 + 3 H 2
С холодными концентрированными серной и азотной не реагирует (пассивирует). Поэтому азотную кислоту перевозят в алюминиевых цистернах. При нагревании алюминий способен восстанавливать эти кислоты без выделения водорода:
Взаимодействие алюминия с щелочами (видео) .
2Al + 2NaOH + 6H 2 O = 2 Na[Al(OH) 4 ] + 3H 2
Na[Аl(ОН)4] – тетрагидроксоалюминат натрия
По предложению химика Горбова, в русско-японскую войну эту реакцию использовали для получения водорода для аэростатов.
Взаимодействие алюминия с растворами солей:
2Al + 3CuSO 4 = Al 2 (SO 4 ) 3 + 3Cu
Если поверхность алюминия потереть солью ртути, то происходит реакция:
2Al + 3HgCl 2 = 2AlCl 3 + 3Hg
Выделившаяся ртуть растворяет алюминий, образуя амальгаму.
5. Применение алюминия и его соединений: РИСУНОК 1 и РИСУНОК 2
Физические и химические свойства алюминия обусловили его широкое применение в технике. Крупным потребителем алюминия является авиационная промышленность: самолет на 2/3 состоит из алюминия и его сплавов. Самолет из стали оказался бы слишком тяжелым и смог бы нести гораздо меньше пассажиров. Поэтому алюминий называют крылатым металлом. Из алюминия изготовляют кабели и провода: при одинаковой электрической проводимости их масса в 2 раза меньше, чем соответствующих изделий из меди.
Учитывая коррозионную устойчивость алюминия, из него изготовляют детали аппаратов и тару для азотной кислоты. Порошок алюминия является основой при изготовлении серебристой краски для защиты железных изделий от коррозии, а также для отражения тепловых лучей такой краской покрывают нефтехранилища, костюмы пожарных.
Оксид алюминия используется для получения алюминия, а также как огнеупорный материал.
Гидроксид алюминия – основной компонент всем известных лекарств маалокса, альмагеля, которые понижают кислотность желудочного сока.
Соли алюминия сильно гидролизуются. Данное свойство применяют в процессе очистки воды. В очищаемую воду вводят сульфат алюминия и небольшое количество гашеной извести для нейтрализации образующейся кислоты. В результате выделяется объемный осадок гидроксида алюминия, который, оседая, уносит с собой взвешенные частицы мути и бактерии.
Таким образом, сульфат алюминия является коагулянтом.
6. Получение алюминия
1) Современный рентабельный способ получения алюминия был изобретен американцем Холлом и французом Эру в 1886 году. Он заключается в электролизе раствора оксида алюминия в расплавленном криолите. Расплавленный криолит Na3AlF6 растворяет Al2O3, как вода растворяет сахар. Электролиз “раствора” оксида алюминия в расплавленном криолите происходит так, как если бы криолит был только растворителем, а оксид алюминия - электролитом.
В английской “Энциклопедии для мальчиков и девочек” статья об алюминии начинается следующими словами: “23 февраля 1886 года в истории цивилизации начался новый металлический век - век алюминия. В этот день Чарльз Холл, 22-летний химик, явился в лабораторию своего первого учителя с дюжиной маленьких шариков серебристо-белого алюминия в руке и с новостью, что он нашел способ изготовлять этот металл дешево и в больших количествах”. Так Холл сделался основоположником американской алюминиевой промышленности и англосаксонским национальным героем, как человек, сделавшим из науки великолепный бизнес.
Металлический алюминий первым выделил в 1825 году датский физик Ханс Кристиан Эрстед. Пропустив газообразный хлор через слой раскаленного оксида алюминия, смешанного с углем, Эрстед выделил хлорид алюминия без малейших следов влаги. Чтобы восстановить металлический алюминий, Эрстеду понадобилось обработать хлорид алюминия амальгамой калия. Через 2 года немецкий химик Фридрих Вёллер. Усовершенствовал метод, заменив амальгаму калия чистым калием.
К 1855 году французский ученый Сен- Клер Девиль разработал способ получения металлического алюминия в технических масштабах. Но способ был очень дорогостоящий. Девиль пользовался особым покровительством Наполеона III, императора Франции. В знак своей преданности и благодарности Девиль изготовил для сына Наполеона, новорожденного принца, изящно гравированную погремушку – первое «изделие ширпотреба» из алюминия. Наполеон намеревался даже снарядить своих гвардейцев алюминиевыми кирасами, но цена оказалась непомерно высокой. В то время 1 кг алюминия стоил 1000 марок, т.е. в 5 раз дороже серебра. Только после изобретения электролитического процесса алюминий по своей стоимости сравнялся с обычными металлами.
А знаете ли вы, что алюминий, поступая в организм человека, вызывает расстройство нервной системы. При его избытке нарушается обмен веществ. А защитными средствами является витамин С, соединения кальция, цинка.
При сгорании алюминия в кислороде и фторе выделяется много тепла. Поэтому его используют как присадку к ракетному топливу. Ракета "Сатурн" сжигает за время полёта 36 тонн алюминиевого порошка. Идея использования металлов в качестве компонента ракетного топлива впервые высказал Ф. А. Цандер.
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1. Для получения алюминия из хлорида алюминия в качестве восстановителя можно использовать металлический кальций. Составьте уравнение данной химической реакции, охарактеризуйте этот процесс при помощи электронного баланса.
Алюминий это металл или неметалл

Химия
Алюминий это металл или неметалл
Один из самых распространенных в строительстве и технике металлов — алюминий. Он используется не только в чистом виде, но и в составе различных сплавов. В земной коре он тоже достаточно широко распространен, занимая почетное третье место, отставая только от кремния и кислорода. Если отдельно взвесить все компоненты, составляющие земную кору, то на алюминий придется 8% от общей массы.
Найти алюминий в периодической системе элементов можно в главной подгруппе III группы, или по новой классификации — в 13 группе. Кто знаком с основами построения таблицы, то безошибочно определит, что этот элемент — металл. В чистом виде найти алюминий не получится, он находится в виде соединений с другими элементами — полевой шпат, квасцы, бокситы, слюда, корунд. Даже в рубинах и сапфирах есть атомы алюминия.
Производится алюминий в промышленных масштабах из бокситов, сначала получают оксид алюминия, сильно нагревая сырье, затем подвергают расплав гидролизу. На катоде оседает металл, на аноде выделяется кислород в виде газа. Фильтрацией или другим способом чистый алюминий получить не удается.
Как устроен атом алюминия
В периодической системе алюминию присвоен 13 номер. В ядре элемента находится 13 нейтронов и 14 протонов. Электронная конфигурация элемента имеет вид 1s 2 2s 2 2p 6 3s 2 3p 1 , а конфигурация электронного распределения — +13Al)2)8)3. Три электрона из последней орбиты легко отделяются, что определяет высокий уровень окисления +3.
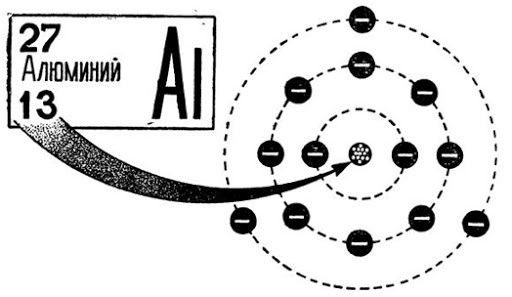
В естественном состоянии чистый алюминий существовать не может, поверхность слитка или изделия сразу же покрывается пленкой окислов, образующих герметичную оболочку. Это объясняет, почему алюминий не реагирует с водой и не поддается коррозии.
Физические и химические свойства алюминия
Если рассматривать физические свойства металла, то алюминий обладает небольшой массой, пластичен и хорошо проводит электричество. В нормальных условиях металл мгновенно покрывается защитной пленкой и не вступает в реакцию ни с водой, ни с кислотами. Это определяет популярность алюминиевой тары для транспортировки этих химических веществ. Кристаллическая структура определяет высокую пластичность металла.
Оксидная пленка снимается солями аммония, горячими щелочами и сплавами ртути, после чего металл вступает в реакцию со многими веществами, в частности с галогенами при комнатной температуре, а при нагревании — с фосфором, серой, азотом, углеродом. С водородом в реакцию металл не вступает. Степень окисления алюминия в соединениях всегда +3, в элементарном состоянии — 0.
Применение алюминия
Популярность металла во многом определена еще одним свойством, он не намагничивается. Это позволяет использовать его для изготовления корпусов различных машин, приборов, проводов. Отличная электропроводимость делает алюминий идеальным материалом для производства кабелей.
Алюминий плавиться при температуре 658 0 С, в расплаве легко вступает в реакцию с другими элементами, меняя свою структуру и свойства. Сплавы на основе алюминия обладают таким же небольшим весом, но значительно тверже, легче в обработке и долговечнее, чем чистый металл.
Одна из форм использования элемента в технике и быту — алюминиевая пудра. Это измельченный до мелкодисперсного состояния чистый алюминий, смешанный с 3 – 3,5 % жирных веществ. Частицы металла имеют чешуйчатую форму, при использовании пудры в качестве краски, они ложатся плоской стороной на поверхность, создают прочную антикоррозионную защиту и придают изделию декоративный вид.
Кроме чистого алюминия в порошке могут находиться железо, кремний, медь в количестве 0,01 – 0,5%. Это просто примеси, которые не вступают с алюминием в реакцию и не оказывают влияния на свойства пудры. Мелкодисперсный металл также используется при производстве взрывчатки, смесей для фейерверков, газообразующих компонентов легких бетонов.
Алюминаты
В природе часто встречаются соли ортоалюминиевой H3 AlO3 и металюминиевой кислот HAlO2. Это различные вещества, в которых алюминий полностью потерял свои металлические свойства и приобрел новые. Так алюминат натрия NaAlO2 используется в промышленности как протравочный реактив, другие соединения, как добавки для бетонов и растворов, ускоряющее отвердевание и повышающие пластичность. Металлические свойства алюминия в этих соединениях никак не проявляются. Степень окисления алюминия в метаалюминиевой кислоте и солях такой же, как и в оксидах +3.
В природе алюминаты находятся в виде минералов, не зная их химических формул сложно сказать, что в их составе находится один из самых распространенных металлов на Земле. Это минералы шпинель, ганит, герценит, хризоберилл. Сама по себе металюминиевая кислота неустойчива, а вот соли вполне самостоятельные твердые вещества с хорошо выраженными свойствами.
Ряд активности металлов

Что же из себя представляет ряд активности металлов давайте разбираться. Металлы — группа химических элементов, обладающих сходными свойствами. Среди них — электропроводность, пластичность, температурная зависимость сопротивления. По виду металлы можно отличить по характерному блеску, который так и назвали — металлический. Но химические свойства элементов отличаются в зависимости от строения их молекул и кристаллической решетки. Особенно ярко отличия проявляются по отношению взаимодействия с кислотами и щелочами. Всего на данный момент насчитывается 96 металлов. Общие свойства металлов показаны в таблице:
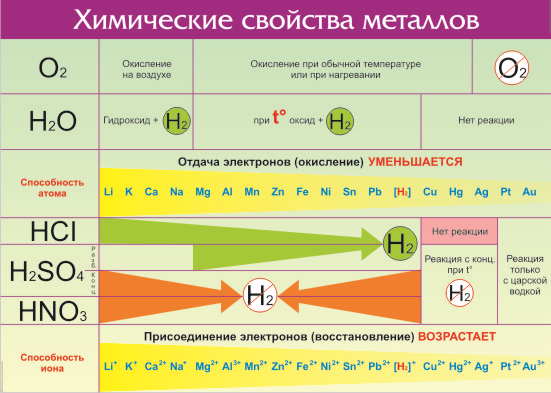
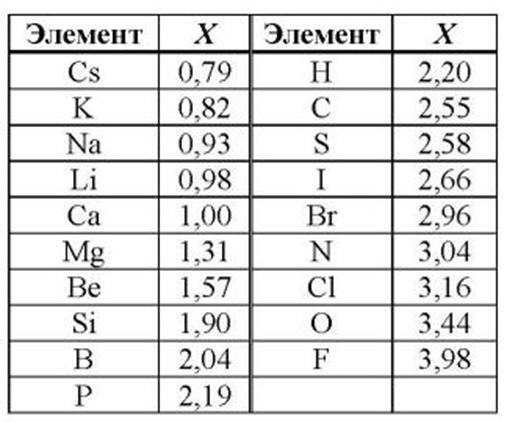
Все металлы в той или иной степени являются восстановителями, то есть, отдают электроны при течении окислительно-восстановительных реакций. Таблица электроотрицательности металлов показывает, какой металл является наиболее активным восстановителем. Если цифра напротив элемента больше 2, то это окислитель с характерными свойствами и выходит из ряда металлов, проявляя типичные свойства неметалла.
Электрохимический ряд активности металлов показывает, какие из металлов более активные, какие менее. Расположение элементов в горизонтальном ряду слева направо показывает направление снижения восстановительной способности и возрастание окислительной.
Восстановительная способность — свойство отдавать электроны в химических реакциях с водными растворами солей и щелочей.
Окислительная способность — свойство присоединять электроны в реакциях с теми же веществами.

Металлы в правой стороне более слабые восстановители, они вытесняются при реакциях с солевыми растворами металлами, расположенными левее. Пример реакции — Zn + Cu 2+ → Zn 2+ + Cu, которая протекает только в одном направлении. Цинк вытесняет медь, реагируя с водным раствором любой соли меди. Цинковая пластинка, при этом, растворяется, а медная восстанавливается.
Такую последовательность элементов еще называют ряд напряженности металлов, или ряд Бекетова. На всех вариантах записи ряда можно заметить, что последовательность металлов разделена знаком водорода (гидрогена), который металлом никак не является. Это своеобразный маркер, показывающий, что стоящие левее металлы вытесняют водород из водных растворов кислот, не обладающих окислительными свойствами. Некоторые металлы, например, литий, кальций, барий и остальные, стоящи до алюминия, вытесняют водород и при реакции с водой.
2Al +3H2SO4 = Al2(SO4)3 + 3H2↑
Fe + 2HCl = FeCl2 + H2↑
Стоящие правее знака водорода металлы с кислотами-неокислителями не взаимодействуют при нормальных условиях.
Шкала активности металлов широко используется для практических целей, например, в гальванике. Если электроды сделаны из разных металлов, то разрушаться будет тот, который стоит левее. Чем больше промежуток между металлами в ряду, тем активнее проходит процесс коррозии.
Например, метод оцинковки позволяет защитить железо именно потому, что цинк находится левее железа в ряду активности. Пока он не разрушится, то ржавчина на железе не появится. При электролизе, расположенные за водородом металлы осаживаются на катоде, а самые активные, занимающее места до алюминия, выделить из солевых растворов в не получится при нормальных температуре и давлении.
Малоактивные металлы, так называемые переходные элементы с электроотрицательностью в пределах 1,5 – 2. Это:
- Ртуть;
- Олово;
- Серебро;
- Никель;
- Рений;
- Медь;
- Марганец и еще несколько элементов.
К металлам средней активности относятся элементы с числом электроотрицательности от 1 до 1,5. В эту группу входят такие известные элементы, как магний, плутоний, неодим, кальций. Остальные элементы обладают высокой химической активностью. Лидирует в этом списке Франций, который практически не встречается в чистом виде. Из более известных можно назвать калий и натрий, которые приходится хранить в керосине, чтобы они не взаимодействовали с водой и воздухом. Если извлечь их из керосина, то металлы практически мгновенно сгорают.
Реакции кальция и натрия с водой при комнатной температуре выглядят так:
2Na + 2H2O = 2NaOH + H2↑
Сa + 2H2O = Сa(OH)2 + H2↑Стоящие в ряду электронапряжения металлов правее элементы тоже взаимодействуют с водой, но реакция протекает при более высокой температуре с образованием оксида и водорода.
3Fe + 4H2O = Fe3O4 + 4H2↑
Если вступает в реакцию металл и неметалл, то электрический ряд напряжений металлов тоже дает возможность заранее узнать, в каком направлении будет протекать реакция. Скорость реакции зависит как от восстановительной активности металла, так и от окислительных свойств неметалла. Стоящие до водорода металлы реагируют с кислородом уже при комнатной температуре, некоторые — достаточно бурно, например, литий и кальций.
4Li + O2 = 2Li2O
2Ca + O2 = 2CaO.
При таком взаимодействии образуются оксиды. Менее активные металлы, например железо, реагируют с кислородом спокойнее, а некоторые, например, золото и серебро, платина не окисляются вовсе, благодаря чему получили определение благородных.
С хлором реагируют практически все активные металлы с выделением теплоты.
2Fe + 3Cl2 = 2FeCl3
Также выделяется теплота при реакции активных металлов с серой, но начинается она при нагревании. После начала реакции нагрев не нужен — образовавшегося тепла достаточно для поддержания реакции.
2Al + 3S = Al2S3
Внимательно изучив ряд металлов, несложно определить тип реакции при контакте с другими элементами в зависимости от места в последовательности. Также легко назвать основные характеристики металла, как химического элемента, и возможность его использования на практике.
АЛЮМИНИЙ
АЛЮМИНИЙ
Al
(от лат. aluminium), химический элемент IIIA подгруппы периодической системы элементов (B, Al, Ga, In, Tl), наиболее распространенный металл в земной коре, встречается в большом количестве минералов, например в глине и граните. Основным сырьем для производства алюминия служат бокситы - руда, представляющая собой в основном гидратированный оксид алюминия Al2O3Ч2H2O. Мировым лидером по производству алюминия являются США, затем Россия, Канада и Австралия. Алюминий наиболее известен как сырье для производства сплавов, используемых для изготовления пищевых емкостей (бидонов, баллонов, банок и т.п.), легкой кухонной посуды и другой домашней утвари. Неочищенный алюминий был впервые выделен Х.Эрстедом в 1825, хотя еще в 1807 Х.Дэви обнаружил неизвестный металл при обработке глины серной кислотой. Дэви не смог выделить металл из соединений, но назвал его алюминум (от лат. alumen - квасцы), а его оксид - глиноземом (alimina); вскоре это название металла по аналогии с названиями других металлов изменили на "алюминий", что стало общепринятым.
Свойства. Замечательным свойством алюминия является его легкость; плотность алюминия примерно в три раза меньше, чем у стали, меди или цинка. Чистый алюминий - мягкий металл, но образует сплавы с другими элементами, что обеспечивает большой диапазон полезных свойств. В ряду величин теплопроводности и электрической проводимости алюминий стоит после серебра и меди. Алюминий отличается высокой реакционной способностью, поэтому он не встречается в природе в свободном состоянии. Металлический алюминий быстро растворяется в соляной кислоте с образованием хлорида AlCl3, медленнее - в серной с образованием сульфата Al2(SO4)3, но с азотной кислотой реагирует только в присутствии солей ртути. В реакции со щелочами он образует алюминаты, например, с NaOH образует NaAlO2. Алюминий проявляет амфотерные свойства, так как он реагирует и с кислотами, и со щелочами. На воздухе алюминий быстро покрывается прочной защитной пленкой оксида Al2O3, предохраняющей его от дальнейшего окисления. Поэтому алюминий стабилен на воздухе и в присутствии влаги даже при умеренном нагревании. Если защитная пленка оксида нарушена, то при нагревании на воздухе или в кислороде он сгорает ярким белым пламенем. При нагревании алюминий активно реагирует с галогенами, серой, углеродом и азотом. Расплавленный алюминий реагирует с водой со взрывом. СВОЙСТВА АЛЮМИНИЯ
Атомный номер 13 Атомная масса 26,9815 Изотопы
Температура плавления, ° С 660 Температура кипения, ° С 2467 Плотность, г/см3 2,7 Твердость (по Моосу) 2,0-2,9 Содержание в земной коре, % (масс.) 8,13 Степени окисления +3
Применение. С давних времен квасцы применяли в медицине как вяжущее средство, в крашении для протравы, и для дубления кожи. Квасцами часто называют смешанные сульфаты одно- и трехвалентного металлов, например алюминия и калия (минерал сольфатерит). Римский ученый Плиний Старший (1 в. н.э.) в своей Естественной истории упоминает о квасцах как о солях, свойства которых изучали алхимики. Впервые для дубления кожи и в медицинских целях квасцы применили египтяне; они, а также лидийцы, финикийцы и иудеи, знали, что некоторые краски, например индиго и кошениль, лучше сохраняются, если их смешивать или пропитывать квасцами. Кристаллический оксид алюминия, встречающийся в природе под названием корунд, используется как абразив, благодаря высокой твердости. Рубин и сапфир - разновидности корунда, окрашенные примесями, являются драгоценными камнями.
Применение металлического алюминия. Алюминий - один из наиболее легких конструкционных металлов (см. табл.). Сплавы, получаемые из алюминия после термообработки, наряду с низкой плотностью отличаются высокой прочностью и другими важными механическими свойствами, что делает алюминий незаменимым для изготовления деталей транспортных средств (поршни и картеры, блоки и головки цилиндров авиационных и автомобильных двигателей, подшипники, силовой набор и обшивка фюзеляжей и пр.). Алюминий легко подвергается волочению и вытяжке, что используется в производстве пищевых емкостей. Удельная электропроводность алюминия составляет ок. 61% электрической проводимости меди, но плотность алюминия в три раза меньше. Сочетание хорошей проводимости с высокой коррозионной стойкостью на воздухе расширяет возможности использования алюминиевых кабелей, часто упрочняемых сталью, для высоковольтных электропередач. Алюминий отличается также и высокой теплопроводностью, что используется в двигателях, системах охлаждения и других устройствах. Металл легко полируется механически и электролитически, поэтому его применяют также для отражателей телескопов и аналогичных целей. Алюминий широко используется как упаковочный материал и имеет максимальный среди других упаковочных материалов коэффициент извлечения при вторичной переработке. Рекуперация алюминиевого вторсырья позволяет экономить энергию, так как ее расход в этом случае меньше, чем при производстве алюминия из руды. В 1981 доля рекуперированного алюминия в производстве пищевых емкостей составляла 53,2%, а к 1991 достигла 62,4% и продолжает расти. Алюминий отличается высокой коррозионной стойкостью благодаря образованию на его поверхности оксидной пленки и поэтому используется как кровельный материал, обшивка, а также в рефлекторах дневного и ИК-света. Коррозионную стойкость его можно еще повысить методом электролитического анодного окисления, известного как анодирование, в результате чего увеличиваются толщина и сцепление оксидной пленки. Анодированная поверхность легко окрашивается, такой способ часто применяют для архитектурных панелей
(см. также КОРРОЗИЯ МЕТАЛЛОВ).
Коррозионная стойкость алюминия в сочетании с красивым внешним видом обеспечивает его широкое применение в холодильной технике. Алюминий - сильный восстановитель, и его используют для выделения менее активных металлов, а также в качестве антиоксиданта в производстве стали и взрывчатых веществ. Алюминиевый порошок применяют в отделочных работах. Алюминиевая краска устойчива к действию промышленных выбросов и выхлопных газов, поэтому широко применяется как защитное покрытие на фасадных частях металлоконструкций, нефтяных танков, в железнодорожном оборудовании и других конструкциях. Алюминиевая фольга - блестящий изолирующий материал, используемый для упаковки пищевых продуктов и для заворачивания их при кулинарной обработке, как декоративное покрытие книг, буквенных знаков, а также в производстве электроконденсаторов. Алюминиевый порошок применяется в порошковой металлургии для изготовления точных деталей, а также служит добавкой в твердых топливах ракетных двигателей. Термитная смесь широко используется как сварочный материал для ремонта толстостенных конструкций, например для сварки стальных рельс
(см. также ПОРОШКОВАЯ МЕТАЛЛУРГИЯ).
Сплавы. Чистый алюминий, мягкий и пластичный, малопригоден для прямого технического применения. Для получения широкого спектра легких алюминиевых сплавов применяется процесс Холла - Эру (см. также АЛЮМИНИЕВАЯ ПРОМЫШЛЕННОСТЬ). Нужды воздухоплавания во времена Первой мировой войны способствовали интенсивному развитию технологии алюминиевых сплавов. Сегодня развивается область специальных сплавов с помощью различных технологий. Из некоторых алюминиевых сплавов получают листовой прокат и профиль, из других тянут пруток, трубы, изготовляют брус с заданным углом, сложные секции и заготовки для обработки давлением. Многие сплавы можно прессовать, вытягивать, волочить и штамповать при комнатной температуре, другие обрабатывают только при повышенной температуре (см. также СПЛАВЫ).
Термообработка. Наиболее важным в технологии сплавов алюминия было открытие А.Вильма в 1911 того, что у некоторых сплавов улучшаются механические свойства в результате специальной термообработки, известной как старение. Впервые это было установлено для сплавов с медью и магнием, а затем и для всех сплавов. Старение проводят в две стадии; на первой сплав нагревают до температуры несколько ниже температуры плавления алюминия, при этом такие компоненты, как медь, образуют твердый раствор. При быстрой закалке компоненты сплава остаются в твердом растворе. На второй стадии при сравнительно низком нагреве растворенные компоненты сплава выделяются в виде чрезвычайно мелких частиц в алюминиевой матрице, улучшая механические свойства сплава. Но не все эффекты увеличения прочности являются следствием термообработки; некоторые из них объясняются тем, что компоненты сплава образуют твердые растворы или интерметаллические соединения.
См. также МЕТАЛЛОВ ТЕРМИЧЕСКАЯ ОБРАБОТКА.
Литье и обработка давлением. Отливка в землю (точнее, в глинисто-песчаные формы) используется для изготовления массивных деталей типа блока цилиндров двигателей, а для массового производства мелких деталей применяется литье в стандартные формы, в том числе и литье под давлением. Широко используются формы для отливок, сделанные из керамики, стали или чугуна (литье в постоянную форму, или кокильное литье). Обычный литьевой сплав может содержать до 8% Cu или до 13% Si. Наиболее распространенные алюминиевые литьевые сплавы содержат добавки Mg, Ni, Fe, Mn или Zn. Низкая температура плавления алюминия и его хорошие литьевые свойства способствуют широкому применению алюминиевого литья.
См. также МЕТАЛЛОВ ЛИТЬЕ. Кроме того, используют алюминиевые заготовки, которые приобретают превосходные качества после термообработки и обработки давлением. Ранее широко применялся дюраль - сплав алюминия с 4% меди, предварительно подвергнутый тепловой и механической обработке. Теперь дюрали - это широкий набор высокопрочных алюминиевых сплавов, содержащих кроме меди также марганец, магний, кремний и др. Эти сплавы имеют прочность на разрыв до 414 МПа (42,2 кг/мм2), близкую к прочности низкоуглеродистой стали. Более современный сплав, содержащий цинк, при комнатной температуре имеет прочность на разрыв до 690 МПа (70,3 кг/мм2). Эти сплавы используются в производстве деталей самолетов и могут заменять некоторые старые медьсодержащие сплавы.
Сплавы горячей и холодной обработки. Алюминий и его сплавы можно подвергать холодной и горячей обработке. При горячей обработке происходит разрушение структуры слитка и превращение ее в однородную мелкозернистую структуру с улучшенными свойствами. Горячая формовка и штамповка позволяют изготавливать тонкие заготовки, которые невозможно получать при холодной обработке. Таким способом получают пруток, проволоку, катанку, лист и другой специальный профиль. Холодная обработка производится на конечной стадии для получения в основном листа, прутка, проволоки и труб. При холодной обработке увеличивается прочность и твердость изделия. В общем, горячая обработка используется для первичной обработки слитка, а холодная имеет преимущество на последней стадии обработки.
См. также ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ.
ЛИТЕРАТУРА
Беляев А.И. Металлургия легких металлов. М., 1970 Промышленные алюминиевые сплавы. М., 1984
Алюминий является самым распространенным металлом в земной коре. Свойства алюминия позволяют активно применять в составе металлоконструкций: он легкий, мягкий, поддается штамповке, обладает высокой антикоррозийной устойчивостью.
Для алюминия характерна высокая химическая активность, отличается также высокой электро- и теплопроводностью.

Основное и возбужденное состояние
При переходе атома алюминия в возбужденное состояние 2 электрона s-подуровня распариваются, и один электрон переходит на p-подуровень.

Природные соединения
- Al2O3 - корунд
- 3BeO*Al2O3*6SiO2 - берилл (аквамарин - примесь Fe и изумруд - примесь Cr2O3)
- Al2O3*Cr2O3 - красный рубин
- Al2O3 с примесью Fe +2 /Fe +3 /Ti
- Al2O3*H2O - боксит

Получение
Алюминий получают путем электролиза расплава Al2O3 в криолите (Na3[AlF6]). Галлий, индий и таллий получают схожим образом - методом электролиза их оксидов и солей.
Химические свойства
При комнатной температуре реагирует с галогенами (кроме фтора) и кислородом, покрываясь при этом оксидной пленкой.
Al + Br2 → AlBr3 (бромид алюминия)
При нагревании алюминий вступает в реакции с фтором, серой, азотом и углеродом.
Al + F2 → (t) AlF3 (фторид алюминия)
Al + S → (t) Al2S3 (сульфид алюминия)
Al + N2 → (t) AlN (нитрид алюминия)
Al + C → (t) Al4C3 (карбид алюминия)

Алюминий проявляет амфотерные свойства (греч. ἀμφότεροι - двойственный), вступает в реакции как с кислотами, так и с основаниями.
Al + NaOH + H2O → Na[Al(OH)4] + H2↑ (тетрагидроксоалюминат натрия; поскольку алюминий дан в чистом виде - выделяется водород)
При прокаливании комплексные соли не образуются, так вода испаряется - вместо них образуются (в рамках ЕГЭ) средние соли - алюминаты (академически - сложные окиселы):
При комнатной температуре не идет из-за образования оксидной пленки - Al2O3 - на воздухе. Если разрушить оксидную пленку нагреванием раствора щелочи или амальгамированием (покрытием металла слоем ртути) - реакция идет.

Алюминотермия (лат. Aluminium + греч. therme - тепло) - способ получения металлов и неметаллов, заключающийся в восстановлении их оксидов алюминием. Температуры при этом процессе могут достигать 2400°C.
С помощью алюминотермии получают Fe, Cr, Mn, Ca, Ti, V, W.

Оксид алюминия
Оксид алюминия получают в ходе взаимодействия с кислородом - на воздухе алюминий покрывается оксидной пленкой. При нагревании гидроксид алюминия, как нерастворимое основание, легко разлагается на оксид и воду.
Проявляет амфотерные свойства: реагирует и с кислотами, и с основаниями.
Al2O3 + NaOH + H2O → Na[Al(OH)4] (тетрагидроксоалюминат натрия)

Гидроксид алюминия
Гидроксид алюминия получают в ходе реакций обмена между растворимыми солями алюминия и щелочами. В результате гидролиза солей алюминия часто выпадает белый осадок - гидроксид алюминия.
Проявляет амфотерные свойства. Реагирует и с кислотами, и с основаниями. Вследствие нерастворимости гидроксид алюминия не реагирует с солями.
Al(OH)3 + LiOH → Li[Al(OH)4] (при избытке щелочи будет верным написание - Li3[Al(OH)6] - гексагидроксоалюминат лития)

Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Читайте также:
