Алюминий очень активный металл
Обновлено: 17.05.2024
ещё как корродирует!! Вплоть до полного разрушения и коллоидного гелеобразного гидроксида алюминия.
При взаимодействии с морской водой чистый алюминий начинает корродировать, т.к. чувствителен к растворенным солям.
Щавелевая, муравьиная, хлорорганические кислоты разрушают металл.
На коррозионную стойкость алюминия очень сильно влияет парообразная и капельножидкая ртуть. После недолгого контакта металл и его сплавы интенсивно корродируют, образуя амальгамы.
Коррозия алюминия в щелочах
Щелочи легко растворяют защитную оксидную пленку на поверхности алюминия, он начинает реагировать с водой, в результате чего металл растворяется с выделением водорода (коррозия алюминия с водородной деполяризацией).
Также оксидную пленку разрушают соли ртути, меди и ионы хлора.
Коррозия алюминия не наблюдается только в тех средах, где на поверхности металла образуется защитная оксидная пленка
Оксид алюминия на поверхности металла образуется только в интервале рН от 3 до 9!
Очень сильно влияет на коррозионную стойкость Al его чистота. Для изготовления химических агрегатов, оборудования используют только металл высокой чистоты (без примесей), например алюминий марки АВ1 и АВ2.


У меня казан алюминиевый после посудомойки кристаллы белые выращивает, как снег.
Хотя уже давно не ставлю в посудомойку, он продолжает кристаллы выращивать
Оксидная пленка предохраняет алюминий от коррозии. Если ее повредить, алюминий очень быстро разрушается, превращаясь в порошок. Не корродируют только благородные металлы - золото, платина и другие из той же группы таблицы Менделеева.
Это не так, вас ввели в заблуждение. При контакте с некоторыми другими металлами и некоторыми химическими соединениями начинает очень хорошо коррозировать. Это очень активный металл.Реакция алюминий+ртуть
Считается, что алюминий не подвергается воздействию коррозии, но это не так. Алюминий – металл, обладающий высокой реакционной способностью. Под воздействием кислорода и влаги он окисляется. Данный процесс ускоряется за счет агрессивных сред и наличия рядом с алюминием некоторых материалов. В результате металл темнеет и покрывается рыхлым слоем окислов.
Почти все металлы подвержены коррозии. Коррозия всегда имеет место во всех известных металлах. Благородные металлы, включая родий, палладий, серебро, платину и золото, обладают высокой коррозионной стойкостью, и их коррозия не очень заметна в течение короткого времени.
Поинтересуйтесь у автомехаников, что происходит с головками блоков многих авто, а ещё с алюминиевыми крыльями и элементами подвески у некоторых.
И это только примеры на виду.

в ГБЦ алюминиевых каналы разъедает напрочь.. кстати в чугунных старинных такого нет, только гильзы меняй.. И кстати насколько старинных? тот же форд мондео . гбц из чугуна
Окисная пленка у алюминия совсем не стойкая и коррозия ему причиняет большой вред. Так что ваши сведения не верны! Если говорить об этом свойстве, то ваш кумир титан! Титан очень хорошо окисляется на воздухе, но окисная плёнка очень плотная и стойкая, из-за этого титан не требует дополнительного покрытия, что удивительно!
Активные металлы

Среди всех металлов некоторые отличаются тем, что они очень легко вступают в восстановительные реакции. Такие металлы имеют много схожих свойств и объединяются в класс активных металлов.
Положение активных металлов в таблице Менделеева
К активным металлам относятся три группы элементов:
- щелочные металлы;
- щелочноземельные металлы;
- алюминий.
Щелочные металлы находятся в первой группе таблицы Менделеева, то есть занимают в ней крайнее левое положение. В частности щелочными металлами являются:
- литий (Li);
- натрий (Na);
- калий (K);
- рубидий (Rb);
- цезий (Cs);
- франций (Fr).
Щелочноземельные металлы находятся во второй группе, то есть правее щелочных металлов. К ним относятся:
В целом активные металлы отличаются тем, что имеют один или два валентных электрона, поэтому они легко отдают эти электроны в ходе химических реакций, выступая в качестве восстановителей. Степень активности металла можно оценить по его расположению в электрохимическом ряде активности металлов. Чем левее там находится металл, тем сильнее выражены его восстановительные свойства. Крайнее левое положение в ряде занимает литий. В вот крайне правое положение в ряду занимает золото, именно поэтому оно почти не окисляется кислотами.

Электрохимический ряд напряжений металлов
Алюминий – это так называемый постпереходный металл, по своим свойствам он находится где-то между активными и среднеактивными металлами. Разные ученые придерживаются различного мнения о том, стоит ли считать алюминий активным металлом.
Активные металлы не встречаются в природе в чистом виде, так как они быстро вступают в химические реакции с другими элементами. Чаще всего в природе они присутствуют в виде оксидов. Например, даже если алюминий получен в чистом виде, то на воздухе он быстро покрывается оксидной пленкой.
Свойства щелочных металлов
Цвет всех щелочных металлов – белый, с серебристым оттенком. Исключением является цезий, имеющий серебристо-желтый цвет. Щелочные металлы можно резать простым скальпелем, так как у них низкая твердость. Также они имеют малую плотность – от 534 кг/м 3 у лития до 1900 кг/м 3 у цезия. Литий, калий и натрий настолько легкие, что они плавают в воде, но построить корабль из них не получится, так как вода быстро окисляет и разрушает эти металлы. Франций и цезий плавятся уже при комнатной температуре, а самый тугоплавкий щелочной металл – это литий, плавящийся при 180,6°С.
Для защиты щелочных металлов от воздуха и волы их хранят в керосине. При реагировании лития с водой выделяется водород, а натрий и особенно калий просто взрываются в воде. При взаимодействии с кислородом образуются оксиды.
Свойства щелочноземельных металлов
Щелочноземельные металлы значительно тверже щелочных, их нельзя просто взять и разрежать ножом. Также они тяжелее – их плотность колеблется от 1550 кг/м 3 у кальция до 5500 кг/м 3 у радия. Цвет щелочноземельных металлов – серый. Температуры плавления этих элементов находятся в диапазоне 650-840°С. Исключение – бериллий, плавящийся лишь при 1278°С.
Чем больше порядковый номер щелочноземельного металла в таблице Менделеева, тем выше его химическая активность. Например, бериллий вообще не взаимодействует с кислородом и по своим свойствам напоминает алюминий. Наиболее активные стронций, барий и радий приходится хранить в керосине, также как и щелочные металлы.
Подведение итогов
Активные металлы отличаются тем, что имеют лишь один-два валентных электрона, которые они легко отдают. Поэтому эти элементы очень быстро вступают в химические реакции, а в природе в чистом виде не встречаются.

Металлы, легко вступающие в реакции, называются активными металлами. К ним относятся щелочные, щелочноземельные металлы и алюминий.
Положение в таблице Менделеева
Металлические свойства элементов ослабевают слева направо в периодической таблице Менделеева. Поэтому наиболее активными считаются элементы I и II групп.
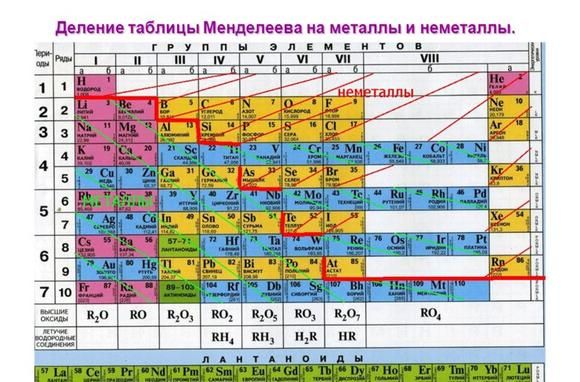
Рис. 1. Активные металлы в таблице Менделеева.
Все металлы являются восстановителями и легко расстаются с электронами на внешнем энергетическом уровне. У активных металлов всего один-два валентных электрона. При этом металлические свойства усиливаются сверху вниз с возрастанием количества энергетических уровней, т.к. чем дальше электрон находится от ядра атома, тем легче ему отделиться.
Наиболее активными считаются щелочные металлы:
- литий;
- натрий;
- калий;
- рубидий;
- цезий;
- франций.
К щелочноземельным металлам относятся:
- бериллий;
- магний;
- кальций;
- стронций;
- барий;
- радий.
Узнать степень активности металла можно по электрохимическому ряду напряжений металлов. Чем левее от водорода расположен элемент, тем более он активен. Металлы, стоящие справа от водорода, малоактивны и могут взаимодействовать только с концентрированными кислотами.

Рис. 2. Электрохимический ряд напряжений металлов.
К списку активных металлов в химии также относят алюминий, расположенный в III группе и стоящий левее водорода. Однако алюминий находится на границе активных и среднеактивных металлов и не реагирует с некоторыми веществами при обычных условиях.
Свойства
Активные металлы отличаются мягкостью (можно разрезать ножом), лёгкостью, невысокой температурой плавления.
Основные химические свойства металлов представлены в таблице.
Реакция
Уравнение
Исключение
Щелочные металлы самовозгораются на воздухе, взаимодействуя с кислородом
Литий реагирует с кислородом только при высокой температуре
Щелочноземельные металлы и алюминий на воздухе образуют оксидные плёнки, а при нагревании самовозгораются
Реагируют с простыми веществами, образуя соли
Алюминий не вступает в реакцию с водородом
Бурно реагируют с водой, образуя щёлочи и водород
Реакция с литием протекает медленно. Алюминий реагирует с водой только после удаления оксидной плёнки
Реагируют с кислотами, образуя соли
Взаимодействуют с растворами солей, сначала реагируя с водой, а затем с солью
Активные металлы легко вступают в реакции, поэтому в природе находятся только в составе смесей – минералов, горных пород.

Рис. 3. Минералы и чистые металлы.
Что мы узнали?
К активным металлам относятся элементы I и II групп – щелочные и щелочноземельные металлы, а также алюминий. Их активность обусловлена строением атома – немногочисленные электроны легко отделяются от внешнего энергетического уровня. Это мягкие лёгкие металлы, быстро вступающие в реакцию с простыми и сложными веществами, образуя оксиды, гидроксиды, соли. Алюминий находится ближе к водороду и для его реакции с веществами требуются дополнительные условия – высокие температуры, разрушение оксидной плёнки.
Химические свойства алюминия

Одним из распространённых элементов планеты является алюминий. Физические и химические свойства алюминия применяются в промышленности. Все, что необходимо знать, про этот металл вы найдете в нашей статье.
Строение атома
Алюминий – это 13 элемент периодической таблицы. Он находится в третьем периоде, III группе, главной подгруппе.
Свойства и применение алюминия связаны с его электронным строением. Атом алюминия имеет положительно заряженное ядро (+13) и 13 отрицательно заряженных электронов, располагающихся на трёх энергетических уровнях. Электронная конфигурация атома – 1s 2 2s 2 2p 6 3s 2 3p 1 .
На внешнем энергетическом уровне находится три электрона, которые определяют постоянную валентность III. В реакциях с веществами алюминий переходит в возбуждённое состояние и способен отдавать все три электрона, образуя ковалентные связи. Как и другие активные металлы, алюминий является мощным восстановителем.
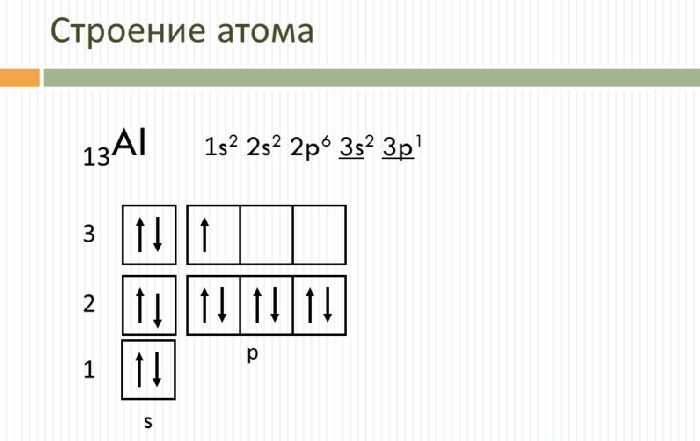
Рис. 1. Строение атома алюминия.
Алюминий – амфотерный металл, образующий амфотерные оксиды и гидроксиды. В зависимости от условий соединения проявляют кислотные или основные свойства.
Физическое описание
- лёгкостью (плотность 2,7 г/см 3 );
- серебристо-серым цветом;
- высокой электропроводностью;
- ковкостью;
- пластичностью;
- температурой плавления – 658°C;
- температурой кипения – 2518,8°C.
Из металла делают жестяные ёмкости, фольгу, проволоку, сплавы. Алюминий используют при изготовлении микросхем, зеркал, композитных материалов.

Рис. 2. Жестяные ёмкости.
Алюминий – парамагнетик. Металл притягивается магнитом только в присутствии магнитного поля.
Химические свойства
На воздухе алюминий быстро окисляется, покрываясь оксидной плёнкой. Она защищает металл от коррозии, а также препятствует взаимодействию с концентрированными кислотами (азотной, серной).
При обычных условиях реакции с алюминием возможны только после удаления оксидной плёнки. Большинство реакций протекают при высоких температурах.
Основные химические свойства элемента описаны в таблице.
Реакция
Описание
Уравнение
Горит при высоких температурах с выделением тепла
Взаимодействует с серой при температуре выше 200°С, с фосфором – при 500°С, с азотом – при 800°С, с углеродом – при 2000°С
Реагирует при обычных условиях, с йодом – при нагревании в присутствии катализатора (воды)
Реагирует с разбавленными кислотами при обычных условиях, с концентрированными – при нагревании
Реагирует с водными растворами щелочей и при сплавлении
Вытесняет менее активные металлы
Алюминий не реагирует непосредственно с водородом. Реакция с водой возможна после снятия оксидной плёнки.

Рис. 3. Реакция алюминия с водой.
Алюминий – амфотерный активный металл с постоянной валентностью. Обладает небольшой плотностью, высокой электропроводностью, пластичностью. Притягивается магнитом только в присутствии магнитного поля. Алюминий реагирует с кислородом, образуя защитную плёнку, которая препятствует реакциям с водой, концентрированными азотной и серной кислотами. При нагревании взаимодействует с неметаллами и концентрированными кислотами, при обычных условиях – с галогенами и разбавленными кислотами. В оксидах вытесняет менее активные металлы. Не реагирует с водородом.
Урок 10. Алюминий

Алюминий — химический элемент третьей группы, третьего периода, следовательно, строение его атома можно изобразить схемой:

Имея на внешнем уровне атома три валентных электрона, алюминий проявляет постоянную валентность III.
Алюминий — мягкий, лёгкий металл. Очень пластичный: вытягивается в тончайшую проволоку, прокатывается в фольгу толщиной всего 0,005 мм. В такую фольгу упаковывают шоколад. Сплавы алюминия с другими металлами имеют высокую прочность, сравнимую со сталью (например, дуралюмин), в то же время они существенно легче. Из таких сплавов делают самолёты, поэтому алюминий называют «крылатым металлом».
Алюминий — очень активный металл, он мгновенно окисляется на воздухе:
причем оксидная плёнка покрывает его поверхность тончайшим слоем. Прочная оксидная плёнка предохраняет алюминий от коррозии, например, алюминиевые предметы не взаимодействуют с водой. Но, если разрушить оксидную плёнку, алюминий активно реагирует с водой, даже при нормальных условиях:
Алюминий активно реагирует с неметаллами:
Вопрос. Почему атом йода принял только один электрон?
Задание 10.1. Составьте уравнения реакций алюминия с серой, азотом (N2).
Алюминий может вытеснять некоторые металлы из их оксидов:
Этот процесс называется «алюминотермия» и применяется для получения некоторых металлов из их оксидов. В результате этого процесса выделяется значительное количество теплоты, так что металл получается в расплавленном состоянии. Поэтому алюминотермия используется для сварки некоторых металлов.
Особенность алюминия заключается в том, что он может реагировать и с кислотами, и со щелочами, т. е. проявляет амфотерные свойства:
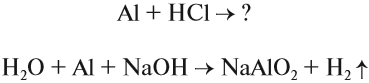
В последней реакции получилась соль метаалюминиевой кислоты, которая в свободном состоянии не выделена.
Задание 10.2. Расставьте коэффициенты в последнем уравнении реакции, пользуясь методом электронного баланса.
Такие же амфотерные свойства проявляют и оксид алюминия, и гидроксид алюминия. Другими словами, оксид алюминия реагирует и с кислотами, и со щелочами. Поскольку в химических реакциях особенно легко реагируют вещества с противоположными свойствами, при взаимодействии с кислотами оксид алюминия ведет себя как обычный основный оксид.
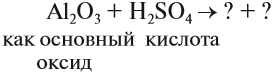
Задание 10.3. Составьте уравнение реакции оксида алюминия с серной кислотой.
При взаимодействии со щелочами оксид алюминия ведет себя как кислотный оксид. А в этом случае, необходимо выяснить, какая кислота соответствует данному оксиду.
Вспомните или см. урок 2.1:
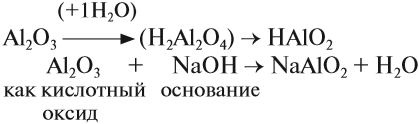
Вопрос. Можно ли в алюминиевой посуде длительное время хранить кислые щи? Щелочные растворы?
Такие же амфотерные свойства проявляет и гидроксид алюминия, т. е. он растворяется и в кислотах, и в щелочах:

Обратите внимание: поскольку здесь гидроксид алюминия реагирует со щёлочью (основанием), он проявляет свойства кислоты и мы формально записываем его состав в «кислотном» виде, т. е. атомы водорода записываются впереди.
Задание 10.4. Составьте уравнения реакций гидроксида алюминия с серной кислотой и гидроксидом кальция. Запишите оба уравнения в ионном виде.
Очень важно понимать, что осадок гидроксида алюминия растворяется в избытке щелочи. Поэтому при получении осадка гидроксида алюминия нужно к щёлочи прибавлять избыток растворимой соли алюминия. Если действовать наоборот, то лишняя щёлочь тут же растворит гидроксид алюминия и осадок не получится. Растворение осадка гидроксида алюминия в избытке щёлочи является качественным признаком присутствия солей алюминия в данном растворе.
Необходимо отметить, что все вышеприведенные реакции взаимодействия алюминия и его соединений со щелочами происходят при сплавлении (без воды). В растворах щелочей происходит растворение этих веществ, что приводит к образованию комплексных соединений:
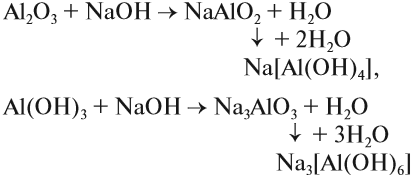
При этом атом алюминия входит в состав прочного комплексного иона, который практически не диссоциирует.
Поэтому растворение алюминия* в растворе щёлочи можно выразить уравнением:
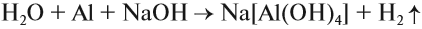
* Аналогичными амфотерными свойствами обладают цинк и его соединения.
Задание 10.5. Расставьте коэффициенты в последнем уравнении реакции, пользуясь методом электронного баланса.
Аналогичными свойствами обладает цинк, его оксид и гидроксид.
Алюминий занимает третье место (после кислорода и кремния) по распространённости на нашей планете и первое место среди металлов. Он входит в состав гранита, глины, драгоценных камней (основу сапфира, аметиста, рубина составляет оксид алюминия). Практическое применение находит как сам алюминий, так и его сплавы, а также некоторые его соли. Так, сульфат алюминия применяется для очистки питьевой воды.
Вопрос. Какие сплавы алюминия вам известны? Где они применяются? (См. урок 8.2.)

Выводы
Алюминий — амфотерный металл, причем некоторые его соединения (оксид, гидроксид) также амфотерны. Поскольку посуда из алюминия встречается на каждой кухне, эти свойства алюминия должен знать каждый и помнить: в алюминиевой посуде кислые и солёные продукты, щелочные растворы хранить нельзя!
Читайте также:
