Аммиак реагирует с металлами
Обновлено: 21.09.2024
Соли аммония – это соли, состоящие из катиона аммония и аниона кислотного остатка .
Способы получения солей аммония
1. Соли аммония можно получить взаимодействием аммиака с кислотами . Реакции подробно описаны выше.
2. Соли аммония также получают в обменных реакциях между солями аммония и другими солями.
Например , хлорид аммония реагирует с нитратом серебра:
3. Средние соли аммония можно получить из кислых солей аммония . При добавлении аммиака кислая соль переходит в среднюю.
Например , гидрокарбонат аммония реагирует с аммиаком с образованием карбоната аммония:
Химические свойства солей аммония
1. Все соли аммония – сильные электролиты , почти полностью диссоциируют на ионы в водных растворах:
NH4Cl ⇄ NH4 + + Cl –
2. Соли аммония проявляют свойства обычных растворимых солей –вступают в реакции обмена с щелочами, кислотами и растворимыми солями , если в продуктах образуется газ, осадок или образуется слабый электролит.
Например , карбонат аммония реагирует с соляной кислотой. При этом выделяется углекислый газ:
Соли аммония реагируют с щелочами с образованием аммиака.
Например , хлорид аммония реагирует с гидроксидом калия:
NH4Cl + KOH → KCl + NH3 + H2O
Взаимодействие с щелочами — качественная реакция на ионы аммония. Выделяющийся аммиак можно обнаружить по характерному резкому запаху и посинению лакмусовой бумажки.
3. Соли аммония подвергаются гидролизу по катиону , т.к. гидроксид аммония — слабое основание:
4. При нагревании соли аммония разлагаются . При этом если соль не содержит анион-окислителя, то разложение проходит без изменения степени окисления атома азота. Так разлагаются хлорид, карбонат, сульфат, сульфид и фосфат аммония:
Если соль содержит анион-окислитель, то разложение сопровождается изменением степени окисления атома азота иона аммония. Так протекает разложение нитрата, нитрита и дихромата аммония:
При температуре выше 300°C:
Разложение бихромата аммония («вулканчик»). Оранжевые кристаллы дихромата аммония под действием горящей лучинки бурно реагируют. Дихромат аммония – особенная соль, в ее составе – окислитель и восстановитель. Поэтому «внутри» этой соли может пройти окислительно-восстановительная реакция (внутримолекулярная ОВР):
Окислитель – хром (VI) превращается в хром (III), образуется зеленый оксид хрома. Восстановитель – азот, входящий в состав иона аммония, превращается в газообразный азот. Итак, дихромат аммония превращается в зеленый оксид хрома, газообразный азот и воду. Реакция начинается от горящей лучинки, но не прекращается, если лучинку убрать, а становится еще интенсивней, так как в процессе реакции выделяется теплота, и, начавшись от лучинки, процесс лавинообразно развивается. Оксид хрома (III) – очень твердое, тугоплавкое вещество зеленого цвета, его используют как абразив. Температура плавления – почти 2300 градусов. Оксид хрома – очень устойчивое вещество, не растворяется даже в кислотах. Благодаря устойчивости и интенсивной окраске окись хрома используется при изготовлении масляных красок.
Видеоопыт разложения дихромата аммония можно посмотреть здесь.
Аммиак. Отгаданные загадки
Будет ли аммиак реагировать с металлами? У атома азота в этом соединении формально восемь внешних электронов (пять своих и три оттянуты от атомов водорода), а металлы стремятся свои валентные электроны отдать. С одной стороны, атому азота уже некуда их принять. С другой – в аммиаке есть атомы водорода, частично обедненные электронами, т. е. имеющие возможность принять их.
Известно, что активные металлы вытесняют водород из воды, а чем аммиак хуже? Ну только разве тем, что аммиак газообразен при температурах выше его точки кипения, равной –33,4 °С. Соответственно газ NH3 рассредоточен в пространстве, и требуется дополнительный подогрев, чтобы реакция пошла. Именно накаливанием металлов в атмосфере аммиака чаще всего и получают нитриды. (Нитриды – это соединения, состоящие из двух элементов, один из которых азот, причем атомы азота имеют в этом соединении отрицательный заряд.) Например:
2. Реакции с неметаллами.
Формальная степень окисления азота в аммиаке –3. Следовательно, аммиак может реагировать с кислородом (и другими окислителями!), увеличивая при этом степень окисления азота, т. е. отдавая электроны. Однако на пути к положительным степеням окисления находится нулевая – простое вещество азот, как мы уже выяснили, необычайно устойчиво.
Можно предположить, что при реакции аммиака с кислородом будут образовываться азот и вода. Именно так и происходит в действительности. Следует добавить, что аммиак горит только в чистом кислороде, а не на воздухе:
Как быть, если надо получить из аммиака оксиды азота? Вспомним о катализаторах – веществах, которые ускоряют реакцию или меняют ее направление. Катализаторы используют и при получении оксидов азота из аммиака и кислорода. Реакцию каталитического окисления проводят на металлической платине:
Интересна реакция аммиака с другим простым веществом – озоном, более агрессивным окислителем, чем кислород. Озон переводит азот из степени окисления –3 в степень окисления +5. Но не весь! В результате получается нитрат аммония:
3. Реакция с водой.
Мы уже говорили о хорошей растворимости аммиака в воде. Но почему фенолфталеин становится в таком растворе малиновым? Загадка?
Попробуем разобраться, откуда появилась в растворе щелочная среда. Для начала вспомним теорию электролитической диссоциации. В водных растворах все ионы и молекулы гидратированы – окружены «шубой» из молекул воды, сориентированных соответствующим образом: к атомам водорода потянулись «кислородные половинки», а к атому азота – «водородная половинка» (рис. 5).
Рис. 5. Аммиак в воде:
атом азота – черный шар; атомы кислорода – большие белые шары; атомы водорода – малые белые шары
В какой-то момент образовалась конструкция Н3N•••НОН. Далее, известно, что вода слабо, но диссоциирует по реакции:
Поскольку электроотрицательность кислорода больше, чем азота, связь кислорода с водородом полярнее, чем связь азота с водородом. Можно предположить, что равновесие в реакции диссоциации гидратированной молекулы аммиака будет больше смещено в сторону образования ионов (по сравнению с водой):
В растворе появляется весьма ощутимый избыток ионов ОН – , и фенолфталеин сигнализирует об этом малиновой окраской. Стоит подчеркнуть, что все эти реакции обратимые. Поэтому вместе со щелочной реакцией среды (правая часть уравнения) растворы аммиака обладают еще и характерным запахом аммиака, выделяющегося из раствора (левая часть уравнения), и заметным количеством нестойкого гидратированного молекулярного аммиака (это подтверждается, например, реакциями образования аммиачных комплексов с ионами металлов).
4. Реакции с кислотами.
Как слабое, но все же основание, водный раствор аммиака реагирует с кислотами с образованием соли и воды:
Соли аммония, подобно солям натрия и калия, хорошо растворяются в воде, но при этом частично гидролизуются:
С кислотами реагирует и газообразный аммиак, причем не только с растворами, но и с газообразными кислотами. В лабораториях, в которых работают с растворами соляной кислоты и аммиака, постоянно появляется белый налет на окружающих предметах. Даже небольших количеств аммиака и хлороводорода в воздухе достаточно для протекания реакции:
5. Реакции со щелочами.
Газообразный аммиак со щелочами не реагирует. А вот водный раствор аммиака «откликается» на добавление щелочи. Поскольку при растворении аммиака в воде протекает обратимая реакция образования иона аммония и гидроксид-иона, то добавление последнего в раствор смещает равновесие, растворимость аммиака уменьшается (а интенсивность запаха соответственно увеличивается):
NН4OH + NaOH = NH3 + H2O + NaOH.
Физические свойства аммиака в цифрах
Молярная масса M(NH3) = 17 г/моль. Температура плавления равна –78 °C, температура кипения –33 °С. Плотность газообразного аммиака при нормальных условиях (0 °С, 1 атм) 0,771 г/л (аммиак легче воздуха почти в два раза). Растворимость при атмосферном давлении и 0 °С около 90 л (!) газа в 100 г воды, при 20 °С – 65 л в 100 г воды.
При сравнении физических свойств аммиака и азота в первую очередь обращает на себя внимание температура кипения. Почему у аммиака она настолько выше? У азота – почти –200 °С, а у аммиака – только –33 °С. Загадка? Попробуем отгадать.
Для начала сопоставим температуры кипения соединений с водородом элементов V, VI и VII групп главных подгрупп периодической системы (рис. 6).
Рис. 6. Графики зависимости температур кипения
водородных соединений элементов V( · ), VI( C )и VII( Д ) групп
главных подгрупп от номера периода (массы атома)
Если экстраполировать графики такой зависимости, можно оценить, какими должны бы быть эти температуры, исходя из общей закономерности. Из графика видно, что аммиак, вода и фтороводород имеют аномально высокие температуры кипения: аммиак – примерно на 50 °С выше «теоретической», фтороводород – на 100 °С, а вода – на 160 °С. Во-первых, видно, что аммиак не одинок, а во-вторых, вспоминается, что у азота, кислорода и фтора самая высокая электроотрицательность. Значит, и связи этих элементов с водородом самые полярные. Водород в таких соединениях почти без электрона и поэтому сильно притягивается к неподеленным парам электронов, которые есть и у азота, и у кислорода, и у фтора. Образуются водородные связи. Они, конечно, слабее обычных ковалентных связей, но их много. И это «много» многое значит.
Водородные связи играют в природе огромную роль. Например, спираль из двух молекул ДНК образуется только за счет водородных связей. Такие связи сравнительно легко разрываются, когда происходит считывание информации с определенного участка ДНК. Когда водородных связей много, получается крепкое связывание в целом.
В заключение стоит сказать, что связь водорода с фтором полярнее, чем связь азота с водородом, и соответственно притяжение сильнее, а температура кипения HF выше, чем NH3. У воды же самая высокая температура кипения из этой троицы, потому что молекулы воды образуют водородные связи сразу «двумя руками» – две неподеленные пары электронов и два атома водорода в каждой молекуле! Аммиак и фтороводород по своему строению «однорукие».
Химические свойства аммиака (дополнение)
Аммиак сам по себе устойчив и разлагается только при очень высоких температурах. Но если проводить нагревание в присутствии обыкновенного железа, он разлагается на азот и водород при значительно более низких температурах. Интересно, что при каталитическом разложении небольшая часть аммиака всегда остается в смеси газов, независимо от времени и температуры проведения реакции. Именно этот факт подсказал ученым мысль о возможности связывания атмосферного азота через аммиак. Действительно, логично предположить, что разложение аммиака – процесс обратимый, тогда изменением условий и подбором катализатора можно сместить процесс в сторону образования аммиака до такой степени, что это станет выгодно для его промышленного получения.
Еще немного о реакциях аммиака с простыми веществами. Интересны реакции аммиака с галогенами. Йод не может изменить степень окисления азота! Он просто сам диспропорционирует:
Нитрид йода (по названию понятно, что у йода в этом соединении степень окисления положительная), или иначе йодистый азот, в сухом виде разлагается со взрывом даже от простого сотрясения.
Бром и хлор могут отнять у азота только по три электрона, переведя в простое вещество. И только фтору под силу перевалить через эту сверхустойчивую нулевую степень окисления азота. Получается трифторид. И это максимально возможный, просто потому, что у атомов второго периода нет «запасных» орбиталей. Не бывает поэтому и пятивалентного азота!
Жидкий аммиак – хороший растворитель. Реакции в жидком аммиаке идут по тем же законам, что и в воде, а вот растворимость в воде и в жидком аммиаке у соединений различная. Например, реакция
в воде идет в сторону образования нерастворимого бромида серебра, а в жидком аммиаке – в сторону образования нерастворимого бромида бария.
Из жидкого аммиака, как и из воды, активные металлы вытесняют водород. Например, реакция с цезием протекает за несколько минут:
А вот аналогичная реакция с натрием протекает значительно дольше. При этом образуется сольватированный электрон! (Сольватация – процесс, аналогичный гидратации, только в других растворителях.)
Экологические свойства аммиака
Аммиак – активное и «едкое» соединение (едкость кислот и щелочей проявляется в том, что большие количества ионов Н + или ОН – разъедают живую ткань растений, животных и, естественно, человека; впрочем, неживую «ткань» они тоже разъедают). Однако если заменить в аммиаке один, два или все три атома водорода на органические радикалы, то «едкость» существенно снижается, а основные свойства остаются. Такие соединения выполняют в живой природе функции оснований.
Животные и человек используют уже приготовленные растениями азотсодержащие органические соединения, поэтому для нас с вами аммиак, безусловно, яд. При попадании на кожу концентрированный раствор аммиака вызывает химические ожоги, при вдыхании большого количества аммиака может наступить отек легких – реакция организма на вдыхание почти всех едких веществ.
Однако, как и многие другие яды, в малых дозах аммиак оказывает положительное влияние на организм: 10%-й раствор аммиака в воде используют в медицине для стимуляции дыхания (его не пьют, конечно, а просто дают понюхать), центральной нервной системы и т. п.
В больших количествах аммиак вреден и для растений. Но в небольших количествах он им необходим. Ведь без азота, и в частности без аммиака, не построить те органические соединения, которые потом превращаются в растительные белки, а в дальнейшем – в белки животных. Большим количествам газообразного аммиака растения противостоят по-разному. Некоторые стараются прекратить ему доступ внутрь (например, закрывают устьица на листьях). Другие растения перерабатывают аммиак с помощью соответствующих ферментов в нитрат-ионы, которые для растений не ядовиты, тем самым запасая ценный для своего развития элемент.
Аммиак: получение и свойства
В молекуле аммиака NH3 атом азота соединен тремя одинарными ковалентными полярными связями с атомами водорода:

Геометрическая форма молекулы аммиака — правильная треугольная пирамида. Валентный угол H-N-H составляет 107,3 о :

У атома азота в аммиаке на внешнем энергетическом уровне остается одна неподеленная электронная пара. Эта электронная пара оказывает значительное влиение на свойства аммиака, а также на его структуру. Электронная структура аммиака — тетраэдр , с атомом азота в центре:

Аммиак – бесцветный газ с резким характерным запахом. Ядовит. Весит меньше воздуха. Связь N-H — сильно полярная, поэтому между молекулами аммиака в жидкой фазе возникают водородные связи. При этом аммиак очень хорошо растворим в воде, т.к. молекулы аммиака образуют водородные связи с молекулами воды.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поск ольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например , аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
Например , гидролиз нитрида кальция:
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
Процесс проводят при температуре 500-550 о С и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непровзаимодействовавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Химические свойства аммиака
1. В водном растворе аммиак проявляет основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H + ), он превращается в ион аммония. Реакция может протекать и в водном растворе, и в газовой фазе:

Таким образом, среда водного раствора аммиака – щелочная. Однако аммиак – слабое основание . При 20 градусах один объем воды поглощает до 700 объемов аммиака.
Видеоопыт растворения аммиака в воде можно посмотреть здесь.
2. Как основание, аммиак взаимодействует с кислотами в растворе и в газовой фазе с образованием солей аммония.
Например , аммиак реагирует с серной кислотой с образованием либо кислой соли – гидросульфата аммония (при избытке кислоты), либо средней соли – сульфата аммония (при избытке аммиака):
Еще один пример : аммиак взаимодействует с водным раствором углекислого газа с образованием карбонатов или гидрокарбонатов аммония:
Видеоопыт взаимодействия аммиака с концентрированными кислотами – азотной, серной и и соляной можно посмотреть здесь.
В газовой фазе аммиак реагирует с летучим хлороводородом. При этом образуется густой белый дым – это выделяется хлорид аммония.
NH3 + HCl → NH4Cl
Видеоопыт взаимодействия аммиака с хлороводородом в газовой фазе (дым без огня) можно посмотреть здесь.
3. В качестве основания, водный раствор аммиака реагирует с растворами солей тяжелых металлов , образуя нерастворимые гидроксиды.
Например , водный раствор аммиака реагирует с сульфатом железа (II) с образованием сульфата аммония и гидроксида железа (II):
4. Соли и гидроксиды меди, никеля, серебра растворяются в избытке аммиака, образуя комплексные соединения – аминокомплексы.
Например , хлорид меди (II) реагирует с избытком аммиака с образованием хлорида тетрамминомеди (II):
Гидроксид меди (II) растворяется в избытке аммиака:
5. Аммиак горит на воздухе , образуя азот и воду:
Если реакцию проводить в присутствии катализатора (Pt), то азот окисляется до NO:
6. За счет атомов водорода в степени окисления +1 аммиак может выступать в роли окислителя , например в реакциях с щелочными, щелочноземельными металлами, магнием и алюминием . С металлами реагирует только жидкий аммиак.
Например , жидкий аммиак реагирует с натрием с образованием амида натрия:
Также возможно образование Na2NH, Na3N.
При взаимодействии аммиака с алюминием образуется нитрид алюминия:
2NH3 + 2Al → 2AlN + 3H2
7. За счет азота в степени окисления -3 аммиак проявляет восстановительные свойства. Может взаимодействовать с сильными окислителями — хлором, бромом, пероксидом водорода, пероксидами и оксидами некоторых металлов. При этом азот окисляется, как правило, до простого вещества.
Например , аммиак окисляется хлором до молекулярного азота:
Пероксид водорода также окисляет аммиак до азота:
Оксиды металлов , которые в электрохимическом ряду напряжений металлов расположены справа — сильные окислители. Поэтому они также окисляют аммиак до азота.
Например , оксид меди (II) окисляет аммиак:
2NH3 + 3CuO → 3Cu + N2 + 3H2O
Азотная кислота
Азотная кислота является одной из самых сильных минеральных кислот, в концентрированном виде выделяет пары желтого цвета с резким запахом. За исключением золота и платины растворяет все металлы.
Применяют азотную кислоту для получения красителей, удобрений, органических нитропродуктов, серной и фосфорной кислот. В результате ожога азотной кислотой образуется сухой струп желто-зеленого цвета.

В промышленности азотную кислоту получают в результате окисления аммиака на платино-родиевых катализаторах.
Чистая азотная кислота впервые была получена действием на селитру концентрированной серной кислоты:
Является одноосновной сильной кислотой, вступает в реакции с основными оксидами, основаниями. С солями реагирует при условии выпадения осадка, выделения газа или образования слабого электролита.

При нагревании азотная кислота распадается. На свету (hv) также происходит подобная реакция, поэтому азотную кислоту следует хранить в темном месте.
Азотная кислота способна окислить все неметаллы, при этом, если кислота концентрированная, азот обычно восстанавливается до NO2, если разбавленная - до NO.

В любой концентрации азотная кислота проявляет свойства окислителя, при этом азот восстанавливается до степени окисления от +5 до -3. На какой именно степени окисления остановится азот, зависит от активности металла и концентрации азотной кислоты.
Для малоактивных металлов (стоящих в ряду напряжений после водорода) реакция с концентрированной азотной кислотой происходит с образованием нитрата и преимущественно NO2.
С разбавленной азотной кислотой газообразным продуктом преимущественно является NO.
В реакциях с металлами, стоящими левее водорода в ряду напряжений, возможны самые разные газообразные (и не газообразные) продукты: бурый газ NO2, NO, N2O, атмосферный газ N2, NH4NO3.
Помните о закономерности: чем более разбавлена кислота и активен металл, тем сильнее восстанавливается азот. Ниже представлены реакции цинка с азотной кислотой в различных концентрациях.

Посмотрите на таблицу ниже, в которой также отражены изученные нами закономерности.

Концентрированная холодная азотная кислота пассивирует хром, железо, алюминий, никель, свинец и бериллий. Это происходит за счет оксидной пленки, которой покрыты данные металлы.
Al + HNO3(конц.) ⇸ (реакция не идет)
При нагревании или амальгамировании (покрытие ртутью) перечисленных металлов реакция с азотной кислотой идет, так как оксидная пленка на поверхности металлов разрушается.
Соли азотной кислоты - нитраты NO3 -
Получают нитраты в ходе реакции азотной кислоты с металлами, их оксидами и основаниями.
В реакциях с оксидами и основаниями газообразный продукт обычно не выделяется.

Нитрат аммония получают реакция аммиака с азотной кислотой.
Обратите внимание на следующую закономерность: концентрированная азотная кислота, как правило, окисляет железо и хром до +3. Разбавленная кислота - до +2.
- Реакции с металлами, основаниями и кислотами
Как и для всех солей, из нитратов можно вытеснить металл другим более активным. Соли реагируют с основаниями и кислотами, если в результате реакции выпадает осадок, выделяется газ или образуется слабый электролит (вода).

Нитраты разлагаются в зависимости от активности металла, входящего в их состав.


Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Азотная кислота
Холодная концентрированная азотная кислота не вступает в реакцию с алюминием, происходит пассивирование.
2. Реакция концентрированной азотной кислоты с малоактивными металлами сопровождается выделением газа
В реакциях концентрированной азотной кислоты и малоактивных металлов преимущественно выделяется NO2.
3. Если в результате реакции активного металла с азотной кислотой выделилось твердое вещество, то речь идет о
Твердый продукт, образовавшийся в ходе реакции с азотной кислотой, нитрат аммония - NH4NO3
Разложение нитрата аммония протекает по схеме: AgNO3 → Ag + NO2 + O2
Азотной кислотой окрашивает пораженную в результате ожога кожу в желтый цвет.
Аммиак реагирует с металлами
Температура кипения азота составляет -195,8 °C. Однако быстрого замораживания объектов, которое часто демонстрируют в кинофильмах, не происходит. Даже для заморозки растения нужно продолжительное время, это связано с низкой теплоемкостью азота.
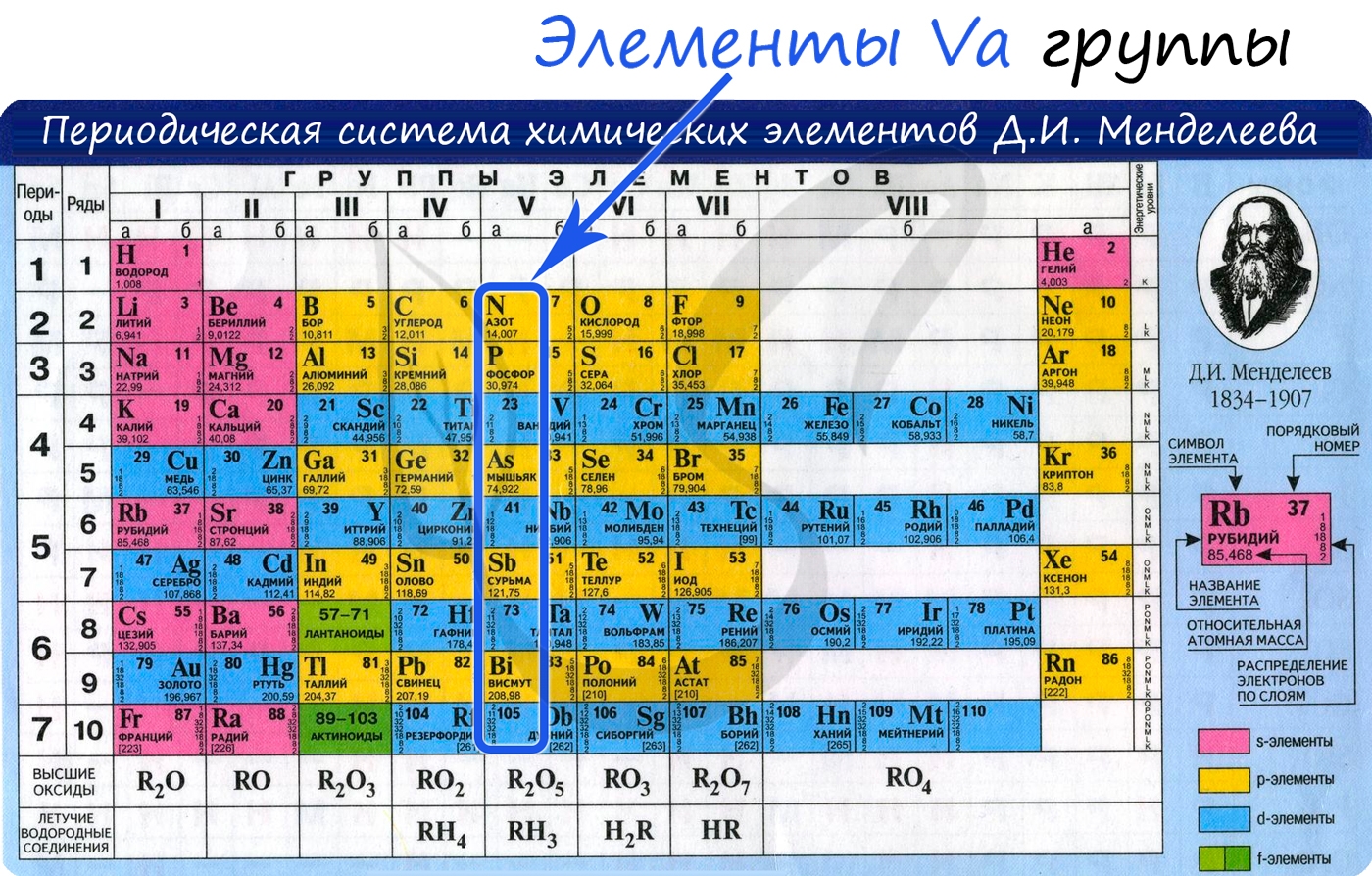
Общая характеристика элементов Va группы
От N к Bi (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Азот, фосфор и мышьяк являются неметаллами, сурьма - полуметалл, висмут - металл.
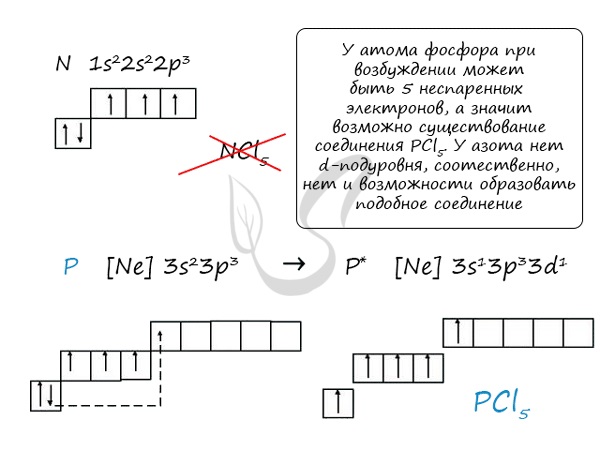
- N - 2s 2 2p 3
- P - 3s 2 3p 3
- As - 4s 2 4p 3
- Sb - 5s 2 5p 3
- Bi - 6s 2 6p 3
Основное и возбужденное состояние азота
При возбуждении атома фосфора электроны на s-подуровне распариваются и переходят на p-подуровень. Однако с азотом ситуация иная. Поскольку азот находится во втором периоде, то 3ий уровень у него отсутствует, а значит распаривание электронов на s-подуровне невозможно - возбужденное состояние у азота отсутствует.
Сравнивая возможности перемещения электронов у азота и фосфора, разница становится очевидна.
Природные соединения
- Воздух - во вдыхаемом нами воздухе содержится 78% азота
- Азот входит в состав нуклеиновых кислот, белков
- KNO3 - индийская селитра, калиевая селитра
- NaNO3 - чилийская селитра, натриевая селитра
- NH4NO3 - аммиачная селитра (искусственный продукт, в природе не встречается)
Селитры являются распространенными азотными удобрениями, которые обеспечивают быстрый рост и развитие растений, повышают урожайность. Однако, следует строго соблюдать правила их применения, чтобы не превысить допустимые концентрации.

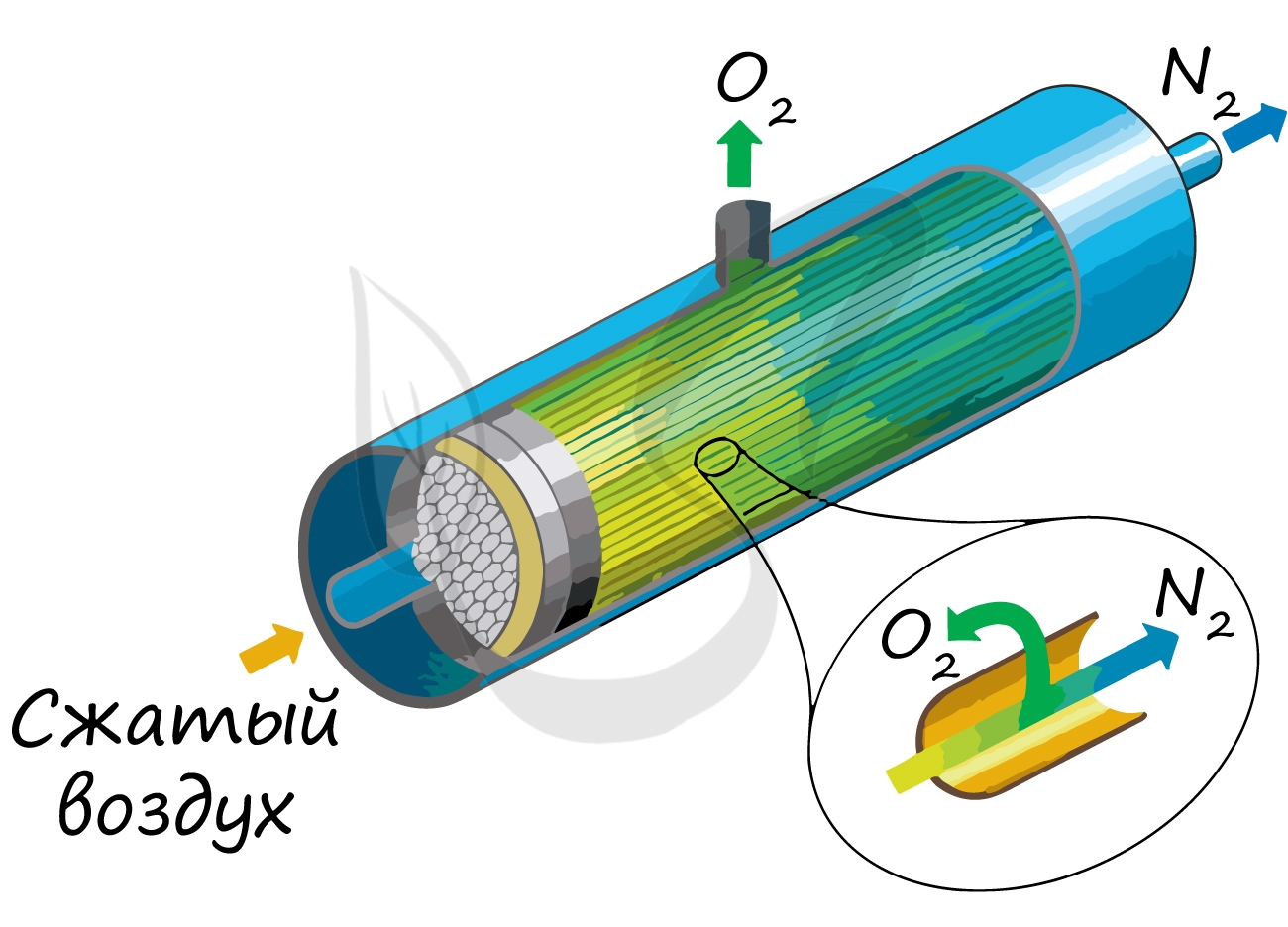
В промышленности азот получают путем сжижения воздуха. В дальнейшем путем испарения из сжиженного воздуха получают азот.
Применяют и метод мембранного разделения, при котором через специальный фильтр из сжатого воздуха удаляют кислород.
В лаборатории методы не столь экзотичны. Чаще всего получают азот разложением нитрита аммония
Также азот можно получить путем восстановления азотной кислоты активными металлами.

Азот восхищает - он принимает все возможные для себя степени окисления от -3 до +5.

Молекула азота отличается большой прочностью из-за наличия тройной связи. Вследствие этого многие реакции эндотермичны: даже горение азота в кислороде сопровождается поглощением тепла, а не выделением, как обычно бывает при горении.

Без нагревания азот взаимодействует только с литием. При нагревании реагирует и с другими металлами.
Важное практическое значение имеет синтез аммиака, который применяется в дальнейшим при изготовлении удобрений, красителей, лекарств.
Аммиак
Бесцветный газ с резким едким запахом, раздражающим слизистые оболочки. Раствор концентрацией 10% аммиака применяется в медицинских целях, называется нашатырным спиртом.
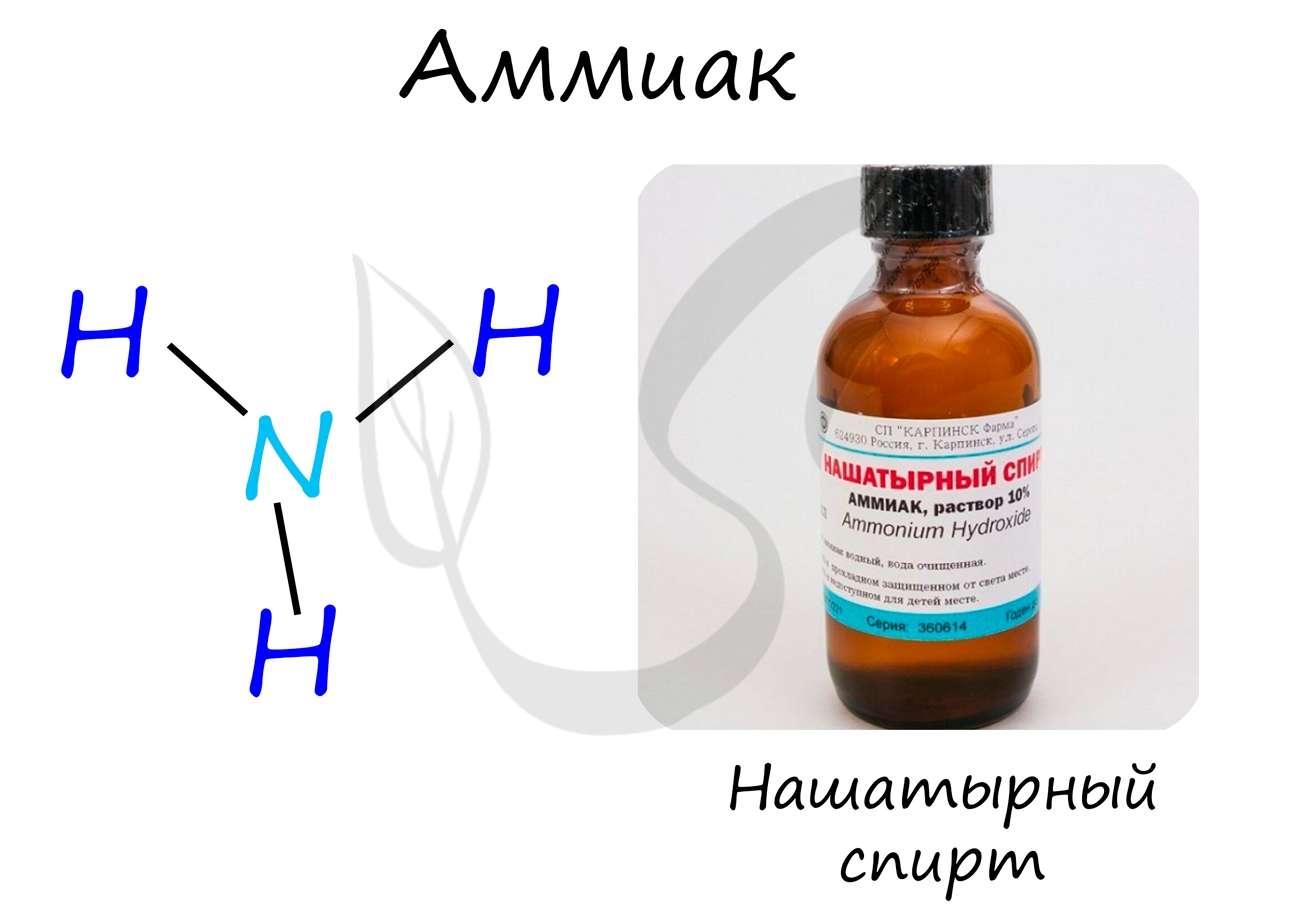
В промышленности аммиак получают прямым взаимодействием азота и водорода.
В лабораторных условиях сильными щелочами действуют на соли аммония.
Аммиак проявляет основные свойства, окрашивает лакмусовую бумажку в синий цвет.
- Реакция с водой
Образует нестойкое соединение - гидроксид аммония, слабое основание. Оно сразу же распадается на воду и аммиак.
Как основание аммиак способен реагировать с кислотами с образованием солей.
NH3 + HCl → NH4Cl (хлорид аммония)

Поскольку азот в аммиаке находится в минимальной степени окисления -3 и способен только ее повышать, то аммиак проявляет выраженные восстановительные свойства. Его используют для восстановления металлов из их оксидов.
Горение аммиака без катализатора приводит к образованию азота в молекулярном виде. Окисление в присутствии катализатора сопровождается выделением NO.

Соли аммония
Помните, что по правилам общей химии, если по итогам реакции выпадает осадок, выделяется газ или образуется вода - реакция идет.
- Реакции с кислотами
В реакциях с щелочами образуется гидроксид аммония - NH4OH. Нестойкое основание, которое легко распадается на воду и аммиак.
В воде ион аммония подвергается гидролизу с образованием нестойкого гидроксида аммония.

Оксид азота I - N2O
Закись азота, веселящий газ - N2O - обладает опьяняющим эффектом. Несолеобразующий оксид. При н.у. является бесцветным газом с приятным сладковатым запахом и привкусом. В медицине применяется в больших концентрациях для ингаляционного наркоза.

Получают N2O разложением нитрата аммония при нагревании:
Оксид азота I разлагается на азот и кислород:
Оксид азота II - NO
Окись азота - NO. Несолеобразующий оксид. При н.у. бесцветный газ, на воздухе быстро окисляется до оксида азота IV.
В промышленных масштабах оксид азота II получают при каталитическом окислении аммиака.
В лабораторных условиях - в ходе реакции малоактивных металлов с разбавленной азотной кислотой.
На воздухе быстро окисляется с образованием бурого газа - оксида азота IV - NO2.
Оксид азота III - N2O3
При н.у. жидкость синего цвета, в газообразной форме бесцветен. Высокотоксичный, приводит к тяжелым ожогам кожи.

Получают N2O3 в две стадии: сначала реакцией оксида мышьяка III с азотной кислотой (две реакции, в которых образуется смесь оксидов азота), затем охлаждением полученной смеси газов до температуры - 36 °C.
При охлаждении газов образуется оксид азота III.
Является кислотным оксидом. соответствует азотистой кислоте - HNO2, соли которой называются нитриты (NO2 - ). Реагирует с водой, основаниями.
Оксид азота IV - NO2
Бурый газ, имеет острый запах. Ядовит.

В лабораторных условиях данный оксид получают в ходе реакции меди с концентрированной азотной кислотой. Также NO2 выделяется при разложении нитратов.
Проявляет высокую химическую активность, кислотный оксид.
Как окислитель NO2 ведет себя в реакциях с фосфором, углеродом и серой, которые сгорают в нем.
Окисляет SO2 в SO3 - на этой реакции основана одна из стадий получения серной кислоты.
Оксид азота IV соответствует сразу двум кислотам - азотистой HNO2 и азотной HNO3. Реакции с водой и щелочами протекают по одной схеме.
Если растворение в воде оксида проводить в избытке кислорода, образуется азотная кислота.

Читайте также:
