Аморфное и кристаллическое строение металлов
Обновлено: 16.05.2024
В технике под металлами понимают вещества, обладающие комплексов металлических свойств: характерным металлическим блеском, высокой электропроводностью, хорошей теплопроводностью, высокой пластичностью.
Кристаллические решетки. Все вещества в твердом состоянии могут иметь кристаллическое или аморфное строение. В аморфном веществе атомы расположены хаотично, а в кристаллическом — в строго определенном порядке. Все металлы в твердом состоянии имеют кристаллическое строение.
Для описания кристаллической структуры металлов пользуются понятием кристаллической решетки. Кристаллическая решетка — это воображаемая пространственная сетка, в узлах которой расположены атомы. Наименьшая часть кристаллической решетки, определяющая структуру металла, называется элементарной кристаллической ячейкой,
На рис. 2 изображены элементарные ячейки для наиболее распространенных кристаллических решеток. В кубической объемно-центрированной решетке (рис. 2, а) атомы расположены в ушах ячейки и один атом в центре куба.
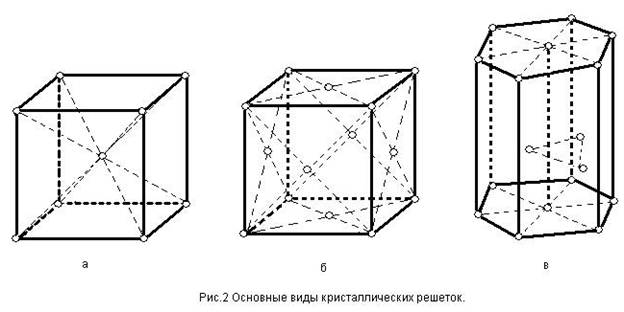
Такую решетку имеют хром, вольфрам, молибден и др. В кубической гранецентрированной решетке (рис. 2, б) атомы расположены в вершинах куба и в центре каждой грани. Эту решетку имеют алюминий, медь, никель и другие металлы. В гексагональной плотноупакованной решетке (рис. 2, в) атомы расположены в вершинах и центрах оснований шестигранной призмы и три атома в середине призмы. Такой тип решетки имеют магний, цинк и некоторые другие металлы.
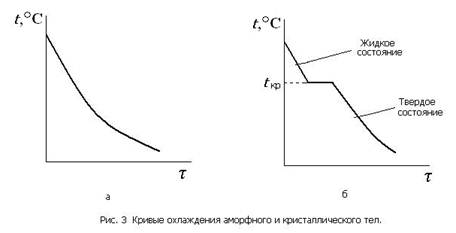
Кристаллизация металлов. Процесс образования в металлах кристаллической решетки называется кристаллизацией. Для изучения процесса кристаллизации строят кривые охлаждения металлов, которые показывают изменение температуры (t) во времени (τ). На рис. 3 приведены кривые охлаждения аморфного и кристаллического веществ. Затвердевание аморфного вещества (рис. 3, а) происходит постепенно, без резко выраженной границы между жидким и твердым состоянием- На кривой охлаждения кристаллического вещества (рис. 3, б) имеется горизонтальный участок с температурой tкр, называемой температурой кристаллизации. Наличие этого участка говорит о том, что процесс сопровождается выделением скрытой теплоты кристаллизации. Длина горизонтального участка — это время кристаллизации.
Кристаллизация металла происходит постепенно. Она объединяет два процесса, происходящих одновременно: возникновение центров кристаллизации и рост кристаллов. В процессе кристаллизации когда растущий кристалл окружен жидкостью, он имеет правильную геометрическую форму. При столкновении растущих кристаллов их правильная форма нарушается (рис. 4). После окончания кристаллизации образуются кристаллы неправильной
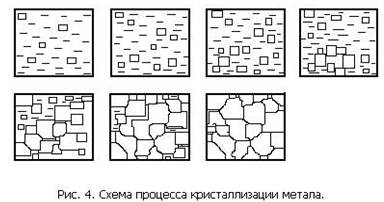
формы, которые называются зернами или кристаллитами. Внутри каждого зерна имеется определенная ориентация кристаллической решетки, отличающаяся от ориентации решеток соседних зерен.
Полиморфизм. Некоторые металлы в зависимости от температуры могут существовать в различных кристаллических формах. Это явление называется полиморфизм или аллотропия, а различные кристаллические формы одного вещества называются полиморфными модификациями. Процесс перехода от одной кристаллической формы к другой называется полиморфным превращением. Полиморфные превращения протекают при определенной температуре.
Полиморфные модификации обозначают строчными греческими буквами α, β, γ, δ и т. д., причем α соответствует модификации, существующей при наиболее низкой температуре. Полиморфизм характерен для железа, олова, кобальта, марганца, титана и некоторых других металлов.
Важное значение имеет полиморфизм железа. На рис. 5 изображена кривая охлаждения железа.
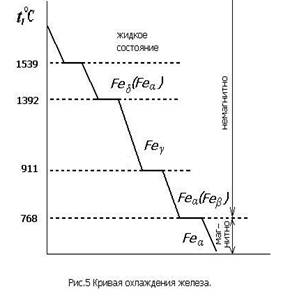
Полиморфные превращения характеризуются горизонтальными участками на кривой охлаждения, так как при них происходит полная перекристаллизация металла. До 911°С устойчиво Feα, имеющее кубическую объемноцептрированную решетку. В интервале 911…1392 °С существует Feγ с кубической гранецентрированной кристаллической решеткой.
При 1392…1539 °С вновь устойчиво Feα. Часто высокотемпературную модификацию Feα обозначают Feδ. Остановка на кривой охлаждения при 768 °С связана не с полиморфным превращением, а с изменением магнитных свойств. До 768 °С железо магнитно, а выше — немагнитно.
Дефекты кристаллического строения. Реальный металлический кристалл всегда имеет дефекты кристаллического строения. Они подразделяются на точечные, линейные и поверхностные (рис. 6).
Точечные дефекты малы во всех трех измерениях. К точечным дефектам относятся вакансии, представляющие собой узлы кристаллической решетки в которых отсутствуют атомы (рис. 6, а), а также замещенные атомы примеси (рис. 6, б) и внедренные атомы (рис. 6, в) которые могут быть как примесными, так и атомами основного металла.
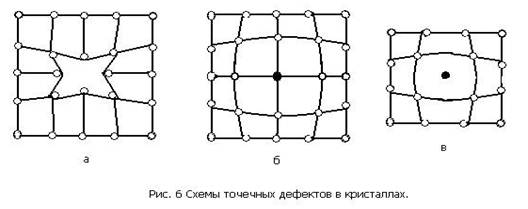
Точечные дефекты вызывают местные искажения кристаллической решетки, которые затухают достаточно быстро по мере удаления от дефекта.
Линейные дефекты имеют малые размеры в двух измерениях и большую протяженность в третьем. Эти дефекты называют дислокациями. Краевая дислокация (рис. 7) представляет собой искажение кристаллической решетки, вызванное наличием «лишней» атомной полуплоскости.
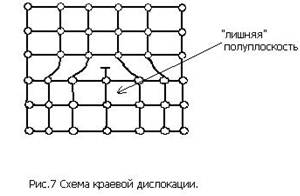
Поверхностные дефекты малы только в одном измерении. К ним относятся, например, границы между отдельными зернами или группами зерен.
Наклеп и рекристаллизация. При пластической деформации изменяется не только форма и размеры металла, но также его внутреннее строение и механические свойства. Зерна разворачиваются, деформируются и сплющиваются, вытягиваясь в направлении деформации. Образуется волокнистая структура. При этом прочность и твердость металла повышаются, а пластичность и вязкость снижаются. Явление упрочнения металла при пластической деформации называется наклепом.
Волокнистое строение и наклеп могут быть устранены при нагреве металла. Частичное снятие наклепа происходит уже при небольшом нагреве (до 300…400 °С для железа). Но волокнистая структура при этом сохраняется. При нагреве до более высокой температуры в металле происходит образование новых равноосных зерен. Этот процесс называется рекристаллизацией. Наклеп при этом снимается полностью.
Температура, при которой начинается процесс рекристаллизации называется температурой рекристаллизации. Абсолютная температура рекристаллизации Тp связана с абсолютной температурой плавления простой зависимостью:
где а — коэффициент, зависящий от состава и структуры металла. Для особо чистых металлов а = 0,2, для металлов технической чистоты а = 0,3…0,4, для сплавов а = 0,5…0,6.
Если деформирование металла происходит при температуре, которая выше температуры рекристаллизации, то наклеп после деформации не возникает. Такая деформация называется горячей. При горячей деформации идут одновременно процессы упрочнения и рекристаллизации. Деформация, которая происходит ниже температуры рекристаллизации называется холодной.
Атомно-кристаллическое строение металлов
Все тела в зависимости от расположения атомов делятся на аморфные и кристаллические. В отличие от аморфных тел, атомы в которых расположены хаотично, металлы в твердом состоянии являются телами кристаллическими. Кристаллическое строение характеризуется закономерным расположением атомов.
Атомы металлов образуют кристаллическую решетку или ячейку. Каждый металл имеет определенный тип кристаллической решетки, чаще всего встречаются три типа решеток: кубическая объемноцентрированная – ОЦК (рис. 16, а), кубическая гранецентрированная – ГЦК (рис. 16, б) и гексагональная – ГПУ (рис. 16, в).
В кубической объемноцентрированной решетке атомы расположены в узлах ячейки и один атом в центре куба. Такие решетки имеют металлы: Feα, Сг, W, Mo, Tiβ, Nb, Та, Li n др.
В кубической гранецентрированной решетке атомы расположены в узлах ячейки и в центре каждой грани. Этот тип решетки имеют металлы: Feγ, Ni, Ag, Au, Pb, Сu, Соβ и др.
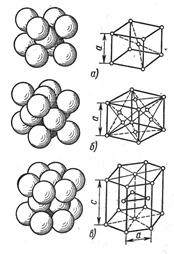
Рис. 16. Типы кристаллических решеток:
а – кубическая объемноцентрированная;
б – кубическая гранецентрированная;
В гексагональной решетке атомы расположены в узлах и центре шестигранных оснований призмы и три атома в средней плоскости призмы. Такую решетку имеют металлы: Zn, Cd, Be, Re, Coα, Tiα и др. Индексы α, β, γ обозначают, что у соответствующих металлов различные кристаллические решетки при различных температурах.
Типы кристаллических ячеек определяются при помощи рентгеноструктурного анализа.
Расстояния между центрами соседних атомов в кристаллической решетке называется периодом (а, b, с). Расстояния между атомами измеряются в ангстремах - , 1 = 1•10 -8 см.
Базис кристаллической решетки - это число атомов, принадлежащих одной элементарной кристаллической ячейке; для ОЦК базис равен 2, для ГЦК – 4, ГПУ – 6.
Плотность упаковки – это отношение объема занимаемого атомами к объему всей ячейки. Плотность упаковки для ОЦК составляет 68%, для ГЦК и ГПУ – 74%. Плотность упаковки характеризуется координационным числом, т. е. числом атомов, находящихся на равном и наименьшем расстоянии от данного атома. Координационное число для ОЦК – 8, для ГЦК и ГПУ – 12.
2.1. Полиморфизм металлов.
Полиморфизмом или аллотропией называют способность металла в твердом состоянии при изменении температуры перестраивать свою кристаллическую решетку. Полиморфные превращения сопровождаются выделением или поглощением теплоты, а также изменением свойств металла. Различные аллотропические состояния называют модификациями. Каждой модификации свойственно оставаться устойчивой лишь в пределах определенного для данного металла интервала температур. Аллотропические формы обозначаются греческими буквами α, β, γ и т. д. На кривых охлаждения и нагрева переход из одного состояния в другое характеризуется остановкой (для чистых металлов) или изменением характера кривой (для сплавов). При аллотропических превращениях кроме изменения свойств (теплопроводности, электропроводности, механических, магнитных и др.) наблюдают изменения объема металла и растворимости (например, углерода в железе). Аллотропические превращения свойственны многим металлам (железу, олову, титану и др.).
Железо известно в двух полиморфных модификациях — α и γ. На рис. 17 приведена кривая охлаждения, характеризующая его аллотропические превращения. Как видно, в интервале температур 911. 1392 °С железо имеет кубическую гранецентрированную решетку γ-железа (γFe), а в интервале от 0 до 911 °С и от 1392 до 1539 °С— объемноцентрированную решетку α-железа (αFe). Железо меняет свои магнитные свойства: выше 768 °С железо немагнитно, а ниже — магнитно.
Строение металлов
Особенности кристаллической и аморфной структуры.
Кристаллическая структура –упорядоченное расположение микрочастиц на строгом расстоянии и под определенном углом.В кристаллических телах частицы располагаются в строгом порядке, образуя пространственные периодически повторяющиеся структуры во всем объеме тела. Для наглядного представления таких структур используются пространственные кристаллические решетки, в узлах которых располагаются центры атомов или молекул данного вещества. Чаще всего кристаллическая решетка строится из ионов (положительно и отрицательно заряженных) атомов, которые входят в состав молекулы данного вещества. В каждой пространственной решетке можно выделить структурный элемент минимального размера, который называется элементарной ячейкой. Вся кристаллическая решетка может быть построена путем параллельного переноса (трансляции) элементарной ячейки по некоторым направлениям.Кристаллические тела могут быть монокристаллами и поликристаллами. Аморфная структура –хаотичное расположение ионов, атомов и молекул в материале.Среди твердых тел встречаются такие, в изломе которых нельзя обнаружить никаких признаков кристаллов. Например, если расколоть кусок обыкновенного стекла, то излом окажется гладким и, в отличие от изломов кристаллов, ограничен не плоскими, а овальными поверхностями. Подобная же картина наблюдается при раскалывании кусков смолы, клея и некоторых других веществ. Такое состояние вещества называют аморфным. Различие между кристаллическими и аморфными структурами особенно резко проявляется в их отношении к нагреванию. В то время как кристаллы каждого вещества при строго определенной температуре происходит переход из жидкого состояния в твердое, аморфные тела не имеют определенной температуры плавления. При нагревании аморфное тело постепенно размягчается, начинает растекаться и становится жидким. При охлаждении оно также постепенно затвердевает. В связи с отсутствием определенной температуры плавления аморфные тела обладают и другой особенностью: многие из них подобно жидкостям текучи, т. е. при длительном действии сравнительно небольших сил постепенно изменяют свою форму. Например, кусок смолы , положенный на плоскую поверхность, в теплом помещении растекается, принимая форму диска.Ещё одной особенностью является упорядоченность в расположении частиц только на очень малых участках.
Вопрос
Типы кристаллических решеток.
Кристаллическая решетка – пространственная сетка, в узлах которых располагются ионы, молекулы и атомы.В зависимости от вида частиц и характера связи между ними различают четыре типа кристаллических решеток:1)ионные (кристаллические решетки, состоящие из ионов, называются ионными. Их образуют вещества с ионной связью ),2)атомные (кристаллические решетки, в узлах которых находятся отдельные атомы, называются атомными. Атомы в таких решетках соединены между собой прочными ковалентными связями ), 3)молекулярные (кристаллические решетки, состоящие из молекул (полярных и неполярных), называются молекулярными ) Молекулы в таких решетках соединены между собой сравнительно слабыми межмолекулярными силами. Поэтому вещества с молекулярной решеткой имеют малую твердость и низкие температуры плавления, нерастворимы или малорастворимы в воде, их растворы почти не проводят электрический ток. Число неорганических веществ с молекулярной решеткой невелико.4)металлические (металлическими называют решётки, в узлах которых находятся атомы и ионы металла ) Для металлов характерны физические свойства: пластичность, ковкость, металлический блеск, высокая электро- и теплопроводностьКристаллы могут быть разных форм. Их делят на 6 систем. Это деление зависит от наличия в кристаллах оси симметрии, их количества, размера и расположения.Системы:1) кубическая2) тетраганальная3) ромбическая (3 оси симметрии, перпендикулярных друг другу, но все разной длины)4) иксогональная ( 4 оси симметрии, 3 из которых равны и образуют угол в 60 град.)5) моноклинная (3 оси симметрии, 2 оси перпендикулярны, а 3 ось перпендикулярна только ко одной)6) триклинная (3 оси симметрии, все разной длины и под разными углами)
Дефекты кристаллических решеток и их влияние на свойства материалов
.Идеальная кристаллическая решетка представляет собой многократное повторение элементарных кристаллических ячеек. Для реального металла характерно наличие большого количества дефектов строения, нарушающих периодичность расположения атомов в кристаллической решетке. Эти дефекты оказывают существенное влияние на свойства материала. Различают три типа дефектов кристаллического строения: точечные, линейные и поверхностные.1.Точечные дефекты характеризуются малыми размерами во всех трех измерениях. Величина их не превышает нескольких атомных диаметров. К точечным дефектам относятся: а) вакансия (свободные места в узлах кристаллической решетки)б) замещающий атомв) внедренный атомТочечные дефекты приводят к локальным изменениям межатомных расстояний и, следовательно, к искажениям кристаллической решетки. При этом увеличивается сопротивление решетки дальнейшему смещению атомов, что способствует некоторому упрочнению кристаллов и повышает их электросопротивление.2. Линейные дефекты (лишняя полуплоскость) характеризуются малыми размерами в двух измерениях, но имеют значительную протяженность в третьем измерении. Наиболее важный вид линейных дефектов — дислокации. Вблизи линии дислокации атомы смещены со своих мест и кристаллическая решетка искажена, что вызывает образование поля напряжений: выше линии дислокации решетка сжата, а ниже растянута. Дислокации образуются уже при кристаллизации металлов, а также в ходе пластической деформации и фазовых превращений. Плотность дислокаций может достигать большой величины.3. Поверхностые дефекты( возникают, когда кристаллизация идет в замкнутом объеме, где кристаллы сближаются и врастают друг в друга)
Вопрос 6
Типы связей: ионная, ковалентная, металлическая, вандервальсовская. Зависимость материалов от типа связей.1) ионнаяИонная связь – частный случай ковалентной, когда образовавшаяся электронная пара полностью принадлежит более электроотрицательному атому, становящемуся анионом. Основой для выделения этой связи в отдельный тип служит то обстоятельство, что соединения с такой связью можно описывать в электростатическом приближении, считая ионную связь обусловленной притяжением положительных и отрицательных ионов. Взаимодействие ионов противоположного знака не зависит от направления, а кулоновские силы не обладают свойством насыщености. Поэтому каждый ион в ионном соединении притягивает такое число ионов противоположного знака, чтобы образовалась кристаллическая решетка ионного типа. В ионном кристалле нет молекул. Каждый ион окружен определенным числом ионов другого знака (координационное число иона). Ионные пары могут существовать в газообразном состоянии в виде полярных молекул.Распространенные строительные материалы этого типа – гипс и ангидрит – имеют невысокую прочность и твердость, они неводостойки2)ковалентнаяКовалентная связь – наиболее общий вид химической связи, возникающий за счет обобществления электронной пары посредством обменного механизма, когда каждый из взаимодействующих атомов поставляет по одному электрону, или по донорно-акцепторному механизму, если электронная пара передается в общее пользование одним атомом (донором) другому атому (акцептору).Такие материалы отличаются очень высокой механической прочностью и твердостью, они весьма тугоплавки.3)металлическаяМеталлическая связь возникает в результате частичной делокализации валентных электронов, которые достаточно свободно движутся в решетке металлов, электростатически взаимодействуя с положительно заряженными ионами. Силы связи не локализованы и не направлены, а делокализированные электроны обусловливают высокую тепло- и электропроводность.Вещества, обладающие металлической связью, часто сочетают прочность с пластичностью, так как при смещении атомов друг относительно друга не происходит разрыв связей.4)вандервальсовскаяНаиболее универсальный вид межмолекулярной связи, обусловлен дисперсионными силами (индуцированный диполь – индуцированный диполь), индукционным взаимодействием (постоянный диполь – индуцированный диполь) и ориентационным взаимодействием (постоянный диполь – постоянный диполь).Вещества, обладающие вандервальсовской связью, - это газы. Они всегда стремятся занять доступный объем, легко сжимаемы и обладают относительно небольшой плотностью
Вопрос 7
Способы формирования структуры веществ и материалов. К структурообразующим элементам относится следующее.
1. Элементарные частицы – это мельчайшие частицы материи: фотоны, электроны, позитроны, мюзоны, нейтрино, протоны, нейтроны, антипротоны, антинейтроны, гипероны. Между ними действуют силы различной интенсивности и радиуса действия: сильные – электромагнитные и слабые – гравитационные.
2. Атомы –это сложные образования, построенные из элементарных частиц. Свойства атома зависят от заряда ядра и строения электронных оболочек (орбиталей), точнее электронных облаков, отличающихся размером и формой. Атомы всех элементов могут соединяться друг с другом или другими атомами, образуя следующие частицы: ионы, свободные радикалы, молекулы.
3. Ионы–образуются из атомов или молекул при отрыве и удалении электронов (ион “+”) или при их присоединении (ион “-”)
4. Свободные радикалы – это осколки молекул, высокоактивные неустойчивые частицы, возникающие при распаде молекул с ковалентной связью между атомами и обладающие неспаренными электронами.
5. Молекулы–наименьшие частицы индивидуального вещества, способные к самостоятельному существованию, состоящие из одинаковых или различных атомов и обладающие основными свойствами. Молекулы рассматривают как "многоатомный атом", в котором электроны находятся на молекулярных орбитах, охватывающих все ядра атомов в молекуле, и молекулярные орбитали занимают весь объем молекулы. В целом это относительно устойчивое электрически нейтральное образование.
6. Комплексные соединения и комплексные ионы – это соединения сложного состава, у которых можно выделить центральный атом (комплексообразователь) и непосредственно связанные с ним молекулы или ионы (лиганды)
7. Элементарные кристаллические решетки* (ячейки) –простейшие структурные единицы кристалла.
8. Коллоидные частицы – это частицы твердых, жидких веществ размером 10 9 –10 -7 м.
9. Дисперсные частицы – это частицы твердых и жидких веществ размером 10 -7 –10 -6 м.
10. Углеводороды с молекулярной массой < 5000 – масла, смолы, асфальты.
11. Углеводороды с молекулярной массой > 5000 – олигомеры, полимеры (-CH2-CH2-)n и др.
12. Кристаллы, кристаллиты и зерна – твердые тела, имеющие упорядоченное взаимное расположение образующих их частиц – атомов, ионов, молекул. Кристаллиты (зерна) имеют искаженную кристаллическую решетку, неправильную форму кристалла, без характерной кристаллической огранки. К ним относятся дендриты, кристаллические зерна металлических слитков, горных пород, минералов.
13. Твердые частицы – частицы крупных размеров (> 3Ч 10 -4 м).
14. Поры, пустоты и т.д.
Этот список можно продолжить. Важно отметить, что в формировании материала на более низких уровнях принимают участие наполнители, заполнители, добавки, которые, с одной стороны, сформированы перечисленными структурообразующими элементами, а с другой – сами играют огромную роль. Таким образом, строение материала характеризуется многоступенчатостью, многообразием структурных элементов и уровней, форм связи между структурообразующими одного и различных уровней.
Структурообразующие элементы имеют различное строение, форму, размеры, по-разному взаимодействуют между собою и располагаются в пространстве, обусловливая тем самым структуру материала, его свойства и, как следствие, области его применения. Поэтому структуру материала изучают на различных уровнях. Величина и число уровней определяются точностью существующих методов исследований и изучаемыми свойствами.
Читайте также:
