Анодная реакция растворения металлов
Обновлено: 05.07.2024
Явление анодного растворения. Электрохимическая обработка металлов основана на способности их растворяться в результате оксидных реакций, происходящих в среде электропроводного раствора — электролита — под действием на него постоянного электрического тока. Такой химический процесс растворения металлов называют электролизом. Электролиз протекает при наличии источника питания электрическим током, электролита и двух металлических проводников, называемых электродами, каждый из которых находится в электролитической ванне с электролитом.
В электролите свободными электрическими зарядами являются ионы, образующиеся при растворении, например в воде солей, кислот или щелочей. Молекулы таких веществ, взаимодействуя с молекулами растворителя — воды, распадаются (диссоциируют) на положительно и отрицательно заряженные ионы. При этом движение ионов в электролите неупорядоченное. Под действием электрического поля, создаваемого источником питания, между электродом, соединенным с положительным полюсом и называемым анодом, и электродом-катодом, соединенным с отрицательным полюсом, возникает направленное движение ионов — отрицательно заряженные ионы (анионы) движутся к аноду, а положительно заряженные ионы (катионы) — к катоду. В электролите, таким образом, возникает электрический ток, представляющий упорядоченное движение положительно и отрицательно заряженных ионов.
Схема движения ионов в наиболее часто применяемом для ЭХО электролите — водном растворе хлористого натрия NaCl — приведена на рис. 1.1. При растворении хлористого натрия в воде его молекула распадается на катион натрия Na + и анион хлора С1-. Вода Н20 при этом также частично диссоциирует на катионы водорода Н+ и анионы гидроксила ОН-. При подаче на электроды напряжения от источника питания анионы гидроксила и катионы водорода вместе с анионами хлора и катионами натрия вынуждены под действием сил электрического поля перемещаться соответственно к катоду и аноду. Атомы поверхностного слоя электрода-анода 1, получая от движущихся к нему анионов хлора и гидроксила дополнительные отрицательные заряды, превращаются в положительные ионы железа. Последние под действием сложных катодных и анодных реакций взаимодействуют с ионами гидроксила и образуют гидрат оксида железа Fe(OH)3, который в виде нерастворимого химического соединения выпадает в осадок. Таким образом происходит электрохимическое анодное растворение железа. Одновременно с этим на катоде выделяется водород, выходящий из электролита в виде пузырьков. Реакции, протекающие на катоде, как правило, не разрушают его, т. е. катод при ЭХО не изнашивается.
Параметры анодного растворения. Из приведенной на рис. 1.1 схемы видно, что электролиз протекает в межэлектродном промежутке (МЭП), под которым принято понимать пространство между поверхностями катода и анода. Следовательно, электрохимическое анодное растворение происходит без непосредственного механического контакта поверхностей катода и анода.
В соответствии с объединенным законом Фарадея объем V (см 3 ) растворенного металла при электролизе прямо пропорционален объемному электрохимическому эквиваленту Kv данного металла, силе тока I и времени t:V=KvIt. Объемный электрохимический эквивалент Kv металла зависит от его валентности и атомной массы; эти величины для определенного металла (табл. 1.1) имеют постоянные значения.
На практике объем растворенного металла не всегда соответствует объему, рассчитанному по этой формуле. При определенном сочетании параметров процесса (плотности тока i на аноде, определяемой отношением силы тока I к площади анода S, вида обрабатываемого металла, состава и скорости обновления электролита в межэлектродном промежутке) объем растворенного металла относительно расчетного его значения может уменьшаться, а в некоторых случаях процесс анодного растворения полностью прекращается. Это объясняется образованием на поверхностях анода труднорастворимых оксидных пленок.


При наличии в электролите достаточного количества активирующих анионов, например анионов хлора С1-, происходит вытеснение из оксидной пленки кислорода и разрушение ее без дополнительных затрат электрической энергии. В таких процессах, называемых активными, электрическая энергия расходуется непосредственно на электрохимическое растворение металла анода. Если в электролите недостает активирующих анионов, то на электрохимическое анодное растворение этих пленок затрачивается дополнительная электрическая энергия. При этом эффективность процессов ЭХО существенно снижается. Такой процесс электрохимического анодного растворения металла называют пассивным.
Активное анодное растворение отличается от пассивного особенностями реакций, происходящих на аноде. Активное растворение характеризуется хорошей растворимостью металла анода, так как при этом побочные реакции, кроме основной — анодного растворения, не протекают. Активное растворение металла происходит, например, при электрохимическом травлении. При пассивном растворении часть электрической энергии расходуется на побочные реакции, обеспечивающие удаление с поверхностей анода труднорастворимых оксидных пленок. Пассивное растворение металла происходит, например, при электрохимическом абразивном полировании.
Повышение плотности тока i относительно оптимального ее значения может привести при определенных условиях к образованию оксидных пленок сложного состава, которые не растворяются при электролизе. При этом наступает полная пассивация, т. е. переход поверхностного слоя металла из активного состояния в пассивное, при котором процесс анодного растворения прекращается. Подобные пленки удаляют с поверхностей анода механически, например абразивной обработкой.
Эффективность процессов ЭХО оценивают так называемым коэффициентом выхода металла по току: п = Vф/V, где Vф — фактический объем растворенного металла при пропускании определенного количества электричества, см 3 ; V — расчетный объем металла, который должен раствориться при пропускании того же количества электричества, см 3 .
С учетом коэффициента п уравнение, характеризующее объем (см 3 ) растворенного металла, приобретает следующий вид: Vф = Kv1tп). Vф, как правило, всегда меньше расчетного V, т. е. п>1. Значение этого коэффициента п отражает характер анодного растворения: активное или пассивное. При активном растворении коэффициент выхода металла по току составляет обычно 0,5—1,0; при пассивном растворении п 1 2 3 . 20 21 22 . 40 41 42
Автор: Администрация
_ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _
ЭЛЕКТРООСАЖДЕНИЕ МЕТАЛЛОВ
ОБЩАЯ ХАРАКТЕРИСТИКА ПРОЦЕССА. Электрохимическое выделение металлов из водных растворов их соединений лежит в основе гидроэлектрометаллургических процессов, т. е. процессов извлечения металлов из руд (электроэкстракция) и их очистки (рафинирование) при помощи электролиза. Гидроэлектрометаллургическим путём получают и очищают такие металлы, как медь, никель, цинк, кадмий, олово, свинец, серебро, золото, марганец и др. Гидроэлектрометаллургия позволяет получать технически чистые металлы и в ряде случаев вести успешную переработку бедных руд. Электрохимическое выделение металлов используется для защиты основного металла от разрушения при помощи покрытий из более устойчивых металлов или сплавов, а также для придания изделиям красивого, декоративного вида (гальванотехника). Кроме того, выделение металлов применяется для получения копий и воспроизведения художественных предметов, изготовления лент, бесшовных труб, печатных схем и т. д. (гальванопластика). Возможность использования процесса электролиза с выделением металлов для практических нужд была открыта в 1837 - 1838 гг. русским академиком Б. С. Якоби.
Электролитическое выделение металлов чаще всего проводят из растворов их простых солей - сульфатов, хлоридов или нитратов. Суммарной катодной реакцией в этом случае будет разряд гидратированных металлических ионов с их последующим переходом в кристаллическую решётку образующегося на катоде осадка :
M n+ × x H2O + ne - = [M] + x H2O
Электрохимическое выделение металлов из водных растворов происходит при более отрицательном потенциале, чем равновесный потенциал соответствующего металла в данных условиях. Разность между потенциалом электрода под током (при катодном выделении металла) и соответствующим обратимым электродным потенциалом даёт электродную поляризацию :
Долю общей поляризации, не связанную с замедленностью процессов транспортировки, часто называют перенапряжением металла. Перенапряжение и здесь тесно связано с природой электродного процесса.
Поляризация при электрохимическом выделении металлов, так же как и при других электродных реакциях, зависит от плотности тока, увеличиваясь вместе с ней. Однако в данном случае характер этой зависимости часто оказывается более сложным. Даже при осаждении одного и того же металла результаты поляризационных измерений могут укладываться в зависимости от диапазона применяемых плотностей тока, состава раствора и температуры на прямые в одной из следующих систем координат :
h - i , h - lg i , 1/h - lg i , 1/h 2 - lg i
Экспериментальное исследование кинетики катодного выделения металлов представляет собой сложную задачу, что связано с некоторыми специфическими особенностями этого процесса. В ходе электролиза поверхность катода не постоянна, а непрерывно изменяется вследствие осаждения металла. Характер роста осадка существенно зависит от природы металла и условий электролиза. Для некоторых металлов, например серебра и таллия, типично образование нитеобразных кристаллов и древовидных ответвлений, так называемых усов и дендритов.
Своеобразие роста электролитических осадков металлов затрудняет измерение плотности тока, иными словами, скорости электрохимического процесса. Здесь необходимо различать кажущуюся плотность тока, т. е. силу тока, приходящуюся на единицу геометрической (видимой) поверхности электрода, и истинную плотность тока, равную отношению силы тока к активной поверхности, т. е. к действительной поверхности роста осадка. В процессе образования катодного осадка при неизменной кажущейся плотности тока истинная плотность тока может меняться.
Изучение кинетики электроосаждения металлов связано также с затруднениями, возникающими в связи с неустойчивостью во времени потенциала катода. Изменение потенциала и электродной поляризации вызывается не только изменением активной поверхности и истинной плотности тока, но и другими причинами. Особенно заметно изменение потенциала со временем при выделении металлов на чужеродных электродах, когда электролиз приводит к образованию новой металлической фазы. Изменение величины перенапряжения со временем наблюдается при выделении металла и на одноимённом катоде.
Характер осадка и условия его формирования во времени при постоянной силе тока (или при заданном потенциале) зависят не только от природы металла, но и от состава раствора и присутствующих в нём примесей. Примеси поверхностно-активных веществ (ПАВ), а также различных окислителей (например, растворённого кислорода) влияют на кинетику электровыделения металлов. В зависимости от степени чистоты раствора и природы примесей могут меняться характер роста кристаллов, число центров кристаллизации, возникающих за единицу времени на единице поверхности катода, значение поляризации при данной плотности тока, характер её изменения со временем и т. п. В тех случаях, когда катодный выход металла меньше единицы (электроотрицательные металлы, высокие плотности тока), возникают осложнения, связанные с изменением (обычно повышением) pH прикатодного слоя вследствие выделения водорода. Подщелачивание раствора вблизи катода благоприятствует процессам гидролиза солей металла с образованием его основных солей и гидроксидов, которые могут влиять на ход электроосаждения и включаться в катодный осадок.
РОЛЬ ПРИРОДЫ МЕТАЛЛА. При электролизе растворов простых солей характер катодных осадков и величина электродной поляризации определяются в первую очередь природой выделяющегося металла. Все металлы можно разделить на три группы. К первой из них относятся металлы, выделяющиеся из водных растворов или совсем без перенапряжения (ртуть), или с очень малым перенапряжением, не превышающим при обычных плотностях тока тысячных долей вольта (серебро, таллий, свинец, кадмий, олово). Для этой группы металлов (кроме ртути) наиболее отчётливо проявляются неустойчивость потенциала во времени, сложный характер роста катодного осадка и другие особенности, свойственные процессу катодного выделения металлов. При промышленных плотностях тока эти металлы дают грубые осадки. Токи обмена для металлов этой группы очень велики.
Висмут, медь, цинк образуют вторую, промежуточную группу. Для неё характерно металлическое перенапряжение порядка нескольких десятков милливольт, образование более тонких осадков и меньшие, чем у металлов предыдущей группы, токи обмена.
Наибольшим металлическим перенапряжением обладают металлы третьей группы, у которых оно достигает нескольких десятых долей вольта. Эти металлы (железо, никель, кобальт) выделяются на катоде в виде плотных тонкокристаллических осадков. Токи обмена у них малы.
В обычных условиях электролиза металл выделяется на поликристаллической основе и дает отложения, также имеющие поликристаллическую структуру. Поверхность таких осадков образована гранями с различными кристаллографическими индексами. Опыты с монокристаллами ряда металлов, ориентированными по отношению к раствору различными гранями, показали, что металлическое перенапряжение зависит от того, на какой грани выделяется металл. Однако кристаллизационные факторы в явлениях перенапряжения играют подчиненную роль : значение металлического перенапряжения в большей степени определяется природой металла, чем кристаллографической ориентацией электродной поверхности.
РОЛЬ СОСТАВА РАСТВОРА. Систематические исследования влияния состава раствора на кинетику электроосаждения металлов были начаты в 1917 г. Н. А. Изгарышевым. Было установлено, что при катодном выделении металлов из растворов их простых солей существенное значение имеет природа аниона соли. Влияние природы аниона на перенапряжение и на характер образующихся осадков наблюдается для многих металлов, но наиболее сильно оно проявляется для металлов, выделение которых не сопровождается высокой поляризацией. Обычно перенапряжение уменьшается при переходе от одного аниона к другому в следующем порядке:
причём в том же направлении увеличивается тенденция к образованию более грубых, крупнокристаллических осадков. Влияние анионов вполне сравнимо с эффектами, связанными с кристаллографическими факторами.
Присутствие в растворе, помимо ионов разряжающегося металла, индифферентных катионов увеличивает металлическое перенапряжение. В водных растворах обычными посторонними катионами являются водородные ионы. Увеличение их концентрации приводит чаще всего к росту металлического перенапряжения. Значительное его повышение наблюдается в присутствии поверхностно-активных катионов типа тетразамещённого аммония.
Высокая чувствительность процесса электроосаждения металлов к чистоте растворов указывает на то, что присутствие не только электролитов, но и любых веществ, особенно обладающих поверхностно-активными свойствами, должно играть здесь существенную роль.
Введение в раствор небольших количеств молекулярных и ионных веществ - один из наиболее эффективных способов воздействия на ход процесса электроосаждения металлов. Многие, преимущественно органические, вещества способны увеличивать блеск осадков (блескообразователи), сглаживать их поверхность (выравниватели), и изменять другие свойства, например пористость, твёрдость, хрупкость, способность окклюдировать водород и т. д.
Обнаруженная М. А. Лошкарёвым адсорбционная поляризация проявляется в том, что при добавлении к раствору некоторых поверхностно-активных веществ (например, трибензиламина) изменяется скорость выделения металла на ртутном и на твёрдых катодах. Она становится, во-первых, меньше той, что наблюдалась до введения добавки, и, во-вторых, не зависящей в широкой области потенциалов от катодного потенциала. Однако после того как достигается определённый (обычно весьма отрицательный) потенциал, действие добавки прекращается. Скорость выделения начинает быстро расти, приближаясь к нормальному для этих условий значению, отвечающему предельному диффузионному току. Потенциал, при котором прекращается действие добавки, совпадает с потенциалом её десорбции. Явление адсорбционной поляризации используется для улучшения качества гальванических осадков при электролитическом получении сплавов.
Все эти данные относятся к тому случаю, когда металлы выделяются из растворов их простых солей. Если неорганические или органические добавки образуют комплексные соединения с выделяющимся металлом, то ход катодного процесса существенно меняется. Прежде всего образование комплексов в растворе смещает равновесный потенциал металла в отрицательную сторону за счёт уменьшения концентрации его свободных ионов. Появление комплексов в растворе сказывается и на величине перенапряжения и на характере катодных осадков. При переходе от простых электролитов к комплексным обычно наблюдается повышение перенапряжения и уменьшение зернистости осадков ; одновременно подавляется тенденция к образованию и росту дендритов.
ПРИРОДА МЕТАЛЛИЧЕСКОГО ПЕРЕНАПРЯЖЕНИЯ. Электродная поляризация, наблюдаемая при выделении металлов, может быть связана либо с фазовыми превращениями и представлять собой один из видов фазового перенапряжения (замедленность образования трёхмерных и двухмерных зародышей, поверхностная диффузия адатомов или адионов), либо с замедленностью собственно электрохимической стадии и совпадать с электрохимическим перенапряжением. При осаждении металлов существенную роль играют затруднения на стадии транспортировки, а также на стадии химического превращения, предшествующего электрохимическому акту. При рассмотрении процессов катодного выделения металлов (особенно из комплексных электролитов) необходимо поэтому всегда учитывать концентрационную поляризацию, т. е. диффузионное перенапряжение и химическое или реакционное перенапряжение. Наконец, в условиях катодного выделения металлов энергетическое состояние иона в образующемся осадке может отличаться от его состояния в нормальной кристаллической решётке данного металла и, как правило, отвечать более высокому уровню энергии. Переход из такого метастабильного состояния к обычному также может обусловливать появление особого вида фазового (кристаллизационного) перенапряжения.
Преобладание того или иного вида перенапряжения определяется природой металла, составом раствора, плотностью тока, температурой электролита. При обычных температурах и при использовании простых, некомплексных электролитов перенапряжение изменяется с природой металлов. Опытные данные указывают на то, что выделение металлов, стоящих в начале ряда (Hg, Ag, Tl, Pb, Cd, Sn), сопровождается лишь незначительной поляризацией, связанной главным образом с замедленностью возникновения и развития новой фазы. Замедленность электрохимической стадии не играет здесь существенной роли. В электрохимической литературе эти металлы, для которых характерно фазовое перенапряжение, называются часто нормальными металлами. Напротив, при выделении металлов группы железа наблюдается высокая поляризация, обусловленная преимущественно замедленностью электрохимической стадии. Эти металлы, для которых характерно электрохимическое перенапряжение, называются инертными металлами. Промежуточное положение и по величине поляризации, и по природе перенапряжения (здесь наиболее вероятно наложение нескольких видов перенапряжения) занимают такие металлы, как Bi, Cu и Zn.
Это различие в величине и механизме перенапряжения обусловливает различный характер осадков, в виде которых нормальные и инертные металлы выделяются на катоде. Все факторы, вызывающие торможение акта разряда, должны, с этой точки зрения, уменьшать относительную роль кристаллизационных явлений и приводить к получению равномерных мелкозернистых осадков. Увеличение торможения достигается или переводом простых ионов в более прочные комплексы, или при помощи добавок поверхностно-активных веществ.
АНОДНОЕ РАСТВОРЕНИЕ
АНОДНОЕ РАСТВОРЕНИЕ металла, электрохим. окисление металла в р-ре или расплаве электролита с образованием р-римых продуктов и отводом освобождающихся электронов во внеш. цепь. В общем виде этот процесс можно записать след. образом:где М-атом металла, n-число освобождающихся электронов. В соответствии с законами Фарадея, в отсутствие др. электродных р-ций зависимость между скоростью окисления металла V [г/(см 2 *с)] и плотностью анодного тока i имеет вид:
Анодное растворение лежит в основе размерной электрохим. обработки металлов и сплавов и их электрополировки, анодного упрочнения металлич. материалов путем удаления с повети тонких механически деформиров. слоев, использования р-римых анодов при электрохим. рафинировании металлов и в гальванотехнике. От анодного растворения в значит. мере зависят эксп-луатац. характеристики гальванич. элементов и аккумуляторов, а также коррозионное поведение конструкц. металлич. материалов.
Важнейшие характеристики анодного растворения-зависимость i от электродного потенциала Е и частная производная обратной зависимости о, т.е. плотностью тока при равновесном потенциале, когда она в точности равна плотности тока обратного процесса - катодного осаждения металла. При i < iо скорость анодного растворения лимитируется скоростью отвода продуктов окисления от пов-сти электрода в объем р-ра; потенциал металла сохраняет равновесное значение по отношению к его ионам в приповерхностном слое р-ра и выражается ур-нием Нернста:где Ео- стандартный электродный потенциал, [М п+ ]- при-поверхностная концентрация ионов металла, Т-абс. т-ра, R-газовая постоянная. Однако, оставаясь равновесным, потенциал меняется, т.к. [М n+ ] у пов-сти возрастает пропорционально скорости анодного растворения (т.е. плотности тока i). Соотв. зависимость Е от i описывается ур-нием:
где К - эмпирич. коэффициент. Это ур-ние м.б. нарушено, когда будет достигнут предел р-римости соли, образуемой металлом с одним из анионов электролита, и [М ] перестанет расти. Если образующийся при этом осадок рыхлый и заметно не препятствует прохождению тока, то далее металл становится практически неполяризуемым. Такова, напр., природа неполяризуемости отрицат. пластины свинцового аккумулятора.
В водных р-рах электролитов поляризуемость описанного концентрац. типа характерна для переходных металлов I и II групп (Ag, Cu, Zn, Cd), к-рым свойственны высокие значения iо. Ее важнейшая особенность - зависимость Е не только от i, но и от интенсивности перемешивания р-ра.
При i > iо растворение протекает с кинетич. контролем, т.е. лимитируется собственно электрохим. стадией - переносом заряженной частицы через границу металл-р-р, и его скорость изменяется с потенциалом Е по закону:где о.
На лимитирующую стадию, а значит, и на весь процесс может сильно влиять предшествующая ей стадия адсорбционного и хим. взаимод. поверхностных атомов металла с компонентами р-ра (молекулами р-рителя, анионами электролита). С учетом этой стадии механизм и скорость анодного растворения можно выразить таким образом:где А - адсорбирующийся компонент р-ра, т- число его молекул, участвующих в процессе, К1- константа. В зависимости от условий адсорбция может стимулировать или ингибировать анодное растворение (т м. б. положительным или отрицательным). Соотв. введение в р-р или удаление из него адсорбирующихся компонентов - один из эффективных методов регулирования скорости анодного растворения в технике. Стимуляторы широко используют в технологии размерной электрохим. обработки металлов, а также для снижения поляризуемости растворяющихся анодов. Использование ингибиторов анодного растворения - один из важных методов защиты металлов от коррозии (см. Ингибиторы коррозии).
Анодное растворение, конечными продуктами к-рого являются многовалентные катионы или их комплексы, протекает, как правило, через ряд одноэлектронных стадий (п — 1), каждая из к-рых в зависимости от условий может оказаться лимитирующей. При этом промежут. ионы металла низких степеней окисления нередко доокисляются до устойчивого состояния не только (а иногда не столько) электрохимически, но и в результате непосредственного взаимод. с окислит. компонентой р-ра (молекулы растворенного кислорода, ионы Н + ), напр. по р-ции:В подобных случаях итоговая скорость анодного растворения может существенно превосходить величину, рассчитанную только по току.
Нередко анодное растворение осложняется вторичными явлениями. Так, образование на пов-сти растворяющегося металла фазовых или адсорбционных солевых или оксидных слоев приводит к пассивации анодного растворения (см. Пассивность металлов), к-рая проявляется в ослаблении зависимости его скорости от потенциала, в достижении предельной плотности тока растворения, а иногда и в изменении типа зависимости. В водных средах повыш. склонностью к пассивации отличаются мн. переходные металлы (Mo, Cr, Ni, Fe и др.). Для них характерен критич. потенциал Екр, зависящий от природы металла и рН р-ра. При достижении Екр обычное увеличение скорости анодного растворения сменяется ее резким снижением, иногда до неск. порядков величины. После этого в большом интервале значений потенциала скорость анодного растворения сохраняется постоянной, а затем снова начинает экспоненциально расти с потенциалом (см. рис.). Последнее явление, известное как перепассивация, обусловлено новым анодным процессом (окислением металла до ионов высшей валентности), к-рый лежит в основе электрохим. технологии получения высших кислородных соед. ряда металлов, напр. Mn, Cr. При анодном растворении сплава возможен неравномерный переход его компонентов в р-р, т.е. избирательное растворение одних компонентов и обогащение поверхностного слоя сплава другими.Зависимость логарифма скорости анодного растворения ог электродного потенциала.
===
Исп. литература для статьи «АНОДНОЕ РАСТВОРЕНИЕ» : Колотыркин Я. М., "Природа", 1979, № 11, с. 2-13: его же, ".Защита металлов", 1983, т. 19, № 5, с. 675-85; Основы теории и практики электрохимической обработки металлов и сплавов, М., 1981. Я.М. Колотыркин.
АНОДНЫЕ ПРОЦЕССЫ
В зависимости от агрегатного состояния получаемых продуктов анодные процессы принято разделять на окислительно-восстановительные процессы без выделения самостоятельной фазы, процессы с образованием твердых анодных продуктов, процессы с газовыделением, процессы с растворением материала анода (растворимые аноды).
К процессам без выделения самостоятельной фазы относятся процессы получения сильных окислителей.
При хлорировании концентрированных щелочных растворов протекают реакции с образованием гипохлоритов и хлорноватистой кислоты:
Cl2 + ОН - = НС1О + Cl - (3.44)
Далее гипохлорит окисляется на аноде до хлората:
6С1О - + ЗН2О -6е = 2С1О3 - + 6Н + + 4С1 - +1,5О2 (3.45)
Второй пример - образование надсерной кислоты при электрохимическом окислении концентрированных растворов серной кислоты:
с последующей димеризацией радикалов
Аналогичным образом на аноде получают ион перманганата:
Так же как в случае протекания подобных процессов на катоде, поляризация анода носит концентрационный характер и определяется затруднениями в доставке к аноду восстановленной формы вещества и отводе от поверхности анода окисленной формы вещества. Распределение их активностей в приэлектродном слое показано на рис.3.9, а поляризационная кривая для катодного и анодного процессов приведена на рис.3.10.
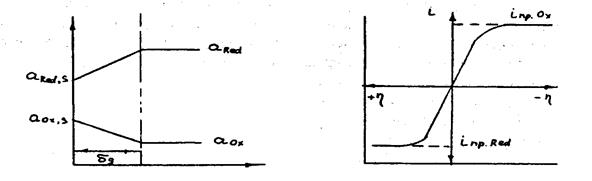
Рис.3.9.Распределение активностей Рис.3.10. Вид поляризационной в прианодном слое кривой
При этом величина поляризации будет связана с величиной плотности тока уравнением:
h = . (3.49)
Примером процессов с образованием на аноде твердых продуктов является электролитическое получение МnО2.
Процесс сводится к окислению на аноде ионов марганца двухвалентного и трехвалентного до четырехвалентного состояния:
Кроме того, ионы Мn 4+ получаются при диспропорционировании ионов Mn 2+ :
2Mn 3+ = Мn 2+ + Мn 4+ . (3.52)
Последующее образование МnО2 происходит за счет реакций гидролиза:
Заметную роль в этом процессе играет фазовая поляризация.
При высоких плотностях тока, низких температурах и концентрациях Мn 2+ растет фазовая поляризация, в результате получается тонкозернистая двуокись марганца. При низких анодных плотностях тока, высоких концентрациях Мn 2+ и температурах фазовая поляризация уменьшается, что позволяет получать крупнокристаллическую двуокись марганца.
Таким же путем получают PbO2, SnО2 и другие продукты.
Широко распространены в гидрометаллургии анодные процессы с газовыделением, например процессы получения хлора электролизом водных растворов NaCI, процессы получения кислорода при электролитическом разложении воды. Поляризация при этом, как правило, носит фазовый характер и определяется либо затруднениями, связанными с рекомбинацией адсорбированных атомов в молекулы, либо с образованием и распадом на поверхности анода сложных соединений. Это наглядно видно на зависимостях величины поляризации от материала анода (рис.3.11 и 3.12). Выделение кислорода происходит по реакциям:
в растворах солей и щелочей:
в растворах сильных кислот:
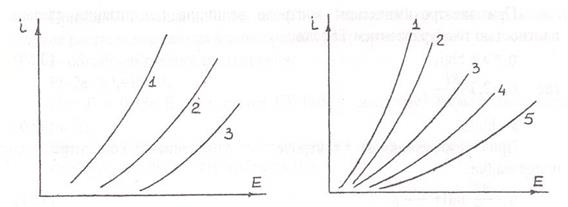
Рис.3.11.Поляризация анода при Рис.3.12Поляризация анода при
выделении хлора из растворов NaCl выделении кислорода из 0,1Н KOH
(250г/л) при 80°С.Материал анода: при 17°С. Материал анода:
1-Pt; 2-графит; 3-магнетит 1-Cu; 2-Ni; 3-Ag; 4-графит; 5-Pt
Самые высокие значения перенапряжения выделения кислорода характерны для металлов платиновой группы, которым свойственны малые значения перенапряжения выделения водорода. Зависимость перенапряжения от плотности тока носит тафелевский характер:
hКоэффициенты а и b меняются с плотностью тока, что связано с различным характером образующихся промежуточных фаз. Так, на платиновом аноде с увеличением плотности тока происходят последовательное образование и распад на поверхности высших нестойких окислов РtO2, РtO3, РtO4, что определяет ступенчатый характер h-lgi прямых и очень высокие значения перенапряжения выделения кислорода, достигающие при 1 А/см 2 1,38 В.
Для всех электродов с газовыделением характерен так называемый "анодный эффект". Он проявляется в резком повышении сопротивления на границе раздела анод-электролит, приводящем к увеличению напряжения на электролизере на 10-100 В, появлению искрового разряда в прианодном слое.
Причины появления анодного эффекта неоднозначны. Ими могут быть поверхностные плохопроводящие соединения типа CFn , СCln, CBrn и т.д.
Другой причиной может оказаться газогидродинамическая неустойчивость, возникающая, когда с увеличением анодной плотности тока до критической газообразные продукты не успевают удалиться из прианодной зоны, обволакивают анод. Возникающая при этом газовая пленка обладает по сравнению с электролитом существенно большим сопротивлением и является причиной анодного эффекта. Последняя трактовка находит подтверждение в зависимости величины критической плотности тока от смачиваемости анода электролитом. Чем лучше смачиваемость, тем выше iкр.
Анодное растворение металлов по реакции
Me - nе = Ме n+ (3.58)
сопровождается либо электрохимической, либо концентрационной поляризацией. Преобладает, как правило, тот же вид поляризации, который является превалирующим и для катодного процесса.
При электрохимическом контроле величина поляризации связана с плотностью тока уравнением Тафеля
где b = 2,3При диффузионном контроле - уравнением концентрационной поляризации:
ha= ). (3.61)
При этом концентрация ионов растворяемого металла в приэлектродном слое (cs) возрастает прямо пропорционально с увеличением плотности тока в соответствии с уравнением
ia=По достижении предела растворимости соли металла в электролите на поверхности анода образуется пленка твердой соли, затрудняющая отвод продуктов электролиза в объем электролита, резко увеличивающая сопротивление и падение напряжения в электролите, снижающая ток электролиза. Это явление носит название "солевой пассивации".
При смещении потенциалов анода в область положительных значений для ряда пассивирующихся металлов создаются условия для образования на их поверхности тонких (2-10 мк), но достаточно плотных окисных пленок, пассивирующих анод, препятствующих прохождению тока электролиза и приводящих к значительной поляризации анода. Это явление носит название "окисной пассивации" или просто "пассивации анода".
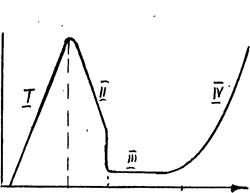
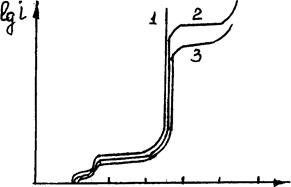
Примером является анодное растворение железа в растворах H2SО4 (рис.3.13)
Lgi
Рис.3.13.Вид поляризационных кривых для пассивирующегося металла (Fe в сернокислых растворах): аб - область активного растворения железа с образованием Fe 2+ . Еф - фляде потенциал - потенциал перехода электрода в пассивное состояние, соответствует реакции 2Fe + 3Н2О-6е=Fе2О3+6Н + ; bг - область пассивного состояния (DЕ); гд - выделение на аноде О2 .
По П.И. Булеру:Примером смешанной "солевой" и "окисной" пассивации является анодное растворение свинца в сернокислых растворах (рис.3.14).
1- область активного растворения:
При Е = 0,356 В достигается ПР РbSO4, наступает солевая пассивация (область П).
При = 0,615В достигается переход анода в пассивное состояние:
0,356 0,615 1,23 E
Рис.3.14. Вид поляризационных кривых при солевой и окисной пассивации (Рb в сернокислых растворах)
При 1,229 В достигаются потенциалы выделения кислорода по реакции Н2О - 2е = 2Н + + 1/2О2 (область 1У).
Поскольку пассивация обусловлена появлением на поверхности металла плотной окисной пленки, придающей изделию ряд ценных свойств, то процесс анодирования изделий широко применяется в производственной практике (антикоррозионные, термостойкие покрытия, грунтовка под покраску, декоративные покрытия и т.д.).
Однако при растворении и рафинировании металлов это явление крайне нежелательно, поскольку приводит к резкому уменьшению скорости растворения, значительной поляризации анода, ионизации электроположительных примесей, загрязнению ими катодного металла. Для уменьшения негативного влияния пассивации анода применяют ряд приемов:
1) использование реверсивного тока для перевода и поддержания анода в области потенциалов активного растворения (В.Г. Лобанов),
2) перепассивация анода, приводящая к образованию высших окислов, хорошо растворимых в электролите. Например, при больших перенапряжениях пассивирующий окисел Сr2О3 переходит в хорошо растворимый бихромат Сг2О7 2- ,
3) введение в электролит активаторов: Сl - , Вг - ,I - , F - и т.д.
Активаторы адсорбционно вытесняют с поверхности электрода пассивирующие агенты, предотвращая тем самым пассивацию анода.
Например, хром в растворах серной кислоты находится в пассивном состоянии и не взаимодействует с ней. Стоит ввести в раствор NaCI, как начинается бурное взаимодействие хрома и серной кислоты с выделением водорода.
Анодное растворение сплавов (амальгам) дополнительно осложнено концентрационной поляризацией со стороны сплава:
hспл = - , которая может быть рассчитана по величине предельного тока ионизации растворяемого из амальгамы металла:
hспл = - .
Вид поляризационных кривых показан на рис.3.15 для амальгам с различной концентрацией электроактивного металла (x1>x2>x3) .
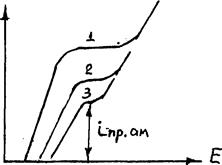
Рис.3.15. Вид поляризационных кривых при растворении амальгам
В принципе все рафинируемые металлы должны рассматриваться как сложные сплавы. Первоначально из них растворяются электроотрицательные компоненты. Например, для меди (Е°=0,337В) это Рb(E o Pb 2+ /Pb=-0,126B), Ni(-0,24 В).
Поскольку концентрация этих металлов незначительна, их растворение идет на предельном токе вместе с основным процессом - ионизацией меди.
По мере растворения меди поверхностный слой обогащается по содержанию электроположительных элементов серебром и золотом: Ag(E°Ag + /Ag = 0,799В), Au (E°Au + /Au = 1,7В). При соблюдении технологии потенциалы ионизации этих металлов не достигаются, и они выкрашиваются из анода, переходя в шлам.
Однако при значительной поляризации анода (за счет пассивации либо достижения inp растворения меди из сплава) из-за большого содержания Ag, Au может наступить ионизация благородных металлов, что увеличит их потери с катодной медью (рис.3.16).
0 0,24 0,48 0,72 0,96 E,B
Рис.3.16. Вид поляризационных кривых черновой меди с различными добавками серебра: 1 - черновой меди;
2 - черновой меди с добавкой 10% Ag; 3-c добавкой 20% Ag
Контроль потенциала является контролем соблюдения технологии, контролем качества получаемого металла, контролем обеспечения нужных экономических показателей.
Читайте также:
