Атомно кристаллическое строение металлов
Обновлено: 21.09.2024
Ознакомиться с типами кристаллических решеток металлов и сплавов, дефектами кристаллического строения и видами твердых растворов.
Приборы, материалы и инструмент Модели основных типов кристаллических решеток металлов и твердых растворов.
Краткие теоретические сведения
Атомно-кристаллическая структура металлов. Металлы при нормальных условиях имеют кристаллическую структуру, отличительной особенностью которой является определенное взаимное периодическое расположение атомов, распространяющееся на сколь угодно большие расстояния. Такое расположение атомов принято называть дальним порядком. Таким образом, под атомнокристаллической структурой понимают взаимное расположение атомов (ионов), существующее в реальном кристалле. Для описания атомно-кристаллической структуры используют понятие пространственной или кристаллической решетки. Кристаллическая решетка металла представляет собой воображаемую пространственную сетку, в узлах которой располагаются атомы (ионы), между которыми движутся свободные электроны. Электростатические силы притяжения между ионами и электронами уравновешивают силы отталкивания между ионами. Таким образом, положения атомов таковы, что обеспечивается минимальная энергия взаимодействия между ними, а, следовательно, устойчивость всего агрегата.
Минимальный объем кристалла, дающий представление об атомной структуре металла во всем объеме, называют элементарной кристаллической ячейкой. Чистые металлы имеют одну из нижеуказанных видов кристаллической решетки: объемноцентрированную (ОЦК), гранецентрированную (ГЦК) и гексагональную плотноупакованную (ГПУ) (рис. 1).
ОЦК решетку имеют, например, -железо, литий, ванадий, вольфрам, молибден, хром, тантал; ГЦК решетку – алюминий, -железо, медь, золото, никель, платина, свинец, серебро. ГПУ решетку имеют магний, цинк, бериллий, кадмий, кобальт, титан.
Координатные направления (кристаллографические оси). В системе кристаллографических осей форма элементарной ячейки пространственной решетки может быть описана с помощью трех координатных углов , и между кристаллографическими осями и трех параметров решетки а, b, с.
Для элементарных ячеек кубических решеток ОЦК (рис. 1а) и ГЦК (рис. 1б) характерно равенство углов = = = 90° и равенство параметров решетки а = b = с. Для ГПУ решетки (рис. 1в) характерны значения углов = = 90° и = 120° и равенство двух параметров решетки а = b с.
Для описания атомных плоскостей и направлений в кристалле используют кристаллографические символы. Для определения символов плоскостей пользуются методом индицирования плоскости по отрезкам. Для этого выбирают систему координат таким образом, чтобы координатные оси I, II, III были параллельны трем пересекающимся ребрам кристалла (рис. 2). Как правило, первая кристаллографическая ось направлена к наблюдателю, вторая – горизонтально, третья ориентируется вверх. Плоскость А1В1С1 отсекает на координатных осях отрезки, равные по величине параметрам решетки ОА1 = а, ОВ1 = в, ОС1 = с. Плоскость А1В1С1 называют единичной. Параметры решетки а, в, с принимают за осевые единицы.

Рисунок 1 – Основные типы элементарных ячеек Бравэ, характерные для металлов: а) – объемноцентрированная кубическая; б) – гранецентрированная кубическая; в) – гексагональная плотноупакованная

Рисунок 2 – Схема к определению символа атомной плоскости в кристалле
Чтобы определить кристаллографические индексы плоскости А2В2С2, необходимо:
- найти параметры заданной плоскости, т. е. отрезки в осевых единицах, отсекаемые данной плоскостью на координатных осях;
- записать отношение трех дробей, числителями которых являются параметры единичной плоскости А1В1С1, а знаменателями – параметры заданной плоскости
- привести полученное соотношение к отношению трех целых взаимно простых чисел, т. е. привести дроби к общему знаменателю, сократить, если можно, на общий множитель, и знаменатель отбросить.
Дефекты кристаллического строения. Реальный кристалл отличается от идеального наличием дефектов кристаллического строения, которые оказывают влияние, часто решающее, на макроскопические свойства кристаллических тел. По геометрическим признакам дефекты подразделяют на три группы:
Точечные дефекты имеют размеры по всем направлениям от одного до четырех атомных диаметров. Подразделяются на собственные и примесные.
К собственным точечным дефектам относятся: вакансии, образующиеся при удалении атома (иона) из его нормального положения в узле кристаллической решетки, и межузельные атомы – атомы основного металла, расположенные в междоузлиях кристаллической решетки. К примесным относятся атомы другого (или других) элементов, растворенные в основной решетке по принципу замещения или внедрения.
На рисунке 7 представлены в двухмерной модели кристалла вакансии, собственный межузельный атом и примесные атомы замещения и внедрения.
Наиболее распространенными являются вакансии. Известны два механизма возникновения вакансий: механизм Шоттки – при выходе атома на внешнюю поверхность или поверхность поры или трещины внутри кристалла под действием тепловых флуктуаций, и механизм Френкеля – при образовании внутри кристаллической решетки пары «собственный межузельный атом – вакансия» при деформации, облучении металлов ионизирующими излучениями: быстрыми электронами, γ – лучами. В реальных кристаллах вакансии постоянно образуются и исчезают под действием тепловых флуктуаций. Энергия активации образования вакансии составляет примерно 1 эв, межузельного атома – от 3 до 10 эв.
С повышением температуры равновесная концентрация точечных дефектов в кристалле увеличивается. При пластической деформации, облучении, закалке количество точечных дефектов резко возрастает, что приводит к нарушению их равновесной концентрации на несколько порядков.
Примесные атомы замещения мигрируют так же, как и основные атомы – по вакансионному механизму. Примесные атомы внедрения имеют малые размеры и поэтому, в отличие от больших собственных межузельных атомов, могут мигрировать по пустотам между атомами кристаллической решетки.
Точечные дефекты оказывают большое влияние на механизм и кинетику процессов ползучести, длительного разрушения, образования диффузионной пористости, обезуглероживания, графитизации и других процессов, связанных с переносом атомов в объеме вещества, а также на физические свойства: электросопротивление, плотность.
Линейные дефекты малы (несколько атомных диаметров) в двух направлениях и имеют большую протяженность, сравнимую с длиной кристалла, в третьем. К линейным дефектам относятся дислокации, цепочки вакансий и межузельных атомов.
Дислокации подразделяются на два основных вида: краевые и винтовые.
Краевую дислокацию можно представить, если мысленно по вертикали частично расщепить совершенный кристалл, скажем с кубической примитивной решеткой, и вставить в него лишний короткий атомный слой, называемый экстраплоскостью. Экстраплоскость можно получить также сдвигом одной части кристалла относительно другой. Экстраплоскость, действуя как клин, изгибает решетку вокруг своего нижнего края внутри кристалла (рис. 8).
Рисунок 7 – Вакансия (1), Рисунок 8 – Модель краевой собственный межузельный атом (2), дислокации в примитивной
примесный атом замещения (3) и кубической решетке. Стрелка –
внедрения (4) в двухмерной модели вектор сдвига кристалла

Рисунок 9 – Схема скольжения краевой дислокации
Заключительным этапом скольжения является выход краевой дислокации (экстраплоскости) на поверхность кристалла. При этом верхняя часть кристалла сдвигается относительно нижней на одно межатомное расстояние в направлении сдвига. Такое перемещение – есть элементарный акт пластической деформации.
Скольжение – консервативное движение, не связанное с переносом массы вещества. Направление и величина сдвига при перемещении краевой дислокации характеризуются вектором Бюргерса b и его мощностью соответственно. Направление перемещения краевой дислокации параллельно вектору Бюргерса.
Кроме скольжения, краевая дислокация может перемещаться переползанием, которое осуществляется диффузионным путем и является термически активируемым процессом. Положительное переползание осуществляется, когда цепочка атомов с края экстраплоскости перемещается в соседние вакансии или междоузлия, т.е. экстраплоскость укорачивается на одно межатомное расстояние и краевая дислокация переходит в верхнюю плоскость скольжения, параллельную первой. Отрицательное переползание происходит, когда край экстраплоскости достраивается атомным рядом за счет присоединения межузельных или соседних атомов, и краевая дислокация переходит в нижнюю плоскость скольжения. Переползание – неконсервативное движение, т.е. происходит с переносом массы. Скорость переползания зависит как от температуры, так и от концентрации точечных дефектов.
Винтовую дислокацию, как и краевую, можно создать с помощью сдвига. Представим кристалл в виде стопки горизонтальных параллельных атомных плоскостей. Мысленно сделаем в кристалле несквозной надрез (рис. 10а) и сдвинем, например, правую часть вниз (вдоль плоскости АВСD) на одно межплоскостное расстояние (рис. 10б).
Рисунок 10 Винтовая дислокация ВС, Рисунок 11 – Кристалл с созданная сдвигом: а, б – кристалл до и винтовой дислокацией после сдвига по плоскости АВСD
соответственно; τ – напряжение сдвига
Винтовая дислокация подразделяется на правую (рис. 10б), когда при движении от верхней плоскости к нижней линию дислокации нужно обходить по часовой стрелке, и левую, когда при движении от верхней плоскости к нижней линию дислокации нужно обходить против часовой стрелки (если относительно плоскости АВСD сдвинуть вниз левую часть кристалла). Линия винтовой дислокации всегда параллельна вектору Бюргерса (рис. 11).
Винтовая дислокация, в отличие от краевой, не связана с определенной плоскостью сдвига, поэтому может перемещаться скольжением в любой кристаллографической плоскости, содержащей линию дислокации и вектор сдвига (рис. 12). Направление перемещения винтовой дислокации всегда перпендикулярно вектору Бюргерса. В результате скольжения как краевой, так и винтовой дислокации, на поверхности кристалла образуется ступенька высотой, равной по модулю вектору Бюргерса b (рис. 12).
Рисунок 12 – Схема скольжения винтовой Рисунок 13 – Схема,
Поверхностные дефекты. К поверхностным дефектам относятся границы зерен (субзерен) (рис. 13). Поверхностные дефекты двумерны, т. е. имеют макроскопические размеры в двух направлениях и атомные в третьем направлении. Границы называют малоугловыми, если разориентация кристаллических решеток соседних зерен не превышает 10°, и высокоугловыми (большеугловыми) при большей разориентации.
Малоугловые границы могут быть образованы системами как краевых, так и винтовых дислокаций разной ориентации и с разными векторами Бюргерса. Малоугловые границы возникают при росте кристаллов из расплава, при пластической деформации и др. Дислокации малоугловой границы притягивают к себе точечные дефекты вследствие упругого взаимодействия с ними. Миграция малоугловой границы осуществляется только диффузионным путем. Поэтому точечные дефекты, сконцентрированные в приграничной зоне в несколько межатомных расстояний, тормозят этот процесс и стабилизируют субструктуру.
Высокоугловые границы обнаружены намного раньше малоугловых и являются «старейшим» видом дефектов кристаллического строения. Считают, что высокоугловая граница представляет собой слой толщиной в 2-3 атомных диаметра, в котором атомы занимают некоторые промежуточные положения по отношению к правильным положениям узлов решеток соседних зерен. Такое положение атомов обеспечивает минимальную потенциальную энергию в пограничном слое, поэтому достаточно стабильно.
Природа и поведение как малоугловых, так высокоугловых границ при силовом и температурном воздействиях влияют на механические свойства материала.
Атомно-кристаллическое строение металлов и сплавов. Дефекты строения. Теоретическая и фактическая прочность.
Под атомно-кристаллической структурой понимают взаимное расположение атомов в кристалле. Кристалл состоит из атомов (ионов), расположенных в определенном порядке, который периодически повторяется в трех измерениях. Наименьший комплекс атомов, который при многократном повторении в пространстве позволяет воспроизвести пространственную кристаллическую решётку, называют элементарной ячейкой.
Рис.2.1. Схема определения координационного числа кристаллической решётки: а – ГЦК; б – ОЦК; в – ГПУ
Простейшим типом кристаллической ячейки является кубическая решётка. В простой кубической решётке атомы расположены (упакованы) недостаточно плотно.
Стремление атомов металла занять места, наиболее близкие друг к другу, приводит к образованию решеток других типов (рис. 2.2):
- объёмноцентрированной кубической решётки (ОЦК) (рис.2.2а) с параметром
а = 0,28 – 0,6мм = 2,8 – 6,0 Å
- гранецентрированной кубической решётки (ГЦК) (рис.2.2б) с параметром
- гексагональной плотно упакованной решётки (ГПУ) (рис.2.2в) с параметром
Рис. 2.2. Кристаллические решётки: а – гранецентрированный куб (ОЦК); б – объемноцентрированный куб (ГЦК); в- гексагональная плотно упакованная (ГПУ)
Узлы (положения атомов), направления в плоскости и в пространстве обозначаются с помощью так называемых индексов Миллера (рис. 2.3). Индексы узла записываются – (mnp), индексы направления - [mnp], индекс плоскости - (hk1).
Рис. 2.3. Символы некоторых важнейших узлов, направлений и плоскостей в кубической решётке
Вследствие неодинаковой плотности атомов в различных плоскостях и направлениях решётки многие свойства отдельно взятого кристалла (химические, физические, механические) по данному направлению отличаются от свойств в другом направлении и, естественно, зависят от того, сколько атомов встречается в этом направлении. Различие свойств в зависимости от направления испытания носит название анизотропии. Все кристаллы анизотропны. Анизотропия – особенность любого кристалла, характерная для кристаллического строения.
Технические металлы являются поликристаллами, т.е. состоят из совокупности кристаллитов с различной ориентацией. При этом свойства во всех направлениях усредняются.
2.2. Дефекты кристаллического строения
Строение реальных кристаллов отличается от идеальных. Реальные кристаллы всегда содержат несовершенства (дефекты) кристаллического строения, которые нарушают связи между атомами и оказывают влияние на свойства металлов.
Дефекты в кристаллах принято классифицировать по характеру их измерения в пространстве:
1. Точечные. Точечными дефектами называются нарушения периодичности кристалла, размеры которых сопоставимы с размерами атома во всех измерениях.
К точечным дефектам относятся вакансии, межузельные атомы, примеси замещения, примеси чужеродных атомов внедрения (рис. 2.5).
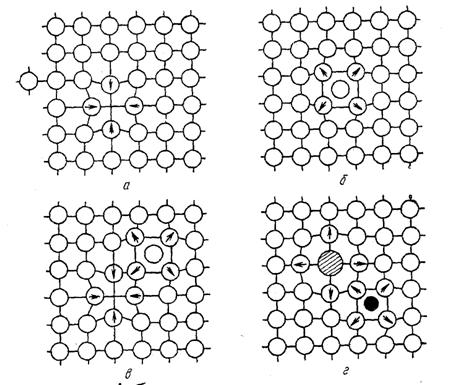
Рис. 2.5.Точечные дефекты в кристаллической решетке: а- вакансия;
б - межузельный атом; в- дефект Френкеля; г- примесные атомы замещения (большой) и внедрения (маленький).
Стрелками указаны направления смещений атомов в решетке.
Вакансии и межузельные атомы появляются в кристаллах при любой температуре выше абсолютного нуля из-за тепловых колебаний атомов. Каждой температуре соответствует равновесная концентрация вакансий, а также межузельных атомов. Например, в меди при температуре 20-25 о С содержится 10 -13 ат. % вакансий, а вблизи точки плавления - уже 0,01 ат. % (одна вакансия приходится на 10 4 атомов).
Пересыщение точечными дефектами достигается при резком охлаждении после высокотемпературного нагрева, при пластическом деформировании и при облучении нейтронами. Чем выше температура, тем больше концентрация вакансий и тем чаще они переходят от узла к узлу. Вакансии являются самой важной разновидностью точечных дефектов; они ускоряют все процессы, связанные с перемещениями атомов: диффузию, спекание порошков и т. д.
2. Линейные. Линейные дефекты в кристаллах характеризуются тем, что их поперечные размеры не превышают нескольких межатомных расстояний, а длина может достигать размера кристалла. К линейным дефектам относятся дислокации – линии, вдоль и вблизи которых нарушено правильное периодическое расположение атомных плоскостей кристалла.
Важнейшие виды линейных несовершенств - краевые и винтовые дислокации (рис.2.6).
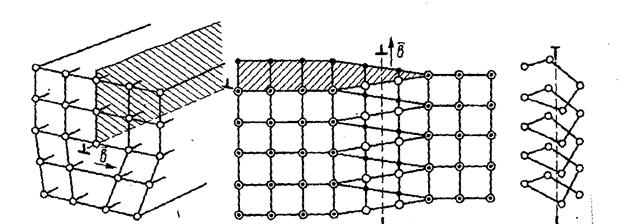
Рис. 2.6. Схема дислокаций: а – краевая; б - винтовая
Краевая дислокация в сечении представляет собой край «лишней» полуплоскости в решетке (рис.2.7)
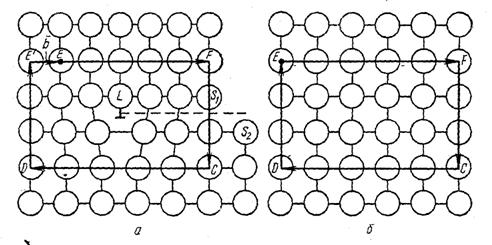
Рис. 2.7. Сечение простой кубической решетки: а - с краевой дислокацией; б - без дислокации.
Вокруг дислокаций решетка упруго искажена. Схема образования атмосферы Коттрелла в кристалле представлена на рисунке 2.8.

Рис. 2.8. Образование атмосферы Коттрелла: а – атомы примеси замещения (заштрихованы) и внедрения беспорядочно расположены в решетке; б, в – атомы примеси переместились к дислокации, в результате чего энергия решетки понизилась.
3. Поверхностные (двумерные). Под этими дефектами понимают нарушения, которые обладают большой протяженностью в двух измерениях и протяженностью лишь в несколько межатомных расстояний в третьем измерении.
К поверхностным дефектам относятся дефекты упаковки, двойниковые границы, границы зерен.
4.Объемные (трехмерные). Под ними понимают нарушения, которые в трех измерениях имеют неограниченные размеры. К таким нарушениям относят трещины, поры, усадочные раковины.
Кристаллическое строение металлов

Металлы – особая группа элементов в периодической таблице Менделеева. В отличие от неметаллов элементы этой группы являются исключительно восстановителями с положительной степенью окисления, а также обладают пластичностью, твёрдостью, упругостью, что обусловлено кристаллическим строением металлов.
Общее строение
Металлы – твёрдые вещества, имеющие кристаллическое строение. Исключение составляет ртуть – жидкий металл. Кристаллические решётки представляют собой упорядоченные определённым образом атомы металла. Каждый атом состоит из положительно заряженного ядра и нескольких отрицательно заряженных электронов. В атомах металлов недостаточно электронов, поэтому они являются ионами.
Единица кристаллической решётки – элементарная кристаллическая ячейка, в условных узлах и на гранях которой находятся положительно заряженные ионы. Их удерживают вместе металлические связи, возникающие за счёт беспорядочного движения отделившихся от атомов электронов (благодаря чему атомы превратились в ионы).
Отрицательно заряженные электроны держат на равном расстоянии положительно заряженные электроны, предавая кристаллической решётке правильную геометрическую форму.
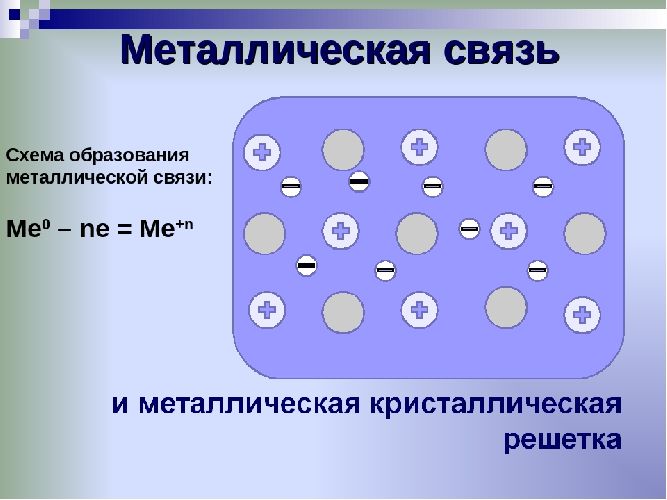
Рис. 1. Схема металлической связи.
Свободное движение электронов обусловливает электро- и теплопроводность металлов.
Виды решёток
Элементарные кристаллические ячейки могут иметь различную конфигурацию. В связи с этим выделяют три типа кристаллических решёток:
- объемно-центрированная (ОЦК) кубическая – состоит из 9 ионов;
- гранецентрированная (ГЦК) кубическая – включает 14 ионов;
- гексагональная плотноупакованная (ГПУ) – состоит из 17 ионов.
ОЦК представляет собой куб, в узлах которого находится по атому. В центре куба, на пересечении диагоналей располагается девятый ион. Этот тип характерен для железа, молибдена, хрома, вольфрама, ванадия.
Элементарной кристаллической ячейкой типа ГЦК является куб с ионами в узлах и в середине каждой грани – на пересечении диагоналей. Такое строение имеют медь, серебро, алюминий, свинец, никель.
Третий тип имеет вид гексагональной призмы, в узлах которой находится по шесть ионов с каждой стороны. Посередине между шестью узлами располагается по одному иону. В середине призмы между шестиугольными гранями находится равносторонний треугольник, который составляют три иона.
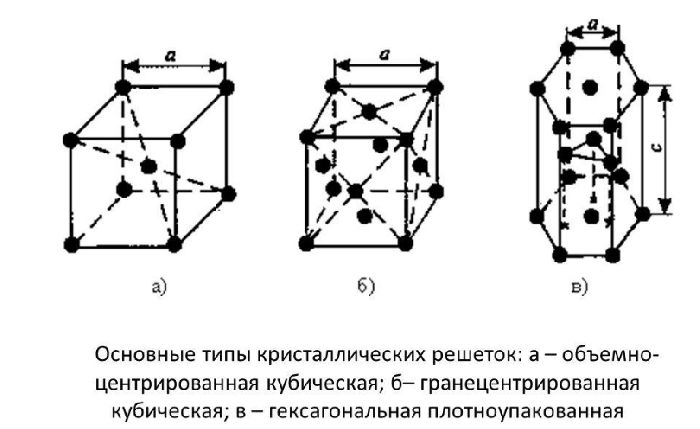
Рис. 2. Типы решёток.
Металл может содержать большое количество дефектов атомного строения. Дефекты влияют на свойства металла.
Характеристика решётки
Кристаллические решётки характеризуются компактностью или степенью наполненности. Компактность определяют показатели:
- параметр решётки – расстояние между атомами;
- число атомов;
- координационное число – количество соседних ячеек;
- плотность упаковки – отношение объёма, занимаемого атомами, к полному объёму решётки.
При подсчёте количества атомов следует помнить, что атомы в узлах и на гранях входят в состав соседних ячеек.
Рис. 3. Кристаллические ячейки составляют решётку.
Что мы узнали?
Узнали кратко об атомно-кристаллическом строении металлов. Металлы – твёрдые кристаллические вещества. Единицей решётки является элементарная кристаллическая ячейка. Благодаря металлическим связям ионы в узлах ячеек удерживаются на одинаковом расстоянии. Различают три типа кристаллических решёток – ОЦК, ГЦК и ГПУ, отличающихся количеством атомов и геометрической формой.
Лекция "Особенности атомно-кристаллического строения металлов"по дисциплине "Основы материаловедения"
Материаловедение - это наука о взаимосвязи электронного строения, структуры материалов с их составом, физическими, химическими, технологическими и эксплуатационными свойствами.
Создание научных основ металловедения по праву принадлежит. Чернову Д.К., который установил критические температуры фазовых превращений в сталях и их связь с количеством углерода в сталях. Этим были заложены основы для важнейшей в металловедении диаграммы состояния железоуглеродистых сплавов.
Открытием аллотропических превращений в стали, Чернов заложил фундамент термической обработки стали. Критические точки в стали, позволили рационально выбирать температуру ее закалки, отпуска и пластической деформации в производственных условиях.
В своих работах по кристаллизации стали, и строению слитка Чернов изложил основные положения теории литья, не утратившие своего научного и практического значения в настоящее время.
Великий русский металлург Аносов П.П. впервые применил микроскоп для исследования структуры металлов. Ему принадлежит приоритет в создании легированных сталей. Разработал теорию и технологию изготовления клинков из булатной стали. Из его работ стало ясно, что так называемый булатный узор на поверхности стали, непосредственно зависит от ее внутренней структуры.
В 1873-1876 г.г Гиббс изложил основные законы фазового равновесия и, в частности, правило фаз, основываясь на законах термодинамики. Для решения практических задач знание фазового равновесия в той или иной системе необходимо, но не достаточно для определения состава и относительного количества фаз. Обязательно знать структуру сплавов, то есть атомное строение фаз, составляющих сплав, а также распределение, размер и форму кристаллов каждой фазы.
Определение атомного строения фаз стало возможным после открытия Лауэ (1912 г), показавшего, что атомы в кристалле регулярно заполняют пространство, образуя пространственную дифракционную решетку, и что рентгеновские лучи имеют волновую природу. Дифракция рентгеновских лучей на такой решетке дает возможность исследовать строение кристаллов.
В последнее время для структурного анализа, кроме рентгеновских лучей, используют электроны и нейтроны. Соответствующие методы исследования называются электронографией и нейтронографией. Электронная оптика позволила усовершенствовать микроскопию. В настоящее время на электронных микроскопах полезное максимальное увеличение доведено до 100000 раз.
В пятидесятых годах, когда началось исследование природы свойств металлических материалов, было показано, что большинство наиболее важных свойств, в том числе сопротивление пластической деформации и разрушению в различных условиях нагружения, зависит от особенностей тонкого кристаллическо строения. Этот вывод способствовал привлечению физических теорий о строении реальных металлов для объяснения многих непонятных явлений и для конструирования сплавов с заданными механическими свойствами. Благодаря теории дислокаций, удалось получить достоверные сведения об изменениях в металлах при их пластической деформации.
Особенно интенсивно развивается металловедение в последние десятилетия. Это объясняется потребностью в новых материалах для исследования космоса, развития электроники, атомной энергетики.
Основными направлениями в развитии металловедения является разработка способов производства чистых и сверхчистых металлов, свойства которых сильно отличаются от свойств металлов технической чистоты, с которыми преимущественно работают. Генеральной задачей материаловедения является создание материалов с заранее расчитаными свойствами применительно к заданным параметрам и условиям работы. Большое внимание уделяется изучению металлов в экстремальных условиях (низкие и высокие температуры и давление).
До настоящего времени основной материальной базой машиностроения служит черная металлургия, производящая стали и чугуны. Эти материалы имеют много положительных качеств и в первую очередь обеспечивают высокую конструкционную прочность деталей машин. Однако эти классические материалы имеют такие недостатки как большая плотность, низкая коррозионная стойкость. Потери от коррозии составляют 20% годового производства стали и чугуна. Поэтому, по данным научных исследований, через 20…40 лет все развитые страны перестроятся на массовое использование металлических сплавов на базе титана, магния, алюминия. Эти легкие и прочные сплавы позволяют в 2-3раза облегчить станки и машины, в 10 раз уменьшить расходы на ремонт.
По данным института имени Байкова А.Н. в нашей стране есть все условия чтобы в течении 10…15 лет машиностроение могло перейти на выпуск алюминиево-титановой подвижной техники, которая отличается легкостью, коррозионной стойкостью и большим безремонтным ресурсом.
Важное значение имеет устранение отставания нашей страны в области использования новых материалов взамен традиционных (металлических) – пластмасс, керамики, материалов порошковой металлургии, особенно композиционных материалов, что экономит дефицитные металлы, снижает затраты энергии на производство материалов, уменьшает массу изделий.
Расчетами установлено, что замена ряда металлических деталей легкового автомобиля на углепластики из эпоксидной смолы, армированной углеродными волокнами, позволит уменьшить массу машины на 40%; она станет более прочной; уменьшится расход топлива, резко возрастет стойкость против коррозии.
Металлы, особенности атомно-кристаллического строения
В огромном ряду материалов, с незапамятных времен известных человеку и широко используемых им в своей жизни и деятельности, металлы всегда занимали особое место.
Подтверждение этому: и в названиях эпох (золотой, серебряный, бронзовый, железный века), на которые греки делили историю человечества: и в археологических находках металлических изделий (кованые медные украшения, сельскохозяйственные орудия); и в повсеместном использовании металлов и сплавов в современной технике.
Причина этого - в особых свойствах металлов, выгодно отличающих их от других материалов и делающих во многих случаях незаменимыми.
Металлы – один из классов конструкционных материалов, характеризующийся определ¨нным набором свойств:
· «металлический блеск» (хорошая отражательная способность);
Данные свойства обусловлены особенностями строения металлов. Согласно теории металлического состояния, металл представляет собой вещество, состоящее из положительных ядер, вокруг которых по орбиталям вращаются электроны. На последнем уровне число электронов невелико и они слабо связаны с ядром. Эти электроны имеют возможность перемещаться по всему объ¨му металла, т.е. принадлежать целой совокупности атомов.
Таким образом, пластичность, теплопроводность и электропроводность обеспечиваются наличием «электронного газа».
Все металлы, затвердевающие в нормальных условиях, представляют собой кристаллические вещества, то есть укладка атомов в них характеризуется определ¨нным порядком – периодичностью, как по различным направлениям, так и по различным плоскостям. Этот порядок определяется понятием кристаллическая реш¨тка.
Другими словами, кристаллическая решетка это воображаемая пространственная решетка, в узлах которой располагаются частицы, образующие твердое тело.
Элементарная ячейка – элемент объ¨ма из минимального числа атомов, многократным переносом которого в пространстве можно построить весь кристалл.
Элементарная ячейка характеризует особенности строения кристалла. Основными параметрами кристалла являются:
размеры р¨бер элементарной ячейки. a, b, c – периоды реш¨тки – расстояния между центрами ближайших атомов. В одном направлении выдерживаются строго определ¨нными. ·
· углы между осями ().
координационное число (К) указывает на число атомов, расположенных на ближайшем одинаковом расстоянии от любого атома в решетке. ·
базис решетки количество атомов, приходящихся на одну элементарную ячейку решетки. ·
плотность упаковки атомов в кристаллической решетке – объем, занятый атомами, которые условно рассматриваются как жесткие шары. Ее определяют как отношение объема, занятого атомами к объему ячейки (для объемно-центрированной кубической решетки – 0,68, для гранецентрированной кубической решетки – 0,74) ·
Рис.1.1. Схема кристаллической решетки
Классификация возможных видов кристаллических решеток была проведена французским ученым О. Браве, соответственно они получили название «решетки Браве». Всего для кристаллических тел существует четырнадцать видов решеток, разбитых на четыре типа;
примитивный – узлы решетки совпадают с вершинами элементарных ячеек; ·
· базоцентрированный – атомы занимают вершины ячеек и два места в противоположных гранях;
объемно-центрированный – атомы занимают вершины ячеек и ее центр; ·
гранецентрированный – атомы занимают вершины ячейки и центры всех шести граней ·
Рис. 1.2. Основные типы кристаллических решеток: а – объемно-центрированная кубическая; б– гранецентрированная кубическая; в – гексагональная плотноупакованная
Основными типами кристаллических реш¨ток являются:
1. Объемно - центрированная кубическая (ОЦК) (см. рис.1.2а), атомы располагаются в вершинах куба и в его центре (V, W, Ti, )
2. Гранецентрированная кубическая (ГЦК) (см. рис. 1.2б), атомы рассполагаются в вершинах куба и по центру куждой из 6 граней (Ag, Au, )
3. Гексагональная, в основании которой лежит шестиугольник:
o простая – атомы располагаются в вершинах ячейки и по центру 2 оснований (углерод в виде графита);
o плотноупакованная (ГПУ) – имеется 3 дополнительных атома в средней плоскости (цинк).
Понятие об изотропии и анизотропии
Свойства тела зависят от природы атомов, из которых оно состоит, и от силы взаимодействия между этими атомами. Силы взаимодействия между атомами в значительной степени определяются расстояниями между ними. В аморфных телах с хаотическим располохением атомов в пространстве расстояния между атомами в различных направлениях равны, следовательно, свойства будут одинаковые, то есть аморфные тела изотропны
В кристаллических телах атомы правильно располагаются в пространстве, причем по разным направлениям расстояния между атомами неодинаковы, что предопределяет существенные различия в силах взаимодействия между ними и, в конечном результате, разные свойства. Зависимость свойств от направления называется анизотропией
Чтобы понять явление анизотропии необходимо выделить кристаллографические плоскости и кристаллографические направления в кристалле.
Плоскость, проходящая через узлы кристаллической решетки, называется кристаллографической плоскостью.
Прямая, проходящая через узлы кристаллической решетки, называется кристаллографическим направлением.
Д ля обозначения кристаллографических плоскостей и направлений пользуются индексами Миллера. Чтобы установить индексы Миллера, элементарную ячейку вписывают в пространственную систему координат (оси X,Y, Z – кристаллографические оси). За единицу измерения принимается период решетки.
Рис.1.3. Примеры обозначения кристаллографических плоскостей (а) и кристаллографических направлений (б)
Для определения индексов кристаллографической кристаллографической плоскости необходимо:
установить координаты точек пересечения плоскости с осями координат в единицах периода решетки; ·
взять обратные значения этих величин; ·
привести их к наименьшему целому кратному, каждому из полученных чисел. ·
Полученные значения простых целых чисел, не имеющие общего множителя, являются индексами Миллера для плоскости, указываются в круглых скобках. Примеры обозначения кристаллографических плоскостей на рис. 1.3 а.
Другими словами, индекс по оси показывает на сколько частей плоскость делит осевую единицу по данной оси. Плоскости,параллельные оси, имеют по ней индекс 0 (110)
Ориентация прямой определяется координатами двух точек. Для определения индексов кристаллографического направления необходимо:
одну точку направления совместить с началом координат; ·
установить координаты любой другой точки, лежащей на прямой, в единицах периода решетки ·
привести отношение этих координат к отношению трех наименьших целыж чисел. ·
Индексы кристаллографических направлений указываются в квадратных скобкаж [111]
В кубической решетке индексы направления, перпендикулярного плоскости (hkl) имеют теже индексы [hkl].
Аллотропия или полиморфные превращения.
Способность некоторых металлов существовать в различных кристаллических формах в зависимости от внешних условий (давление, температура) называется аллотропией или полиморфизмом.
Каждый вид решетки представляет собой аллотропическое видоизменение или модификацию.
Примером аллотропического видоизменения в зависимости от температуры является железо (Fe).
Превращение одной модификации в другую протекает при постоянной температуре и сопровождается тепловым эффектом. Видоизменения элемента обозначается буквами греческого алфавита в виде индекса у основного обозначения металла.
Примером аллотропического видоизменения, обусловленного изменением давления, является углерод: при низких давлениях образуется графит, а при высоких – алмаз.
Используя явление полиморфизма, можно упрочнять и разупрочнять сплавы при помощи термической обработки.
Магнитные превращения
Некоторые металлы намагничиваются под действием магнитного поля. После удаления магнитного поля они обладают остаточным магнетизмом. Это явление впервые обнаружено на железе и получило название ферромагнетизма. К ферромагнетикам относятся железо, кобальт, никель и некоторые другие металлы.
При нагреве ферромагнитные свойства металла уменьшаются постепенно: вначале слабо, затем резко, и при определ¨нной температуре (точка Кюри) исчезают (точка Кюри для железа – ). Выше этой температуры металлы становятся парамагнетиками. Магнитные превращения не связаны с изменением кристаллической решетки или микроструктуры, они обусловлены изменениями в характере межэлектронного взаимодействия.
Читайте также:
