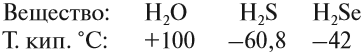Атомы металлов отдавая внешние электроны
Обновлено: 17.05.2024
Теорию ионной связи предложил в 1916г. немецкий ученый В. Коссель. Эта теория объясняет образование связей между атомами типичных металлов и атомамитипичных неметаллов:CsF, CsCl, NaCl, KF, KCl, Na2O и др.
Согласно этой теории, при образовании ионной связи атомы типичных металлов отдают электроны, а атомы типичных неметаллов принимают электроны.
В результате этих процессов атомы металлов превращаются в положительно заряженные частицы, которые называются положительными ионами или катионами; а атомы неметаллов превращаются в отрицательные ионы — анионы. Заряд катиона равен числу отданных электронов.
Атомы металлов отдают электроны внешнего слоя, а образующиеся ионы имеют завершенные электронные структуры (предвнешнего электронного слоя).
Величина отрицательного заряда аниона равна числу принятых электронов.
Атомы неметаллов принимают такое количество электронов, какое им необходимо для завершения электронного октета (внешнего электронного слоя).
Например: общая схема образования молекулы NaCl из атомов Na и С1: Na°-le = Na +1 Образование ионов
Na +1 + Сl - = Nа + Сl -
Na°+ Сl°= Nа + Сl - Соединение ионов
· Связь между ионами называется ионной связью.
Соединения, которые состоят из ионов, называются ионными соединениями.
Алгебраическая сумма зарядов всех ионов в молекуле ионного соединения должна быть равна нулю,потому что любая молекула является электронейтральной частицей.
Резкой границы между ионной и ковалентнои связями не существует. Ионную связь можно рассматривать как крайний случай полярной ковалентнои связи, при образовании которой общая электронная пара полностьюсмещается к атому с большей электроотрицательностью.
Атомы большинства типичных металлов на внешнем электронном слое имеют небольшое число электронов (как правило, от 1 до 3); эти электроны называются валентными. В атомах металлов прочность связи валентных электронов с ядром невысокая, то есть атомы обладают низкой энергией ионизации. Это обусловливает легкость потери валентных электронов ч превращения атомов металла в положительно заряженные ионы (катионы):
В кристаллической структуре металла валентные электроны обладают способностью легко перемещаться от одного атома к другому, что приводит к обобществлению электронов всеми соседними атомами. Упрощенно строение кристалла металла представляется следующим образом: в узлах кристаллической решетки находятся ионы Ме п+ и атомы Ме°, а между ними относительно свободно перемещаются валентные электроны, осуществляя связь между всеми атомами и ионами металла (рис. 3). Это особый тип химической связи, называемой металлической.
· Металлическая связь — связь между атомами и ионами металлов в кристаллической решетке, осуществляемая обобществленными валентными электронами.
Благодаря этому типу химической связи металлы обладают определенным комплексом физических и химических свойств, отличающим их от неметаллов.
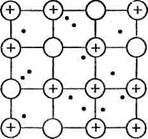
Рис. 3. Схема кристаллической решетки металлов.
Прочность металлической связи обеспечивает устойчивость кристаллической решетки и пластичность металлов (способность подвергаться разнообразной обработке без разрушения). Свободное передвижение валентных электронов позволяет металлам хорошо проводить электрический ток и тепло. Способность отражать световые волны (т.е. металлический блеск) также объясняется строением кристаллической решетки металла.
Таким образом, наиболее характерными физическими свойствами металлов в зависимости от наличия металлической связи являются:
■металлический блеск и непрозрачность;
■пластичность, ковкость, плавкость;
■высокие электро- и теплопроводность; и склонность к образованию сплавов.
Атомы металлов отдают электроны ___________________ или ____________________
электронного слоя и превращаются в ___________________________________ ионы.
2. Свойства металлов в главных подгруппах периодической системы Д.И. Менделеева
изменяются следующим образом:
число электронов на внешнем слое _____________________________________________
радиус атома ________________________________________________________________
электроотрицательность ______________________________________________________
восстановительные свойства _____________________________________________________
металлические свойства _______________________________________________________
3. Восстановительные свойства металлов в побочных подгруппах с увеличением
порядкового номера
_________________________________________________________
4. Степень окисления в ряду Be — Mg — Са:
а) увеличивается, так как увеличивается число электронных слоев атома
б) изменяется периодически, так как изменяется номер периода
в) уменьшается, так как уменьшается электроотрицательность атомов
г) одинакова, так как одинаково число валентных электронов
5. Общее у металлической связи и других видов химической связи: _________________
____________________________________________________________________________
____________________________________________________________________________
6. Тип химической связи, который реализуется в сплаве Sn-Pb:
а) ионная в) водородная
б) металлическая г) ковалентная
7. Фактор, обусловивший полиморфизм:
а) различная масса элементов, образующих вещество
б) многообразие неорганических веществ
в) большое число химических элементов
г) различие кристаллических форм
8. Свойства, нехарактерные для веществ с металлической кристаллической решеткой:
а) низкая температура кипения
б) теплопроводность
в) хрупкость
г) низкая электропроводность
д) твердость
е) пластичность
ж) металлический блеск
з) низкая плотность
и) магнетизм
9. Наиболее пластичные металлы: ______________________________________________
____________________________________________________________________________
Практическая значимость пластичности металлов: __________________________________
______________________________________________________________________________
_____________________________________________________________
помогиииите
Посетители, находящиеся в группе Гости, не могут оставлять комментарии к данной публикации.
найдите все значения а кратных числу 3 при которых будет верным неравенство 145
Лабораторная работа № 9.1.1. Российская империя на рубеже XIX – ХХ вв. и её место в мире
Документ № 1. Из письма министра финансов С.Ю. Витте Николаю II
В настоящее время политическая сила Великих держав, которые призваны решить грандиозные исторические задачи в мире, создаётся не только силой духа их народов, но также их экономическим устройством. Даже военный потенциал страны определяется… степенью её промышленного развития. Россия нуждается, возможно, более чем какая-либо другая страна, в надлежащей экономической основе для её национальной политики и культуры.
Документ № 2. О положении нашей промышленности. Из доклада министра финансов С.Ю. Витте.
Возрастание промышленности в сравнительно короткий срок само по себе представляется очень значительным. По быстроте и силе этого роста Россия стоит впереди всех иностранных экономически развитых государств, и не подлежит сомнению, что страна, которая оказалась в состоянии в два десятилетия более чем утроить свою горную и фабрично-заводскую промышленность, таит в себе запас внутренних сил для дальнейшего развития, а такое развитие в ближайшем будущем настоятельно необходимо, ибо как ни велики уже достигнутые результаты, тем не менее и по отношению к потребностям населения, и по сравнению с иностранными государствами наша промышленность ещё очень отстала.
В иностранных государствах промышленность не развивается так быстро, как в России, потому что она уже достигла там уровня гораздо более высокого, чем у нас.
Документ № 3 Темпы роста основных экономических показателей развития Российской империи к 1914 г. (уровень 1887 г. принят за 100%)
Валовые сборы хлебов – 177%
Протяжённость железных дорог – 257%
Обороты торговых заведений- 264%
Внешнеторговые обороты – 285%
Капиталы акционерных обществ – 392%
Стоимость продукции фабрично-заводской промышленности – 456%
Пассивы акционерных коммерческих банков – 1096%
Документ № 4 Производство чугуна и каменного угля на рубеже XIX – XX вв. ( в кг. на одного жителя)
Англия 208 1808
Германия 128 2304
Документ № 5 Мнение историка: из книги Л. Холмса «Социальная история России: 1917 – 1941»
… Индустриализация для России была абсолютной необходимостью. Россия уже долгое время играла роль великой державы и делала это довольно успешно со времён Петра Великого. Но в ХХ в., чтобы сохранить этот статус, ей нужна была индустриализация. Выбора не было: к лучшему или худшему; но Россия была частью Европы – и не могла избежать её конфликтов.
Документ № 6 Свидетельство Ф .А. Щербины, известного статистика начала XX в.
В 1884 г. из 100 опрошенных крестьян, по крайней мере, человек 60 или 70 заявляли, что школа им не нужна, что это – дело барское и для крестьянина неподходящее… Содержать школу казалось и дорого и тяжело населению… С тех пор прошло 15 лет, и картина сильно и ярко изменилась. И сельская школа, и народный учитель, и грамотность, и книга – всё это стало насущной необходимостью крестьянской среды… Знания заметно увеличились, и сельская школа… играла в этом отношении, если не единственную, то во всяком отношении преобладающую роль.
Документ № 7 Мнения крестьян (начало ХХ в.)
…Учиться стало нужно: в солдаты возьмут, облегчение даётся; записать, что по извозу; деньги получить… Письменный всюду гож: приведи к купцу, в лавочку, в шинок, его принимают; и дома – расписка, какая, и всякое дело – ему видней…
Мальчика обязательно надо учить: на чужую сторону пойдёт – может хорошее место получить. Кроме того, и в солдатах говорят, легче служить…
Документ № 8. Из данных статистики начала ХХ в.
Из 976 отзывов крестьян 88,4% высказались в пользу грамотности; в том числе было 66% неграмотных. Безразлично отнеслись 8,9%, а против высказались 2,7%. Правда, относительно девочек старый взгляд сохранился крепче… Но и тут положение улучшилось. Из 551 ответа на этот вопрос 376 (68,3%) оказалось положительных и только 84 (15,2%) отрицательных.
Документ № 9 Рост государственных расходов на начальное образование .
Годы сумма в рублях
Документ № 10. Из «Докладной записки Совета съездов Представителей Промышленности и Торговли о мерах к развитию производительных сил России и улучшению торгового баланса». 1914 г.
. Города растут у нас с поистине американской быстротой. Целый ряд железнодорожных станций, фабричных и заводских посёлков, особенно на юге, обратился в крупные центры городской культуры. Естественный в известные периоды экономического развития процесс концентрации населения, в силу происходящих сейчас коренных изменений в жизни сельскохозяйственного населения России, пойдёт, несомненно, с возрастающей быстротой и лет через 20-30 мы увидим, быть может, картину самых крупных в этой области перемен, но рост городов есть в то же время рост совершенно новых потребностей, для удовлетворения которых будут возникать целые отрасли промышленности, неизвестные или очень слабо развитые в настоящее время. Без преувеличения можно сказать, что рост городской жизни вызовет переворот в нашей промышленности.
Документ № 11. Из книги французского экономического обозревателя начала века Э. Тэри «Россия в 1914 г. Экономический обзор».
Благодаря протяжённости своей территории, разнообразию продукции, богатству недр и, в особенности, необыкновенному росту населения, Россия призвана стать великой промышленной державой.
Почти не существовавшая в середине прошлого века, русская промышленность развивалась благодаря строительству железных дорог, которые сделали легкодоступными богатые месторождения Кривого Рога, Донбасса, Польши, Урала и Кавказа и позволили ввести их в эксплуатацию.
Молодые страны имеют то преимущество, что могут немедленно воспользоваться плодами прогресса, добытыми долгими годами опыта в старых промышленных странах. Вот почему шахты и металлургические предприятия, созданные в пустынных степях южной России, были сразу оснащены по образцу наиболее усовершенствованных предприятий Западной Европы, т.е. сразу воспользовались апробированной технологией и самым совершенным оборудованием.
Атомы металлов главных подгрупп, отдавая электроны, приобретают электронную структуру внешнего энергетического уровня:
1. щелочных металлов
2. кислорода
3. благородных газов
Урок 4. Понятие о химической связи

В предыдущих уроках данного курса есть много рассуждений о том, что вещество состоит из молекул, что молекулы состоят из атомов. А не возникал ли у вас вопрос: почему атомы, составляющие молекулу, не разлетаются в разные стороны? Что удерживает атомы в молекуле?
Их удерживает химическая связь.
Химическая связь — совокупность сил, которые удерживают атомы в молекуле или кристалле.
Для того чтобы понять природу химической связи, достаточно вспомнить простой физический опыт. Два шарика, висящие рядом на ниточках, никак не «реагируют» друг на друга. Но если придать одному шарику положительный заряд, а другому — отрицательный, они притянутся друг к другу. Не эта ли сила притягивает атомы друг к другу? Действительно, исследования показали, что химическая связь имеет электрическую природу.
Откуда же возникают заряды в нейтральных атомах?
Ионная связь
При описании строения атомов было показано, что все атомы, за исключением атомов благородных газов, стремятся присоединить или отдать электроны. Причина — образование устойчивого восьмиэлектронного внешнего уровня (как у благородных газов). При приёме или отдаче электронов возникают электрические заряды и, как следствие, электростатическое взаимодействие частиц. Так возникает ионная связь.
Ионная связь — это связь между ионами.
Ионы — это устойчивые заряженные частицы, которые образуются в результате приема или отдачи электронов.
Например, в реакции участвует атом активного металла и активного неметалла:
В этом процессе атом металла (натрия) отдаёт электроны (рис. 14).

Таким образом, в этом процессе образовалась устойчивая частица (8 электронов на внешнем уровне), которая имеет заряд, так как у ядра атома натрия заряд по-прежнему +11, а оставшиеся электроны имеют суммарный заряд –10. Поэтому заряд иона натрия +1. Кратко запись этого процесса выглядит так:
Что происходит с атомом серы? Этот атом принимает электроны до завершения внешнего уровня (рис. 15).
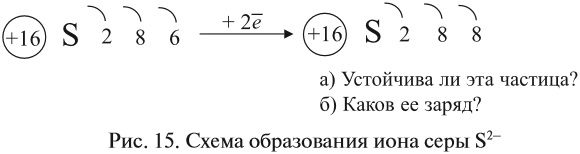
Простой подсчёт показывает, что эта частица имеет заряд:
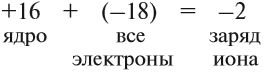
Разноименно заряженные ионы притягиваются, в результате чего возникает ионная связь и «ионная молекула»:
Существуют и другие способы образования ионов (см. урок 6).
Формально сульфиду натрия приписывают именно такой состав молекулы, хотя вещество, состоящее из ионов, имеет приблизительно такое строение (рис. 16).
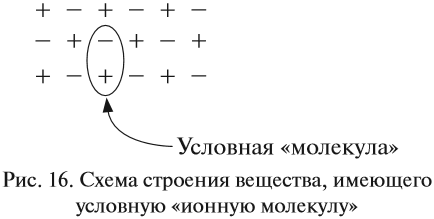
Таким образом, можно сказать определённо, что вещества, состоящие из ионов, не содержат отдельных молекул! В этом случае можно говорить лишь об условной «ионной молекуле».
Задание 4.1. Покажите, как происходит переход электронов при возникновении ионной связи между атомами:
Помните! Атом металла отдаёт внешние электроны; атом неметалла принимает недостающие электроны.
Вывод. Ионная связь по описанному выше механизму образуется между атомами активных металлов и активных неметаллов.

Ковалентная связь
Исследования, однако, показывают, что полный переход электронов от одного атома к другому происходит далеко не всегда. Очень часто химическая связь образуется не при отдаче-приёме электронов, а в результате образования общих электронных пар*. Такая связь называется ковалентной.
* Эти электронные пары возникают в месте пересечения электронных облаков.
Ковалентная связь образуется в месте перекрывания электронных облаков* обоих атомов.
* Электронное облако — область пространства, где нахождение электрона наиболее вероятно.
Такая связь образуется, например, между атомами неметаллов. Возникает вопрос: каким образом область пересечения электронных облаков может связывать атомы? Рассмотрим динамическую модель этого явления, т. е. процесс возникновения ковалентной связи. Предположим, два атома сблизились на достаточно близкое расстояние.
Вопрос. Какие силы возникли между атомами?
Поскольку вокруг ядер атомов расположены отрицательно заряженные электроны, между атомами возникают силы отталкивания. Но если атомы обладают достаточной энергией, их электронные облака перекрываются (см. рис. 17.).
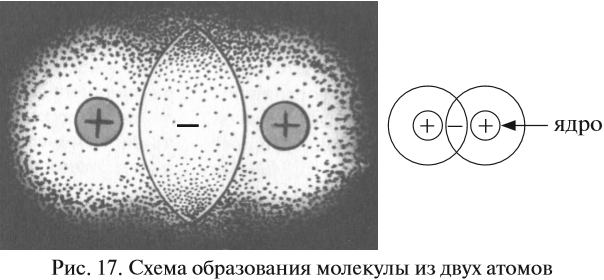
В этой области пространства возникает избыточный отрицательный заряд. А ядра атомов, как известно, имеют положительный заряд. Таким образом, ядра обоих атомов притягиваются к общему отрицательному заряду, который возник благодаря пересечению электронных облаков. Поэтому:
- во-первых, область перекрывания электронных облаков является, фактически, химической связью;
- во-вторых, чем больше область перекрывания электронных облаков, тем прочнее (при прочих равных условиях) данная связь.
В месте перекрывания электронных облаков образуются общие электронные пары. Рассмотрим, как возникает ковалентная связь в молекуле азота N2. Для этого рассмотрим строение атома азота:
Или: N … 2s 2 2р 3
Вопрос. Сколько электронов не хватает до завершения внешнего уровня?
Не хватает трёх электронов. Поэтому, обозначив каждый электрон внешнего уровня точкой, получим:
Вопрос. Почему три электрона обозначены одиночными точками?
Дело в том, что мы хотим показать образование общих пар электронов. А пара — это два электрона. Такая пара возникает, в частности, если каждый атом предоставит по одному электрону для образования каждой пары (1 + 1 = 2). Атому азота не хватает трёх электронов до завершения внешнего уровня. Значит, он должен «приготовить» три одиночных электрона для образования будущих пар.
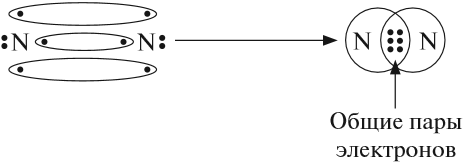
Получена электронная формула молекулы азота, при помощи которой показано, что:
- у каждого атома азота имеется теперь восемь электронов (шесть из них обведены кружочком плюс 2 электрона «собственной», неподелённой пары электронов);
- между атомами возникли 3 общие пары электронов (место пересечения кружков).
Каждая общая пара электронов соответствует одной ковалентной связи. Сколько ковалентных связей возникло? Три. Каждую связь (каждую общую пару электронов) покажем при помощи чёрточки (валентный штрих):
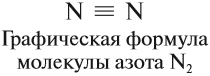
Эта графическая формула показывает, что атом азота в молекуле N2 — трёхвалентен, так как валентность — это способность атома образовывать определённое число ковалентных химических связей.
Может ли возникнуть такая связь между разными атомами? Может. Пусть атом азота взаимодействует с атомами водорода:
Строение атома водорода показывает, что этот атом имеет один электрон. Сколько таких атомов нужно взять, чтобы атом азота «получил» «желаемое» — три электрона? Очевидно, три атома водорода (рис. 19).
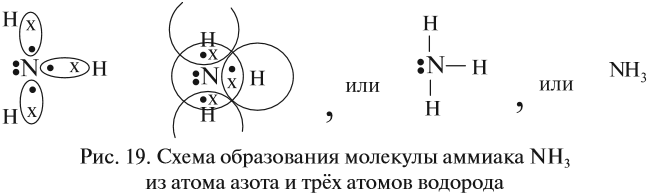
Крестиком (х) обозначены электроны атома водорода. Электронная формула молекулы аммиака показывает, что у атома азота стало восемь электронов, а у каждого атома водорода получилось по два электрона (а больше на первом энергетическом уровне и быть не может).
Графическая формула показывает, что атом азота имеет валентность три (три чёрточки, или три валентных штриха), а каждый атом водорода — валентность один (по одной чёрточке).
Значит, атом азота в этих молекулах (N2 и NН3) трёхвалентен. Поскольку пара электронов может образовываться из неспаренных электронов обоих атомов, то валентность атома часто соответствует числу неспаренных электронов. Например, в атоме азота 3 неспаренных электрона, поэтому валентность атома азота (в молекуле азота) равна III.
Казалось бы, атом азота не может иметь бОльшую валентность, так как в образовании химической связи задействованы все неспаренные электроны. Но у атома азота осталась «лишняя» неподелённая пара электронов, которая не участвовала в образовании ковалентных связей.
Если ковалентная связь образуется с участием атома, который имеет «собственную» пару электронов (2), то второй атом должен иметь свободную орбиталь (0):
В этом случае атом, имеющий пару электронов (донор), передаёт её на свободную орбиталь второго атома (акцептора). Рассмотрим механизм образования ковалентной связи по донорно-акцепторному механизму:
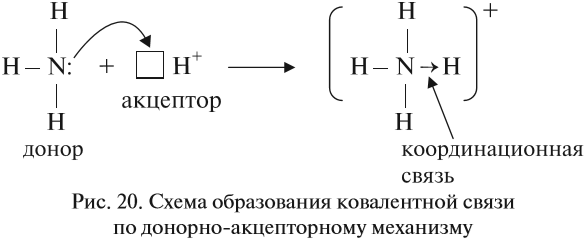
В полученном катионе аммония валентность атома азота равна IV.
Отметим, что валентность IV для атома азота — максимально возможная. Дело в том, что ковалентные связи образуются за счёт пересечения электронных облаков. А сколько таких электронных облаков в атоме азота? Четыре (одно s— и три р-облака). Поэтому и образуются 4 ковалентные связи. И не больше!
Ковалентная связь может быть полярной и неполярной. Полярность ковалентной связи определяется электроотрицательностью атомов её образующих. Электроотрицательность — способность атома смещать к себе общую пару электронов. Максимальную электроотрицательность (ЭО) имеет фтор 4,1. Далее значение ЭО уменьшается в ряду:
Хотя в состав обеих молекул N2 и NН3 входит один и тот же атом азота, химические связи между атомами отличаются друг от друга. В молекуле азота N2 химические связи образуют одинаковые атомы, поэтому общие пары электронов находятся посередине между атомами. Атомы сохраняют нейтральный характер. Такая химическая связь называется неполярной.
В молекуле аммиака NH3 химическую связь образуют разные атомы. Поэтому один из атомов (в данном случае — атом азота) сильнее притягивает общую пару электронов, так как имеет бОльшую ЭО. Общие пары электронов смещаются в сторону атома азота, и на нём возникает небольшой отрицательный заряд, а на атоме водорода — положительный (рис. 21).

Задание 4.2. Определите, какая химическая связь осуществляется между атомами в веществах:
Задание 4.3. Составьте электронные и графические формулы для тех веществ из упражнения 4.2, в которых вы определили наличие в них ковалентной связи. Для ионной связи составьте схемы перехода электронов.

Химическая связь и агрегатные состояния вещества. Кристаллические решётки
Тип химической связи влияет на свойства вещества, на его поведение в растворах. Так, чем больше, значительнее притяжение между частицами, тем труднее их оторвать друг от друга, тем труднее перевести твёрдое вещество в газообразное или жидкое состояния. Попробуйте определить, между какими частицами больше силы взаимодействия.
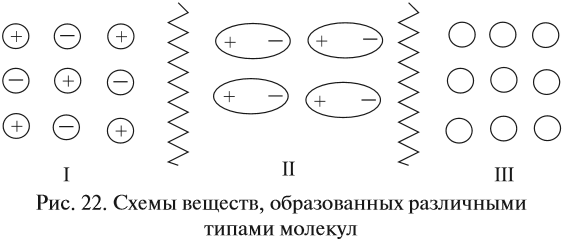
Если силы притяжения частиц значительны (притяжение разноимённо заряженных ионов), то частицы колеблются вблизи положения равновесия, а перемещаться не могут, что обусловливает сохранение формы и объёма. Максимальное взаимодействие между частицами осуществляется в случае I (ионная связь). Такие вещества находятся в твёрдом состоянии. Все вещества, построенные по ионному типу, — твёрдые. Среди веществ с ионной структурой ни жидких, не газообразных веществ нет! Для таких веществ характерно особое внутреннее строение — кристаллическая решётка:
От типа кристаллической решётки, которая формируется в твёрдом состоянии, зависят многие физические свойства вещества. В зависимости от вида частиц и характера связи между ними различают четыре типа кристаллических решёток: ионные, атомные, молекулярные и металлические.
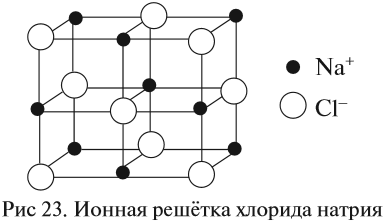
Кристаллические решётки, состоящие из ионов, называются ионными. Их образуют вещества с ионной связью. Примером может служить кристалл поваренной соли (хлорида натрия), в котором каждый ион натрия окружен шестью хлорид-ионами, а каждый хлорид-ион — шестью ионами натрия. Очень часто кристаллические решётки изображают, как показано на рис. 23, где указывается только взаимное расположение частиц, но не их размеры.
Такие вещества обладают твёрдостью, тугоплавкостью, их расплавы проводят электрический ток. Ионные соединения, как правило, легко растворяются в жидкостях, состоящих из полярных молекул, например в воде, хотя бывают и исключения.
Большинство веществ, построенных при помощи ковалентной связи, состоят из отдельных молекул (рис. 24).
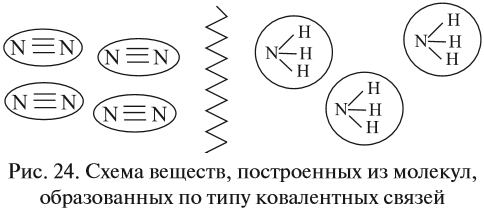
К таким веществам относятся спирты, сахара и большинство органических соединений. Поэтому, если такое вещество станет твёрдым, то эти молекулы образуют молекулярную кристаллическую решётку, т. е. в узлах её находятся молекулы.
Кристаллические решётки, состоящие из молекул (полярных и неполярных), называются молекулярными. Молекулы в таких решётках соединены между собой сравнительно слабыми межмолекулярными силами. Поэтому вещества с молекулярной решёткой имеют малую твёрдость и низкие температуры плавления, их растворы почти не проводят электрический ток. Число неорганических веществ с молекулярной решёткой невелико: вода, кислоты.
Кристаллические решётки, в узлах которых находятся отдельные атомы, называются атомными. Атомы в таких решётках соединены между собой прочными ковалентными связями. Примером может служить алмаз — одна из модификаций углерода. Алмаз состоит из атомов углерода, каждый из которых связан с четырьмя соседними атомами:
Весь кристалл алмаза следует рассматривать как гигантскую молекулу. Атомная кристаллическая решетка характерна для твёрдого бора, кремния, германия и соединений некоторых элементов с углеродом и кремнием, а также кварца — чистого оксида кремния. Такие вещества очень прочные и тугоплавкие. Они нерастворимы в воде и прочих растворителях.
Металлы образуют металлическую кристаллическую решётку. Свойства таких веществ рассмотрены в уроке 8 данного Самоучителя.
- молекулярное строение имеют вещества, построенные при помощи ковалентной связи, которые, связывая атомы, образуют молекулы;
- немолекулярное строение имеют вещества, построенные при помощи
- ковалентной связи, которые связывают отдельные атомы;
- металлической связи;
- ионной связи.
Задание ЕГЭ. К числу веществ молекулярного строения относятся: 1) древесный уголь; 2) кварц; 3) лёд; 4) известняк. Укажите тип кристаллической решётки в остальных веществах.
Наименьшее взаимодействие между незаряженными частицами (рис. 22, случай III), поэтому между молекулами вещества с неполярной ковалентной связью силы притяжения ничтожны. В этом случае молекулы свободно двигаются во всех направлениях, вещество находится в газообразном состоянии *.
Подробнее о газах рассказано в уроке 30.1 данного Самоучителя. Там же рассматриваются способы решения задач по теме «Газы».
Следовательно, вещества, состоящие из неполярных молекул или молекул с неполярными связями, являются газами или летучими жидкостями. Среди веществ такого типа только йод является твёрдым (при нормальных условиях) из-за высокой массы молекул, но он легко возгоняется, переходя из твёрдого состояния сразу в газообразное состояние.
У полярных молекул (диполей) межмолекулярные взаимодействия многократно сильнее, поэтому частицы могут перемещаться «на один шаг», соблюдая ближний порядок, что обусловливает текучесть жидкости. Впрочем, молекулы с полярными связями могут быть и газообразными, и твёрдыми.
Агрегатное состояние в этом случае (при прочих равных условиях) обычно зависит:
- от молярной массы вещества (чем она больше, тем выше температура плавления или кипения);
- от степени полярности связей (чем она больше, тем выше температура плавления или кипения);
- от наличия водородных связей.
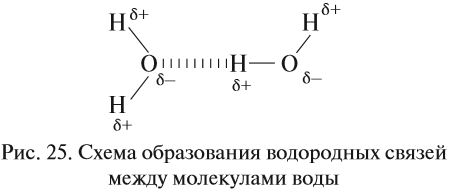
Водородные связи возникают за счёт сильно полярных связей, содержащих атом водорода: N–H, O–H, F–H.
В таких случаях на атомах возникают довольно значительные заряды (δ+) и (δ–) (но всё же меньше единицы!), и атомы (а, значит, и молекулы в целом) притягиваются друг к другу. Атом водорода имеет очень маленький радиус и может частично «внедряться» в электронное облако соединённого атома:
![]()
Поэтому все молекулы воды оказываются связанными бесчисленными водородными связями. В результате на разрыв всех этих связей требуется затратить очень много энергии (например, при испарении воды). Поэтому вода имеет аномально высокую температуру кипения:
![]()
Если рассуждать логически, опираясь на положение кислорода в периодической системе, экстраполировать параметры в системе Н2О — H2S — H2Se — H2Тe, то у воды как самого лёгкого водородного соединения шестой группы должна быть температура кипения около –80 °C! А на самом деле? А на самом деле она намного выше: +100 °C.
Выводы. Таким образом, агрегатное состояние веществ (температуры кипения и плавления) зависит:
Читайте также: