Базис кристаллической решетки металла характеризует
Обновлено: 04.10.2024
Все тела в зависимости от расположения атомов делятся на аморфные и кристаллические. В отличие от аморфных тел, атомы в которых расположены хаотично, металлы в твердом состоянии являются телами кристаллическими. Кристаллическое строение характеризуется закономерным расположением атомов.
Атомы металлов образуют кристаллическую решетку или ячейку. Каждый металл имеет определенный тип кристаллической решетки, чаще всего встречаются три типа решеток: кубическая объемноцентрированная – ОЦК (рис. 16, а), кубическая гранецентрированная – ГЦК (рис. 16, б) и гексагональная – ГПУ (рис. 16, в).
В кубической объемноцентрированной решетке атомы расположены в узлах ячейки и один атом в центре куба. Такие решетки имеют металлы: Feα, Сг, W, Mo, Tiβ, Nb, Та, Li n др.
В кубической гранецентрированной решетке атомы расположены в узлах ячейки и в центре каждой грани. Этот тип решетки имеют металлы: Feγ, Ni, Ag, Au, Pb, Сu, Соβ и др.
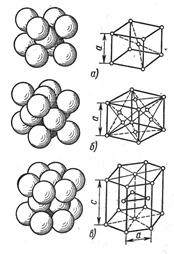
Рис. 16. Типы кристаллических решеток:
а – кубическая объемноцентрированная;
б – кубическая гранецентрированная;
В гексагональной решетке атомы расположены в узлах и центре шестигранных оснований призмы и три атома в средней плоскости призмы. Такую решетку имеют металлы: Zn, Cd, Be, Re, Coα, Tiα и др. Индексы α, β, γ обозначают, что у соответствующих металлов различные кристаллические решетки при различных температурах.
Типы кристаллических ячеек определяются при помощи рентгеноструктурного анализа.
Расстояния между центрами соседних атомов в кристаллической решетке называется периодом (а, b, с). Расстояния между атомами измеряются в ангстремах - , 1 = 1•10 -8 см.
Базис кристаллической решетки - это число атомов, принадлежащих одной элементарной кристаллической ячейке; для ОЦК базис равен 2, для ГЦК – 4, ГПУ – 6.
Плотность упаковки – это отношение объема занимаемого атомами к объему всей ячейки. Плотность упаковки для ОЦК составляет 68%, для ГЦК и ГПУ – 74%. Плотность упаковки характеризуется координационным числом, т. е. числом атомов, находящихся на равном и наименьшем расстоянии от данного атома. Координационное число для ОЦК – 8, для ГЦК и ГПУ – 12.
2.1. Полиморфизм металлов.
Полиморфизмом или аллотропией называют способность металла в твердом состоянии при изменении температуры перестраивать свою кристаллическую решетку. Полиморфные превращения сопровождаются выделением или поглощением теплоты, а также изменением свойств металла. Различные аллотропические состояния называют модификациями. Каждой модификации свойственно оставаться устойчивой лишь в пределах определенного для данного металла интервала температур. Аллотропические формы обозначаются греческими буквами α, β, γ и т. д. На кривых охлаждения и нагрева переход из одного состояния в другое характеризуется остановкой (для чистых металлов) или изменением характера кривой (для сплавов). При аллотропических превращениях кроме изменения свойств (теплопроводности, электропроводности, механических, магнитных и др.) наблюдают изменения объема металла и растворимости (например, углерода в железе). Аллотропические превращения свойственны многим металлам (железу, олову, титану и др.).
Железо известно в двух полиморфных модификациях — α и γ. На рис. 17 приведена кривая охлаждения, характеризующая его аллотропические превращения. Как видно, в интервале температур 911. 1392 °С железо имеет кубическую гранецентрированную решетку γ-железа (γFe), а в интервале от 0 до 911 °С и от 1392 до 1539 °С— объемноцентрированную решетку α-железа (αFe). Железо меняет свои магнитные свойства: выше 768 °С железо немагнитно, а ниже — магнитно.
Параметры решетки, базис, координационное число
В общем случае элементарная ячейка кристаллической решетки представляет собой наклонный параллелепипед (рис. 8).

Если поместить начало координат в одну из вершин ячейки, то расстояния а,b,c до ближайших вершин и углы a, b, g между координатными осями называют параметрами кристаллической решетки.
Параметры a, b, c выражаются в ангстремах 1А=10 -8 см (у металлов параметры решеток находятся в пределах 2-6 А.).
Базис решетки- это число атомов, приходящихся на однуэлементарную ячейку.
В объемно центрированной ячейке всего 9 атомов ( 8 по вершинам куба и 1 в центре). Однако каждый из угловых атомов принадлежит данной ячейке только на 1/8, т.к. он одновременно принадлежит 8 соприкасающимся ячейкам. Поэтому на ячейку приходится (8 х 1/8) + 1 = 2 атома. Базис ОЦК - 2 атома.
В гранецентрированной ячейке всего 14 атомов ( 8 по вершинам куба и 6 в центрах боковых граней ). Каждый угловой атом принадлежит ячейке на 1/8, каждый центральный атом – на 1/2 . Поэтому базис ГЦК ( 8 х 1/8) + ( 6 х 1/2 ) = 4 атома.
В гексагональной плотноупакованной ячейке 17 атомов. На ГПУ ячейку
от 12 угловых атомов приходится только по 1/6 , от 2 атомов, лежащих в центрах оснований, - по 1/2, и только 3 атома, расположенные внутри ячейки, полностью принадлежат ей. Таким образом, базис ГПУ решетки - (12 х 1/6) + (2 х 1/2) + 3 = 6 атомов.
Кристаллическая решетка характеризуется также координационным числом К, которое показывает число атомов, расположенных на ближайшем одинаковом расстоянии от любого атома. Для ОЦК решетки К = 8, для ГЦК и ГПУ решеток К = 12. Чем выше координационное число, тем большая плотность упаковки атомов в ячейке.
1.4 Плотность упаковки атомов в решетке
При моделировании кристаллической решетки в виде соприкасающихся шаровмежду ними образуются пустоты.
Так, например, три шара, прикрытые сверху одним шаром, образуют пустоту, называемую тетраэдрической (см. рис. 9,а), т. к. линии, соединяющие центры этих шаров, образуют тетраэдр. В тетраэдрическую пустоту можно вписать шар радиусом 0,22 R, где R - радиус шаров (атомов ячейки). Другой случай, когда три шара первого слоя прикрыты сверху не одним шаром, а треугольником из шаров, повернутым на 60 0 относительно первого слоя. Пустоту, образованную шестью шарами, называют октаэдрической, т.к. линии, соединяющие центры этих шаров, образуют октаэдр (см. рис. 9, в). В нее можно вписать шар радиусом 0,41 R. На каждый шар приходится 1 эктаэдрическая и 2 тетраэдрические пустоты.
Наличие пустот в элементарной ячейке определяет плотность упаковки атомов в решетке. Плотностью упаковки называется отношение объема, занятого атомами, к объему ячейки. Так, плотность упаковки ОЦК равна 0,68, а упаковок ГЦК и ГПУ - 0,74.

Индексация плоскостей и направлений
В кристаллической решетке
Индексация плоскостей
Для обозначения плоскостей и направлений в кристаллической решетке используют индексы, связанные с координатными осями [3].
Для кубической решетки систему координат строят следующим образом. Начало координат помещают в одной из вершин элементарной ячейки, ось «х» направляют в сторону наблюдателя, ось «у» направляют горизонтально вправо и ось «z» - вертикально вверх.
Положение плоскости определяется отрезками, отсекаемыми ею на координатных осях. За единицу измерения вдоль каждой оси принимают параметр ( период ) решетки в направлении данной оси. Чтобы не иметь дело с бесконечностями, а также дробными числами, используют величины, обратные отрезкам, отсекаемым плоскостью на координатных осях, причем отношение этих величин приводят к отношению трех наименьших целых чисел. Совокупность таких чисел ( h,k,l ), заключенная в круглые скобки, называется индексами Миллера.
Индексы плоскости отыскиваются следующим образом. Определяются отрезки А, В и С, которые этой плоскостью отсекаются на осях координат.
Записываются величины, обратные отсекаемым отрезкам, например: 1/А, 1/В,1/С. Полученные дроби приводят к общему знаменателю, например,
это будет число D. Целые числа h = D / А, k = D / В, l = D / С и являются индексами данной плоскости.
Определим, например, индексы плоскости, которая отсекает на осях координат отрезки А = , В = 2 и С = . Отношения : : =
= . Общий знаменатель D = 2.
плоскости являются величины h = , k = , l = .
Обозначение плоскости (416).
В гексагональной решетке начало координат помещают в центре основания ячейки и в плоскости основания проводят три координатные оси x, y, u,расположенные под 120 0 и ось zвертикально вверх. Такая 4-х индексная система Миллера - Бравэ содержит четвертый индекс i, который ставят на третьем месте ( h, k, i, l ). Дополнительный индекс i вычисляется через индексы h и k: i = - ( h + k ). В случае, если отрезок отсекается плоскостью на отрицательном направлении координатной оси, то над соответствующим индексом ставится черта.
Примеры индексации плоскостей в кубической решетке показаны на рис. 10, а
в гексагональной плотноупакованной решетке – на рис. 11.
Непараллельные плоскости, имеющие одинаковое атомное строение (количество атомов и их расположение), кристаллографически эквивалентны.
Всю совокупность эквивалентных плоскостей обозначают индексом какой-либо одной плоскости, заключенным в фигурные скобки. Например, плоскости 100, 010, 001, 100, 010, 001. Их обозначают индексом одной какой-либо плоскости и заключают в фигурные скобки как семейство плоскостей или . Другой пример, семейство . Это плоскости 111, 111,111, 111 и др. Если плоскость проходит через начало координат, то для удобства ее
индексации начало координат следует перенести в какую-либо соседнюю вершину элементарной ячейки.


Индексация направлений
Ориентация прямой определяется координатами двух ее точек. Если выбрать из семейства прямых ту, которая проходит через начало координат, или перенести прямую параллельно самой себе так, чтобы она прошла через
начало координат, то направление прямой определится координатами только второй ее точки.
Направления в кристаллической решетке обозначают координатами конца отрезка, проходящего через начало координат. Эти координаты называются индексами направлений. За единицу измерения по каждой кристаллографической оси выбирают период решетки. Полученные значения координат точки приводят к отношению трех наименьших целых чисел. Эти числа, заключенные в квадратные скобки, обозначают собой индексы направлений. Совокупность непараллельных кристаллографических направлений, эквивалентных по числу атомов, составляют семейство направлений. Его обозначают индексом одного из направлений и заключают в угловые скобки. Например, семейство шести ребер куба 100, 010, 001, 100, 010, 001 обозначают < 100 >.
Примеры обозначения направлений в кубической и гексагональной плотноупакованной ( ГПУ) решетке показаны на рис. 12 и 13.

Для определения направлений в ГПУ-решетке также используют 4-х индексовую систему Миллера - Бравэ. Для этого направление переносят параллельно самому себе в начало координат и из любой его точки опускают перпендикуляры на координатные оси. Например, направление +y имеет индексы [1210].
Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни.

Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ - конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой.
Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.
© cyberpedia.su 2017-2020 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!

Металлы – особая группа элементов в периодической таблице Менделеева. В отличие от неметаллов элементы этой группы являются исключительно восстановителями с положительной степенью окисления, а также обладают пластичностью, твёрдостью, упругостью, что обусловлено кристаллическим строением металлов.
Общее строение
Металлы – твёрдые вещества, имеющие кристаллическое строение. Исключение составляет ртуть – жидкий металл. Кристаллические решётки представляют собой упорядоченные определённым образом атомы металла. Каждый атом состоит из положительно заряженного ядра и нескольких отрицательно заряженных электронов. В атомах металлов недостаточно электронов, поэтому они являются ионами.
Единица кристаллической решётки – элементарная кристаллическая ячейка, в условных узлах и на гранях которой находятся положительно заряженные ионы. Их удерживают вместе металлические связи, возникающие за счёт беспорядочного движения отделившихся от атомов электронов (благодаря чему атомы превратились в ионы).
Отрицательно заряженные электроны держат на равном расстоянии положительно заряженные электроны, предавая кристаллической решётке правильную геометрическую форму.

Рис. 1. Схема металлической связи.
Свободное движение электронов обусловливает электро- и теплопроводность металлов.
Примеры материалов
Все металлы характеризуются кристаллическим строением. Они отличаются наличием малоподвижных ионов с положительным зарядом и движущимися между ними электронами. Данные структуры именуют металлическими связями.
Объемно-центрированная кубическая решетка свойственна для Fe при комнатной температуре, W, V, Cr, Mo и прочих металлов.

Гранецентрированная кубическая решетка встречается на Mg, Ti, Zn, Zr и прочих металлах.
Виды решёток
Элементарные кристаллические ячейки могут иметь различную конфигурацию. В связи с этим выделяют три типа кристаллических решёток:
- объемно-центрированная (ОЦК) кубическая – состоит из 9 ионов;
- гранецентрированная (ГЦК) кубическая – включает 14 ионов;
- гексагональная плотноупакованная (ГПУ) – состоит из 17 ионов.
ОЦК представляет собой куб, в узлах которого находится по атому. В центре куба, на пересечении диагоналей располагается девятый ион. Этот тип характерен для железа, молибдена, хрома, вольфрама, ванадия.
Элементарной кристаллической ячейкой типа ГЦК является куб с ионами в узлах и в середине каждой грани – на пересечении диагоналей. Такое строение имеют медь, серебро, алюминий, свинец, никель.
Третий тип имеет вид гексагональной призмы, в узлах которой находится по шесть ионов с каждой стороны. Посередине между шестью узлами располагается по одному иону. В середине призмы между шестиугольными гранями находится равносторонний треугольник, который составляют три иона.

Рис. 2. Типы решёток.
Металл может содержать большое количество дефектов атомного строения. Дефекты влияют на свойства металла.
Структура и геометрия
Кристаллические решетки представляют совокупность кристаллитов. В ближних зернах они взаимно расположены под некоторым углом. Атомы, представляющие собой микроскопические частицы вещества и наименьшие части химических элементов, в кристаллитах размещены в соответствии с ближним и дальним порядком. Первый подразумевает определенный порядок размещения и стабильности ближайших друг к другу микрочастиц, второй – самых отдаленных. Возможно покидание отдельными атомами мест расположения вследствие диффузии, однако это не приводит к нарушению упорядоченности строения.

Тип решетки определяют формой простейшего геометрического тела, образующего ее. Кубические решетки дифференцируют на четыре вида:
- кубическая с микрочастицами в углах;
- объемно-центрированный вариант имеет восемь атомов, расположенных по углам, и один в центре;
- гранецентрированная кубическая решетка отличается размещением атомов в центрах граней и вершинах;
- гексагональная плотноупакованная с нахождением микрочастиц в углах шестигранной призмы, в центре оснований и трех в центральной плоскости.
К основным параметрам решеток относят компактность, под которой понимают степень заполнения объема атомами. Ее определяют тремя прочими показателями:
- параметр решетки – значение межатомного расстояния в нм по ребру простейшей ячейки (характеризуется для кубических вариантов длиной ребра);
- координационное число, под которым понимают количество ближайших соседних микрочастиц;
- плотность упаковки, представленная отношением общего атомного объема решетки и ее общего объема.

Для измерения параметра решеток применяют рентгеноструктурный метод анализа. При подсчете количества атомов учитывают, что каждый из них принадлежит к нескольким ячейкам сразу. Для кубических решеток исключение представляет размещенная в центре куба микрочастица.
Для объемно-центрированного типа координационное число составляет 8 по числу ближайших атомов к центральному. Для гранецентрированного варианта микрочастица на кубической грани размещена на одинаковом расстоянии от четырех в углах, четырех на гранях, четырех ближайшей кристаллической ячейки. То есть, координационное число составляет 12.
Различные варианты кристаллических решеток характеризуются разной плотностью упаковки. Для простой кубической решетки координационное число равно 6, для ОЦК — 8, ГЦК и ГП (гексагональной плотноупакованной) — 12.
Для объемно-центрированного варианта объемы микрочастиц и межатомных промежутков соотносятся в пропорции 68/32%, для ГЦК значения соответствующих параметров равны 74 и 26% соответственно. Компактность решетки определяется особенностями металлической электронной структуры и характером атомной связи.
Ввиду упорядоченности решетки возможно выделение кристаллографических плоскостей и направлений.
Под направлениями понимают прямые, вдоль которых находятся атомы. То есть они представлены ребрами, диагоналями и гранями.
Плоскости подразделяют на диагональные и плоскости кубических граней.
Для обозначения данных категорий применяют трехзначные индексы. Для направлений их определяют путем нахождения ближайшего атома и использования его координат относительно точки O. Для плоскостей находят координаты точек их пересечения с осями координат и меняют на обратные.
Следует отметить, что в кристаллических телах наблюдается изменение механических свойств вдоль направлений. Данная особенность, называемая анизотропией, объясняется различной атомной плотностью. Так, для кубических решеток вдоль диагоналей и на диагональных плоскостях данный показатель больше, чем вдоль ребер и на проходящих сквозь грани плоскостях. При этом анизотропия наблюдается в пределах кристаллита либо монокристалла. Для поликристаллических тел она нехарактерна ввиду усреднения параметров по всем направлениям для большого числа произвольно взаимно ориентированных зерен. Ввиду этого металлы относят к псевдо- или квазиизотропным телам.
Кроме того, для некоторых металлов (Ti, Fe, Sn) характерна аллотропия, под которой понимают изменение кристаллического строения путем изменения типа простейшей ячейки. Также данное свойство называют полиморфизмом.
Так, у железа в температурном интервале 911-1392 °C кубическая решетка гранецентрированного типа, а при температурах за пределами приведенного диапазона – отдельно-центрированная (до плавления при 1539 °C). Для дифференциации аллотропических форм применяют греческие буквы.
Возможно наличие дефектов решетки. Их классифицируют на несколько типов.
- Точечные, по размеру близкие к атомам, представлены вакансиями (пустые узлы, межузельные микрочастицы), примесными атомами замещения (того же размера, что и исходные) и внедрения (маленькие микрочастицы в междоузлиях).
- Линейные (протяженные) представлены дислокациями (плоскостные смещения). Их классифицируют на наиболее распространенные краевые (экстраплоскость или полуплоскость) и винтовые (закручивание плоскостей).
- Поверхностные – искажения на границах зерен ввиду передвигающихся зерен дислокации.
- Объемные – поры и трещины.

Названные дефекты по-разному сказываются на прочности. Для точечных степень влияния на данный показатель определяется их характером и числом в конкретном объеме. Линейные дефекты ввиду большой подвижности значительно сказываются на прочности, упрощая сдвиги кристаллитов под влиянием напряжений. Воздействие линейных дефектов на прочность оценивают по их плотности (отношение их общей длины к объему материала). Ее предельное значение – 1013 см-2 (при большем происходит разрушение). На основе того, что мелкозернистые материалы более прочны в сравнении с крупнозернистыми при большей общей протяженности границ, поверхностные дефекты наоборот повышают прочность. Объемные, помимо непосредственного снижения прочности, значительно повышают напряжения от рабочих нагрузок, концентрируя их.
Характеристика решётки
Кристаллические решётки характеризуются компактностью или степенью наполненности. Компактность определяют показатели:
- параметр решётки – расстояние между атомами;
- число атомов;
- координационное число – количество соседних ячеек;
- плотность упаковки – отношение объёма, занимаемого атомами, к полному объёму решётки.
При подсчёте количества атомов следует помнить, что атомы в узлах и на гранях входят в состав соседних ячеек.

Рис. 3. Кристаллические ячейки составляют решётку.
Типы кристаллических решеток
В огромном ряду материалов, с незапамятных времен известных человеку и широко используемых им в своей жизни и деятельности, металлы всегда занимали особое место. Причина этого — в особых свойствах металлов, выгодно отличающих их от других материалов и делающих во многих случаях незаменимыми.
– один из классов конструкционных материалов, характеризующийся определенным набором свойств:
· «металлический блеск» (хорошая отражательная способность);
Данные свойства обусловлены особенностями строения металлов. Согласно теории металлического состояния, металл представляет собой вещество, состоящее из положительных ядер, вокруг которых по орбиталям вращаются электроны. На последнем уровне число электронов невелико и они слабо связаны с ядром. Эти электроны имеют возможность перемещаться по всему объему металла, т.е. принадлежать целой совокупности атомов. Таким образом, пластичность, теплопроводность и электропроводность обеспечиваются наличием «электронного газа».
Все металлы, затвердевающие в нормальных условиях, представляют собой кристаллические вещества, то есть укладка атомов в них характеризуется определенным порядком – периодичностью, как по различным направлениям, так и по различным плоскостям. Этот порядок определяется понятием кристаллическая решетка.
Элементарная ячейка
– элемент объема из минимального числа атомов, многократным переносом которого в пространстве можно построить весь кристалл.
Все металлы и металлические сплавы – тела кристаллические. Атомы (ионы) расположены в металлах закономерно, в геометрически правильном порядке и образуют пространственную кристаллическую решетку.
Решетка характеризуется наличием каркаса из малоподвижных заряженных ионов, в промежутках которого с огромной скоростью движутся свободные электроны. Если через атомы в кристаллических решетках провести плоскости, то атомы в них будут располагаться в геометрически правильном порядке, образуя кристаллографические плоскости. Наименьший объем металла, который характеризует атомно–кристаллическое строение всего объема, называется элементарной кристаллической решеткой.
Пространственные кристаллические решетки полностью определяют строение кристалла.
Различают простые и сложные кристаллические решетки. В простой решетке атомы (ионы) расположены только в вершинах, а в сложных – они могут находиться также внутри многогранника или на его гранях.
Металлы имеют сложные кристаллические решетки. Всего существует четырнадцать типов решеток, но основными являются три — это:
— Объемно-центрированная кубическая решетка (ОЦК);
— Гранецентрированная кубическая решетка (ГЦК);
— Гексагональная плотноупакованная решетка (ГПУ).
1) В элементарной ячейке ОЦК атомы находятся в вершинах куба и в центре на пересечении пространственных диагоналей. Всего 9 атомов (рис.1).
2) В гранецентрированной кубической решетке атомы расположены в вершинах куба и в центрах каждой грани куба. Всего 14 атомов (рис.2).
3) Гексагональная плотноупакованная решетка. Элементарная ячейка – шестигранная призма, в которой атомы находятся в вершинах и в центре оснований призмы, а также внутри призмы — 3 атома. ГПУ содержит 17 ионов (рис.3).
Кристаллические решетки характеризуют следующие основные параметры: период решетки, атомный радиус, координационное число, базис и коэффициент компактности решетки.
- Периодом решетки называется расстояние между центрами двух соседних частиц (атомов, ионов) в элементарной ячейке решетки (a,b,с). Периоды решетки выражаются в ангстремах – А (1А=10-8 см).
- Под атомным радиусом понимают половину межатомного расстояния между центрами ближайших атомов в кристаллической решетке элемента при нормальной температуре и атмосферном давлении. Однако атомный радиус не является неизменной величиной, а изменяется в зависимости от ряда факторов, важнейшим из которых являются координационное число и тип химической связи между атомами в кристалле.
- Координационное число Кпоказывает количество атомов, находящихся на наиболее близком и равном расстоянии от любого выбранного атома в решетке. Чет выше координационное число, тем плотнее пространственная кристаллическая решетка материала.
- Базисом решетки называется количество атомов, приходящихся на одну элементарную ячейку решетки.
- Коэффициент компактности η решетки определяется отношением объема, занимаемого атомами Va, ко всему объему решетки Vp, т.е. η = Va / Vp.
Рассмотрим эти параметры для основных типов кристаллических решеток.

ОЦК решетка
Период решетки – а = 0,286 — 0,607 нм.
Координационное число К
Каждый угловой атом входит в восемь соединительных ячеек, следовательно, одной ячейке принадлежит от угловых атомов только 1/8 атома; только внутренний атом целиком принадлежит данной ячейки. Таким образом, на одну ячейку объемно-центрированной кристаллической решетки приходится 8 * 1/8 + 1 = 2 атома.
Объемно-центрированную кубическую решетку имеют металлы: Li, Na, K, V, Cr, Feα, Rb, Nb, Mo, W и др.
ГЦК решетка
Период решетки – а.
Каждый угловой атом входит в восемь ячеек, а находящийся в центре грани – в две соседние ячейки; в центре атома нет. Следовательно, на одну ячейку приходится 8*1/8+6*1/2 = 4 атома.
Гранецентрированную кубическую решетку имеют металлы: AI, Ca, Feγ, Ni, Cu, Pb, Ag, Pt, Au, Pd и др.
ГПУ решетка
Период решетки а и с (а = 0,228 — 0,398 нм; с = 0,357 — 0,652 нм), причем с/а = 1,633 (если с/а > 1,633, то данная решетка будет гексагональной, но не плотноупакованная, характерная для Mg, Zn).
Базис решетки – 6 атомов.
На одну ячейку кристаллической решетки приходится 6 атомов: 2 атома, лежащие в центре шестиугольника, входят в две соседние ячейки (2*1/2) = 1атом, а 12 атомов, образующие вершины призмы, — в 6 соседних ячеек (12*16/) = 2 атома, 3 атома, лежащие внутри призмы, целиком принадлежат данной ячейке (3*1 = 3 атома).
В гексагональной системе кристаллизуются Be, Мg, Cd, Ti, Co, Zn и другие металлы.
Многие металлы при разных температурах имеют неодинаковые кристаллические решетки. Это явление называется полиформизмом или аллотропией (например Fe, имеет α и γ решетки).
1.2. Параметры кристаллической решетки
Кристаллическую решетку характеризуют следующие основные параметры:
· базис и коэффициент компактности решетки.
Периодом решетки называется расстояние между центрами двух соседних частиц (атомов, ионов) в элементарной ячейке решетки (см. рис. 1.2, а, b). Периоды решетки выражаются в ангстремах (1 = 10 -8 см). Параметры решетки металлов находятся в пределах 0,2 – 0,7 нм и определяются методом рентгеноструктурного анализа с точностью до третьего, а при необходимости и до четвертого или даже пятого знака после запятой.
Под атомным радиусом понимают половину межатомного расстояния между центрами ближайших атомов в кристаллической решетке элемента при нормальной температуре и атмосферном давлении. Однако атомный радиус не является постоянной величиной, а изменяется в зависимости от ряда факторов, важнейшими из которых являются координационное число и тип химической связи между атомами в кристалле.
Энергия кристаллической решетки определяется как энергия, выделяющаяся при образовании кристалла из ионов, атомов или других частиц, образующих кристалл, когда исходное состояние этих частиц газообразное. От величины энергии решетки зависят такие свойства вещества, как температура плавления, модуль упругости, прочность, твердость и др. Увеличение валентности атомов приводит к увеличению энергии решетки.
Координационное число (К), показывает количество атомов, находящихся на наиболее близком и равном расстоянии от любого выбранного атома в решетке.
Базисом решетки называется количество атомов, приходящихся на одну элементарную ячейку решетки.
Коэффициент компактности (?) решетки определяется отношением объема, занимаемого атомами (Va), ко всему объему решетки (Vp), т.е.
? = Va/Vp. Представленные на рис. 1.2 (сверху) типы кристаллических решеток схематично отражают взаимное расположение атомов (ионов) в кристалле. Если условно считать атомы шарами одинакового диаметра, то снизу на рис. 1.2 дано более точное представление о действительном расположении атомов в кристаллах ОЦК, ГЦК и ГПУ
Пример: Гранецентрированная кубическая решетка (рис. 1.2, б) имеет восемь атомов по вершинам и по одному атому в центре граней куба. Определим для нее такие понятия, как «координационное число» и «базис» решетки.
Оперируя с элементарной ячейкой, нельзя забывать, что в реальном кристалле такая ячейка окружена со всех сторон другими ячейками и поэтому не все атомы, отно
сящиеся к рассматриваемой ячейке, принадлежат только этой ячейке. Для того чтобы это понять, рекомендуется изобразить на клетчатой бумаге элементарную ячейку и пристроить к ней со всех сторон другие ячейки. Важность такого построения выявляется при решении конкретных задач.
Из рис. 1.2, б видно, что минимальное расстояние между атомами в решетке ГЦК равно половине диагонали грани. Пристроив около какой-либо вершины куба другие примыкающие к ней ячейки, подсчитаем координационное число: к любой вершине куба реально пристроены 8 элементарных ячеек; в каждой ячейке на расстоянии η диагонали грани находится три атома; каждая грань обслуживает две ячейки, поэтому
Понятие кристаллической решётки
Для описания упорядоченного расположения частиц вещества в кристаллах используют некую геометрическую модель, называемую кристаллической решёткой. Кристаллическая решётка представляет собой воображаемую пространственную координатную сетку, узлы которой показывают расположение в пространстве центров тяжести атомов, молекул или ионов кристалла. Поскольку частицы в кристаллах располагаются закономерно, нет необходимости изображать всю пространственную сетку, достаточно ограничиться изображением системы координат и минимальной группы повторяющихся в ней узлов. Такую минимальную группу узлов, периодически повторяющихся в пространстве, называют элементарной ячейкой. В общем случае элементарная ячейка имеет вид параллелепипеда, частным случаем которого является куб (рис. 1).
Рис. 1. Простая кубическая элементарная ячейка.
Рёбра элементарного параллелепипеда (a, b, c) и его углы (α, β, γ) называют параметрами элементарной ячейки. Соотношения между этими параметрами определяют форму элементарной ячейки и соответствующую систему симметрии. Всего существует 7 систем симметрии:
1) триклинная a ≠ b ≠ c, α ≠ β ≠ γ ≠ 90°;
2) моноклинная a ≠ b ≠ c, α = β = 90°, γ ≠ 90°;
3) ромбическая a ≠ b ≠ c, α = β = γ = 90°;
4) ромбоэдрическая a = b = c, α = β = γ ≠ 90°;
5) гексагональная a = b ≠ c, α = β = 90°, γ = 120°;
6) тетрагональная a = b ≠ c, α = β = γ = 90°;
7) кубическая a = b = c, α = β = γ = 90°.
Если элементарную ячейку перемещать (транслировать) вдоль координатных осей OX, OY и OZ с шагом, соответственно a, b и c, то можно воспроизвести всю пространственную координатную сетку, т.е. кристаллическую решётку. Параметры элементарной ячейки a, b и c называют также периодами кристаллической решётки. По своему физическому смыслу это расстояния между центрами тяжести соседних частиц, в частности атомов, сближенных в кристаллах до соприкосновения. По порядку величины a, b и c составляют 0,1 нанометра (1нм это 10 -9 м), или 1 Ангстрем (1Å = 10 -10 м).
Элементарная ячейка, изображённая на рис. 1, относится к числу простых (примитивных) ячеек. Но возможны и более сложные ячейки, содержащие дополнительные узлы, расположенные либо в центре всех граней элементарного параллелепипеда (гранецентрированная ячейка), либо в центре верхней и нижней грани (базоцентрированная ячейка), либо в центре объёма (объёмоцентрированная ячейка). Всего насчитывается 14 типов элементарных ячеек (трансляционных решёток Бравэ), которые неравномерно распределены по 7 системам симметрии. В частности, триклинной системе симметрии принадлежит только одна примитивная ячейка, а кубическая система симметрии содержит примитивную, объёмоцентрированную и гранецентрированную ячейки.
Структура кристаллов
Следует различать понятия кристаллическая решётка и структура кристалла. Структура кристалла – это физическая реальность, конкретное расположение в пространстве различных атомов. Кристаллическая решётка – это геометрический образ структуры, отражающий лишь симметрию расположения частиц кристалла. Для более полного описания структуры кристаллов используют понятие базис. Базисом кристаллической структуры называют совокупность определённым образом расположенных в пространстве различных атомов, приходящихся на одну элементарную ячейку. Т.е. перечисляются все полностью принадлежащие одной элементарной ячейке атомы, вместе с их координатами в этой ячейке. Таким образом, если элементарная ячейка определяет размер и форму «элементарных кирпичиков», из которых построен кристалл, то базис определяет «материал» этих кирпичиков. Другими словами, базис это тот «элементарный блок вещества», периодическим повторением которого в пространстве воспроизводится весь рассматриваемый кристалл.
Базис сложных органических кристаллов, состоящих из больших молекул, может включать в себя несколько тысяч различных атомов. В простейшем случае, когда в узлах кристаллической решётки расположены однотипные атомы или ионы, базис состоит только из одной или нескольких таких частиц. Подобная ситуация характерна, в частности, для металлов. Если структуру металла описывает кристаллическая решётка с примитивной ячейкой (рис. 1), то базис такой структуры состоит только из одного атома данного металла. (Действительно, в данном случае, каждый атом металла, расположенный в узле кристаллической решётки, находится на пересечении 8 аналогичных ячеек и принадлежит рассматриваемой ячейке только на ⅛ часть. Но поскольку таких узлов в ячейке 8, то полностью принадлежит ей ровно один атом, составляющий по определению базис. Перемещая этот атом–базис вдоль координатных осей с шагом, соответствующим периодам кристаллической решётки, воспроизводится вся пространственная структура металла). В случае объёмоцентрированной ячейки базис составляют 2 атома металла (атом в центре ячейки полностью принадлежит данной ячейке, плюс один атом дают узлы, расположенные в вершинах ячейки), а гранецентрированной – 4 (каждый из 6 атомов, расположенных в центрах граней, принадлежит рассматриваемой ячейке только на ½ часть).
Система симметрии, величина периодов решётки и базис полностью определяют кристаллическую структуру конкретного материала. Если известны эти параметры, то известной считается и структура кристалла. Однако для более полного описания структуры иногда используют такие дополнительные параметры как координационное число и коэффициент компактности. Координационным числом называют число ближайших равноудалённых соседей любого атома. Если в качестве примера рассматривать структуру, изображенную на рис. 1, то для неё координационное число равно шести. Коэффициент компактности (степень компактности) представляет собой отношение объёма, занятого атомами, ко всему объёму элементарной ячейки. В случае чистых металлов коэффициент компактности может достигать величины 0,74. Это означает, что 74 % объёма металла занято атомами, а остальную его часть составляют пустоты (поры).
Читайте также:
