Более активный металл вытесняет
Обновлено: 18.05.2024
Химические свойства металлов определяются их активностью. Простые вещества – металлы в химических реакциях всегда являются восстановителями . Положение металла в ряду активности характеризует то, насколько активно данный металл способен вступать в химические реакции (т. е. то, насколько сильно у него проявляются восстановительные свойства).
Среди металлов традиционно выделяют несколько групп.
благородные металлы (серебро, золото, платина, иридий);
щелочные металлы – I(A) группа ;
щелочноземельные металлы – II(A) группа , кроме Be, Mg.
Металлы встпают в реакции с простыми веществами – неметаллами (кислород, галогены, сера, азот, фосфор и др.) и сложными веществами (вода, кислоты, растворы солей)
Взаимодействие с простыми веществами-неметаллами
1. Металлы взаимодействуют с кислородом, образуя оксиды:
4Li + O 2 = обыч. усл . = 2Li 2 O
2Mg + O 2 = t, °C = 2MgO
Серебро, золото и платина с кислородом не реагируют
2. Металлы взаимодействуют с галогенами (фтором, хлором, бромом и йодом), образуя галогениды – Ме +n Г -1 n
2Na + Cl 2 = 2NaCl
3. Металлы взаимодействуют с серой, образуя сульфиды.
4. Активные металлы при нагревании реагируют с азотом, фосфором и некоторыми другими неметаллами.
3Na + P = t, °C = Na 3 P
Взаимодействие со сложными веществами
I. Взаимодействие воды с металлами
1). Взаимодействие с самыми активными металлами, находящимися в периодической системе в I(А) и II(А) группах (щелочные и щелочноземельные металлы) и алюминий . В результате образуются основание и газ водород .
Me + H 2 O = Me(OH) n + H 2 (р. замещения)
Внимание! Алюминий и магний ведут себя также:
Магний (в горячей воде):
2) Взаимодействие воды с менее активными металлами, которые расположены в ряду активности от алюминия до водорода.
Металлы средней активности, стоящие в ряду активности до (Н 2 ) – Be, Fe, Pb, Cr, Ni, Mn, Zn – реагируют с образованием оксида металла и водорода
Me + Н 2 О = Ме х О у + Н 2 (р. замещения)
Бериллий с водой образует амфотерный оксид:
Be + H 2 O = t°C = BeO + H 2
Раскалённое железо реагирует с водяным паром, образуя смешанный оксид — железную окалину Fe 3 O 4 и водород:
3) Металлы, стоящие в ряду активности после водорода, не реагируют с водой.
Cu + H 2 O ≠ нет реакции
II. Взаимодействие растворов кислот с металлами
Металлы, стоящие в ряду активности металлов левее водорода, взаимодействуют с растворами кислот ( раствор азотной кислоты – исключение ), образуя соль и водород.
Кислота (раствор) + Me до (Н2) = Соль + H 2 ↑
III. Взаимодействие кислот-окислителей с металлами
Металлы особо реагируют с серной концентрированной и азотной кислотами:
H 2 SO 4 (конц.) + Me = Сульфат + H 2 O + Х
HNO 3 + Me = Нитрат + H 2 O + Х
4Zn + 10HNO 3 (раствор горячий) = t˚C = 4Zn(NO 3 ) 2 + N 2 O + 5H 2 O
4Zn + 10HNO 3 (оч. разб. горячий) = t˚C = 4Zn(NO 3 ) 2 + NH 4 NO 3 + 3H 2 O
IV. С растворами солей менее активных металлов
Ме + Соль = Новый металл + Новая соль
Активность металла в реакциях с кислотами, водными растворами солей и др. можно определить, используя электрохимический ряд, предложенный в 1865 г русским учёным Н. Н. Бекетовым: от калия к золоту восстановительная способность (способность отдавать электроны) уменьшается, все металлы, стоящие в ряду левее водорода, могут вытеснять его из растворов кислот; медь, серебро, ртуть, платина, золото, расположенные правее, не вытесняют водород.
Химическая активность металлов
Электрохимический ряд активности металлов (ряд напряжений, ряд стандартных электродных потенциалов) — последовательность, в которой металлы расположены в порядке увеличения их стандартных электрохимических потенциалов φ 0 , отвечающих полуреакции восстановления катиона металла Me n+ : Me n+ + nē → Me
Ряд напряжений характеризует сравнительную активность металлов в окислительно-восстановительных реакциях в водных растворах.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Электрохимический ряд активности металлов показывает, какие из металлов более активные, какие менее. Расположение элементов в горизонтальном ряду слева направо показывает направление снижения восстановительной способности и возрастание окислительной.
Реакции металлов с кислородом и водой
Что вы знаете о ржавлении железа? Расскажите о разрушении металлов?
Как вы думаете, как можно защитить металлы от разрушения? Где применяются металлы? Приведите примеры из жизни.
Металлы мы часто применяем в повседневной жизни. Это алюминий, медь, железо, золото, серебро и т. д. Алюминий и медь применяются для изготовления проводов. Алюминиевой фольгой упаковывают лекарства. В домашнем обиходе вы часто встречаете алюминиевую посуду и упаковки для напитков. Но больше всего применяется железо для изготовления различных металлоконструкций, трубопроводов, деталей машин и т. д. Этот металл от
воды и кислорода воздуха приходит в негодность, изменяет цвет и тускнеет.
Железо покрывается ржавчиной красно-бурого цвета. Железо + вода + воздух → ржавчина. Такой химический процесс называется коррозией (от лат. corrodere – разъедать).
Самопроизвольное разрушение металлов в результате их взаимодействия с веществами окружающей среды называется коррозией.
Поверхность алюминия покрывается оксидной пленкой, которая препятствует коррозии:

Химические активные металлы легко окисляются кислородом воздуха (Na, Mg, Ca). Железо и медь окисляются только при нагревании:
А золото и некоторые благородные металлы вообще не окисляются кислородом.
Рассмотрите рисунок 15 и сами сделайте выводы.
Ежегодно четвертая часть всего производимого металла из-за коррозии приходит в негодность (рис. 16).

Знаменитую Эйфелеву башню в Париже красили уже 18 раз, в результате чего ее масса увеличилась на 70 т.
Коррозия вызывает серьезные экологические катастрофы. Из разрушенных трубопроводов может быть утечка газа, нефти, опасных химических продуктов.
Это приводит к загрязнению окружающей среды, что отрицательно влияет на здоровье и жизнь людей.
Металлы защищают от коррозии нанесением покрытий на поверхность изделия: окраска металла лаками, красками, эмалями. Но это покрытие недолговечно. Предохраняют металл покрытием другого металла, менее подверженного коррозии. Это – золото, серебро, хром, никель, олово, цинк и др. В повседневной жизни часто применяют оцинкованные ведра, никелированные кровати. Для консервных банок применяют железо, покрытое оловом. Такое железо называют белой жестью. Белую жесть получают в г. Темиртау Карагандинской области на металлургическом заводе. Можно уменьшить коррозию железа, добавляя другие металлы: никель, хром, молибден. Таким образом, получают сплав, который называется нержавеющей сталью. Из этой стали изготавливают столовые приборы, трубы и другие изделия.
Олово - достаточно редкий, но очень полезный металл. Известно, что его начали добывать раньше, чем железо.
Олово - это мягкий белый металл, который можно сплавлять с медью, чтобы получить бронзу. Олово - один из первых освоенных человеком металлов. Оно не подвержено коррозии, поэтому из него делают тару для упаковки. Слой олова, нанесенный на другие металлы, делает их поверхность гладкой и блестящей. Банки для хранения консервов и напитков также делают из тонкого стального листа, покрытого оловом.

Взаимодействие воды с некоторыми металлами (рис. 17).
1. Взаимодействие воды с активными металлами в обычных условиях идет очень интенсивно.
При этом протекают реакции замещения

При проведении таких опытов необходимо соблюдать меры предосторожности.
2. При взаимодействии металлов средней активности с водой вместо щелочи выделяется оксид металла:
3. Малоактивные металлы (Cu) с водой не реагируют.
Коррозия, ржавчина, защита от коррозии, белая жесть, алюминиевая фольга, сплав
Свинец - тяжелый голубовато-серый металл, который не ржавеет. Он используется в автомобильных аккумуляторах. Свинцовые экраны защищают людей от опасной радиации. Но свинец токсичен и ядовит для человека.
Демонстрация №2
Взаимодействие активных металлов с холодной и горячей водой
Демонстрацию выполняет учитель, учащиеся наблюдают, делают выводы.
Цель: узнать, как реагируют активные металлы с холодной и горячей водой.

Обрежьте кусочек натрия скальпелем, высушите фильтровальной бумагой. Высушенный кусочек натрия следует бросить в кристаллизатор с холодной, а затем горячей водой. Наблюдать за ходом реакции через стекло вытяжного шкафа. Такую же реакцию проделать и с металлическим кальцием. Испытать полученные растворы двумя индикаторами.
Взаимодействие металлов с кислотами. ряд активности металлов
Что такое кислоты? Какие кислые вещества вы встречали в природе?
В соответствии с определением кислоты должны вступать в реакции с металлами. Все ли металлы взаимодействуют с кислотами? Это можно проверить на опыте.
В четыре пронумерованные пробирки нальем одинаковое количество раствора соляной кислоты и добавим: в первую пробирку – Mg; во вторую – Zn; в третью – Sn; в четвертую – Cu.
Как видим, не все металлы могут взаимодействовать с кислотами и скорости их взаимодействия различны (рис. 18).
На основании интенсивности взаимодействия металлов с кислотами русским ученым Н.Н. Бекетовым был составлен ряд активности металлов:
Li K Ca Na Mg Al Zn Fe Ni Sn Pb (H2) Cu Hg Ag Au
При использовании ряда химической активности нужно помнить
следующие правила:
2) активность металлов в этом ряду снижается слева направо 3) только металлы, стоящие в ряду активности до водорода, вытесняют водород из растворов кислот
активный металл + кислота —> соль + водород
Протекает реакция замещения.
Металлы, стоящие в ряду активности после водорода, не реагируют с разбавленными растворами кислот (табл. 6).


Лабораторный опыт №3
Взаимодействие металлов с растворами кислот
Цель: исследовать реакции различных металлов с растворами кислот и
сделать вывод о существовании химически инертных металлов.

Налейте в четыре пробирки раствор соляной кислоты. В одну из пробирок насыпьте порошка магния, в другую – поместите гранулы цинка, в третью – опилки железа, в четвертую – стружки меди.
Может ли железо не подвергаться коррозии? Да, если оно очень чистое. Например, в Дели (Индия) находится Кутубская колонна высотой 7 м, массой 6,5 т. Она установлена в IX в. до н. э., в ее составе 99,72% Fe. До сих пор эта колонна не подверглась коррозии.
Взаимодействие металлов с растворами солей
Какие соли вы встречали в повседневной жизни?
Химически активные металлы вытесняют менее активные металлы из растворов солей, при этом протекает реакция замещения. Например, из раствора сульфата меди (ІІ) железо вытесняет медь (рис. 19):

Схема реакций замещения выглядит следующим образом:
соль 4- активный металл = новая соль + новый металл (менее активный)
Реакции такого типа протекают при следующих условиях:
1) взаимодействующие соли должны быть растворимыми в воде;
2) более активный металл вытесняет из соли менее активный металл.
Демонстрация №3
Вытеснение металлов из растворов солей
Цель: понимать, что более активный металл вытесняет менее активный
металл из растворов его солей.


В пробирку поместите гранулы цинка и налейте раствор сульфата меди.
В другую пробирку поместите небольшие кусочки железа и налейте раствор сульфата меди. Что наблюдаете? Напишите уравнение реакции. Сделайте вывод.
Практическая работа № 1
Сравнение активности металлов
Цель: Разработать ряд активности металлов. Обобщить результаты и сделать выводы.

Ход работы
В пять пробирок налейте растворы солей по 5 мл, опустите в каждую пробирку стружки меди. Затем такие опыты повторите с другими металлами. Наблюдайте за интенсивностью хода реакций. Заполните таблицу: где идет реакция следует поставить знак “+”, если не идет реакция – знак “–”. По сравнительной интенсивности, т. е. по числу протекающих реакций, составьте ряд активности металлов.

- 1. Атомы металлов в реакциях только отдают электроны, образуя положительно заряженные ионы.
- 2. Самопроизвольное разрушение металлов в результате их взаимодействия с веществами окружающей среды называется коррозией.
- 3. Сравнительную активность металлов можно определить с помощью ряда активности, составленного Н. Н. Бекетовым.
- 4. Металлы IA, НА группы очень легко вступают во взаимодействие с кислородом и водой. Многие металлы образуют оксидную пленку, которая препятствует дальнейшему окислению. Благородные металлы вообще не реагируют с кислородом и водой.
Услуги по химии:
Лекции по химии:
Лекции по неорганической химии:
Лекции по органической химии:
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
Ряд активности металлов

Химия
Что же из себя представляет ряд активности металлов давайте разбираться. Металлы — группа химических элементов, обладающих сходными свойствами. Среди них — электропроводность, пластичность, температурная зависимость сопротивления. По виду металлы можно отличить по характерному блеску, который так и назвали — металлический. Но химические свойства элементов отличаются в зависимости от строения их молекул и кристаллической решетки. Особенно ярко отличия проявляются по отношению взаимодействия с кислотами и щелочами. Всего на данный момент насчитывается 96 металлов. Общие свойства металлов показаны в таблице:
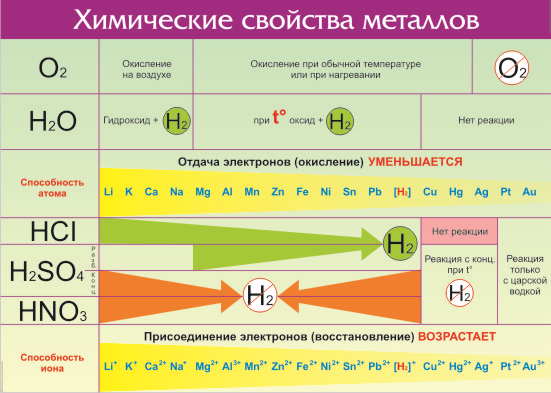
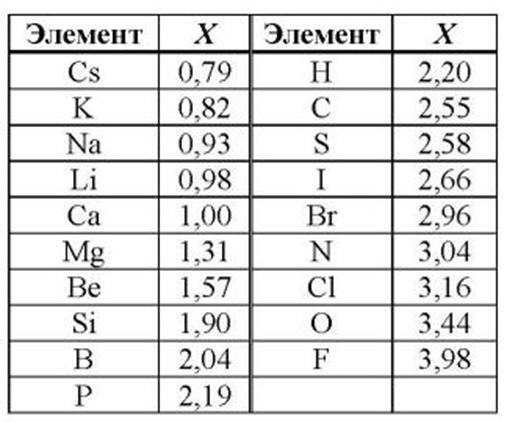
Все металлы в той или иной степени являются восстановителями, то есть, отдают электроны при течении окислительно-восстановительных реакций. Таблица электроотрицательности металлов показывает, какой металл является наиболее активным восстановителем. Если цифра напротив элемента больше 2, то это окислитель с характерными свойствами и выходит из ряда металлов, проявляя типичные свойства неметалла.
Восстановительная способность — свойство отдавать электроны в химических реакциях с водными растворами солей и щелочей.
Окислительная способность — свойство присоединять электроны в реакциях с теми же веществами.

Металлы в правой стороне более слабые восстановители, они вытесняются при реакциях с солевыми растворами металлами, расположенными левее. Пример реакции — Zn + Cu 2+ → Zn 2+ + Cu, которая протекает только в одном направлении. Цинк вытесняет медь, реагируя с водным раствором любой соли меди. Цинковая пластинка, при этом, растворяется, а медная восстанавливается.
Такую последовательность элементов еще называют ряд напряженности металлов, или ряд Бекетова. На всех вариантах записи ряда можно заметить, что последовательность металлов разделена знаком водорода (гидрогена), который металлом никак не является. Это своеобразный маркер, показывающий, что стоящие левее металлы вытесняют водород из водных растворов кислот, не обладающих окислительными свойствами. Некоторые металлы, например, литий, кальций, барий и остальные, стоящи до алюминия, вытесняют водород и при реакции с водой.
2Al +3H2SO4 = Al2(SO4)3 + 3H2↑
Fe + 2HCl = FeCl2 + H2↑
Стоящие правее знака водорода металлы с кислотами-неокислителями не взаимодействуют при нормальных условиях.
Шкала активности металлов широко используется для практических целей, например, в гальванике. Если электроды сделаны из разных металлов, то разрушаться будет тот, который стоит левее. Чем больше промежуток между металлами в ряду, тем активнее проходит процесс коррозии.
Например, метод оцинковки позволяет защитить железо именно потому, что цинк находится левее железа в ряду активности. Пока он не разрушится, то ржавчина на железе не появится. При электролизе, расположенные за водородом металлы осаживаются на катоде, а самые активные, занимающее места до алюминия, выделить из солевых растворов в не получится при нормальных температуре и давлении.
Малоактивные металлы, так называемые переходные элементы с электроотрицательностью в пределах 1,5 – 2. Это:
- Ртуть;
- Олово;
- Серебро;
- Никель;
- Рений;
- Медь;
- Марганец и еще несколько элементов.
К металлам средней активности относятся элементы с числом электроотрицательности от 1 до 1,5. В эту группу входят такие известные элементы, как магний, плутоний, неодим, кальций. Остальные элементы обладают высокой химической активностью. Лидирует в этом списке Франций, который практически не встречается в чистом виде. Из более известных можно назвать калий и натрий, которые приходится хранить в керосине, чтобы они не взаимодействовали с водой и воздухом. Если извлечь их из керосина, то металлы практически мгновенно сгорают.
Реакции кальция и натрия с водой при комнатной температуре выглядят так:
2Na + 2H2O = 2NaOH + H2↑
Сa + 2H2O = Сa(OH)2 + H2↑Стоящие в ряду электронапряжения металлов правее элементы тоже взаимодействуют с водой, но реакция протекает при более высокой температуре с образованием оксида и водорода.
3Fe + 4H2O = Fe3O4 + 4H2↑
Если вступает в реакцию металл и неметалл, то электрический ряд напряжений металлов тоже дает возможность заранее узнать, в каком направлении будет протекать реакция. Скорость реакции зависит как от восстановительной активности металла, так и от окислительных свойств неметалла. Стоящие до водорода металлы реагируют с кислородом уже при комнатной температуре, некоторые — достаточно бурно, например, литий и кальций.
4Li + O2 = 2Li2O
2Ca + O2 = 2CaO.
При таком взаимодействии образуются оксиды. Менее активные металлы, например железо, реагируют с кислородом спокойнее, а некоторые, например, золото и серебро, платина не окисляются вовсе, благодаря чему получили определение благородных.
С хлором реагируют практически все активные металлы с выделением теплоты.
2Fe + 3Cl2 = 2FeCl3
Также выделяется теплота при реакции активных металлов с серой, но начинается она при нагревании. После начала реакции нагрев не нужен — образовавшегося тепла достаточно для поддержания реакции.
2Al + 3S = Al2S3
Внимательно изучив ряд металлов, несложно определить тип реакции при контакте с другими элементами в зависимости от места в последовательности. Также легко назвать основные характеристики металла, как химического элемента, и возможность его использования на практике.
Электрохимический ряд напряжений металлов (ряд Бекетова)
Первоначально Бекетов предполагал, что способность одних металлов вытеснять из растворов солей другие металлы связана с их плотностью: более лёгкие металлы способны вытеснять металлы более тяжелые. Но опыты говорили о ином. Непонятно было и то, как связан “вытеснительный ряд” с рядом напряжений Алессандро Вольта. Со временем накапливалось всё больше экспериментальных данных того, что некоторые правила вытеснения нарушаются при определенных условиях. Бекетов обнаружил, что водород под давлением 10 атмосфер вытесняет серебро из раствора нитрата серебра. Английский химик Уильям Одлинг (1829-1921) описал множество случаев подобных аномалий. Например, медь вытесняет олово из концентрированного подкисленного раствора хлорида олова (II) и свинец – из кислого раствора хлорида свинца (II). Медь, олово и свинец находятся в ряду правее кадмия, однако могут вытеснять его из кипящего слабо подкисленного раствора хлорид кадмия.
Теоретическую основу ряда активности (и ряда напряжений) заложил немецкий физикохимик Вальтер Нернст (1864-1941). Вместо качественной характеристики – “склонности” металла и его иона к тем или иным реакциям – появилась точная количественная величина. Такой величиной стал стандартный электродный потенциал металла, а соответствующий ряд, выстроенный в порядке изменения потенциалов, называется рядом стандартных электродных потенциалов.
Электрохимический ряд напряжений металлов (ряд Бекетова) это последовательность расположения металлов и их ионов в порядке возрастания стандартных электродных потенциалов в растворах электролитов. Электродом сравнения обычно служит стандартный водородный электрод, электродный потенциал которого условно принимается равным нулю.
| Восстановленная форма | Число отданных електронов | Окисленная форма | Стандартный электродный потенциал, В |
| Li | 1e | Li + | -3,05 |
| K | 1e | K + | -2,925 |
| Rb | 1e | Rb + | -2,925 |
| Cs | 1e | Cs + | -2,923 |
| Ba | 2e | Ba 2+ | -2,91 |
| Sr | 2e | Sr 2+ | -2,89 |
| Ca | 2e | Ca 2+ | -2,87 |
| Na | 1e | Na + | -2,71 |
| Mg | 2e | Mg 2+ | -2,36 |
| Al | 3e | Al 3+ | -1,66 |
| Mn | 2e | Mn 2+ | -1,18 |
| Zn | 2e | Zn 2+ | -0,76 |
| Cr | 3e | Cr 3+ | -0,74 |
| Fe | 2e | Fe 2+ | -0,44 |
| Cd | 2e | Cd 2+ | -0,40 |
| Co | 2e | Co 2+ | -0,28 |
| Ni | 2e | Ni 2+ | -0,25 |
| Sn | 2e | Sn 2+ | -0,14 |
| Pb | 2e | Pb 2+ | -0,13 |
| Fe | 3e | Fe 3+ | -0,04 |
| H2 | 2e | 2H + | 0,00 |
| Cu | 2e | Cu 2+ | 0,34 |
| Cu | 1e | Cu + | 0,52 |
| 2Hg | 2e | Hg2 2+ | 0,79 |
| Ag | 1e | Ag + | 0,80 |
| Hg | 2e | Hg 2+ | 0,85 |
| Pt | 2e | Pt 2+ | 1,20 |
| Au | 3e | Au 3+ | 1,50 |
Место каждого элемента в ряду напряжений условно, т.к. величина электродного потенциала зависит от температуры и состава раствора, в который погружены электроды, в частности от концентрации ионов. Большое значение также имеет состояние поверхности электрода (гладкая, шероховатая). Стандартный электродный потенциал относится к водным растворам при температуре 25 °С, давлении газов 1 атмосфера и концентрации ионов 1 моль/л.
Из электрохимического ряда напряжений металлов вытекает ряд важных следствий:
- Каждый металл способен вытеснять (замещать) из растворов солей все другие металлы, стоящие правее данного металла;
- Все металлы, расположенные левее водорода, способны вытеснять его из кислот;
- Чем дальше расположены друг от друга два металла в ряду напряжений, тем большее напряжение может давать созданный из них гальванический элемент.
Восстановление водородом из оксидов
Металлы, которые водород не восстанавливает из их оксидов
Читайте также:
