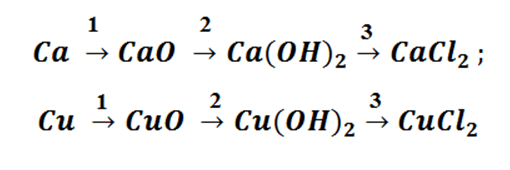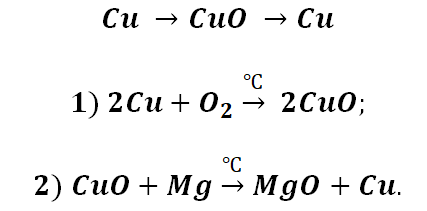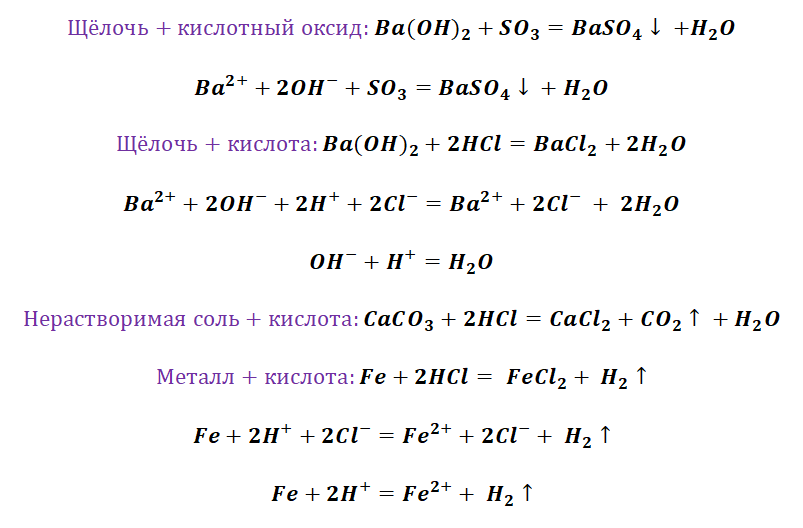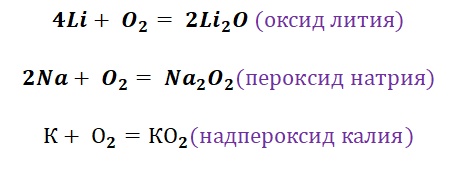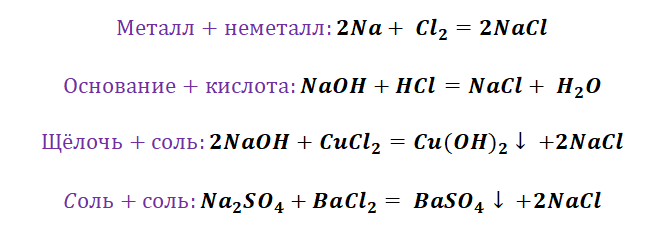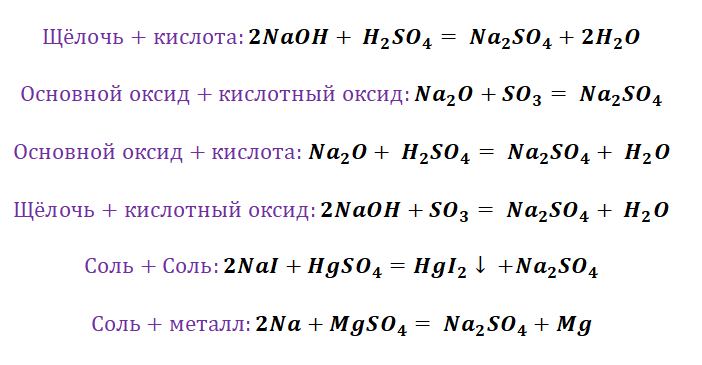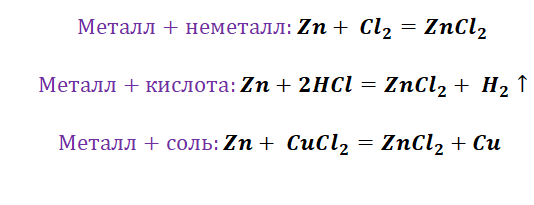Цепочки превращений с металлами
Обновлено: 17.05.2024
Напишите уравнения реакций, соответствующие схеме превращений. Где необходимо составьте сокращенные ионные уравнения.
Практическая работа по химии №1 «Осуществление цепочки химических превращений» (9 класс)
Практическая работа №1. 9 класс
Осуществление цепочки химических превращений
Цель: Осуществить цепочку химических превращений; изучить способы получения и свойства гидроксидов металла (меди)
1.Повторите правила техники безопасности
2. Проведите реакции, в которых осуществляются предложенные ниже химические превращения:
Инструкция к выполнению первой цепочки переходов.
Опыт.1) Для осуществления цепочки превращений выданы пробирки №1, №2. В пробирку №1 прилейте 1-2 мл раствора CuSO4 . Для осуществления 1-ого опыта приливайте к этому раствору 1 мл необходимого реактива.
2) Второй и третий переход проводите в этой же пробирке (№1). Составьте молекулярные и ионные уравнения реакций.
Для отчёта оформите таблицу
Выводы, запись уравнений реакций
Опыт. Инструкция к выполнению цепочки переходов.
1) Для осуществления цепочки переходов выданы пробирки №1, №2;
а) в пробирку прилейте 1-2 мл раствора хлорида цинка. Получите гидроксид цинка, для этого добавьте несколько капель необходимого реактива. Полученный гидроксид разлейте в две пробирки.
б) в пр.№1 получите ZnCl2, в пр.№2 получите Na2Zn(OH)4. Что наблюдаете?
Составьте молекулярные и ионные уравнения реакций. Для отчёта оформите таблицу:
Методическая разработка «Алгоритм решения превращений по химии»
Методические рекомендации решения «цепочек» превращения по химии.
В заданиях ля школьников по химии на любом этапе обучения и для любой параллели всегда имеются задания со схемами последовательных превращений одних веществ в другие, которые характеризуют связь между основными классами органических и неорганических веществ. Многостадийную схему превращения одних веществ в другие в определенной последовательности часто называют «цепочкой». Для выполнения этих заданий необходимо знать основные классы неорганических и органических соединений, номенклатуру, химические свойства, в том числе продукты термического разложения веществ, механизмы реакций.
«Цепочки» – это оптимальный способ проверить большой объем знаний (практически по всем разделам общей, неорганической и органической химии) в одной задаче.
Для того, чтобы успешно решать цепочки химических превращений из одного вещества в другое, необходимо изучить свойства веществ, их взаимодействия и особенности каждого класса соединений. Среди качественных задач решение цепочек веществ встречаются чаще всего.
Алгоритм решения «цепочки»:
1.Внимательно прочитайте условие задачи. Если необходимо, можете сделать это не один раз.
Напишите уравнения, с помощью которых можно получить следующие превращения:
Al → → Al2O3 → Al(OH)3 → K[AL(OH)4] → AlCl3 → Al(NO3)3 → AlPO4.
Для каждого превращения составьте уравнения реакций. Если переход в одну стадия невозможен, составьте два и более уравнений реакций.
2.Выпишите цепочку отдельно, из условия задачи. Вы можете пронумеровать количество реакций и ли веществ для удобства. Помните, что каждое следующее вещество является исходным для последующего. Определите к какому классу веществ относиться каждый член цепочки. Под первым номером стоит металл алюминий. исходным продуктом реакции должна стать соль. По свойствам металла, соль получается при взаимодействии с кислотой. В данном случае с азотной кислотой. Проанализируйте возможна ли эта реакция. Составьте схему уравнения, расставьте коэффициенты. Первое превращение готова. Далее следуйте шаг за шагом, постепенно продвигаясь к последнему веществу, фосфату алюминия.
3.Проверьте себя еще раз. Пробегитесь взглядом по уравнениям реакций, проверьте везде ли стоят нужные коэффициенты. Не забудьте правильно оформить уравнения реакций.
Решение
1.Al + 6HNO3(конц.) => Al(NO3)3 + 3NO2 + 3h3O
2.4Al(NO3)3 => 2AL2O3 + 12NO2 + 3O2
3.Al2O3 + 3h3SO4 => Al2(SO4)3 + 3h3O
Al2(SO4)3 + 6NaOH => 2Al(OH)3 + 3Na2SO4
4.Al(OH)3 +KOH => K[Al(OH)4]
5.K[Al(OH)4] + 4HCl => KCl + AlCl3 + 4h3O
6.AlCl3 + 3AgNO3 => Al(NO3)3 + 3AgCl
7.Al(NO3)3 + K3PO4 => AlPO4 + 3KNO3
Решите «цепочки» самостоятельно:
Cu CuO Cu(OH)2 CuO
Практическая работа №1 «Осуществление цепочки химических превращений» 9 класс по УМК Габриеляна
Практическая работа №1 «Осуществление цепочки химических превращений» 1вариант
Цель: 1. Экспериментально осуществить следующие превращения ( соблюдайте правила техники безопасности)
Составить уравнения реакций обмена в молекулярном и ионном виде.
Практическую работу оформить в виде таблицы
Уравнения химических реакций
Практическая работа №1 «Осуществление цепочки химических превращений» 2 вариант
Практическая работа №1 «Осуществление цепочки химических превращений» 3 вариант
Решение качественных задач-2. Цепочки превращений. Видеоурок. Химия 10 Класс
Данный текст представляет собой неотредактированную версию стенограммы, которая в дальнейшем будет отредактирована.
Химия. 10 класс
Урок 70. Решение качественных задач-2. Цепочки превращений
Загорский Вячеслав Викторович, д.п.н., проф. Специализированного учебно-научного центра МГУ (школа им. А.Н. Колмогорова при МГУ),
многократный лауреат грантов «Учитель Москвы»
24.03. 2011 г.
При участии: Менделеевой Екатерины Александровны, к.х.н., доц. СУНЦ МГУ
Морозовой Натальи Игоревны, к.х.н., ст. преп. СУНЦ МГУ
Решение качественных задач по химии — цепочка превращений
Здравствуйте! Тема сегодняшнего урока – «Решение качественных задач. Цепочки превращений». Некоторые задачи на цепочки превращений фактически являются качественными задачами, в которых нужно проанализировать органические соединения, зашифрованные буквами алфавита.
Вспомним такую задачу из прошлого урока: «Вещество А представляет собой легко кипящую жидкость с приятным запахом. При гидролизе А образуется два соединения с одинаковым числом атомов углерода. Плотность паров одного из этих соединений В лишь немного превышает плотность воздуха. Вещество В может быть окислено оксидом меди. Вещество С, которое используется для сохранения биологических препаратов. Приведите возможные формулы веществ А, В, С».
А теперь решим задачу, которая представляет собой подобную цепочку в чистом виде. Требуется установить структурные формулы и названия веществ от А до Е. В этой цепочке есть определенное начало, что облегчает наши действия. Начальная формула дана однозначно. Фактически такая задача сводится к написанию последовательных уравнений реакции. Сами уравнения нам пока не ясны, но зато указаны условия. Исходное вещество должно прореагировать с бромом на свету. Это типичная реакция радикального замещения. Замещение у вторичных атомов протекает быстрее, чем у первичных. Поэтому при среднем атоме углерода замещается атом водорода существенно быстрее, чем при крайних, и основным продуктом превращений будет вещество А — 2 бром пропан. Затем 2 бром пропан реагирует со спиртовым раствором щелочи. Если раствор щелочи не водный, а именно спиртовой, то происходит отщепление – элиминирование бромоводорода, при этом образуется вещество В, а именно – пропен.
Пропен присоединяет молекулу хлора, в общем-то, в любых условиях. И получается вещество С — 1, 2 дихлорпропан. Затем снова спиртовой раствор щелочи. Реакция идет так же, как и с 2 бром пропаном. Отщепляется молекула галоген водорода. Но здесь два атома галогена, поэтому отщепятся два галоген водорода, а именно два хлороводорода. В результате получится не двойная, а тройная связь. И тогда вещество Д – пропин.
И, наконец, пропин присоединяет воду в кислой среде в присутствии соли ртути. Подобное присоединение идет по правилам Морковникова, т.е. водород уходит на край молекулы, а гидроксильная группа идет в центр. В результате получается непредельный спирт или енол. Но такие спирты неустойчивы, и он тут же перегруппировывается в кетон. Простейший кетон, который называется ацетон. Таким образом, задача решена.
Следующая разновидность цепочек содержит вещества с относительно простыми молекулярными формулами, и нужно подобрать условия, при которых одно вещество будет превращаться в другое.
Рассмотрим такую цепочку. Как превратить этиловый спирт в этилен?
Чтобы получить непредельный углеводород из спирта, нужно забрать у спирта воду. Такая реакция называется дегидратацией. Обычно ее проводят, нагревая этиловый спирт с концентрированной серной кислотой. Затем этилен или этен надо превратить в дихлорэтан. Для того чтобы присоединить хлор, достаточно просто взаимодействия даже в темноте. Затем из 1, 2 дихлорэтана, который получается в этих условиях, нужно получить ацетилен или этин. Нельзя просто отщепить молекулу хлора. Тогда получится этен или этилен. Поэтому нужно отщепить две молекулы хлороводорода. Чтобы произвести такое отщепление или элиминирование, нужно подействовать спиртовым раствором щелочи. И, наконец, последний шаг: из этина или ацетилена нужно получить бензол. Для того чтобы произошла такая реакция, она называется тримеризация, необходим катализатор, имеющий типичную для бензола гексагональную или шестиугольную структуру. В качестве катализатора чаще всего используют активированный уголь или оксид хрома. Данная задача решена.
Мы подобрали все условия реакции.
Еще одна разновидность задач на цепочки – это задачи, в которых в цепочке находятся уже относительно сложные молекулярные формулы. В таком случае расшифровка цепочки является уже не очень простой задачей.
Рассмотрим это на конкретном примере. Данная цепочка превращений сложна еще и тем, что требует определенного внимания. Она двойная. Мы видим, что стрелки расходятся от центра цепочки к ее краям. Сразу видно, что число атомов водорода в формулах всех перечисленных веществ относительно мало, т.е. такое соотношение углерода и водорода характерно для аренов или производных бензола. В формулах большинства веществ в данной цепочке находятся 7 атомов углерода. Скорее всего, они как-то генетически связаны с формулой, имеющей одно бензольное кольцо и один метильный радикал.
Состав вещества, отвечающего такой формуле С7Н8. Исходное вещество находится в середине цепочки. По сравнению с предложенной нами, так называемой базовой формулой, соответствующей талуолу, в нем не хватает 3-х атомов водорода. Зато есть азот и кислород. Предположим, что 3 атома водорода были замещены другими группами.
Какие это могут быть группы? Исходя из видимого нами состава, можно предположить, что одна из групп – это нитрогруппа. Но тогда остается 2 атома кислорода. Атомы кислорода не могут быть сами по себе заместителями в ароматическом ядре. Они не входят и в состав спиртовых групп, потому что для этого не хватит водорода в исходной формуле. Тогда логично предположить, что атомы кислорода замещают атомы водорода не в бензольном ядре, а в метильном радикале.
Если мы заменим метильную группу карбоксильной группой, т.е. кислотной, мы как раз получим ту формулу, которая соответствует находящейся в условии задачи. В исходной формуле находятся и нитрогруппа, и карбоксильная группа. Исходное вещество – нитробензольная кислота. Однако мы пока не можем судить о взаимном расположении этих заместителей. Надо выбрать направление цепочки. Здесь скорее помогает интуитивная оценка имеющейся у нас ситуации. Предположим, мы пойдем влево. У соседнего вещества на 2 атома кислорода меньше, но больше на 3 атома водорода и появился атом хлора. Если число атомов кислорода уменьшилось и возникли атомы водорода, по-видимому, произошло восстановление. При восстановлении нитрогруппа превращается в аминогруппу, тогда не очень понятно, откуда взялся атом хлора. Однако если восстановление протекало в кислой среде, то вместо амина образуется аммониевая соль. Тогда соответствующий анион – хлорид.
Итак, условия реакции восстановления – взаимодействие с активным металлом в солянокислой среде. Металлом может быть, например, цинк. Теперь пойдем еще на 1 шаг влево по данной цепочке.
При таком переходе у нас как бы пропал атом хлора, но появился атом калия и уменьшилось число атомов водорода. Эта комбинация из изменений намекает нам на то, что кислая среда сменилась на основную или щелочную. И тогда хлорид в аминогруппе заменяется солью калия, которая будет, разумеется, не по аминогруппе, а по карбоксильной группе кислоты. Такая реакция протекает при взаимодействии предшествовавшего вещества – соли аммония с концентрированным раствором щелочи.
Теперь двинемся по той же цепочке вправо. Условия реакция здесь довольно однозначные – нужно нитрование. Однако условия нитрования потребуются весьма жесткие, потому что уже есть две функциональные группы, которые не способствуют подобным реакциям. Поэтому придется довольно сильно нагревать вещество с нитрующей смесью. И карбоксильная группа, и нитрогруппа ориентируют новые заместители в метоположение. А поскольку, согласно цепочке, в результате реакции образовалось только одно вещество, то ориентация этих двух исходных заместителей является согласованной. Такая ситуация возможна только в одном случае: и карбоксильная группа, и нитрогруппа по отношению друг другу находятся в метоположении. А продуктом реакции является 3, 5 динитробензольная кислота. Это вещество превращается далее, например, за счет взаимодействия по карбоксильной группе. Возможно образование сложного эфира со спиртом, содержащим 2 атома углерода. И тогда последний продукт – это этиловый эфир 3, 5 динитробензольной кислоты. Реакция идет в кислой среде. Итак, цепочка превращений расшифрована.
На этом наш урок закончен. До свидания.
Инструктивная карточка для проведения практической работы №1 «Осуществление цепочки превращений» по химии 9 класс
Данная инструктивная карточка предназначена для учащихся при проведении практической работы №1 по УМК О.С. Габриеляна. Может быть использованна при проведении похожих практических работ в УМК других авторов.
Просмотр содержимого документа
«Инструктивная карточка для проведения практической работы №1 «Осуществление цепочки превращений» по химии 9 класс»
Практическая работа №1
«Осуществление цепочки химических превращений металлов».
CuSO4 –Cu(OH)2 – CuO – CuSO4
Цель работы: научиться осуществлять цепочки химических превращений, исходя из предложенных веществ; закрепить практические навыки проведения химических опытов; повторить технику безопасности при проведении практических опытов по химии.
Реактивы и оборудование: сульфат меди CuSO4, щелочь NaOH, серная кислота Н2 SO4; спиртовка, штатив с набором пробирок, спички, спиртовка, держатель для пробирок
ИНТСТУКТАЖ ПО ТЕХНИКЕ БЕЗОПАСНОСТИ
В пробирку с CuSO4 добавить NaOH. Что наблюдаете?
Составьте уравнение реакции в молекулярном и ионном виде. Укажите тип химической реакции
Опыт №2. Получение CuO
Пробирку с Cu(OH)2 нагреть. Что наблюдаете?
Составьте уравнение реакции.
В пробирку с полученным осадком добавьте кислоту и при необходимости немного нагрейте. Что наблюдаете?
Цепочки превращений с металлами
Тип 7 № 91Установите соответствие между простым веществом и реагентами, с каждым из которых оно может реагировать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
А) — неметалл обладает свойствами восстановителя и окислителя — реагирует с простыми веществами металлами и неметаллами — 3.
Б) — неметалл обладает свойствами восстановителя и окислителя — реагирует с водородом, металлами, с восстановителями, с водой, также может реагировать и с сильными окислителями (хлором и кислотами окислителями) — 5.
В) (графит) — неметалл, обладает свойствами восстановителя и окислителя, поэтому может реагировать и с металлами и с неметаллами — 3.
Г) — простое вещество, металл — обладает всеми типичными свойствами металлов, а также может восстанавливать соединения железа (3) — 4.
Почему для йода - ответ 5? Йод диспропорционирует в щёлочи, соединяется с водородом, а как проходит реакция йода с азотной кислотой?
задание с йодом не входит в школьную программу по химии!
Можете написать каким образом будет происходить реакция железа с оксидом железа 3 ?
напишите реакцию иода с гидроксидом натрия, пожалуйста
I2 + 6NaOH = 5NaI + NaIO3 +3H2O?
Кальций не реагирует с углеродом.
йод может реагировать с кальцием,кислородом и йодом,почему в ответе предпочтение отдается 5 варианту ответа если 3 вариант ответа идет первым?
галогены не реагируют напрямую с кислородом
Тип 7 № 134Установите соответствие между формулой вещества и формулами простых веществ, которые могут с ним реагировать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
А) HI (раствор) — ведет себя как сильная кислота, поэтому может реагировать с металлами до водорода и хлором — 4.
Б) — кислотный оксид, но не в высшей степени окисления, поэтому может реагировать с кислородом и углеродом — 5.
В) (раствор) — это щелочь, поэтому может реагировать с кремнием для его травления , а также с фосфором — 1.
Г) (раствор) — с металлами стоящими до него в ряду напряжения металлов — 3.
А варианту Г не может соответсвовать вариант 2 ?
В принципе, при очень сильном нагревании, хлорид ртути(II) может реагировать с натрием и водородом, но обычно реакции в экстремальных условиях не рассматриваются.
Тип 7 № 220Установите соответствие между реагирующими веществами и продуктами их взаимодействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
А) Кислая соль и щелочь образуют среднюю соль и воду (1).
Б) При взаимодействии гидрокарбоната и сильной кислоты образуются угольная кислота, которая распадается на углекислый газ и воду и соль этой кислоты (4).
В) Гидрокарбонаты термически неустойчивы, при нагревании разлагаются на карбонаты, углекислый газ и воду (2).
Г) Это реакция образования из средней соли кислой (6).
Тип 7 № 263Установите соответствие между реагирующими веществами и продуктами реакции, содержащими азот: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Мы не понимаем зачем Вам в этом задании коэффициенты.
В пояснении даны не уравнения, а схемы реакций, которых для ответа на поставленный вопрос вполне достаточно.
В части С, в уравнениях коэффициенты действительно важны, и мы стараемся их там везде расставлять. Если Вы заметите в части С уравнения без коэффициентов или ошибки в них, убедительно просим Вас сообщать нам об этих недочетах
NH4NO3 разлагается двумя способами в зависимости от условий:
если температура меньше 270, то
если больше 270, то
это я нашла в книге Дерябиной. Так что ваше задание сделано некорректно. постарайтесь исправить (хотя бы укажите температуру)
Обычно в школе рассматривается только первый вариант, поэтому он и подразумевается.
Тип 7 № 306Установите соответствие между схемами превращений и формулами веществ, необходимых для их последовательного осуществления: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Для первой цепочки превращений выбираем набор реактивов № 1, 3 набор отвергаем, так как железо переходит в хлорид железа +2, это возможно, если реакция идет с соляной кислотой. Взаимодействие с хлором приводит к образованию соли железа +3. Для 2 цепочки превращений ответ очевиден, поскольку в первой реакции должен участвовать магний, а такой вариант ответа только один. Для цепочек В и Г, первые два превращения одинаковы. Вторая реакция это гидролиз силицидов.
В цепочке Г последнее превращение это образование оксида — необходимо провести окисление, а для цепочки B — образование соли из щелочи, здесь подходит кислотный оксид в качестве реагента.
Взаимопревращения между классами веществ
Наверняка у каждого из Вас есть семейный альбом, где есть фото родителей, бабушек, дедушек, прабабушек. А возможно у кого-то есть сведения о предках не одного поколения, и это всё отображается в виде генетического дерева. Правомерный вопрос, к чему эти сведения и химия? Однако и в химии есть, так называемые, прародители (металлы и неметаллы), с которых путём химических превращений, были получены новые классы соединений и между ними существует генетическая связь.
План урока:
Почему связь между классами веществ считается генетической
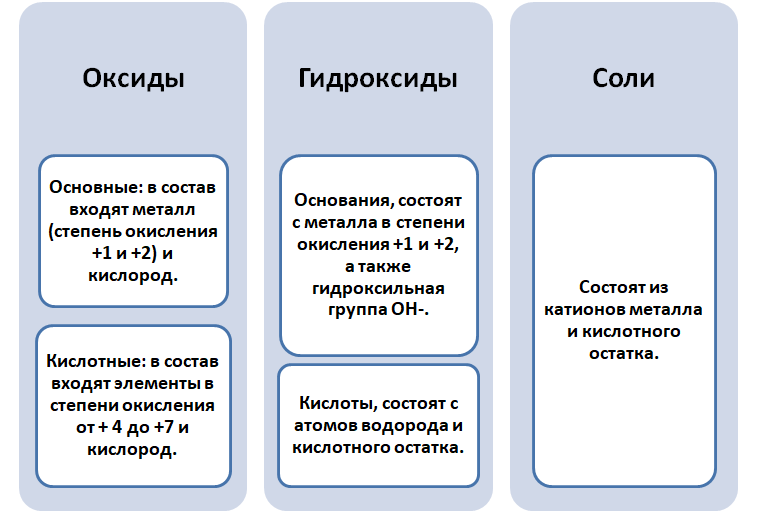
Чтобы разобраться в этом вопросе. Вспомним состав классов веществ, с которыми Вы познакомились на предыдущих занятиях.
Обратите внимание, что соли содержат в себе частицы как оснований (атомы металла), так и кислот (кислотных остатков). Если соль рассматривать как «венец» превращений, то давайте, попытаемся прийти к истокам. Всё начинается с простого, точнее металла и неметалла, как простых веществ.
Попробуем построить генетический ряд металлов, переходя от одного класса к другому.
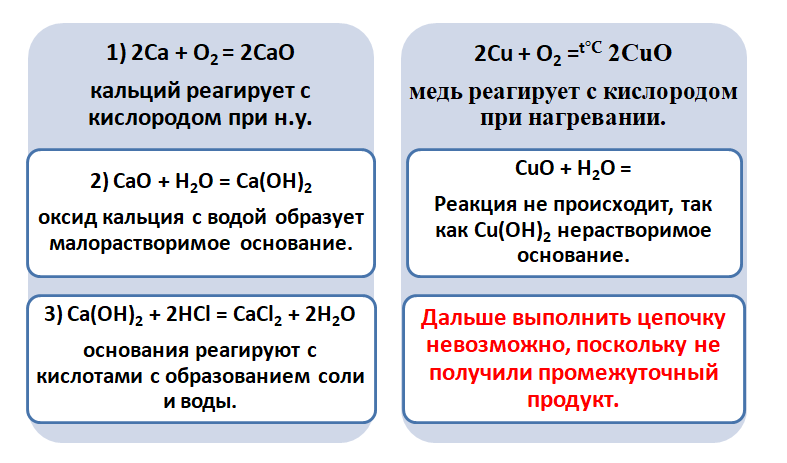
Возьмём, к примеру, металлы кальций и медь, подставив их в цепочку уравнений.
Обратите внимание, что данные металлы отличаются своей реакционной способностью.
Получается, эта генетическая связь соединений присуща только для активных металлов, оксиды которых, реагируя с водой, дают продукт в виде щёлочи.
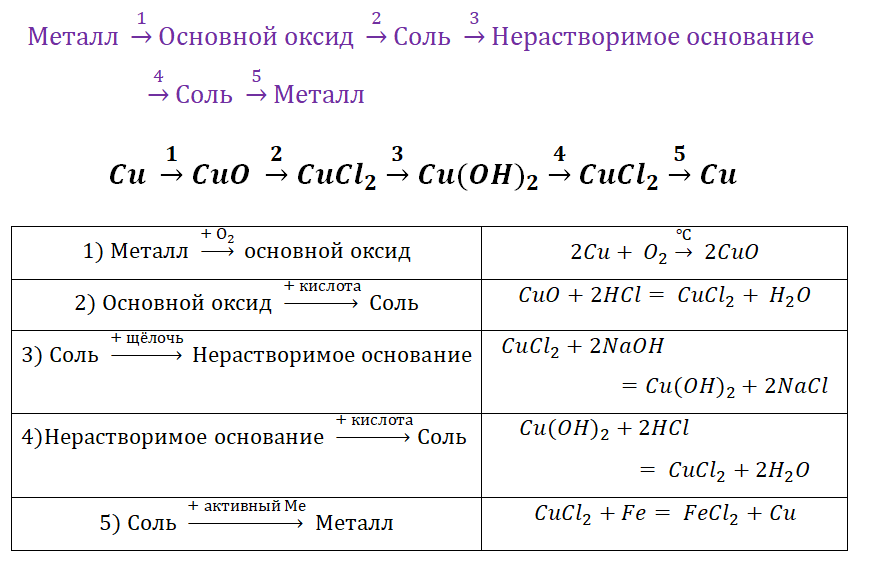
Для металлов, которые отличаются малой активностью, переход от вещества, находящегося в простом состоянии, к соли, происходит путём превращений.
Поскольку основные оксиды реагируют с металлами (более активными, чем металлы, которые входят в состав оксида), то эту схему можно сократить.
Аналогичным способом можно составить генетический ряд неметаллов, начиная от неметалла заканчивая солью или неметаллом.
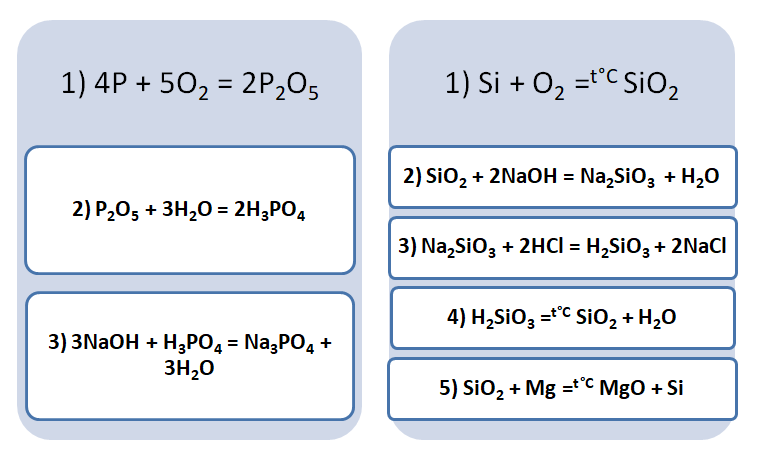
Подставим в цепочку уравнений фосфор и кремний.
А возможны иные пути решения данных цепочек уравнений. Способы получения кислотных оксидов реализуются путём взаимодействия простых веществ с кислородом. А вот не с каждого оксида можно получить ему соответствующую кислоту, путём прибавления воды. Поскольку кремниевая кислота нерастворима в воде, то необходимо получить сначала соль, а потом уже и кислоту.
В данном решении предлагается добыть соль Na3PO4, взаимодействием основания и кислоты. Однако можно использовать и другие варианты, которые также будут верны.
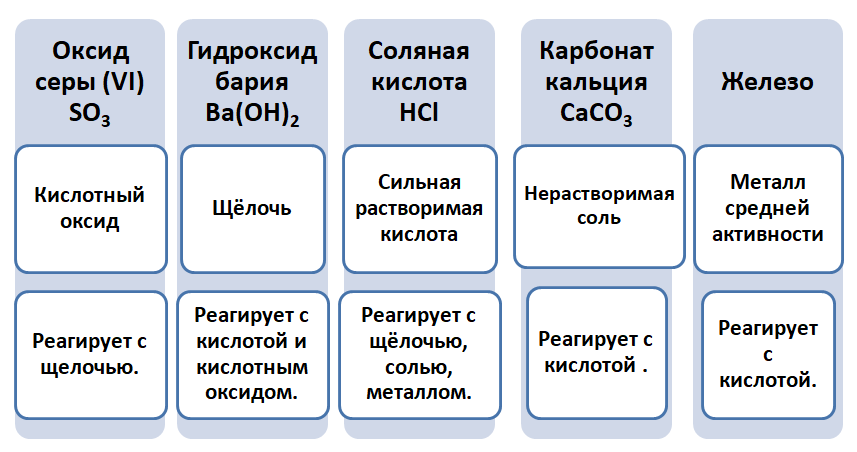
Если объединить генетические ряды металлов и неметаллов, получим дружную семью неорганических соединений, где каждое вещество связано неразрывной нитью с другими классами. Таблица 1.
Данная таблица отображает, как реагируют между собой вещества и какие продукты возможны, вследствие реакции.
Промоделируем на примере: В вашем распоряжении имеются следующие вещества: оксид серы (VI), гидроксид бария, соляная кислота, карбонат кальция и железо. Ваша задача спрогнозировать, между какими соединениями возможна реакция и, записать, соответствующие уравнения реакций.
Подтвердив свои прогнозы молекулярно-ионными уравнениями в сокращённом и полном виде.
Родственные связи между металлами и неметаллами
Кислород является типичным представителем неметаллов. Он является достаточно сильным окислителем, перед которым может устоять только фтор. Получение основных оксидов происходит путём взаимодействия кислорода и металлов. Однако не все металлы охотно с ним реагируют. Щелочные реагируют бурно, именно поэтому их хранение осуществляется под слоем керосина. Необходимо заметить, что щелочные металлы не образуют оксиды во время взаимодействия с О2. Их чрезвычайная активность позволяет получать только для их характерные продукты, это будут пероксиды и надпероксиды (за исключением лития, продукт Li2O).
А вот, чтобы менее активные металлы – железо или медь прореагировали, необходимо нагревание.
Получение кислотных оксидов происходит аналогично взаимодействием неметаллов с О2.
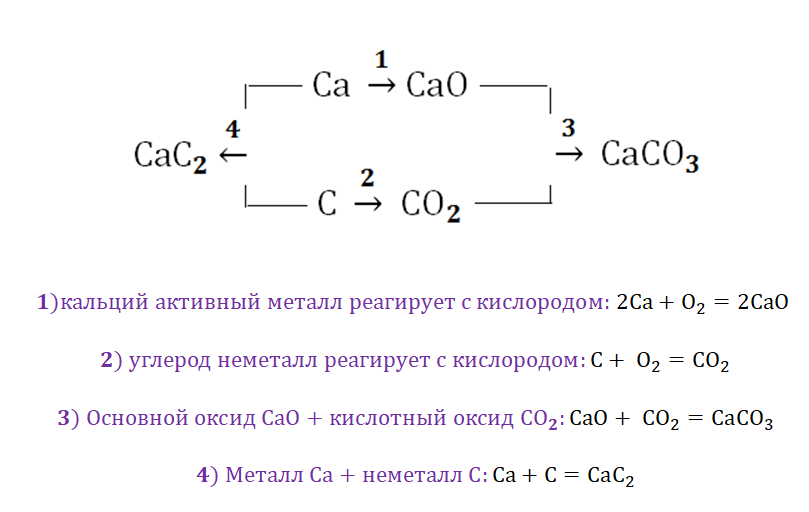
Металлы и неметаллы в химии рассматриваются как противоположности, которые, как заряды (положительные и отрицательные) имеют свойства притягиваться. Рассмотрим на примере металла кальций и неметалла углерод.
Соль СаСО3 имеет истоки от простых веществ Са и С, промежуточным звеном являются оксиды этих веществ, для которых свойственно реагировать между собой.
Вспомним с Вами один с основных постулатов химии, а именно, закон постоянства состава вещества.
Представим, что мы с Вами химики-первооткрыватели и нам предстоит сложная задача получить азотную кислоту, которая имеет важную роль в химической промышленности. Получение кислот возможно несколькими способами. Обращаясь к таблице 1, делаем вывод, что нам доступно несколько способов, а именно.
Взаимодействие кислот с солями приведёт нас к желаемому результату, однако не забывайте, что в продукте должны увидеть газ, осадок либо окрашивание.
Способы получения средних солей доказательно показывают связь между веществами. Снова выручалочкой нам послужит таблица 1. Наша задача получить вещество, без которого, полагаем, Вы не представляете своё существование, это соль NaCl. Используя данные, видим, что доступно для её получения 4 способа (Вы ищете, где продуктом является соль и применяете данные на свой пример).
Рассмотрим подробно каждый с них.
Способы получения солей отличаются, причиной этому является то, какую именно соль мы хотим получить, кислородсодержащей,сильной или слабой кислоты. К примеру, получение Na2SO4 будет отличаться от предыдущего примера с NaCl. Количество способов будет больше, так как это соль кислородсодержащей кислоты.
Здесь следуют отметить особенность щелочных, а также щелочно-земельных металлов, для которых свойственно взаимодействие с водой. По сути, идёт два параллельных процесса.
Полученная щёлочь реагирует с кислотой.
Способы получения солей аммония несколько отличаются, от солей металлов, тем, что аммиак непосредственно реагирует с кислотами (смотри урок химическая связь) с образованием донорно-акцепторных связей.
Гидроксид аммония имеет способность взаимодействовать с кислотами, с образованием необходимого продукта, не иначе как солей аммония.
Наверняка некоторые из Вас пугал вид заданий, который был цепочек уравнений. Обобщая всё выше сказанное, рассмотрим несколько примеров.
Чтобы справится с данной задачей, проанализируем условие. Первое, что необходимо выделить – это количество уравнений (смотрим по стрелочкам, их 5). Второе определим исходное вещество – цинк, металл средней силы. Чтобы получить с него соль (не забываем о таблице 1), можно использовать 3 способа:
Выбор за Вами, одного из трёх уравнений. Переходим к следующей части цепочки ZnCl2 → Zn(OH)2. Здесь решением будет один вариант, это прибавление щёлочи.
Zn(OH)2 относится к нерастворимым основанием, поэтому при нагревании распадаются.
И наконец, итоговый продукт, металл. Его необходимо выделить из соли. Для этого необходимо взять металл, сила которого будет больше. Если эту информацию забыли, то освежить эти данные сможете с помощью урока Соли и их свойства.
Решение цепочек химических уравнений на первый взгляд кажется не посильной задачей, но если внимательно изучить свойства веществ, то они кажутся не такими уж и сложными.
Взаимопревращение между классами веществ
Обобщая сведения о свойствах неорганических соединений, составим схему 1. Взаимосвязь между классами неорганических веществ.
Эта схема и таблица 1 будут служить Вам волшебной палочкой в изучении неорганической химии.
Пособие-репетитор по химии
2. Краткая история открытия и происхождение названия.
3. Физические свойства.
4. Химические свойства.
5. Важнейшие соединения: оксиды, пероксиды, гидроксиды, соли.
6. Качественные реакции на катионы щелочных металлов.
7. Нахождение в природе.
8. Основные методы получения.
П о л о ж е н и е в т а б л и ц е Д. И. М е н д е л е е в а,
с т р о е н и е а т о м а
К щелочным металлам относят элементы Ia группы периодической системы Д.И.Менделеева: литий, натрий, калий, рубидий, цезий, франций. Свое название эти металлы получили потому, что при взаимодействии с водой они и их оксиды образуют щелочи. Щелочные металлы относятся к s-элементам и имеют один валентный электрон на внешнем уровне (ns 1 ). Сверху вниз в подгруппе радиус атома увеличивается, энергия ионизации уменьшается, способность отдавать валентный электрон увеличивается, поэтому восстановительная способность также увеличивается. Самым активным из щелочных металлов является франций (радиоактивен). Все щелочные металлы хранят под слоем керосина или минерального масла из-за их высокой реакционной способности. В соединениях щелочные металлы всегда проявляют степень окисления +1, преобладающий тип связи – ионная.
К р а т к а я и с т о р и я о т к р ы т и я
и п р о и с х о ж д е н и е н а з в а н и я
Название лития произошло от греческого слова «камень», поскольку впервые он был обнаружен в виде гидроксида в составе минерала (камня). Название натрия происходит от древнеегипетского «натрон», так называли любую щелочь. Название калия происходит от арабского названия щелочей – «алкали», ранее калий называли «поташ», но это название не прижилось. Рубидий получил свое название из-за цвета спектральных линий (лат. «рубидус» – красный). Цезий также обязан своим названием цвету линии спектра – латинским словом «цезиус» (голубой, светло-серый) в древности обозначали голубизну ясного неба. Франций был назван французской исследовательницей М.Перей, открывшей этот элемент, в честь ее родины.
Ф и з и ч е с к и е с в о й с т в а
Все щелочные металлы – мягкие серебристые вещества с характерным блеском на свежесрезанной поверхности. Они имеют низкие температуры плавления и кипения, хорошо проводят тепло и электрический ток. Литий, натрий и калий легче воды. Сверху вниз по подгруппе плотность металлов увеличивается, а температуры плавления уменьшаются.
Х и м и ч е с к и е с в о й с т в а
Все щелочные металлы отличаются высокой реакционной способностью. Они реагируют с водородом, кислородом и другими неметаллами:
Щелочные металлы реагируют с водой, образуя щелочи:
Натрий и другие щелочные металлы вытесняют водород из кислот-неокислителей:
2Na + 2HCl = 2NaCl + H2.
C кислотами-окислителями образуются другие продукты восстановления:
Металлический натрий вытесняет калий из расплава KCl при 450 °С:
KCl + Na = NaCl + K.
О к с и д ы щ е л о ч н ы х м е т а л л о в – твердые вещества белого (оксиды лития и натрия), желтого (оксиды калия и рубидия) и оранжевого (оксид цезия) цвета. Они обладают ярко выраженными основными свойствами. Эти оксиды реагируют с водой, кислотами, амфотерными и кислотными оксидами, кислородом:
Оксид лития получают прямым взаимодействием простых веществ, остальные оксиды получают другими способами – при нагревании смеси гидроксида, пероксида и надпероксида с избытком соответствующего металла в отсутствие кислорода, например:
П е р о к с и д ы щ е л о ч н ы х м е т а л л о в – желтовато-белые порошки. Они реагируют с водой, неметаллами, кислотами, угарным и углекислым газами. В ОВР пероксиды проявляют окислительно-восстановительную двойственность, например:
Г и д р о к с и д ы щ е л о ч н ы х м е т а л л о в – твердые белые вещества, хорошо растворимые в воде. Щелочи проявляют ярко выраженные основные свойства. При движении вниз по подгруппе от Li к Fr растворимость в воде их щелочей и сила оснований увеличиваются. Эти гидроксиды являются сильными электролитами, реагируют с кислотами, кислотными оксидами, некоторыми неметаллами, амфотерными оксидами и гидроксидами, солями:
Все гидроксиды щелочных металлов, кроме гидроксида лития, термически устойчивы. Гидроксид лития при прокаливании разлагается на оксид и воду:
Гидроксиды щелочных металлов можно получить электролизом водных растворов хлоридов, взаимодействием металла или его оксида с водой или некоторыми обменными реакциями:
Большинство с о л е й щ е л о ч н ы х м е т а л л о в хорошо растворимы в воде, исключение составляют некоторые соли лития. Растворы солей щелочных металлов, образованных слабыми кислотами, имеют щелочную реакцию среды вследствие гидролиза. Cоли, образованные сильными кислотами, не гидролизуются, например:
Соли и другие соединения щелочных металлов изменяют окраску пламени, что используется в химическом анализе. Ионы лития окрашивают пламя в карминово-красный цвет, ионы калия – в фиолетовый, ионы натрия – в желтый, ионы рубидия – в беловато-розовый, ионы цезия – в фиолетово-красный цвет.
В п р и р о д е щелочные металлы встречаются только в виде соединений вследствие своей высокой химической активности. Важнейшие соединения: поваренная соль NaCl, сильвинит NaCl•KCl, мирабилит, или глауберова соль, Na2SO4•10H2O, селитры – NaNO3, KNO3.
Щ е л о ч н ы е м е т а л л ы п о л у ч а ю т электролизом расплавов солей (чаще хлоридов) или щелочей, например:
Тривиальные названия распространенных солей: поваренная (каменная) соль NaCl, кальцинированная сода Na2CO3, каустическая сода NaOH, кристаллическая сода Na2CO3•10H2O, питьевая сода NaHCO3; марганцовка KMnO4, бертолетова соль KClO3, глауберова соль Na2SO4•10H2O, калийная селитра KNO3, поташ K2CO3, растворимое стекло или силикатный клей – смесь силикатов натрия, калия.
Тест по теме «щелочные металлы»
В промышленности металлический натрий может быть получен:
а) взаимодействием раствора хлорида натрия с металлическим калием;
б) электролизом расплава гидроксида натрия;
в) восстановлением оксида натрия водородом;
г) электролизом раствора гидроксида натрия.
2. Какой металл может плавать на поверхности воды? (возможно более одного варианта ответа.)
а) Осмий; б) алюминий;
в) литий; г) калий.
3. Из перечисленных солей выберите ту, которая гидролизуется с образованием раствора, имеющего рН > 7:
а) сульфид свинца; б) нитрит свинца;
в) йодид натрия; г) сульфид калия.
4. Ионы калия придают окраске пламени цвет:
а) желтый; б) фиолетовый;
в) карминово-красный; г) оранжевый.
5. При электролизе раствора фосфата калия образуются следующие продукты реакции:
а) на катоде – водород, на аноде – кислород, в растворе – фосфат калия;
б) на катоде – калий, на аноде – фосфорная кислота, в растворе – вода;
в) на катоде – водород, на аноде – фосфорная кислота, в растворе – гидроксид калия;
г) на катоде – калий и водород, на аноде – кислород, в растворе – фосфорная кислота.
6. Какой объем раствора хлорида натрия с молярной концентрацией 3 моль/л и плотностью 1,12 г/мл надо прилить к воде массой 200 г, чтобы получить раствор с массовой долей поваренной соли 10%?
а) 56,7 мл; б) 200 мл; в) 94,2 мл; г) 315 мл.
7. Сумма коэффициентов в реакции взаимодействия калия с избытком сильно разбавленного раствора азотной кислоты равна:
а) 30; б) 29; в) 7; г) 12.
8. При растворении 10,8 г гидрида щелочного металла в воде выделяется 10,08 л газа (н.у.). Металл, входящий в состав гидрида, – это:
а) литий; б) натрий;
в) калий; г) рубидий.
9. Коэффициент перед восстановителем в ОВР между нитритом калия и дихроматом калия в сернокислом растворе равен:
а) 1; б) 2; в) 3; г) 4.
10. Какое вещество является природным источником калия?
а) надпероксид калия; б) гидроксид калия;
в) нитрат калия; г) гидрид калия.
Ключ к тесту
Задачи и упражнения по теме «Щелочные металлы»
Хлорид натрия карбонат натрия хлорид натрия гидроксид натрия натрий сульфат натрия хлорид натрия.
2. Калий гидроксид калия гидрокарбонат калия карбонат калия сульфат калия хлорид калия гидросульфат калия.
3. Хлорид натрия гидроксид натрия карбонат натрия гидрокарбонат натрия нитрат натрия.
4. Хлорид натрия гидроксид натрия карбонат натрия гидроксид натрия натрий нитрат натрия.
5. Гидроксид калия хлорид калия нитрат калия нитрит калия хлорид калия.
6. Натрий пероксид натрия оксид натрия гидроксид натрия хлорат натрия хлорид натрия нитрат натрия нитрит натрия.
7. Хлорид натрия натрий гидрид натрия гидроксид натрия гидросульфит натрия.
У р о в е н ь А
1. Образец бинарного соединения натрия с элементом пятой группы содержит 4,14 г натрия и 4,5 г другого элемента. Назовите это соединение.
Ответ. Арсенид натрия Na3As.
2. При действии избытка воды на 1,38 г металла выделился газ, занимающий при н.у. объем 672 мл. Определите металл.
По закону эквивалентов:
где газ – водород, Э(М) – эквивалент металла.
Если валентность металла I, то Ar(M) = 23, металл – натрий Na.
Если валентность металла II, то Ar(M) = 46, такого металла нет.
3. Найдите массу соли, образующейся при сжигании 11,2 г лития в 20 л хлора (н.у.).
4. Через склянку, содержащую раствор гидроксида натрия массой 80 г, пропустили избыток углекислого газа, в результате чего масса раствора увеличилась на 8,8 г. Найдите массовую долю гидроксида натрия в исходном растворе.
5. Какая масса 40%-го раствора гидроксида натрия необходима для получения 212 г карбоната натрия, если доля выхода продукта реакции составляет 80% от теоретически возможного?
6. При электролизе 400 г 20%-го раствора хлорида калия получен раствор гидроксида калия. Через этот раствор пропустили избыток углекислого газа. Найдите массу соли, образовавшейся в растворе, если доли выхода продуктов описанных реакций составляют 80% и 75% от теоретически возможного.
У р о в е н ь Б
1. Масса щелочного металла, необходимого для получения его бромида, в 1,395 раза больше, чем масса этого металла, необходимая для получения его йодида. Определите металл, если известно, что массы полученных галогенидов одинаковы.
2. Образец натрия массой 2,3 г опустили в 5%-й раствор гидроксида натрия. После окончания реакции массовая доля гидроксида натрия в растворе стала равна 10%. Найдите массу 5%-го раствора гидроксида натрия.
3. При добавлении смеси лития с гидридом лития к 200 г 5%-го раствора гидроксида лития образовался 10%-й раствор гидроксида лития. Найдите массу смеси лития с гидридом лития, если известно, что количества веществ ее компонентов одинаковы.
200 г 5%-го раствора LiOH содержат m0(LiOH) = 10 г и 190 г H2O.
Уравнения протекающих реакций:
Обозначим (Li) = (LiH) за x моль.
Массовая доля полученного раствора 1(р-ра) = 10%, или 0,1; 1(р-ра) = m1(LiOH)/ m0(р-ра).
Общая масса гидроксида лития: m1(LiOH) = m0(LiOH) (10 г) + ma(LiOH) (в реакции а, 24х г) +
+ mб(LiOH) (в реакции б, 24х г).
Масса нового раствора: m1(р-ра) = m(Li) (7х г) + m(LiH) (8х г) + m0(р-ра) (200 г) – m(Н2)
(в реакции а, 0,5х г) – m(Н2) (в реакции б, 0,5х г).
Отсюда х = 0,2146 моль.
m(Li) = •M(Li) = 0,2146•7 = 1,5 г,
m(LiH) = •M(LiH) = 0,2146•8 = 1,7 г.
Масса исходной смеси Li и LiH:
4. При действии избытка углекислого газа на 32,9 г неизвестного соединения металла с кислородом образовалось твердое вещество А и выделился газ В. Вещество А растворили в воде и добавили избыток раствора нитрата бария, при этом выпало 27,58 г осадка. Газ В пропустили через трубку с раскаленной медью, масса трубки при этом увеличилась на 6,72 г. Установите формулу исходного соединения.
1. В четырех пробирках находятся водные растворы сульфида, сульфита, сульфата и силиката натрия. Как с помощью одного реактива можно распознать содержимое каждой пробирки? Ответ подтвердите уравнениями реакций.
Ответ. Реактив – кислота HCl.
2. Простое вещество, газ А желто-зеленого цвета с резким запахом реагирует с серебристо-белым металлом В, плотность которого меньше плотности воды. В результате образуется вещество С, окрашивающее пламя в коричнево-красный цвет. При действии на твердое вещество С концентрированной серной кислотой при нагревании выделяется бесцветный газ D с резким запахом, хорошо растворимый в воде. Определите вещества А, В, С, D, напишите уравнения перечисленных реакций.
Ответ. А – Cl2, B – Li, C – LiCl, D – HCl.
3. В четырех пробирках находятся растворы веществ: техническая сода, растворимое стекло (или силикатный клей), каустическая сода, серная кислота. Предложите наиболее рациональный путь определения каждого из этих веществ.
Ответ. Определить среду растворов универсальным бумажным индикатором,
а затем к щелочным растворам добавить кислоту HCl.
4. С какими из данных веществ будет взаимодействовать оксид калия: сернистый газ, вода, ортофосфорная кислота, гидроксид натрия, сульфат железа(III), йодоводородная кислота. Напишите уравнения возможных реакций.
5. Вещество А – мягкий серебристо-белый металл, легче воды. При взаимодействии вещества А с простым веществом В образуется соединение С, растворимое в воде с образованием щелочного раствора. При обработке вещества С соляной кислотой выделяется газ D с неприятным запахом и образуется соль, окрашивающая пламя горелки в фиолетовый цвет. Идентифицируйте вещества, напишите уравнения реакций.

Для удобства пользователей и возможности быстрого нахождения реакций.
Кроме того, реакции и цепочки превращений, относящиеся к определенному разделу химии (ОВР, кислоты-соли-основания, комплексные соединения. ) частично находятся в этих темах.
Всем успеха!
Задача 1
Cl2 → ClF → ClF3 → ClF5 → HClO3 → КClO3 → KClO4 → Cl(-) → Cl2
Cl2 + ClF3 → 3 ClF
ClF + F2 → ClF3
ClF3 + F2 → ClF5
ClF5 + 3 H2O → HClO3 + 5 НF
HClO3 + КОН (разб.) → КClO3 + H2O
KClO3 + H2O -(электролиз)→ KClO4 + Н2↑
KClO4 -(600°С)→ KCl + 2O2↑ , KCl -(растворение в воде)→ Cl(-) + К(+)
2Cl(-) + F2 → Cl2 + 2F(-)
Задача 2
MnO2+HCl → A(газ при t=0°)+Ca(OH)2 → Б+CO2 → A+KI → В+KOH(при t) → Г+AgNO3 → Д(осадок)
Решение:
MnO2 + 4 HCl (конц.) → MnCl2 + Cl2↑ [A] + 2 H2O
2 Cl2 + 2 Ca(OH)2 (хол.) → Ca(ClO)2 [Б] + CaCl2 + 2 H2O
Ca(ClO)2 + CO2 + 2 H2O → СаСО3 + 2 HClO - в этой реакции хлор [A] в одну стадию не получится, для этого нужно к полученной HClO добавить конц. сильную кислоту, напр., HCl или H2SO4:
HClO + HCl (конц.) → Cl2↑ [A] + H2O
Или сразу к Ca(ClO)2 вместо СО2 добавить конц. сильную кислоту:
Ca(ClO)2(тв) + 4 HCl (конц.) → CaCl2 + 2 Cl2↑ + 2 H2O
Cl2 + 2 KI → I2 [В] + КCl
3 I2 + 6 KOH (конц, гор) → KIO3 + 5KI [Г] + 3H2O
KI + AgNO3 → AgI↓ [Д] + КNO3
Задача 4
Какие оксиды можно получить при термическом разложении каждого из веществ: Fe(OH)2, H2SO4, Ca(OH)2 ? Напишите уравнение реакции.
Решение:
Fe(OH)2 → FeO + Н2О
H2SO4(безводн.) → H2O + SO3
Ca(OH)2 → CaO + Н2О
Задача 5
Металлический алюминий растворили в растворе гидроксида натрия. Через полученный раствор пропустили избыток углекислого газа. Выпавший осадок прокалили, и полученный продукт сплавили с карбонатом натрия. Записать уравнения.
Решение:
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
NaAlO2 + CO2 + 2 H2O → Al(OH)3↓ + NaHCO3
2Al(OH)3 → Al2O3 + 3H2O
Al2O3 + Na2CO3 → 2NaAlO2 + CO2↑
Задача 6
Be →Be(NO3)2→ Be(OH)2→K2BeO2→BeSO4
Решение:
3Be + 8HNO3 = 3Be(NO3)2 + 2NO↑ + 4H2O
Be(NO3)2 + 2KOH = Be(OH)2↓ + 2KNO3
Be(OH)2 + 2KOH = K2BeO2 + 2H2O
K2BeO2 + 2H2SO4 = BeSO4↓ + K2SO4 + 2H2O
Задача 7
Cl2 → HClO → NaClO → NaClO3 → KClO3 → KClO4 → HClO4 → Cl2O7
Решение:
Cl + 2NaOH (хол.) → NaCl + NaClO + H2O
HClO + NaOH (разб.) → NaClO + H2O
3NaClO -(30-50°С)→ NaClO3 + 2NaCl
NaClO3 + KOH -(0°С)→ KClO3 + NaOH
KClO3 + H2O -(электролиз)→ KClO4 + Н2↑
KClO4 + H2SO4 (конц.) → НClO4↑ + К2SO4
3НClO4 (безводн.) -(0-20°С)→ Cl2O7 + НClO4∙H2O↓
Задача 9
MgCO3 → MgCl2 → Mg(OH)2 → MgSО4
Задача 10
CuSO4 → Cu(OH)2 → CuO → Cu
Задача 11
ZnCl2 → Zn(OH)2 → ZnCl2
Zn(OH)2 → Na2ZnO2
Задача 12
N2H2 что за вещество?
Ответ:
а-3, б-1, в-4, г-2
сполучення (соединения) - из нескольких веществ получается только одно,
розкладу (разложения) - из одного получается несколько,
замiщення (замещения) - из простого и сложного - другие простое и сложное,
обмiну (обмена) - из двух сложных - другие два сложных.
Задача 14
Ланцюжок
кальцій сульфід→каліцій нітрат→кальцій нітрит→кальцій сульфат
Решение:
CaS → Ca(NO3)3 → Ca(NO2)3 → CaSO4
1. CaS + 4НNO3 (конц.) → Ca(NO3)3 + S↓ + 2NO2↑ + 2H2O
2. Ca(NO3)2 -(400-500°C) → Ca(NO2)2 + O2↑
3. Ca(NO2)2 (насыщ.) + H2SO4 (конц.) → CaSO4↓ + NO2↑ + NO↑ + H2O
Задача 15
Напишите уравнения реакций, в результате которых можно осуществить следующие превращения:
алюминий → нитрат алюминия → алюминат натрия → гидроксид алюминия → оксид алюминия → метаалюминат магния;
Решение:
Al + 6 HNO3(конц.) → Al(NO3)3 + 3 NO2↑ + 3 H2O
Al(NO3)3 (тв.) + 4NaOH (тв.) → NaAlO2 + 3NaNO3 + 2H2O (при сплавлении, ок. 1000°C)
NaAlO2 + 2H2O(гор.) → NaOH + Al(OH)3↓
2Al(OH)3 → Al2O3 + 3H2O (ок. 600°C)
MgO + Al2O3 → Mg(AlO2)2
Задача 16
Напишите уравнения реакций, в результате которых можно осуществить следующие превращения:
силикат кальция → оксид кремния (IV) → силикат натрия → кремний → тетрафторид кремния.
Решение:
Есть несколько силикатов кальция с общей формулой хCaO∙уSiO2, в школе, как правило, обозначается как метасиликат CaSiO3.
CaSiO3 + 2HCl → CaCl2 + SiO2 + H2O (при нагревании)
SiO2+2NaOH(расплав или гор. конц.) → Na2SiO3+H2O
Na2SiO3 → Si ?? не знаю такой реакции, но можно в 2 стадии:
1) Na2SiO3 + 2HCl → NaCl + SiO2↓ + H2O
2) SiO2 + 2Mg → Si + 2MgO (ок. 1000°C без доступа воздуха)
Si + 2F2 (г) → SiF4 (горение кремния во фторе)
Ответ:
Замещение, ОВР, экзотермическая, гетерогенная.
Задача 18
Как из образца медного купороса, содержащего радиоактивный изотоп серы S35, получить меченый этой серой сульфид железа (II), не загрязняя его другими изотопами? Написать уравнения реакций.
Решение:
Чтобы не загрязнить меченый сульфид железа (II) другими изотопами серы, нельзя применять никакие серосодержащие реагенты, кроме имеющегося медного купороса.
Поэтому реакции типа CuSO4 + Н2S не подойдут - Н2S содержит высокий процент распространенного в природе изотопа серы S32 и др. изотопы.
Можно так, например:
CuSO4 + ВаСl2 = ВаSO4↓ + CuСl2
ВаSO4 + 4CО = ВаS + 4СО2↑ (600°С)
ВаS +2НСl = ВаСl2 + Н2S↑
H2S + FeO = FeS + H2O (500°C)
Задача 19
Сколько простых веществ указано в следующим перечне:
озон, азот, вода, пирит, сажа, графит, карбин, карбид?
A)1. Б)5, В)3, Г)2
Читайте также: