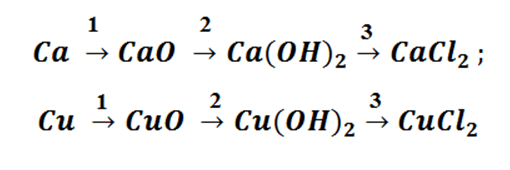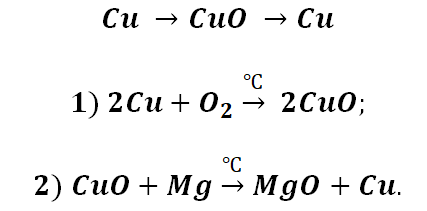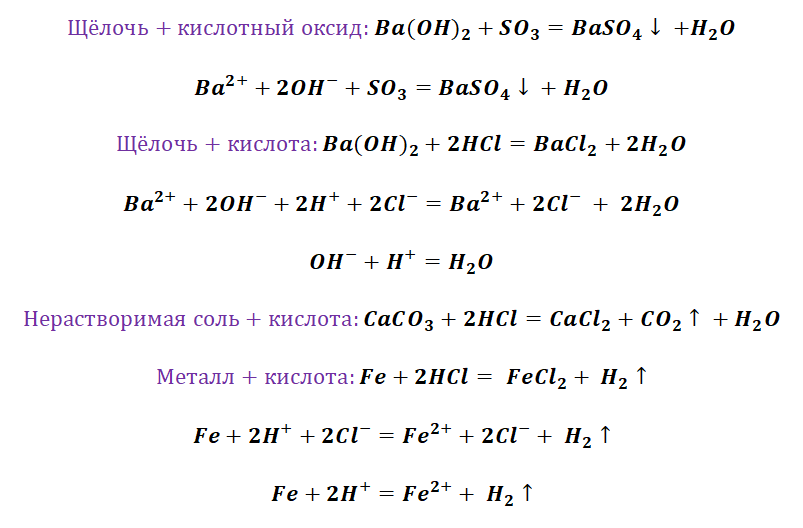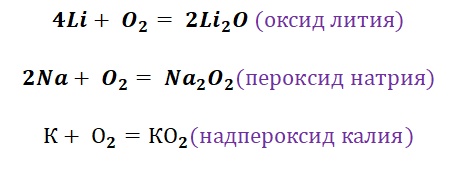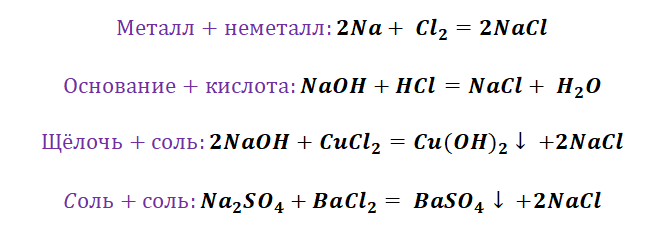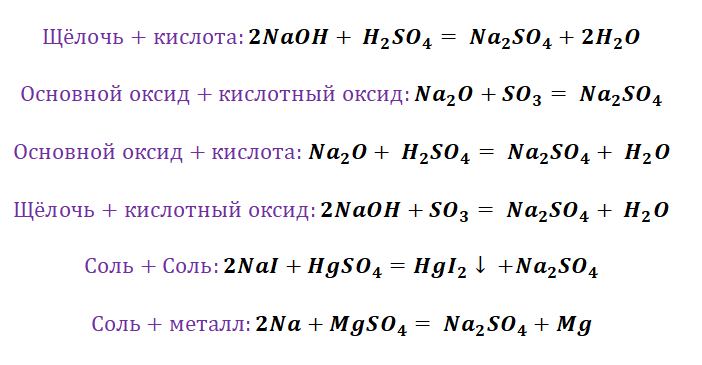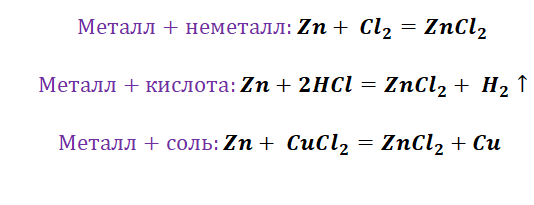Цепочки реакций с металлами
Обновлено: 02.07.2024
Положение в периодической системе
1. Типичные металлы – s - элементы: IА - IIА группы (искл.Н)
2. Нетипичные металлы: р-элементы: IIIА гр. (кроме В), IV гр – Ge , Sn , Pb ; V гр.- Sb , Bi ; VI гр.- Po .
3. Переходные металлы: d -элементы – все элементы побочных подгрупп; f - элементы: лантоноиды, актиноиды.
У атомов металлов небольшое количество электронов (ē) на внешнем энергетическом уровне и большие радиусы атомов ( R )
Кристаллическая решетка – металлическая: состоит из чередующихся в пространстве атомов и положительных ионов, внутри-общие электроны– «электронный газ».
Тип химической связи – металлическая.
Металлические (восстановительные) свойства в группе (А п/гр) усиливаются (растет R атома , и электроны легче отрываются), в периоде – ослабляются (растет заряд ядра, электроны внешнего уровня сильнее удерживаются).
Восстановительные свойства уменьшаются (активность металлов уменьшается)
Li, Cs,Rb,K, Ba, Ca, Na, Mg, Al, Mn, Cr, Zn, Fe, Cd, Co, Sn, Ni, Pb, H2, Cu, Ag, Hg, Pt, Au
Физические свойства
Наличие свободных электронов обуславливает:
- Металлический блеск (непрозрачность)-ē отражают световые лучи, большинство металлов в порошкообразном состоянии теряют свой блеск, за исключением алюминия и магния.
- Цвет Большинство металлов светло-серого цвета (Исключение: золото - желтое, медь- красная, цезий - светло-желтый)
- Электропроводность (свободные ē приобретают направленное движение) Лучшие проводники электричества: Cu , Ag , далее Au , Al , Fe. С повышением температуры – электропроводность понижается, т.к. усиливаются колебания атомов, электронам трудно перемещаться.
- Теплопроводность
- Пластичность
- Плотность ( Самый легкий - Li , самые тяжелые - Os и Ir)
- Температура плавления ( самый легкоплавкий - Hg −39 °C , самый тугоплавкий – W 3410 °C )
- Твердость (щелочные металлы можно резать ножом, самый твердый – Cr) Большинство металлов твердые, за исключением ртути и ,условно, франция.
Получение
· Пирометаллургия- получение из руд при высоких температурах при взаимодействии с хорошими восстановителями (H2, CO,C и др.)
Выделяют два этапа: 1) Обжиг металлсодержащей руды; 2) Получение чистого металла
· Металлотермия- восстановление металлами (алюминотермия, кальцийтермия, магнийтермия и т.д.):
· Гидрометаллургия- соединения металлов переводят в раствор и восстанавливают:
· Электрометаллургия – электролиз растворов и расплавов:
Запомнить: Алюминий получают из оксида (глинозема, бокситов и т.д.) в расплаве криолита Na 3 AlF 6
Запомнить: Металлы никогда не вытесняют из Н N О3(к) H 2 SO 4(к) водород; они пассивируют Al , Cr , Fe
в) Взаимодействие с солями ( более активные металлы вытесняют менее активные из растворов их солей )
CuCl 2 + Fe = FeCl 2 + Cu;
- но если металл взаимодействует с водой, то
CuCl 2 +2К +2 H 2 O = 2К Cl + Cu (ОН)2↓+ Н2↑; т.к.: 1) 2К + 2 H 2 O = 2КОН+ Н2
2) CuCl 2 +2КОН= Cu (ОН)2↓+ 2К Cl
г) Взаимодействуют с оксидами металлов и неметаллов:
е)Другое:
Между собой образуют интерметаллические соединения, сплавы: Na 2 Sb
С органическими веществами ( со спиртами, фенолами, карбоновыми кислотами и др. )
Химические свойства металлов

Свойства металлов начинают изучать на уроках химии в 8–9 классе. В этом материале мы подробно разберем химические свойства этой группы элементов, а в конце статьи вы найдете удобную таблицу-шпаргалку для запоминания.
О чем эта статья:
8 класс, 9 класс, ЕГЭ/ОГЭ
Металлы — это химические элементы, атомы которых способны отдавать электроны с внешнего энергетического уровня, превращаясь в положительные ионы (катионы) и проявляя восстановительные свойства.
В окислительно-восстановительных реакциях металлы способны только отдавать электроны, являясь сильными восстановителями. В роли окислителей выступают простые вещества — неметаллы (кислород, фосфор) и сложные вещества (кислоты, соли и т. д.).
Металлы в природе встречаются в виде простых веществ и соединений. Активность металла в химических реакциях определяют, используя электрохимический ряд, который предложил русский ученый Н. Н. Бекетов. По химической активности выделяют три группы металлов.
Ряд активности металлов
Металлы средней активности
Общие химические свойства металлов
Взаимодействие с неметаллами
Щелочные металлы сравнительно легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность:
оксид образует только литий
натрий образует пероксид
калий, рубидий и цезий — надпероксид
Остальные металлы с кислородом образуют оксиды:
2Zn + O2 = 2ZnO (при нагревании)
Металлы, которые в ряду активности расположены левее водорода, при контакте с кислородом воздуха образуют ржавчину. Например, так делает железо:
С галогенами металлы образуют галогениды:
Медный порошок реагирует с хлором и бромом (в эфире):
При взаимодействии с водородом образуются гидриды:
Взаимодействие с серой приводит к образованию сульфидов (реакции протекают при нагревании):
Реакции с фосфором протекают до образования фосфидов (при нагревании):
Основной продукт взаимодействия металла с углеродом — карбид (реакции протекают при нагревании).
Из щелочноземельных металлов с углеродом карбиды образуют литий и натрий:
Калий, рубидий и цезий карбиды не образуют, могут образовывать соединения включения с графитом:
С азотом из металлов IA группы легко реагирует только литий. Реакция протекает при комнатной температуре с образованием нитрида лития:
Взаимодействие с водой
Все металлы I A и IIA группы реагируют с водой, в результате образуются растворимые основания и выделяется H2. Литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом:
Металлы средней активности реагируют с водой только при условии, что металл нагрет до высоких температур. Результат данной реакции — образование оксида.
Неактивные металлы с водой не взаимодействуют.
Взаимодействие с кислотами
Если металл расположен в ряду активности левее водорода, то происходит вытеснение водорода из разбавленных кислот. Данное правило работает в том случае, если в реакции с кислотой образуется растворимая соль.
2Na + 2HCl = 2NaCl + H2
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.


Металлы IА группы:
Металлы IIА группы
Такие металлы, как железо, хром, никель, кобальт на холоде не взаимодействуют с серной кислотой, но при нагревании реакция возможна.
Взаимодействие с солями
Металлы способны вытеснять из растворов солей другие металлы, стоящие в ряду напряжений правее, и могут быть вытеснены металлами, расположенными левее:
Zn + CuSO4 = ZnSO4 + Cu
На металлы IА и IIА группы это правило не распространяется, так как они реагируют с водой.
Реакция между металлом и солью менее активного металла возможна в том случае, если соли — как вступающие в реакцию, так и образующиеся в результате — растворимы в воде.
Взаимодействие с аммиаком
Щелочные металлы реагируют с аммиаком с образованием амида натрия:
Взаимодействие с органическими веществами
Металлы IА группы реагируют со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
Также они могут вступать в реакции с галогеналканами, галогенпроизводными аренов и другими органическими веществами.
Взаимодействие металлов с оксидами
Для металлов при высокой температуре характерно восстановление неметаллов или менее активных металлов из их оксидов.
3Са + Cr2O3 = 3СаО + 2Cr (кальциетермия)
Вопросы для самоконтроля
С чем реагируют неактивные металлы?
С чем связаны восстановительные свойства металлов?
Верно ли утверждение, что щелочные и щелочноземельные металлы легко реагируют с водой, образуя щелочи?
Методом электронного баланса расставьте коэффициенты в уравнении реакции по схеме:
Mg + HNO3 → Mg(NO3)2 + NH4NO3 + Н2O
Как металлы реагируют с кислотами?
Подведем итоги
От активности металлов зависит их химические свойства. Простые вещества — металлы в окислительно-восстановительных реакциях являются восстановителями. По положению металла в электрохимическом ряду можно судить о том, насколько активно он способен вступать в химические реакции (т. е. насколько сильно у металла проявляются восстановительные свойства).
Напоследок поделимся таблицей, которая поможет запомнить, с чем реагируют металлы, и подготовиться к контрольной работе по химии.
Таблица «Химические свойства металлов»
Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb
Cu, Hg, Ag, Pt, Au
Восстановительная способность металлов в свободном состоянии
Возрастает справа налево
Взаимодействие металлов с кислородом
Быстро окисляются при обычной температуре
Медленно окисляются при обычной температуре или при нагревании
Взаимодействие с водой
Выделяется водород и образуется гидроксид
При нагревании выделяется водород и образуются оксиды
Водород из воды не вытесняют
Взаимодействие с кислотами
Вытесняют водород из разбавленных кислот (кроме HNO3)
Не вытесняют водород из разбавленных кислот
Реагируют с концентрированными азотной и серной кислотами
С кислотами не реагируют, растворяются в царской водке
Взаимодействие с солями
Не могут вытеснять металлы из солей
Более активные металлы (кроме щелочных и щелочноземельных) вытесняют менее активные из их солей
Взаимодействие с оксидами
Для металлов (при высокой температуре) характерно восстановление неметаллов или менее активных металлов из их оксидов
Презентация "Составление уравнений реакций, решение задач по теме "Химические свойства металлов"


Цели работы по данной обучающей программе
Необходимо знать:
классы неорганических соединений, с которыми металлы вступают в химические реакции;
продукты, которые получаются при протекании химической реакции;
вклад каких процессов, протекающих с выделением или поглощением энергии, определяет положение каждого элемента в электрохимическом ряду напряжений металлов
Необходимо уметь:
составлять молекулярные формы уравнений химических реакций, полную и краткую ионные формы уравнений реакций, протекающих в растворах;
определять окислитель, восстановитель в окислительно-восстановительных уравнениях реакций;
подбирать коэффициенты в уравнениях реакций методом электронного баланса;
выполнять расчеты по уравнениям химических реакций.

Классификация химических реакций
Химическая форма движения материи сложна, поэтому не существует единой классификации химических реакций. Реакции подразделяют на группы по различным признакам. В данном случае мы остановимся на классификации химических реакций, когда основанием классификации будут являться следующие признаки:
количество исходных веществ и продуктов реакции, состав веществ;
изменяются или остаются постоянными степени окисления элементов.

Классификация химических реакций
Если основание классификации «количество исходных веществ и продуктов реакции, состав веществ», то выделяют следующие типы химических реакций:
реакции соединения – это такие реакции, в результате которых из одного или нескольких исходных веществ образутся одно сложное вещество
2Fe + 3Cl2 = 2FeCl3
реакции разложения – это такие реакции, в результате которых из одного сложного вещества образуется два и более новых веществ
2Fe(ОН)3 = Fe2О3 + 3Н2О

Классификация химических реакций
реакции замещения – это такие реакции, в результате которых атомы простого вещества замещают атомы одного из химических элементов в сложном веществе
Zn + Н2О = ZnО + Н2 ↑
реакции обмена – это реакции, в результате которых два сложных вещества обмениваются своими составными частями
FeCl2 + 2AgNO3 = Fe(NO3)2 + 2AgCl↓

Классификация химических реакций
Если основание классификации «значение степени окисления элементов», то реакции бывают
окислительно-восстановительные – реакции в результате которых происходит изменение степеней окисления атомов химических элементов или ионов, образующих реагирующие вещества
Zn + 2HCl = ZnCl2 +H2↑
0 0
Zn + 2H+ = Zn2+ + H2 ↑
не окислительно-восстановительные (например, реакции ионного обмена)

Алгоритм подбора коэффициентов в окислительно-восстановительных уравнениях реакций
Под восстановлением понимают процесс присоединения электронов атомами, или молекулами. Степень окисления при этом понижается.
+2 0 +2
Сu + 2e → Сu Сu - окислитель
Атомы, ионы или молекулы, принимающие электроны, называют окислителями.
Под окислением понимают процесс отдачи электронов атомами, ионами или молекулами.
0 +2 0
Сu - 2e → Сu Сu - восстановитель
Атомы, ионы или молекулы, отдающие электроны, называют восстановителями.

Алгоритм подбора коэффициентов в окислительно-восстановительных уравнениях реакций
В окислительно-восстановительных реакциях число электронов, отдаваемых восстановителем, равно числу электронов, принимаемых окислителем, т.е. соблюдается электронный баланс. Метод электронного баланса применяют для записей электронных уравнений процессов окисления и восстановления.
Например, реакцию алюминия с хлоридом меди (II) описывают схемой:
+2 -1 0 +3 -1 0
Cu Cl2 + Al → AlCl3 + Cu
а электронные уравнения будут иметь вид:
+2 восстановление 0
Cu + 2e → Cu 3
окислитель
0 окисление +3
Al -3e → Al 2
восстановитель
Молекулярное уравнение этой реакции написать уже несложно, так как коэффициенты для него будут взяты из электронных уравнений:
3Cu Cl2 + 2Al → 2AlCl3 + 3Cu

Алгоритм решения задач
При решении задач следует соблюдать следующий порядок действий:
прочитать условие задачи;
записать данные задачи в тетрадь;
составить уравнение реакции, по которому необходимо провести расчет;
если в условии задачи дана масса вещества, или объем, то необходимо найти соответствующие значения количества вещества;
над уравнением реакции над соответствующим веществом поставить значение количества вещества и x (неизвестное) над веществом, для которого необходимо определить неизвестную величину;
под уравнением реакции под соответствующим веществом поставить значение количества вещества в соответствии с коэффициентом реакции и под веществом, для которого необходимо определить неизвестную величину, также поставить количество вещества в соответствии с коэффициентом реакции;
составить пропорцию;
определить неизвестное количество вещества x ;
найти необходимую величину.

Основные формулы для определения количества вещества
n – количество вещества (моль);
m – масса (г);
M – молярная масса (г/моль);
N – число молекул;
NA= 6*10231/моль – постоянная Авогадро
V – объем (л)
VM= 22,4 л/моль (при нормальных условиях) –молярный объем газа

Пример решения задачи
Задача. Определите объем водорода, который выделится при взаимодействии 0,23 г натрия с водой.
Дано: Решение:
m(Na)=0,23 г
0,01 моль х
V(Н2) = ? 2Na + 2Н2О = 2NaОН + Н2
2 моль 1 моль
n= m / M; М (Na) = 23 г/моль;
n(Na) = 0,23г / 23 г/моль = 0,01 моль;
V = VM * n; V (Н2) = 22,4 л/моль * 0,01 моль = 0,224 л
Ответ: V (Н2) = 0,224 л

Строение атомов металлов.
Металлическая связь.
Металлическая кристаллическая решетка
Если в периодической системе мысленно провести диагональ от водорода к астату, то левее и ниже окажутся элементы главных подгрупп, у которых преобладают металлические свойства. Металлические свойства характерны также для всех элементов побочных подгрупп.
К металлам принадлежат почти все s- элементы, многие p-элементы, все d- и f-элементы. Общим для строения атомов металлов является наличие на наружном энергетическом уровне электронной оболочки небольшого числа электронов (1-3), слабо связанных с ядром.
Металлическая химическая связь осуществляется за счет взаимного притяжения положительно заряженных атом-ионов и отрицательно заряженных свободно движущихся электронов.
Упаковка атом-ионов в кристалле может быть разной: плотнейшую гексогональную кристаллическую решетку имеют бериллий, магний, цинк; плотную кубическую гранецентрированную имеют алюминий, медь, серебро, свинец, золото; кубическую объемноцентрированную имеют натрий, железо, ванадий.
Общность в физических свойствах связана с наличием в кристаллах свободно движущихся электронов.

Общие химические свойства металлов
На внешнем энергетическом уровне атомов металлов находится от одного до трех электронов, которые атомы металлов отдают в ходе протекания химических реакций и превращаться в положительно заряженные ионы, т.е. металлы в реакциях являются восстановителями.

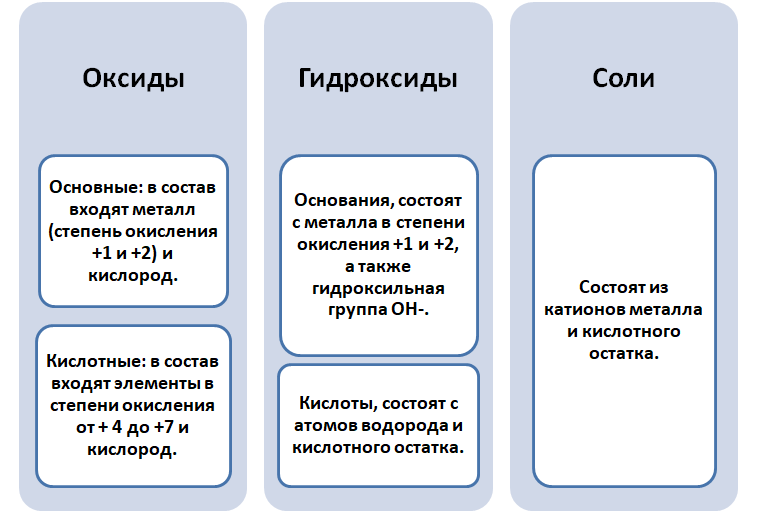
Схема генетической связи между классами неорганических соединений
МЕТАЛЛЫ
Взаимопревращения между классами веществ
Наверняка у каждого из Вас есть семейный альбом, где есть фото родителей, бабушек, дедушек, прабабушек. А возможно у кого-то есть сведения о предках не одного поколения, и это всё отображается в виде генетического дерева. Правомерный вопрос, к чему эти сведения и химия? Однако и в химии есть, так называемые, прародители (металлы и неметаллы), с которых путём химических превращений, были получены новые классы соединений и между ними существует генетическая связь.
План урока:
Почему связь между классами веществ считается генетической
Чтобы разобраться в этом вопросе. Вспомним состав классов веществ, с которыми Вы познакомились на предыдущих занятиях.
Обратите внимание, что соли содержат в себе частицы как оснований (атомы металла), так и кислот (кислотных остатков). Если соль рассматривать как «венец» превращений, то давайте, попытаемся прийти к истокам. Всё начинается с простого, точнее металла и неметалла, как простых веществ.
Попробуем построить генетический ряд металлов, переходя от одного класса к другому.
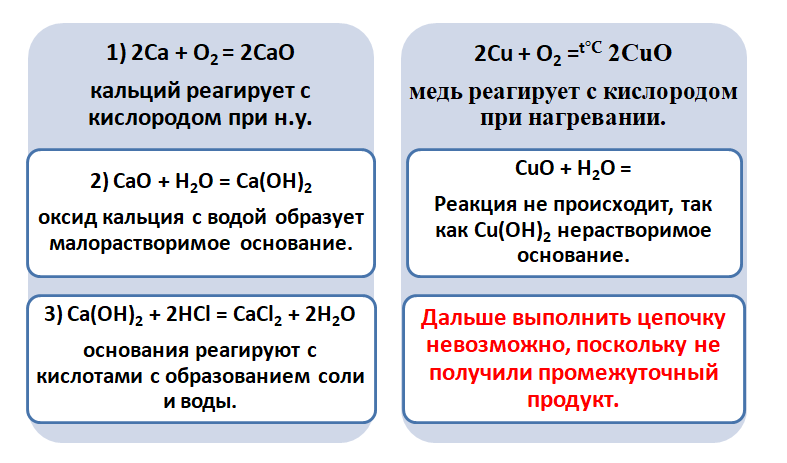
Возьмём, к примеру, металлы кальций и медь, подставив их в цепочку уравнений.
Обратите внимание, что данные металлы отличаются своей реакционной способностью.
Получается, эта генетическая связь соединений присуща только для активных металлов, оксиды которых, реагируя с водой, дают продукт в виде щёлочи.
Для металлов, которые отличаются малой активностью, переход от вещества, находящегося в простом состоянии, к соли, происходит путём превращений.
Поскольку основные оксиды реагируют с металлами (более активными, чем металлы, которые входят в состав оксида), то эту схему можно сократить.
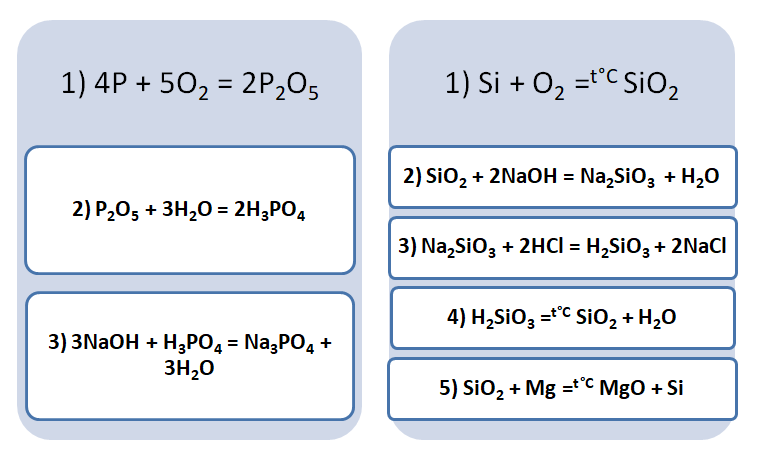
Аналогичным способом можно составить генетический ряд неметаллов, начиная от неметалла заканчивая солью или неметаллом.
Подставим в цепочку уравнений фосфор и кремний.
А возможны иные пути решения данных цепочек уравнений. Способы получения кислотных оксидов реализуются путём взаимодействия простых веществ с кислородом. А вот не с каждого оксида можно получить ему соответствующую кислоту, путём прибавления воды. Поскольку кремниевая кислота нерастворима в воде, то необходимо получить сначала соль, а потом уже и кислоту.
В данном решении предлагается добыть соль Na3PO4, взаимодействием основания и кислоты. Однако можно использовать и другие варианты, которые также будут верны.
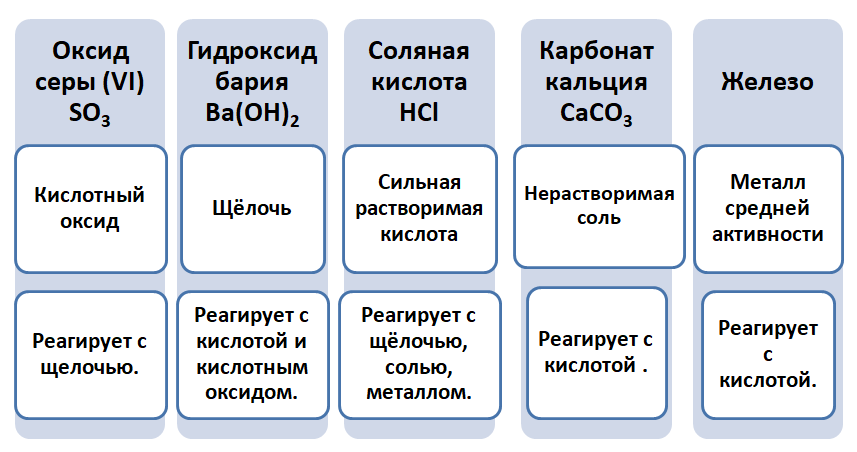
Если объединить генетические ряды металлов и неметаллов, получим дружную семью неорганических соединений, где каждое вещество связано неразрывной нитью с другими классами. Таблица 1.
Данная таблица отображает, как реагируют между собой вещества и какие продукты возможны, вследствие реакции.
Промоделируем на примере: В вашем распоряжении имеются следующие вещества: оксид серы (VI), гидроксид бария, соляная кислота, карбонат кальция и железо. Ваша задача спрогнозировать, между какими соединениями возможна реакция и, записать, соответствующие уравнения реакций.
Подтвердив свои прогнозы молекулярно-ионными уравнениями в сокращённом и полном виде.
Родственные связи между металлами и неметаллами
Кислород является типичным представителем неметаллов. Он является достаточно сильным окислителем, перед которым может устоять только фтор. Получение основных оксидов происходит путём взаимодействия кислорода и металлов. Однако не все металлы охотно с ним реагируют. Щелочные реагируют бурно, именно поэтому их хранение осуществляется под слоем керосина. Необходимо заметить, что щелочные металлы не образуют оксиды во время взаимодействия с О2. Их чрезвычайная активность позволяет получать только для их характерные продукты, это будут пероксиды и надпероксиды (за исключением лития, продукт Li2O).
А вот, чтобы менее активные металлы – железо или медь прореагировали, необходимо нагревание.
Получение кислотных оксидов происходит аналогично взаимодействием неметаллов с О2.
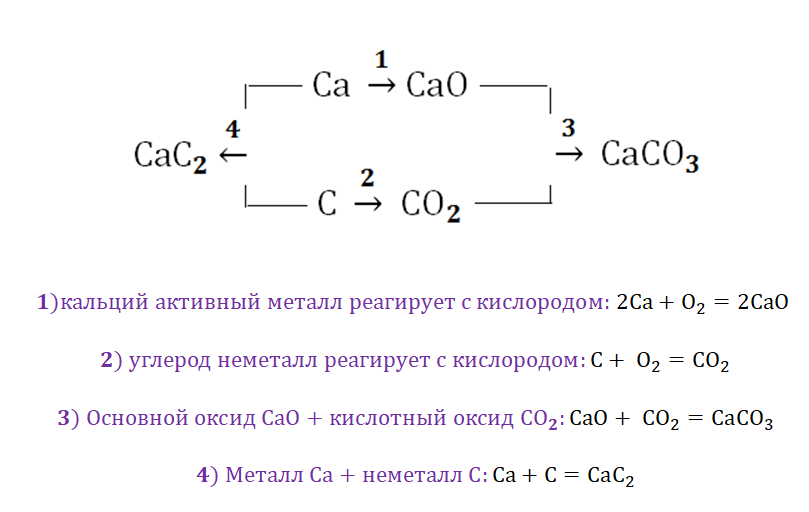
Металлы и неметаллы в химии рассматриваются как противоположности, которые, как заряды (положительные и отрицательные) имеют свойства притягиваться. Рассмотрим на примере металла кальций и неметалла углерод.
Соль СаСО3 имеет истоки от простых веществ Са и С, промежуточным звеном являются оксиды этих веществ, для которых свойственно реагировать между собой.
Вспомним с Вами один с основных постулатов химии, а именно, закон постоянства состава вещества.
Представим, что мы с Вами химики-первооткрыватели и нам предстоит сложная задача получить азотную кислоту, которая имеет важную роль в химической промышленности. Получение кислот возможно несколькими способами. Обращаясь к таблице 1, делаем вывод, что нам доступно несколько способов, а именно.
Взаимодействие кислот с солями приведёт нас к желаемому результату, однако не забывайте, что в продукте должны увидеть газ, осадок либо окрашивание.
Способы получения средних солей доказательно показывают связь между веществами. Снова выручалочкой нам послужит таблица 1. Наша задача получить вещество, без которого, полагаем, Вы не представляете своё существование, это соль NaCl. Используя данные, видим, что доступно для её получения 4 способа (Вы ищете, где продуктом является соль и применяете данные на свой пример).
Рассмотрим подробно каждый с них.
Способы получения солей отличаются, причиной этому является то, какую именно соль мы хотим получить, кислородсодержащей,сильной или слабой кислоты. К примеру, получение Na2SO4 будет отличаться от предыдущего примера с NaCl. Количество способов будет больше, так как это соль кислородсодержащей кислоты.
Здесь следуют отметить особенность щелочных, а также щелочно-земельных металлов, для которых свойственно взаимодействие с водой. По сути, идёт два параллельных процесса.
Полученная щёлочь реагирует с кислотой.
Способы получения солей аммония несколько отличаются, от солей металлов, тем, что аммиак непосредственно реагирует с кислотами (смотри урок химическая связь) с образованием донорно-акцепторных связей.
Гидроксид аммония имеет способность взаимодействовать с кислотами, с образованием необходимого продукта, не иначе как солей аммония.
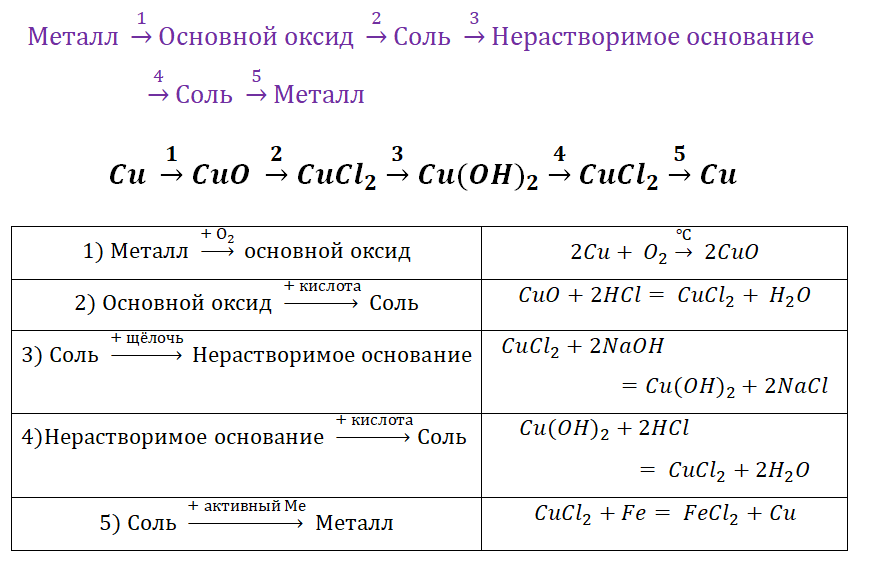
Наверняка некоторые из Вас пугал вид заданий, который был цепочек уравнений. Обобщая всё выше сказанное, рассмотрим несколько примеров.
Чтобы справится с данной задачей, проанализируем условие. Первое, что необходимо выделить – это количество уравнений (смотрим по стрелочкам, их 5). Второе определим исходное вещество – цинк, металл средней силы. Чтобы получить с него соль (не забываем о таблице 1), можно использовать 3 способа:
Выбор за Вами, одного из трёх уравнений. Переходим к следующей части цепочки ZnCl2 → Zn(OH)2. Здесь решением будет один вариант, это прибавление щёлочи.
Zn(OH)2 относится к нерастворимым основанием, поэтому при нагревании распадаются.
И наконец, итоговый продукт, металл. Его необходимо выделить из соли. Для этого необходимо взять металл, сила которого будет больше. Если эту информацию забыли, то освежить эти данные сможете с помощью урока Соли и их свойства.
Решение цепочек химических уравнений на первый взгляд кажется не посильной задачей, но если внимательно изучить свойства веществ, то они кажутся не такими уж и сложными.
Взаимопревращение между классами веществ
Обобщая сведения о свойствах неорганических соединений, составим схему 1. Взаимосвязь между классами неорганических веществ.
Эта схема и таблица 1 будут служить Вам волшебной палочкой в изучении неорганической химии.
Урок №48. Химические свойства металлов. Ряд активности (электрохимический ряд) металлов
Химические свойства металлов определяются их активностью. Простые вещества – металлы в химических реакциях всегда являются восстановителями . Положение металла в ряду активности характеризует то, насколько активно данный металл способен вступать в химические реакции (т. е. то, насколько сильно у него проявляются восстановительные свойства).
Среди металлов традиционно выделяют несколько групп.
благородные металлы (серебро, золото, платина, иридий);
щелочные металлы – I(A) группа ;
щелочноземельные металлы – II(A) группа , кроме Be, Mg.
Металлы встпают в реакции с простыми веществами – неметаллами (кислород, галогены, сера, азот, фосфор и др.) и сложными веществами (вода, кислоты, растворы солей)
Взаимодействие с простыми веществами-неметаллами
1. Металлы взаимодействуют с кислородом, образуя оксиды:
4Li + O 2 = обыч. усл . = 2Li 2 O
2Mg + O 2 = t, °C = 2MgO
Серебро, золото и платина с кислородом не реагируют
2. Металлы взаимодействуют с галогенами (фтором, хлором, бромом и йодом), образуя галогениды – Ме +n Г -1 n
2Na + Cl 2 = 2NaCl
3. Металлы взаимодействуют с серой, образуя сульфиды.
4. Активные металлы при нагревании реагируют с азотом, фосфором и некоторыми другими неметаллами.
3Na + P = t, °C = Na 3 P
Взаимодействие со сложными веществами
I. Взаимодействие воды с металлами
1). Взаимодействие с самыми активными металлами, находящимися в периодической системе в I(А) и II(А) группах (щелочные и щелочноземельные металлы) и алюминий . В результате образуются основание и газ водород .
Me + H 2 O = Me(OH) n + H 2 (р. замещения)
Внимание! Алюминий и магний ведут себя также:
Магний (в горячей воде):
2) Взаимодействие воды с менее активными металлами, которые расположены в ряду активности от алюминия до водорода.
Металлы средней активности, стоящие в ряду активности до (Н 2 ) – Be, Fe, Pb, Cr, Ni, Mn, Zn – реагируют с образованием оксида металла и водорода
Me + Н 2 О = Ме х О у + Н 2 (р. замещения)
Бериллий с водой образует амфотерный оксид:
Be + H 2 O = t°C = BeO + H 2
Раскалённое железо реагирует с водяным паром, образуя смешанный оксид — железную окалину Fe 3 O 4 и водород:
3) Металлы, стоящие в ряду активности после водорода, не реагируют с водой.
Cu + H 2 O ≠ нет реакции
II. Взаимодействие растворов кислот с металлами
Металлы, стоящие в ряду активности металлов левее водорода, взаимодействуют с растворами кислот ( раствор азотной кислоты – исключение ), образуя соль и водород.
Кислота (раствор) + Me до (Н2) = Соль + H 2 ↑
III. Взаимодействие кислот-окислителей с металлами
Металлы особо реагируют с серной концентрированной и азотной кислотами:
H 2 SO 4 (конц.) + Me = Сульфат + H 2 O + Х
HNO 3 + Me = Нитрат + H 2 O + Х
4Zn + 10HNO 3 (раствор горячий) = t˚C = 4Zn(NO 3 ) 2 + N 2 O + 5H 2 O
4Zn + 10HNO 3 (оч. разб. горячий) = t˚C = 4Zn(NO 3 ) 2 + NH 4 NO 3 + 3H 2 O
IV. С растворами солей менее активных металлов
Ме + Соль = Новый металл + Новая соль
Активность металла в реакциях с кислотами, водными растворами солей и др. можно определить, используя электрохимический ряд, предложенный в 1865 г русским учёным Н. Н. Бекетовым: от калия к золоту восстановительная способность (способность отдавать электроны) уменьшается, все металлы, стоящие в ряду левее водорода, могут вытеснять его из растворов кислот; медь, серебро, ртуть, платина, золото, расположенные правее, не вытесняют водород.
Читайте также: