Чем отличаются металлы от неметаллов по физическим свойствам
Обновлено: 04.10.2024
Наш мир наполняют различные простые вещества – металлы или неметаллы. При существовании 120 химических элементов, Вселенную наполняют более 400 простых веществ. Этот парадокс связан с понятием аллотропии – явлением образования одним химическим элементом двух и более простых веществ. Например, атом кислорода может формировать молекулярный кислород О2 и озон О3.
План урока:
Физические свойства металлов
Металлы – химические элементы, атомы которых в процессе реакции стремятся отдавать электроны. Они обладают металлической кристаллической решеткой и общими физическими свойствами. На данный момент известно более 87 металлов.
Для металлов характерен ряд свойств:
- твердость (кроме ртути, которая представляет собой жидкость);
- металлический блеск;
- проводимость электрического тока и тепла;
- пластичность.
Металлы при ударах не разрушаются, а меняют форму. С этой особенностью связано то, что из них производят проволоку, металлические листы и др. Развитие бронзового и железного века связано с производством товаров из металлов.
Физические свойства неметаллов
Неметаллы – химические элементы, атомы которых стремятся принять чужие электроны. Для них характерны атомные и молекулярные кристаллические решетки. Для атомов неметаллов не характерны общие физические свойства. На данный момент существует 22 неметалла.
Для неметаллов характерен ряд свойств:
- хрупкость (неметаллы нельзя ковать);
- отсутствие блеска;
- непроводимость электрического тока и тепла.
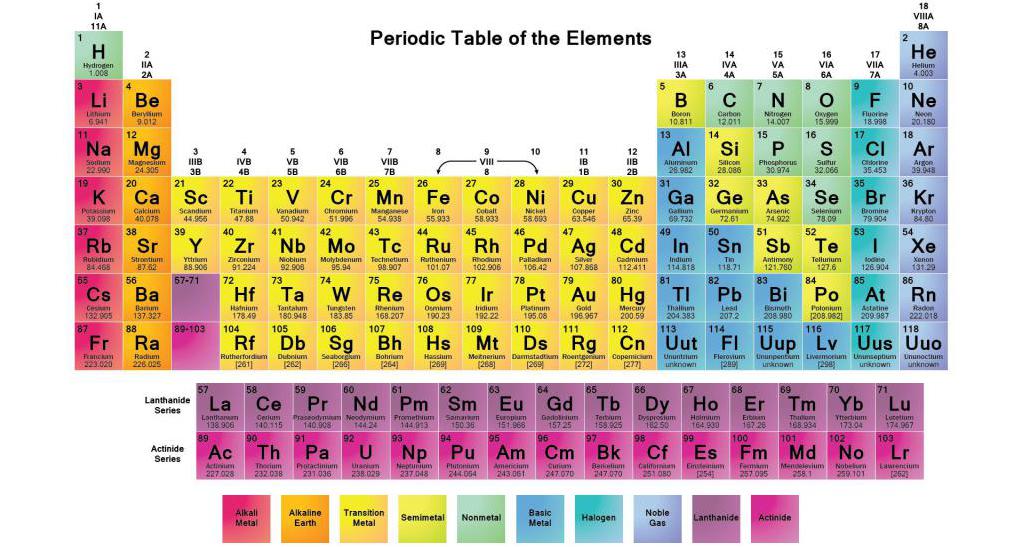
Расположение металлов и неметаллов в периодической таблице Д.И. Менделеева
Определить, является простое вещество металлом или неметаллом, можно с помощью периодической таблицы Менделеева. Металлы располагаются ниже диагонали «водород-бор- кремний-мышьяк-теллур-астат», а неметаллы выше.
Красные ячейки – неметаллы, синие – металлы
Элементы, расположенные вблизи диагонали, обладают смешанными свойствами: проявляют как металлические, так и неметаллические свойства. Они называются полуметаллами.
Красные ячейки – полуметаллы
Полуметаллы имеют ковалентную кристаллическую решетку при наличии металлической проводимости (электропроводности). Валентных электронов у них либо недостаточно для образования полноценной ковалентной связи, либо они не удерживаются достаточно прочно из-за больших размеров атома. Поэтому связь в ковалентных кристаллах этих элементов имеет частично металлический характер.
Закономерности в таблице Д.И. Менделеева
Каждый атом состоит из протонов, нейтронов и электронов. Протоны и нейтроны находятся в ядре, который несет положительный заряд. Вокруг ядра движутся отрицательно заряженные электроны. Атомный номер указывает на количество протонов.
Чем больше заряд ядра, тем сильнее к нему притягиваются электроны. Т.о., атому сложнее отдавать электроны. Поэтому в периоде слева направо, с увеличением порядкового номера металлические свойства ослабевают, а неметаллические – усиливаются.
Неметаллы стремятся принять электроны от других атомов. Период в таблице указывает на количество электронных уровней. По мере увеличения числа орбиталей электроны отдаляются от ядра и атому сложнее удерживать электроны на последних уровнях. Т.о., в группе сверху вниз количество орбиталей возрастает, поэтому металлические свойства усиливаются, а неметаллические – уменьшаются.
Способы получения металлов
Большую часть металлов получают из оксидов при нагревании.
Металлы, имеющие на внешнем уровне один-два электрона, получают с помощью электролиза расплавов.
Химические свойства металлов
Все металлы проявляют восстановительные свойства. Легкость в отдачи внешнего электрона применяется в фотоэлементах. Степень активности определяется рядом активности. У самых активных на внешнем уровне располагается по одному электрону.
Общие химические свойства металлов выражаются в реакциях со следующими соединениями.
Активные металлы реагируют с галогенами и кислородом. С азотом взаимодействуют только литий, кальций и магний. Большинство металлов при взаимодействии с кислородом образуют оксиды, а наиболее активные металлы – пероксиды (N2O2).
2 Ca + MnO2 → 2 CaO + Mn(нагревание)
Водород в кислотах вытесняют только те металлы, которые в ряду напряжений стоят до водорода.
Более активные металлы вытесняют из соединений менее активные.
- Химические свойства щелочных и щелочно-земельных металлов (реакции с водой)
2 Na + 2 H2O → 2 NaOH + H2
Способы получения неметаллов
Неметаллы синтезируют из природных соединений с помощью электролиза.
2 KCl → 2 K + Cl2
Также неметаллы получают в результате окислительно-восстановительных реакций.
SiO2 + 2 Mg → 2 MgO + Si
Химические свойства неметаллов
Неметаллы проявляют окислительные свойства. Самый активный неметалл – фтор. Он бурно реагирует со всеми веществами, а некоторые реакции сопровождаются горением и взрывом. В атмосфере фтора горят даже вода и платина. Фтор окисляет кислород и образует фторид кислорода OF2.
Неметаллы вступают в реакции со следующими веществами.
3 F + 2 Al → 2 AlF3 (нагревание)
S + Fe →FeS (нагревание)
Меньшей активностью обладают такие неметаллы как бор, графит, алмаз. Они могут проявлять восстановительные свойства.
2 C + MnO2 → Mn + 2 CO
Коррозия металла
Коррозия – это процесс разрушения металлов или металлических конструкций под действием кислорода, воды и вредных примесей. Не все металлы подвергаются коррозии. Их стойкость зависит от ряда факторов.
- На благородных металлах не образуется коррозия.
- На поверхности алюминия, титана, цинке, хрома и никеля есть оксидная пленка, которая предотвращает процессы коррозии.
Различают несколько видов коррозии – химическую и электрохимическую.
Химическая коррозия
Химическая коррозия сопровождается химическими реакциями. Она образуется под действием газов.
Электрохимическая коррозия
Электрохимическая коррозия – процесс разрушения металлов или металлических конструкций, который сопровождается электрохимическими реакциями. В большинстве металлов находятся примеси. В процессе коррозии электродами могут служить не только металлы, но и его примеси.
Например, в железе могут находиться примеси олова. В этом случае на аноде электроны переносятся от олова к железу и металлы растворяются, т.е. железо подвергаются коррозии. На катоде восстанавливается водород из воды или растворенного кислорода. Электрохимическая коррозия может сопровождаться следующими процессами.
Анод: Fe 2+ - 2e → Fe 0
Катод: 2H + + 2e → H2
Способы защиты от коррозии
В промышленности популярны различные методы защиты металлов от коррозии.
Покрытия защищают поверхности от действия окислителей. Ими служат различные вещества:
- покрытие менее активным металлом (железо покрывают оловом);
- краски, лаки, смазки.
- Создание специальных сплавов
Физические свойства сплавов и чистых металлов отличаются. Поэтому для повышения стойкости в сплав необходимо добавить дополнительные металлы.
Биологическая роль металлов и неметаллов
В организмах содержится множество различных металлов и неметаллов. Различных химических элементов в организме может не хватать, поэтому приходится потреблять их извне.Химические элементы можно разделить на две большие группы – макроэлементы и микроэлементы.
К макроэлементам относятся вещества, содержание которых в организме превышает 0,005 %. Эта группа включает водород, углерод, кислород, азот, натрий, магний, фосфор, сера, хлор, калий, кальций.Микроэлементы – элементы, содержание которых не превышает 0,005%. К ним относятся железо, медь, селен, йод, хром, цинк, фтор, марганец, кобальт, молибден, кремний, бром, ванадий, бор. Каждый макро- и микроэлемент в организме выполняет определенную функцию.
Применение металлов и неметаллов
В синтезе химических препаратов и лекарств применяются чистые металлы и неметаллы. В органической химии металлы используются в качестве катализаторов, а также при получении металлорганических соединений. Неметаллы служат исходным сырьем для получения чистых кислот и других химических соединений.
Металлы и неметаллы
Чем металлы отличаются от неметаллов - особенности, свойства и характеристики
В повседневной жизни человек взаимодействует с множеством веществ. Все элементы можно классифицировать по физическим и химическим качествам. В статье рассмотрим, чем отличаются металлы от неметаллов, их свойства и понятие.
Определение металла и его свойства
Каждый день мы имеем дело с металлами и это неспроста. Большинство элементов таблицы Менделеева являются ими. Все они имеют свои характеристики и свойства.
Как правило, металлы — это такие элементы, которые хорошо проводят тепло и электричество. Также металлы очень пластичны, что позволяет изменять их форму путем ковки, еще они имеют высокий коэффициент твердости. Отличительной особенностью этого элемента является блеск, который называется металлическим. Свойства металла делятся на две основные фракции, такие как:
- Физические свойства.
- Химические свойства.
Чем металлы отличаются от металлов по физическим характеристикам? К физическим свойствам относится:
- Цвет. Металлы, как правило, имеют плотную структуру, которая не пропускает сквозь себя свет. А их цвет определяется отражением света от его поверхности. Так, металлы в большинстве случаев имеют расцветку от серого до серебристого. Но есть и исключения, как, например, медь, которая имеет красный цвет, и золото, имеющее желтый окрас.
- Состояние формы, твердость и плотность. Сами по себе металлы имеют твердое агрегатное состояние, но способны переходить в жидкое при высоких температурах. Так, металлы плавятся при температуре от 40 до 3400 градусов по Цельсию. Но встречаются металлы, чье основное агрегатное состояние - жидкое. К таким элементам относят ртуть.
- Электропроводимость. Особенностью является ее снижение при повышении температуры вещества.
- Теплопроводность и температура кипения/плавления.
Чем металлы отличаются от металлов по химическим свойствам? В этой группе выделяют:
- Окисляемость. Также металлы окисляются, и оксидная пленка на поверхности может придать им другой оттенок.
- Вступление в реакцию с неметаллами, кислотами, водой, солями.

Чем металлы отличаются друг от друга
Многие не знают, чем металлы отличаются от металлов. Их различия можно классифицировать:
- Металлы между собой отличаются по цвету, как, например, золото и медь.
- Также металлы плавятся при разных температурах. Некоторые металлы, например, олово и свинец, можно расплавить в домашних условиях, а вот для остальных нужна более высокая температура.
- Между собой металлы делятся на две группы: тяжелые и легкие. К тяжелым металлам относятся те, чья плотность составляет от 5 г/см 3 , легкие металлы имеют плотность меньше 5 г/см 3 . К легким металлам относится литий, который имеет плотность 0.2 г/см 3 , место самого тяжелого металла делят между собой осмий и иридий. Их плотность составляет 22.6 г/см 3 .
- Металлы отличаются друг от друга пластичностью и электропроводность. Некоторые из них очень пластичны. К примеру, из всего лишь 1 грамма золота можно сделать тонкую проволоку в 3.5 километра. Она будет гибкой и не сломается. Повторить такое с менее пластичным металлом не получится.
- Также часть металлов проводит ток лучше, чем другие. Самыми электропроводными металлами признаны медь, серебро и алюминий. Их наиболее часто применяют в качестве проводящих элементов.
Чем неметаллы отличаются от металлов
Неметаллами принято называть элементы, которые имеют неметаллические свойства. Чем отличаются металлы от неметаллов? Рассмотрим подробнее:
- Форма. Так неметаллы имеют три агрегатных состояния: жидкое, твердое и газообразное.
- Электропроводимость. Неметаллы не проводят ток как металлы, имеют более низкую теплопроводность.
- Зрительные отличия. Металл легко отличить визуально от неметалла, так как первый имеет металлический блеск. К неметаллам относятся такие элементы как бром, сера и водород.
- Химическое строение. Также легко отличить их и по строению. Металлы имеют четкую кристаллическую решетку. У неметаллов строение ионное.
- Вступление в реакции. Неметаллы имеют большее число незанятых электронов, находящихся на внешних уровнях. Именно это позволяет им иметь высокую окислительную способность по сравнению с металлами.

Чем дерево похоже на металл и в чем их отличия
Дерево — это растительное сырье. Металл же это результат природного химического соединения. Чем отличается дерево от металла:
- Древесина не проводит электричество и возгорается при довольно низкой температуре по сравнению с металлами.
- Древесина не плавится при воздействии высоких температур.
- Также дерево плохо проводит тепло, в отличие от металлов.
- Древесина упругая, но не гибкая. Металлы же имеют более низкий коэффициент упругости, но они более пластичны. Так сложить пополам проволоку и не сломать ее можно легко, древесина при таком воздействии сломается пополам.
- Также отличительной чертой древесины от металла является то, что она не покрывается коррозией. Есть породы дерева, которые могут долгое время находиться в воде и не гнить. Металлы же при таких условиях покрываются ржавчиной. достаточно низкая по сравнению с металлами. Хотя некоторые металлы имеют плотность ниже дерева, они относятся к легким металлам.

Чем отличаются полупроводники от металлов
Полупроводниками называются неметаллы, которые имеют некоторые металлические свойства. Металлы и полупроводники имеют схожесть в том, что и те, и другие способны проводить ток.
Но полупроводники имеют отличительную особенность, которая заключается в том, что их электропроводность может возрастать в несколько раз в зависимости от внешних факторов. Таким образом, полупроводник проводит ток лучше при повышении температуры. У металлов электропроводность с повышением температуры уменьшается. Также на электропроводность может повлиять наличие посторонних примесей. Так, в металлах примеси понижают электропроводность, а в полупроводниках повышают.
Полупроводники в отличие от металлов могут обладать позитивной и негативной электропроводимостью. Сами по себе полупроводники по способности пропускать сквозь себя ток стоят между металлом и элементами, которые не проводят ток совсем.

Отличие металла от стали
Ошибочно считать, что металл и сталь — это совершенно разные элементы. На самом деле сталь — это тоже металл. Чем отличается металл от стали?
Дело в том, что металлами называют целую группу элементов, которые имеют металлические свойства. В эту группу входит и железо. Сталь не что иное, как сплав железа с элементами, входящими в группу металлов.
Чаще всего в состав стали помимо железа входят такие элементы таблицы Менделеева как молибден, хром и ванадий. Также в состав стали входит и углерод. С помощью него повышают прочность железа.
Таким образом, варьируя количеством углерода в сплаве можно получить очень прочный материал. Но чем прочнее сталь, тем больше она становится хрупкой. Так, при длительной динамической нагрузке сталь легко ломается. Добавление других примесей к ней помогает добиться устойчивости к каким-либо воздействиям.

Итак, в статье было рассмотрено, чем металлы отличаются от металлов и неметаллов. Характеристики всех элементов можно сравнивать по химическим и физическим свойствам. Ежедневно человек пользуется такими элементами и создает новые вещества для улучшения качества жизни.
Металлы и неметаллы – в чем разница и как понять, когда металлические свойства усиливаются, а когда ослабевают

Металлы – это такие элементы, которые стараются отдавать свои электроны. Неметаллы – наоборот, стараются их принимать. Вам надо понять, почему это происходит, и что значат фразы типа «металлические свойства усиливаются, а неметаллические ослабевают». Сейчас я вам это объясню.
Почему металлические свойства слабеют «слева направо»
Итак. В атоме есть три частицы: протоны, нейтроны и электроны. У протонов заряд +1, у электронов -1. У нейтронов заряда нет.
Протоны и нейтроны находятся в ядре. Поэтому заряд ядра всегда плюсовой. А электроны крутятся вокруг ядра и притягиваются к нему, потому что у них заряд минусовой.
Электроны крутятся по электронным уровням – как планеты по орбитам вокруг Солнца.
Атомный номер показывает, сколько в атоме протонов. Как видите, это количество постоянно увеличивается.

Чем больше протонов, тем сильнее они «тянут» к себе электроны. Сравните:

Вывод – чем больше становится протонов, тем сильнее они удерживают электроны. Тем сложнее становится эти электроны отдавать. Поэтому слева направо, с увеличением порядкового номера (и, соответственно, числа протонов) металлические свойства слабеют, а неметаллические усиливаются.
На заметку – про радиус атома
Чем сильнее протоны притягивают электроны, тем ближе эти электроны становятся к протонам. Поэтому радиус атома уменьшается, атом как бы сжимается из-за увеличения заряда.
Почему неметаллические свойства слабеют «сверху вниз»
Идем дальше. Период в таблице показывает количество уровней (тех самых орбит), по которым летают электроны.
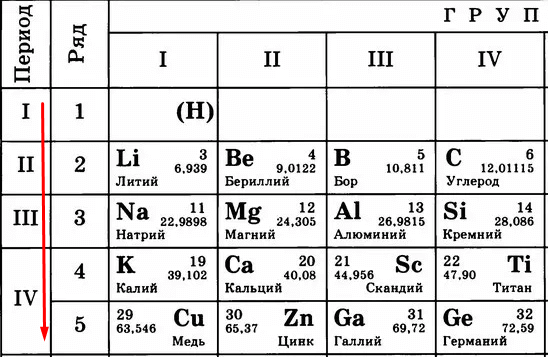
Чем больше период, тем больше этих орбит и тем дальше оказываются электроны от ядра. Сравните:
Кому сложнее удерживать электроны на последнем уровне? Меди, конечно, потому что эти электроны в два раза дальше от ядра, чем, например, у лития. Их проще становится отдать, чем пытаться удерживать.
Следовательно, «сверху вниз» количество уровней, по которым движутся электроны, растет, удерживать их становится сложнее, поэтому металлические свойства усиливаются, а неметаллические – слабеют.
Еще про радиус
Если смотреть на таблицу «сверху вниз» радиус ядра растет, потому что уровней становится больше.
Да, заряд атома тоже растет, но все-таки расстояние перевешивает. Чем больше уровней, тем труднее становится держать электроны, даже несмотря на то, что заряд увеличивается.
- Слева направо в таблице металлические свойства слабеют, неметаллические усиливаются из-за того, что ядро сильнее тянет к себе электроны.
- Сверху вниз металлические свойства усиливаются, неметаллические слабеют, потому что уровней становится больше, и удерживать электроны на последних уровнях становится труднее.
Из этих двух положений следует, что в правом углу таблицы Менделеева будут сосредоточены неметаллы, а в левом – металлы.
Я нашел вам вот такую картинку, на ней показаны все неметаллы. То, что выделено курсивом – это так называемые металлоиды – вроде и не совсем металлы, и в то же время не неметаллы. Нечто среднее.
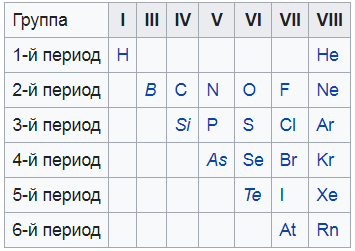
Это основа основ. Надеюсь, я объяснил понятно и вы разобрались. Если нет – перечитайте еще раз, задайте вопросы мне в комментариях. Только когда разберетесь – читайте дальше.
Свойства металлов
Эти свойства проявляются в разной мере, но все-таки присущи всем металлам:
- Плавятся.
- Их можно ковать.
- Обладают металлическим блеском.
- Проводят электрический ток. Это происходит благодаря металлической связи, которая соединяет их атомы.
- Проводят тепло.
- Твердые – это касается всех, кроме ртути.
На сегодняшний день металлов известно 87.
Свойства неметаллов
У них почти все наоборот:
- Ковать нельзя, потому что они хрупкие.
- Не обладают металлическим блеском.
- Не проводят электрический ток (за редким исключением – кремний и графит могут быть проводниками).
- Очень плохо проводят тепло.
- Есть твердые, газообразные, жидкие.
Неметаллов на данный момент 22.
Это первая статья по химии на нашем сайте. Напишите, что не так, что нравится и не нравится. Я буду думать, как сделать материал лучше.
И еще – есть идея записывать видеоролики с объяснениями. Лично вам удобнее разбираться в чем-то, читая текст, или просматривая видео?
Читайте также:
