Число электронов на внешнем слое атомов металлов
Обновлено: 05.10.2024
Планетарная модель атома Резерфорда – вокруг ядра (с протонами и нейтронами) по слоям (или уровням) вращаются электроны.
Модель изотопа атома лития:
В ядре 3 протона (красные) и 4 нейтрона (синие).
Вокруг ядра вращаются электроны по шаровым орбитам. Нужно учитывать, что третий электрон движется на большем расстоянии от ядра
и он неспаренный!
ОПРЕДЕЛЕНИЯ ЭЛЕМЕНТАРНЫХ ЧАСТИЦ .
· ПРОТОН – элементарная частица с единичным положительным зарядом и единичной относительной массой.
· НЕЙТРОН – нейтральная элементарная частица с единичной относительной массой.
· ЭЛЕКТРОН – отрицательно заряженная элементарная частица с незначительной массой
· Атомный номер элемента, заряд ядра атома и число протонов в ядре обозначают буквой Z, а число нейтронов – буквой N.
· Суммарное число протонов и нейтронов называют МАССОВЫМ ЧИСЛОМ атома А = Z + N
Оно приблизительно равно (округлённо) относительной атомной массе Аr
· Ч ИСЛО НЕЙТРОНОВ в ядре равно округленной атомной массе (или массовому числу конкретного изотопа) минус номер элемента N = A – Z
· ИЗОТОПЫ элемента имеют одинаковое количество протонов и разное число нейтронов, то есть разные массовые числа и одинаковый порядковый номер.
У разных изотопов слева от знака элемента обозначают верхним индексом массовое число, а нижним порядковый номер или заряд ядра
Cl
То есть количество протонов и электронов в атоме равно порядковому номеру,
а количество нейтронов надо посчитать. Оно равно разности
между массой атома и количеством протонов.
Конкретная масса изотопа или дана в условии задачи, или нужно взять округленную до целого числа атомную массу из таблицы Менделеева.
Для хлора с массовым числом 35 (из рамочки сверху) число нейтронов 35-17=18
ДляСОСТОЯНИЕ ЭЛЕКТРОНА В АТОМЕ
Электрон в атоме находится в постоянном движении вокруг ядра.
Электронное облако — область пространства, в каждой точке которой может находиться данный электрон.
Электронная орбиталь — область околоядерного пространства, в которой вероятность нахождения электрона более 90 %.
Чем дальше электрон от ядра, тем больше его энергия и слабее связь с ядром.
На одной орбитали может содержаться не более двух электронов. Два электрона на одной орбитали называют спаренными. Если на орбитали находится один электрон, то он неспаренный.
Отрицательно заряженные электроны отталкиваются и поэтому находятся на разных расстояниях от ядра. При этом электроны, имеющие приблизительно равный запас энергии, образуют энергетический уровень.
Периодическая таблица Д.И.Менделеева (ПСХЭ)
Период – горизонтальный ряд элементов.
Малые периоды – 1-3. Большие (2 горизонтальных ряда) – 4 -7.
Группа – вертикальный столбик.
Главная подгруппа (А) – элементы больших и малых периодов (начинается сверху таблицы – высокий столбик, точно друг под другом по линейке)
Побочная подгруппа(В) – элементы только больших периодов (начинается в 4 периоде – низкий столбик, точно друг под другом по линейке)
ФИЗИЧЕСКИЙ СМЫСЛ НОМЕРОВ В ТАБЛИЦЕ МЕНДЕЛЕЕВ А.
· Порядковый номер элемента – заряд ядра, количество протонов и ТАКОЕ ЖЕ количество электронов.
· Номер периода – количество электронных слоёв (или энергетических уровней).
· Номер группы – количество внешних электронов (или электронов на внешнем уровне) для элементов главных подгрупп.
Ø Наибольшее влияние на свойства атомов оказывают электроны внешнего слоя. Это валентные электроны.
Ø В химических процессах участвуют только валентные электроны.
Число электронов на внешнем уровне атомов периодически повторяется, поэтому периодически повторяются свойства химических элементов. Это сущность и физический смысл периодического закона.
Важно знать, что, независимо от номера энергетического уровня, на внешнем (последнем) уровне не может быть больше восьми электронов.
Внешний восьмиэлектронный энергетический уровень является наиболее устойчивым и называется завершённым . Такие энергетические уровни имеются у самых неактивных элементов — благородных газов.
Число электронов на внешнем уровне равно:
· для элементов главных подгрупп — номеру группы;
· для элементов побочных подгрупп — оно не может быть больше двух!
Очень важно правильно определять число внешних электронов, так как именно с ними связаны важнейшие свойства атома. В химических реакциях атомы стремятся «приобрести» устойчивый, завершённый внешний уровень (8ē). Для этого атомы, на внешнем уровне которых мало электронов, «предпочитают» их отдать.
Химические элементы, атомы которых способны только отдавать электроны, относятся к МЕТАЛЛАМ. Очевидно, что на внешнем уровне атома металла должно быть мало электронов: 1, 2, 3. Чем легче отдает электроны атом, тем сильнее выражены его металлические свойства.
МЕТАЛЛЫ – элементы с 1-3 электронами на внешнем уровне (кроме водорода, гелия и бора).
Самые активные – щелочные – главная подгруппа 1 группы (кроме водорода).
Металлы в ПСХЭ – главные подгруппы 1-3 групп (кроме водорода и бора) и элементы
всех побочных подгрупп внутри и внизу таблицы Д.И.Менделеева.
Если на внешнем энергетическом уровне атома много электронов, то такие атомы стремятся принять электроны до завершения внешнего энергетического уровня, т. е. до восьми электронов. Такие элементы относятся к НЕМЕТАЛЛАМ.
Металлы и неметаллы главных подгрупп в таблице Менделеева отделяет диагональ, которую можно провести от бора к астату. На этой линии и выше (включая водород) располагаются неметаллы, ниже — металлы.
НЕМЕТАЛЛЫ ( их всего 23) элементы – с 4-8 электронами на внешнем уровне
в таблице Менделеева расположены ТОЛЬКО в главных подгруппах .
Внешние энергетические уровни атомов неМе заполнены на половину и более (исключение бор).
Особую группу составляют БЛАГОРОДНЫЕ ГАЗЫ (главная подгруппа 8 группы), имеют завершенный внешний уровень – 8 электронов , поэтому не вступают в химические реакции,
за что получили своё второе название - ИНЕРТНЫЕ ГАЗЫ.
7 группу называют ГАЛОГЕНАМИ – это самые активные неметаллы,
так как до завершения внешнего электронного уровня не хватает 1 электрона.
Простые вещества у галогенов всегда – двухатомные молекулы.
ФТОР никогда не отдаёт электроны, только забирает. Фтор – самый сильный неметалл.
На втором месте КИСЛОРОД , который стремится забрать у других элементов 2 электрона.
Кислород отдаёт электроны только фтору, но только 2.
Энергетический уровень (электронный слой) — совокупность электронов с близкими значениями энергии.
Энергетические уровни нумеруют, начиная с самого близкого к ядру.
На каждом энергетическом уровне может находиться ограниченное число электронов:
Установлено, что максимальное число электронов на энергетическом уровне равно 2n² , где n — его номер. Значит, на энергетическом уровне может находиться
Ø на первом – не более 2 электронов;
Ø на втором – не более 8 электронов;
Ø на третьем – не более 18 электронов.
Каждый следующий по порядку атом повторяет электронную структуру предыдущего и ещё один электрон в главных подгруппах добавляется на внешний уровень, а в побочных подгруппах – на предыдущий (или предпредпоследний для лантаноидов и актиноидов – внизу таблицы).
Для того, чтобы составить ЭЛЕКТРОННУЮ СХЕМУ – распределение электронов по уровням, следует воспользоваться следующим АЛГОРИТМОМ:
- Определить общее число электронов в атоме (по порядковому номеру).
- Определить число энергетических уровней (по номеру периода).
- Определить число внешних электронов (по виду подгруппы и номеру группы).
- Указать число электронов на всех уровнях, кроме предпоследнего.
- Рассчитать число электронов на предпоследнем уровне.
Например скандий – 4 период 3 группа, побочная подгруппа (или подгруппа В)
2е - 8е - …е - 2е - 2+8+2=12
Sc номер 21 21-12=9, значит на третьем уровне 9 электронов
Sc 2 е - , 8 е - , 9е - , 2е -
Первые две цифры будут повторяться для всех элементов, начиная с №10 (неона).
Распределение электронов по подуровням.
Электроны в атоме занимают не только определённые уровни, но и определённые подуровни каждого уровня. Вид подуровня (орбитали) обозначается латинской буквой: s, p, d.
s -орбиталь p -орбиталь Известны и более сложные по форме орбитали.
На каждой орбитали не может быть больше 2-х электронов. Электроны стремятся занять свободную орбиталь. Р-электроны азота занимают каждый свою орбиталь – все они неспаренные.
Число возможных подуровней равно номеру уровня:
· первый уровень состоит из одного s-подуровня;
· второй уровень состоит из двух подуровней: s и р и т. д.
На каждом подуровне может находиться строго ограниченное число электронов:
· на s-подуровне — не больше 2ē;
· на р-подуровне — не больше 6ē;
· на d-подуровне — не больше 10ē;
· на f -подуровне — не больше 14ē.
Подуровни одного уровня заполняются в строго определённом порядке:
Таким образом, р-подуровнь не может начать заполняться,
если не заполнен s-подуровень данного энергетического уровня и т. д.
По электронной схеме для скандия Sc можно записать электронную формулу :
Металлическая связь
Теорию ионной связи предложил в 1916г. немецкий ученый В. Коссель. Эта теория объясняет образование связей между атомами типичных металлов и атомамитипичных неметаллов:CsF, CsCl, NaCl, KF, KCl, Na2O и др.
Согласно этой теории, при образовании ионной связи атомы типичных металлов отдают электроны, а атомы типичных неметаллов принимают электроны.
В результате этих процессов атомы металлов превращаются в положительно заряженные частицы, которые называются положительными ионами или катионами; а атомы неметаллов превращаются в отрицательные ионы — анионы. Заряд катиона равен числу отданных электронов.
Атомы металлов отдают электроны внешнего слоя, а образующиеся ионы имеют завершенные электронные структуры (предвнешнего электронного слоя).
Величина отрицательного заряда аниона равна числу принятых электронов.
Атомы неметаллов принимают такое количество электронов, какое им необходимо для завершения электронного октета (внешнего электронного слоя).
Например: общая схема образования молекулы NaCl из атомов Na и С1: Na°-le = Na +1 Образование ионов
Na +1 + Сl - = Nа + Сl -
Na°+ Сl°= Nа + Сl - Соединение ионов
· Связь между ионами называется ионной связью.
Соединения, которые состоят из ионов, называются ионными соединениями.
Алгебраическая сумма зарядов всех ионов в молекуле ионного соединения должна быть равна нулю,потому что любая молекула является электронейтральной частицей.
Резкой границы между ионной и ковалентнои связями не существует. Ионную связь можно рассматривать как крайний случай полярной ковалентнои связи, при образовании которой общая электронная пара полностьюсмещается к атому с большей электроотрицательностью.
Атомы большинства типичных металлов на внешнем электронном слое имеют небольшое число электронов (как правило, от 1 до 3); эти электроны называются валентными. В атомах металлов прочность связи валентных электронов с ядром невысокая, то есть атомы обладают низкой энергией ионизации. Это обусловливает легкость потери валентных электронов ч превращения атомов металла в положительно заряженные ионы (катионы):
В кристаллической структуре металла валентные электроны обладают способностью легко перемещаться от одного атома к другому, что приводит к обобществлению электронов всеми соседними атомами. Упрощенно строение кристалла металла представляется следующим образом: в узлах кристаллической решетки находятся ионы Ме п+ и атомы Ме°, а между ними относительно свободно перемещаются валентные электроны, осуществляя связь между всеми атомами и ионами металла (рис. 3). Это особый тип химической связи, называемой металлической.
· Металлическая связь — связь между атомами и ионами металлов в кристаллической решетке, осуществляемая обобществленными валентными электронами.
Благодаря этому типу химической связи металлы обладают определенным комплексом физических и химических свойств, отличающим их от неметаллов.
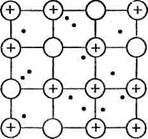
Рис. 3. Схема кристаллической решетки металлов.
Прочность металлической связи обеспечивает устойчивость кристаллической решетки и пластичность металлов (способность подвергаться разнообразной обработке без разрушения). Свободное передвижение валентных электронов позволяет металлам хорошо проводить электрический ток и тепло. Способность отражать световые волны (т.е. металлический блеск) также объясняется строением кристаллической решетки металла.
Таким образом, наиболее характерными физическими свойствами металлов в зависимости от наличия металлической связи являются:
■металлический блеск и непрозрачность;
■пластичность, ковкость, плавкость;
■высокие электро- и теплопроводность; и склонность к образованию сплавов.
Металлы
В периодах и группах периодической системы Д. И. Менделеева существуют закономерности в изменении металлических и неметаллических свойств элементов, можно достаточно определённо указать положение элементов-металлов и элементов-неметаллов в периодической системе. Если провести диагональ от элемента бора B (порядковый номер 5) до элемента астата At (порядковый номер 85), то слева от этой диагонали в периодической системе все элементы являются металлами, а справа от неё элементы побочных подгрупп являются металлами, а элементы главных подгрупп – неметаллами. Элементы расположенные вблизи диагонали (например, Al, Ti, Ge, Sb, Te, As, Nb), обладают двойственными свойствами: в некоторых своих соединениях ведут себя как металлы; в некоторых – проявляют свойства неметаллов.
Все s-элементы (кроме H и He), d-элементы (все элементы побочных подгрупп) и f-элементы (лантаноиды и актиноиды) являются металлами. Среди p-элементов есть и металлы, и неметаллы, число элементов-металлов увеличивается с увеличением номера периода.
Деление на металлы и неметаллы объясняется различием в строении атомов. Рассмотрим, например, строение атомов третьего периода:
Элементы третьего периода: Na, Mg, Al, Si, P, S, Cl, Ar (аргон).
Радиус атома: 0.19; 0.16; 0.143; 0.134; 0.130; 0.104; 0.099.
Число электронов на внешнем слое: 1, 2, 3, 4, 5, 6, 7.
Электроотрицательность: 0.9; 1.2; 1.5; 1.8; 2.1; 2.5; 3.0.
Любой гидроксид содержит гидроксидные группы – OH.
а. Радиус атомов уменьшается;
б. Заряд ядра увеличивается;
в. Электроотрицательность увеличивается;
г. Число электронов на внешнем слое увеличивается;
д. Прочность связи внешних электронов с ядром увеличивается;
е. Способность атомов отдавать электроны уменьшается.
Na, Mg, Al – металлы, а Si, P, S, Cl – неметаллы.
Атомы большинства металлов на внешнем электронном слое имеют от 1 до 3 электронов. Исключение: атомы германия Ge, олова Sn, свинца Pb на внешнем электронном слое имеют четыре электрона, атомы сурьмы Sb, висмута Bi – пять, атомы полония Po – шесть. Атомы металла имеют меньший заряд ядра и больший радиус (размер) по сравнению с атомами неметаллов данного периода. Потому прочность связи внешних электронов с ядром в атомах металлов небольшая. Атомы металлов легко отдают валентные электроны и превращаются в положительно заряженные ионы.
Простые вещества, которые образуют элементы-металлы, при обычных условиях являются твёрдыми веществами (кроме ртути). Кристаллическая решётка металлов образуется за счёт металлической связи. Имеющиеся между узлами кристаллической решётки свободные электроны могут переносить теплоту и электрический ток, что является причиной главных физических свойств металлов – высокой электро- и теплопроводности.
Металлическая связь образуется во всех металлах. Это связь, которую осуществляют относительно свободные электроны с положительными ионами металлов в кристаллической решётке. Атомы металла легко отдают валентные электроны и превращаются в положительные ионы. Относительно свободные электроны перемещаются между положительными ионами металла и между ними возникает металлическая связь, то есть электроны как бы цементируют положительные ионы металла в кристаллической решётке.
Атомы металлов более или менее легко отдают электроны, то есть окисляются.
Энергия, которая необходима для отрыва электрона от атома и превращение его в положительно заряженный ион, называется энергией ионизации. Металлы характеризуются небольшими величинами энергий ионизации.
Атомы металлов не могут присоединять электроны. Поэтому металлы во всех химических реакциях являются восстановителями и в соединениях имеют только положительные степени окисления. Восстановительная активность различных металлов не одинакова. В периодах слева направо восстановительная активность уменьшается; в главных подгруппах сверху вниз – увеличивается. Восстановительная активность металлов в химических реакциях, которые протекают в водных растворах различных веществ, характеризуется положением металлов в электрохимическом ряду напряжений металлов.
Металлы являются восстановителями и вступают в химические реакции с различными окислителями.
2. Альдегиды
Альдегиды – органические вещества, содержащую функциональную группу (альдегидную группу).
Лекция по Химии на тему "Металлы"
1. Где расположены металлы в периодической системе химических элементов Д.И.Менделеева?
2. Каковы особенности строения атомов металлов?
3. В чём различие в строении внешнего энергетического уровня у металлов и неметаллов?
4. Сколько наружных электронов имеют атомы металлов главных и побочных подгрупп?
5. В каких формах могут находиться металлы в природе?
6. Как устроена кристаллическая решетка металлов?
7. Каковы физические свойства металлов?
8. Как можно получить металлы из их соединений?
9. Как ведут себя атомы металлов в химических реакциях и почему?
10. Какие свойства – окислителей или восстановителей – проявляют металлы в химических реакциях?
11. Расскажите об электрохимическом ряде напряжений металлов.
12. Перечислите реакции, в которые могут вступать металлы.
13. Каково значение металлов в жизни человека?
1. Особенности электронного строения металлов.
Металлы - это химические элементы, атомы которых отдают электроны внешнего (а иногда предвнешнего) электронного слоя, превращаясь в положительные ионы. Металлы – восстановители Ме 0 – nе = Ме n+ . Это обусловлено небольшим числом электронов внешнего слоя (в основном 1 - 3), большим радиусом атомов, вследствие чего эти электроны слабо удерживаются с ядром.
2. Положение металлов в ПСХЭ.
Легко увидеть, что большинство элементов ПСХЭ – металлы (92 из 114).
Металлы размещены в левом нижнем углу ПСХЭ. Это все элементы, расположенные ниже диагонали В – А t , даже те у которых на внешнем слое 4 электрона ( Je , Sn , Pb ), 5 электронов ( Sb , Di ), 6 электронов ( Po ), так как они отличаются большим радиусом. Среди них есть s и p -элементы – металлы главных подгрупп, а также d и f металлы, образующие побочные подгруппы.
В соответствии с местом, занимаемым в периодической системе, различают переходные (элементы побочных подгрупп) и непереходные металлы (элементы главных подгрупп). Металлы главных подгрупп характеризуются тем, что в их атомах происходит последовательное заполнение электронных s- и р-подуровней. В атомах металлов побочных подгрупп происходит достраивание d- и f-подуровней.
Закономерности в изменении свойств элементов – металлов.
Признаки сравнения
В главной подгруппе
Число электронов на внешнем слое
У элементов – металлов побочных подгрупп свойства чуть-чуть другие.
В побочных подгруппах ( Cu , Ag , Au ) – активност ь элементов – металлов падает. Эта закономерность наблюдается и у элементов второй побочной подгруппы Zn , Cd , Hg . У элементов побочных подгрупп – это элементы 4-7 периодов – с увеличением порядкового элемента радиус атомов изменятся мало, а величина заряда ядра увеличивается значительно, поэтому прочность связи валентных электронов с ядром усиливается, восстановительные свойства ослабевают.
3. Металлическая химическая связь. Кристаллические решетки.
Связь в металлах между («атом-ионами» ) посредством (большого количества не связанных с ядрами подвижных электронов) называется (металлической связью) .
Все металлы являются кристаллическими телами, имеющими определенный тип кристаллической решетки, состоящей из малоподвижных положительно заряженных ионов, между которыми движутся свободные электроны (так называемый электронный газ). Такой тип структуры называется металлической связью.
Тип решетки определяется формой элементарного геометрического тела, многократное повторение которого по трем пространственным осям образует решетку данного кристаллического тела.
Обобщим сведения о типе химической связи, образуемой атомами металлов и строение кристаллической решетки:
- сравнительно небольшое количество электронов одновременно связывают множество ядер, связь делаколизована;
- валентные электроны свободно перемещаются по всему куску металла, который в целом электронейтрален;
- металлическая связь не обладает направляемостью и насыщенностью.
4. Физические свойства металлов
В соответствие именно с таким строением металлы характеризуются общими физическими свойствами.
а) твердость – все металлы кроме ртути, при обычных условиях твердые вещества. Самые мягкие – натрий, калий. Их можно резать ножом; самый твердый хром – царапает стекло.
б) плотность. Металлы делятся на мягкие (5г/см³) и тяжелые (меньше 5г/см³).
в) плавкость. Металлы делятся на легкоплавкие и тугоплавкие.
г) электропроводность, теплопроводность металлов обусловлена их строением. Хаотически движущиеся электроны под действием электрического напряжения приобретают направленное движение, в результате чего возникает электрический ток.
При повышении температуры амплитуда движения атомов и ионов, находящихся в узлах кристаллической решетки резко возрастает, и это мешает движению электронов, и электропроводность металлов падает.
д) металлический блеск – электроны, заполняющие межатомное пространство отражают световые лучи, а не пропускают как стекло. Поэтому все металлы в кристаллическом состоянии имеют металлический блеск. Для большинства металлов в ровной степени рассеиваются все лучи видимой части спектра, поэтому они имеют серебристо-белый цвет. Только золото и медь в большой степени поглощают короткие волны и отражают длинные волны светового спектра, поэтому имеют желтый цвет. Самые блестящие металлы – ртуть, серебро, палладий. В порошке все металлы, кроме Al и Mg , теряют блеск и имеют черный или темно-серый цвет.
е) пластичность. Механическое воздействие на кристалл с металлической решеткой вызывает только смещение слоев атомов и не сопровождается разрывом связи, и поэтому металл характеризуется высокой пластичностью.
Некоторые металлы, например, железо, титан, олово и др. способны по достижении определенных температур изменять кристаллическое строение. Это явление получило название аллотропии или полиморфизма, а сами переходы от одного кристаллического строения к другому называются аллотропическими или полиморфными.
5. Химические свойства металлов
Ряд напряжений характеризует химические свойства металлов: чем меньше электродный потенциал металла, тем больше его восстановительная способность.
А) Взаимодействие с неметаллами ( в названиях полученных веществ окончание
2Mg 0 +O2 0 —>2Mg 2+ O 2- (оксид магния)
Fe 0 +S 0 —>Fe 2+ S 2- ( сульфид железа II)
Б) Взаимодействие с водой. Самые активные металлы реагируют с водой при обычных условиях, и в результате этих реакций образуются растворимые в воде основания и выделяется водород
2Na + 2HOH = 2NaOH + H2
2Li 0 +2H2 + O 2– —> 2Li + O 2- H + + H2 0
Менее активные металлы реагируют с водой при повышенной температуре с выделением водорода и образованием оксида соответствующего металла Zn + H2O = ZnO +H2
В) Взаимодействие с растворами кислот. Происходит при соблюдении ряда условий
· Металл должен находиться левее в ряду напряжений металлов;
· В результате реакции должна образовываться растворимая соль, иначе металл покроется осадком и доступ кислоты к металлу прекратиться;
· Для этих реакций не рекомендуется использовать щелочные металлы, так как они взаимодействуют с водой в растворе кислоты;
· По особому взаимодействуют с металлами концентрированные азотная и серная кислоты;
2H + Cl – +Zn0 → Zn 2+ Cl2 - +H20
Г) Взаимодействие с растворами солей. При этом соблюдаются следующие условия
· Металл должен находиться в ряду напряжений левее металла, образующего соль;
· Для этих реакций не рекомендуется использовать щелочные металлы, так как они взаимодействуют с водой в растворе соли;
Fe 0 +Cu 2+ Cl2 – →Fe 2+ Cl2 – +Cu 0
Д) Взаимодействие со щелочами (только амфотерные)
Магний и щелочноземельные металлы с щелочами не реагируют.
Е) Взаимодействие с оксидами металлов (металлотермия).
Некоторые активные металлы способны вытеснять другие металлы из их оксидов при поджигании смеси.
2Al 0 + Fe 2 O 3 = Al 2 O 3 +2 Fe 0
Ж) Коррозия (будет рассмотрена на другом занятии).
6. Способы получения металлов
Существуют несколько основных способов получения — металлов.
а) Пирометаллургия – это получение металлов из их соединений при высоких температурах с помощью различных восстановителей (C, CO, H2, Al, Mg и др.).
— из их оксидов углем или оксидом углерода (II)
ZnО + С = Zn + СО
Fе2О3 + ЗСО = 2Fе + ЗСО2
— водородом
WO3 + 3H2 =W + 3H2O
СоО + Н2 = Со + Н2О
— алюминотермия
4Аl + ЗМnО2 = 2А12О3 + ЗМn
б) Гидрометаллургия – это получение металлов, которое состоит из двух процессов: сначала природное соединение металла (оксид) растворяют в кислоте, в результате чего получают соль металла. Затем из полученного раствора необходимый металл вытесняют более активным металлом. Например:
Обжигом сульфидов металлов и последующим восстановлением образовавшихся оксидов (например, углем):
2ZnS + ЗО2 = 2ZnО + 2SО2
ZnО + С = СО + Zn
в) Электрометаллургия – это получение металлов при электролизе растворов или расплавов их соединений. Роль восстановителя при этом играет электрический ток.
СuСl2 → Сu 2 + 2Сl -
Катод (восстановление): Сu 2+ - 2е - = Сu 0
Строение атома. Строение электронных оболочек атомов первых 20 элементов Периодической системы Д.И. Менделеева

Атом — электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов. В центре атома находится положительно заряженное ядро. Оно занимает ничтожную часть пространства внутри атома, в нём сосредоточены весь положительный заряд и почти вся масса атома.
Ядро состоит из элементарных частиц — протона и нейтрона; вокруг атомного ядра по замкнутым орбиталям движутся электроны.
Протон (р) — элементарная частица с относительной массой 1,00728 атомной единицы массы и зарядом +1 условную единицу. Число протонов в атомном ядре равно порядковому номеру элемента в Периодической системе Д.И. Менделеева.
Нейтрон (n) — элементарная нейтральная частица с относительной массой 1,00866 атомной единицы массы (а. е. м.).
Число нейтронов в ядре N определяют по формуле:
где А — массовое число, Z — заряд ядра, равный числу протонов (порядковому номеру).
Обычно параметры ядра атома записывают следующим образом: слева внизу от символа элемента ставят заряд ядра, а вверху — массовое число, например:
Эта запись показывает, что заряд ядра (следовательно, и число протонов) для атома фосфора равен 15, массовое число равно 31, а число нейтронов равно 31 – 15 = 16. Так как массы протона и нейтрона очень мало отличаются друг от друга, то массовое число приблизительно равно относительной атомной массе ядра.
Электрон ( е – ) — элементарная частица с массой 0,00055 а. е. м. и условным зарядом –1. Число электронов в атоме равно заряду ядра атома (порядковому номеру элемента в Периодической системе Д.И. Менделеева).
Электроны движутся вокруг ядра по строго определённым орбиталям, образуя так называемое электронное облако.
Область пространства вокруг атомного ядра, где наиболее (90 и более %) вероятно нахождение электрона, определяет форму электронного облака.
Электронное облако s-электрона имеет сферическую форму; на s-энергетическом подуровне может максимально находиться два электрона.
Электронное облако p-электрона имеет гантелеобразную форму; на трёх p-орбиталях максимально может находиться шесть электронов.
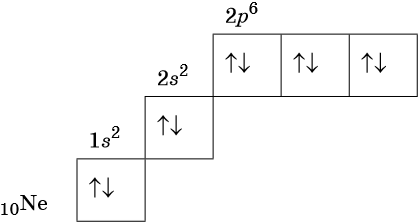
Орбитали изображают в виде квадрата, сверху или снизу которого пишут значения главного и побочного квантовых чисел, описывающих данную орбиталь. Такую запись называют графической электронной формулой, например:
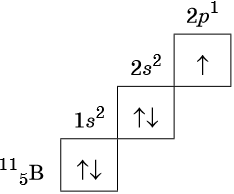
В этой формуле стрелками обозначают электрон, а направление стрелки соответствует направлению спина — собственного магнитного момента электрона. Электроны с противоположными спинами ↑↓ называют спаренными.
Электронные конфигурации атомов элементов можно представить в виде электронных формул, в которых указывают символы подуровня, коэффициент перед символом подуровня показывает его принадлежность к данному уровню, а степень у символа — число электронов данного подуровня.
В таблице 1 приведено строение электронных оболочек атомов первых 20 элементов Периодической системы химических элементов Д.И. Менделеева.
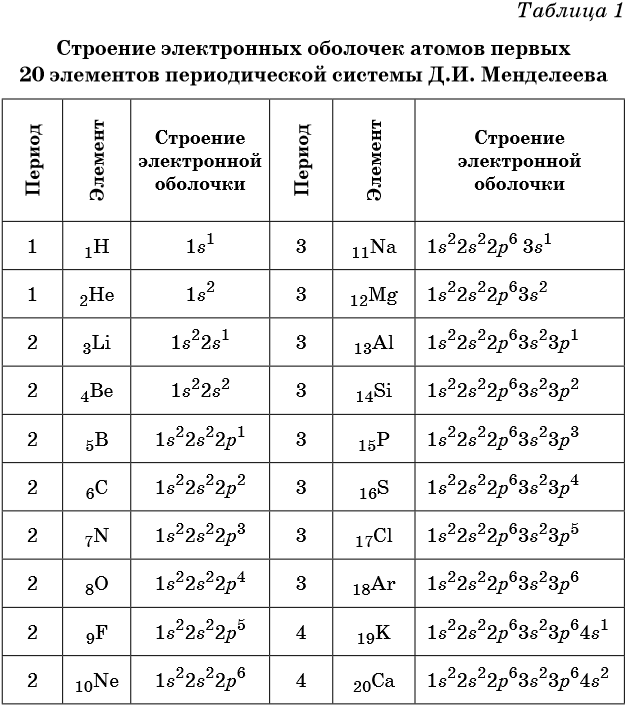
Химические элементы, в атомах которых s-подуровень внешнего уровня пополняется одним или двумя электронами, называют s-элементами. Химические элементы, в атомах которых заполняется p-подуровень (от одного до шести электронов), называют p-элементами.
Число электронных слоёв в атоме химического элемента равно номеру периода.
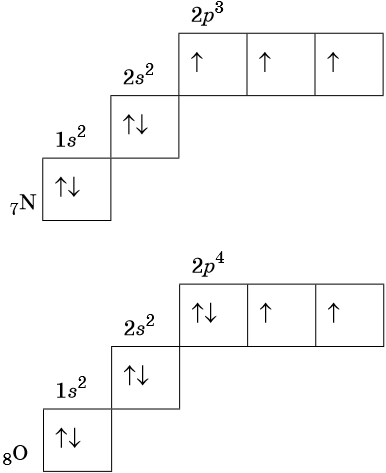
В соответствии с правилом Хунда электроны располагаются на однотипных орбиталях одного энергетического уровня таким образом, чтобы суммарный спин был максимален. Следовательно, при заполнении энергетического подуровня каждый электрон прежде всего занимает отдельную ячейку, а только после этого начинается их спаривание. Например, у атома азота все p-электроны будут находиться в отдельных ячейках, а у кислорода начнётся их спаривание, которое полностью закончится у неона.
Изотопами называют атомы одного и того же элемента, содержащие в своих ядрах одинаковое число протонов, но различное число нейтронов.
Изотопы известны для всех элементов. Поэтому атомные массы элементов в периодической системе являются средним значением из массовых чисел природных смесей изотопов и отличаются от целочисленных значений. Таким образом, атомная масса природной смеси изотопов не может служить главной характеристикой атома, а следовательно, и элемента. Такой характеристикой атома является заряд ядра, определяющий число электронов в электронной оболочке атома и её строение.
Рассмотрим несколько типовых заданий по этому разделу.
Пример 1. Атом какого элемента имеет электронную конфигурацию 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 ?
На внешнем энергетическом уровне у данного элемента находится один 4s-электрон. Следовательно, этот химический элемент находится в четвёртом периоде первой группе главной подгруппе. Этот элемент — калий.
К этому ответу можно прийти по-другому. Сложив общее количество всех электронов, получим 19. Общее число электронов равно порядковому номеру элемента. Под номером 19 в периодической системе находится калий.
Пример 2. Химическому элементу соответствует высший оксид RO2. Электронной конфигурации внешнего энергетического уровня атома этого элемента соответствует электронная формула:
- ns 2 np 4
- ns 2 np 2
- ns 2 np 3
- ns 2 np 6
По формуле высшего оксида (смотрите на формулы высших оксидов в Периодической системе) устанавливаем, что этот химический элемент находится в четвёртой группе главной подгруппы. У этих элементов на внешнем энергетическом уровне находятся четыре электрона — два s и два p. Следовательно, правильный ответ 2.
Тренировочные задания
1. Общее число s-электронов в атоме кальция равно
2. Число спаренных p-электронов в атоме азота равно
3. Число неспаренных s-электронов в атоме азота равно
4. Число электронов на внешнем энергетическом уровне атома аргона равно
5. Число протонов, нейтронов и электронов в атоме 9 4Be равно
1) 9, 4, 5
2) 4, 5, 4
3) 4, 4, 5
4) 9, 5, 9
6. Распределение электронов по электронным слоям 2; 8; 4 — соответствует атому, расположенному в(во)
1) 3-м периоде, IА группе
2) 2-м периоде, IVА группе
3) 3-м периоде, IVА группе
4) 3-м периоде, VА группе
7. Химическому элементу, расположенному в 3-м периоде VA группе соответствует схема электронного строения атома
1) 2, 8, 6
2) 2, 6, 4
3) 2, 8, 5
4) 2, 8, 2
8. Химический элемент с электронной конфигурацией 1s 2 2s 2 2p 4 образует летучее водородное соединение, формула которого
9. Число электронных слоёв в атоме химического элемента равно
1) его порядковому номеру
2) номеру группы
3) числу нейтронов в ядре
4) номеру периода
10. Число внешних электронов в атомах химических элементов главных подгрупп равно
1) порядковому номеру элемента
2) номеру группы
3) числу нейтронов в ядре
4) номеру периода
11. Два электрона находятся во внешнем электронном слое атомов каждого из химических элементов в ряду
1) He, Be, Ba
2) Mg, Si, O
3) C, Mg, Ca
4) Ba, Sr, B
12. Химический элемент, электронная формула которого 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 , образует оксид состава
13. Число электронных слоев и число p-электронов в атоме серы равно
1) 2, 6
2) 3, 4
3) 3, 16
4) 3, 10
14. Электронная конфигурация ns 2 np 4 соответствует атому
1) хлора
2) серы
3) магния
4) кремния
15. Валентные электроны атома натрия в основном состоянии находятся на энергетическом подуровне
1) 2s
2) 2p
3) 3s
4) 3p
16. Атомы азота и фосфора имеют
1) одинаковое число нейтронов
2) одинаковое число протонов
3) одинаковую конфигурацию внешнего электронного слоя
4) одинаковое число электронов
17. Одинаковое число валентных электронов имеют атомы кальция и
1) калия
2) алюминия
3) бериллия
4) бора
18. Атомы углерода и фтора имеют
1) одинаковое число нейтронов
2) одинаковое число протонов
3) одинаковое число электронных слоёв
4) одинаковое число электронов
19. У атома углерода в основном состоянии число неспаренных электронов равно
20. В атоме кислорода в основном состоянии число спаренных электронов равно
Читайте также:
