Что называется стандартным электродным потенциалом металла
Обновлено: 27.09.2024
В электрохимии стандартный электродный потенциал, обозначаемый E o , E 0 , или E O , является мерой индивидуального потенциала обратимого электрода (в равновесии) в стандартном состоянии, которое осуществляется в растворах при эффективной концентрации в 1 моль/кг и в газах при давлении в 1 атмосферу или 100 кПа (килопаскалей). Объёмы чаще всего взяты при 25 °C. Основой для электрохимической ячейки, такой как гальваническая ячейка всегда является окислительно-восстановительная реакция, которая может быть разбита на две полуреакции: окисление на аноде (потеря электрона) и восстановление на катоде (приобретение электрона). Электричество вырабатывается вследствие различия электростатического потенциала двух электродов. Эта разность потенциалов создаётся в результате различий индивидуальных потенциалов двух металлов электродов по отношению к электролиту.
Содержание
Вычисление стандартных электродных потенциалов
Электродный потенциал не может быть получен эмпирически. Потенциал гальванической ячейки вытекает из "пары" электродов. Таким образом, невозможно определить величину для каждого электрода в паре, используя эмпирически полученный потенциал гальванической ячейки. Для этого установлен стандартный водородный электрод, для которого этот потенциал точно определён и равен 0,00 В, и любой электрод, для которого электронный потенциал ещё неизвестен, может быть соотнесён со стандартным водородным электродом с образованием гальванической ячейки - и в этом случае потенциал гальванической ячейки даёт потенциал неизвестного электрода.
Так как электродные потенциалы традиционно определяют как восстановительные потенциалы, знак окисляющегося металлического электрода должен быть изменён на противоположный при подсчёте общего потенциала ячейки. Также нужно иметь ввиду, что потенциалы не зависят от количества передаваемых электронов в полуреакциях (даже если оно различно), так как они рассчитаны на 1 моль переданных электронов. Отсюда при расчёте какого-либо электродного потенциала на основании двух других следует проявлять внимательность.
(ур-е 1) Fe 3+ + 3e - --> Fe(тв) -0.036 В
(ур-е 2) Fe 2+ + 2e - --> Fe(тв) -0.44 В
Для получения третьего уравнения:
(ур-е 3) Fe 3+ + e - --> Fe 2+ (+0.77 В)
следует умножить потенциал первого ур-я на 3, перевернуть ур-е 2 (поменять знак) и умножить его потенциал на 2. Сложение этих двух потенциалов даст стандартный потенциал ур-я 3.
Таблица стандартных электродных потенциалов
Чем больше стандартные восстановительные потенциалы, тем легче их можно восстановить, другими словами, тем более сильными окислителями они являются. И наоборот: большой отрицательный потенциал означает, что данная форма является сильным восстановителем. Например, F2 имеет 2,87 В, а Li + имеет -3,05 В, фтор - окислитель, литий - восстановитель. Таким образом, Zn 2+ , стандартный восстановительный потенциал которого равен -0,76 В, может быть окислен любым другим электродом, стандартный потенциал которого больше -0,76 В. (напр., H + (0 В), Cu 2+ (0,16 В), F2(2,87 В)) и может быть восстановлен любым электродом, стандартный потенциал которого меньше -0,76 В (напр., H2(-2,23 В), Na + (-2,71 В), Li + (-3,05 В)).
В гальванической ячейке, где самопроизвольная окислительно-восстановительная реакция заставляет ячейку производить электрический потенциал, Энергия Гиббса ΔG o должна быть отрицательной, в соответствии со следующем уравнением:
где n это количество молей электронов на моль продуктов, а F является постоянной Фарадея, ~96485 Кл/моль. Таким образом применимы следующие правила:
если E o яч> 0, тогда процесс самопроизвольный (гальваническая ячейка) если E o яч< 0, тогда процесс несамопроизвольный (электролитическая ячейка)
См. также Таблица стандартных электродных потенциалов
Нестандартные условия
Стандартные электродные потенциалы даны при стандартных условиях. Однако, реальные ячейки могут действовать и при нестандартных условиях. При данном стандартном потенциале, потенциал при нестандартных эффективных концентрациях может быть вычеслен с использованием уравнения Нернста:
= E^0 - \frac\ln\frac\>>\>>" />
Величины E 0 зависят от температуры (кроме стандартного водородного электрода) и обычно относятся к стандартному водородному электроду при этой температуре. Для конденсированных фаз, величины потенциалов также зависят от давления.
См. также
- Таблица стандартных электродных потенциалов
- Восстановительный потенциал
- Абсолютный электродный потенциал
- Электрохимический потенциал
- Равновесный электродный потенциал
- Электрохимическая ячейка
- Гальваническая ячейка
Литература
- Zumdahl, Steven S., Zumdahl, Susan A (2000) Chemistry (5th ed.), Houghton Mifflin Company. ISBN 0-395-98583-8
- Atkins, Peter, Jones, Loretta (2005) Chemical Principles (3rd ed.), W.H. Freeman and Company. ISBN 0-7167-5701-X
- Zu, Y, Couture, MM, Kolling, DR, Crofts, AR, Eltis, LD, Fee, JA, Hirst, J (2003) Biochemistry, 42, 12400-12408
- Shuttleworth, SJ (1820) Electrochemistry (50th ed.), Harper Collins.
Ссылки
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Нормальный электродный потенциал" в других словарях:
нормальный электродный потенциал — standartinis elektrodo potencialas statusas T sritis chemija apibrėžtis Potencialų skirtumas, susidarantis metalui arba nemetalui liečiantis su tirpalu, kurio elektrochemiškai veiklių jonų koncentracija 1 mol/l. atitikmenys: angl. standard… … Chemijos terminų aiškinamasis žodynas
СТАНДАРТНЫЙ ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ — (нормальный электродный потенциал) потенциал электрода в растворе, в котором ионы, определяющие электродный процесс, имеют активность, равную единице. Стандартный потенциал данного электрода измеряется относительно стандартного (нормального)… … Большая политехническая энциклопедия
стандартный электродный потенциал — standartinis elektrodo potencialas statusas T sritis chemija apibrėžtis Potencialų skirtumas, susidarantis metalui arba nemetalui liečiantis su tirpalu, kurio elektrochemiškai veiklių jonų koncentracija 1 mol/l. atitikmenys: angl. standard… … Chemijos terminų aiškinamasis žodynas
Электродный потенциал — разность электрических потенциалов между Электродом и находящимся с ним в контакте электролитом (См. Электролиты) (чаще всего между металлом и раствором электролита). Возникновение Э. п. обусловливается переносом заряженных частиц через… … Большая советская энциклопедия
Окислительно-восстановительный потенциал — равновесный Электродный потенциал, характеризующий данную электролитическую среду. О. в. п. при постоянной температуре зависит только от состава среды и может быть сообщен ею погруженному в неё электронному проводнику (электроду), если… … Большая советская энциклопедия
Металл — (Metal) Определение металла, физические и химические свойства металлов Определение металла, физические и химические свойства металлов, применение металлов Содержание Содержание Определение Нахождение в природе Свойства Характерные свойства… … Энциклопедия инвестора
Рафинирование металлов — Рафинирование металлов, очистка первичных (черновых) металлов от примесей. Черновые металлы, получаемые из сырья, содержат 96‒99% основного металла, остальное приходится на примеси. Такие металлы не могут использоваться промышленностью из за… … Большая советская энциклопедия
Рафинирование — I Рафинирование (нем. Raffinieren, от франц. raffiner очищать) окончательная очистка продукта от примесей в металлургической, химической, пищевой и др. отраслях промышленности. II Рафинирование металлов, очистка первичных… … Большая советская энциклопедия
Натрий — (Natrium) Na, химический элемент I группы периодической системы Менделеева; атомный номер 11, атомная масса 22,9898; серебристо белый мягкий металл, на воздухе быстро окисляющийся с поверхности. Природный элемент состоит из одного… … Большая советская энциклопедия
Понятие об электродном потенциале
Электроды– электрохимические системы, состоящие из металла или полупроводника, погруженного в раствор или расплав электролита. Фактически, это металлические или графитовые изделия (проводники первого рода), находящиеся в среде, проводящей электрический ток (проводники второго рода). Носителями свободных зарядов в проводниках первого рода являются электроны, а в проводниках второго рода – ионы обоих знаков.
Металлы, как правило, имеют кристаллическое строение. В узлах кристаллической решетки расположены положительные ионы (катионы), находящиеся в равновесии с электронным газом:
При погружении металла в раствор начинается сложное взаимодействие металла с компонентами раствора. Катионы металла выходят в электролит, а катионы электролита встраиваются в кристаллическую решетку металла. Со временем устанавливается равновесие между электродом и электролитом. В зависимости от того, куда смещено это равновесие, поверхность металла приобретает больший или меньший потенциал.
В результате перераспределения зарядов на границе «металл – раствор» возникает двойной электрический слой (рис. 9.1) и возникает скачок потенциала между металлом и раствором.
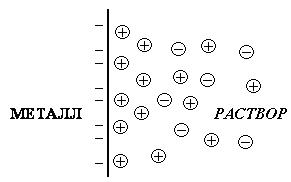 |
| Рис. 9.1. Двойной электрический слой на границе раздела «металл – раствор» |
Потенциал электрода, опущенного в электролит, называется электродным потенциалом. Его значения зависят от многих факторов: материала электрода, состава электролита, температуры, давления и т. д. Величину электродного потенциала измеряют относительно некоторого выбранного электрода сравнения, потенциал которого принимают равным нулю. В качестве электрода сравнения обычно принимают стандартный водородный электрод.
Стандартным электродным потенциалом (j 0 )называется потенциал металла, погруженного в раствор собственной соли и измеренный относительно водородного электрода в стандартных условиях. Стандартные условия: концентрация ионов в растворе 1 моль/л, температура Т = 298 К, давление Р = 1,01325∙10 5 Па.
По результатам измерений получен ряд стандартных электродных потенциалов (табл. 9.1), который позволяет дать количественную характеристику электрохимической активности металлов. Чем меньше значение φ 0 , тем сильнее выражены восстановительные свойства металла, т. е. он легче отдает электроны, легче окисляется. Чем больше значение φ 0 , тем сильнее окислительные свойства катиона металла, находящегося в растворе.
Стандартные электродные потенциалы φ 0 некоторых металлов
| Электрод | Электродный потенциал, В | Электрод | Электродный потенциал, В |
| Li + /Li | –3,05 | Cd 2+ /Cd | –0,40 |
| Rb + /Rb | –2,93 | Co 2+ /Co | –0,28 |
| K + /K | –2,92 | Ni 2+ /Ni | –0,25 |
| Ba 2+ /Ba | –2.90 | Sn 2+ /Sn | –0,136 |
| Ca 2+ /Ca | –2,87 | Pb 2+ /Pb | –0,127 |
| Na + /Na | –2,71 | 2H + /H | 0,00 |
| Mg 2+ /Mg | –2,37 | Sb 3+ /Sb | +0,20 |
| Al 3+ /Al | –1,70 | Bi 3+ /Bi | +0,22 |
| Ti 2+ /Ti | –1,60 | Cu 2+ /Cu | +0,34 |
| V 2+ /V | –1,18 | Ag + /Ag | +0,85 |
| Mn 2+ /Mn | –1,18 | Hg 2+ /Hg | +0,85 |
| Zn 2+ /Zn | –0,76 | Pt 2+ /Pt | +1,19 |
| Cr 3+ /Cr | –0,74 | Au 3+ /Au | +1,5 |
| Fe 2+ /Fe | –0,44 |
Для вычисления электродных потенциалов в условиях, отличных от стандартных, используют уравнение Нернста:
где T – температура, К;
F – число Фарадея, равное 96 500 Кл/моль;
R – универсальная газовая постоянная, равная 8,314 Дж/(моль . К);
n – число электронов, принимающих участие в элементарном акте окислительно-восстановительного процесса;
Стандартные электродные потенциалы
Мерой склонности веществ к окислению и восстановлению служит стандартный электродный потенциал. Так как нет методов измерения абсолютных величин, то измеряют относительные электродные потенциалы, пользуясь так называемыми электродами сравнения. Основным электродом сравнения является водородный. Условно потенциал водородного электрода принимают за ноль и называют стандартным.
Стандартный потенциал металла E 0 — это разность потенциалов между металлом, погруженным в раствор своей соли, содержащий один моль иона этого металла в литре, и стандартным водородным электродом.
Стандартные потенциалы E 0 распространенных металлов Me n + /Me 0 приведены в справочниках, они всегда относятся к определенному электродному процессу, т.е. определенному заряду и составу катиона металла в растворе. Последовательность расположения металлов по возрастанию стандартного потенциала E 0 (от меньших отрицательных к бо́льшим положительным значениям) как раз и отвечает электрохимическому ряду напряжений. Такая
Стандартные потенциалы металлических электродов при 25 °C
| Элемент | Электродный процесс | Е 0 , В |
| Li | Li + + ē → Li 0 | –3,04 |
| K | K + + ē → K 0 | –2,92 |
| Ba | Ba 2+ + 2ē → Ba 0 | –2,90 |
| Ca | Ca 2+ + 2ē → Ca 0 | –2,87 |
| Na | Na + + ē → Na 0 | –2,71 |
| Mg | Mg 2+ + 2ē → Mg 0 | –2,36 |
| Al | Al 3+ + 3ē → Al 0 | –1,66 |
| Mn | Mn 2+ + 2ē → Mn 0 | –1,18 |
| Zn | Zn 2+ + 2ē → Zn 0 | –0,76 |
| Cr | Cr 3+ + 3ē → Cr 0 | –0,74 |
| Fe | Fe 2+ + 2ē → Fe 0 | –0,44 |
| Cd | Cd 2+ + 2ē → Cd 0 | –0,40 |
| Co | Co 2+ + 2ē → Co 0 | –0,28 |
| Ni | Ni 2+ + 2ē → Ni 0 | –0,25 |
| Sn | Sn 2+ + 2ē→ Sn 0 | –0,14 |
| Pb | Pb 2+ + 2ē → Pb 0 | –0,13 |
| H | 2H + + 2ē → H2 | 0,00 |
| Cu | Cu 2+ + 2ē → Cu 0 | +0,34 |
| Hg | Hg2 2+ + 2ē → 2Hg 0 | +0,79 |
| Ag | Ag + + ē → Ag 0 | +0,80 |
| Pt | Pt 2+ + 2ē → Pt 0 | +1,19 |
| Au | Au 3+ + 3ē → Au 0 | +1,50 |
последовательность называется рядом стандартных электродных потенциалов металлов (табл. 3) и является фрагментом ряда стандартных электродных потенциалов (см. табл. 2). Чем отрицательнее потенциал электрода, тем сильнее восстановительные свойства и больше активность металла.
Стандартные электродные потенциалы металлов
В 1865 г. (т.е. за 4 года до открытия Д.И. Менделеевым переодического закона) металлы уже были классифицированы по их активности. Это сделал известный русский ученый Н.Н. Бекетов, который изучал действие различных металлов на разбавленные кислоты и воду и заметил, что наиболее активно ведут себя щелочные металлы. Некоторые же металлы, такие, как Cu, Hg, Ag, Au, вообще не вытесняли водород из растворов кислот, даже наоборот — водород сам способен вытеснять металлы из солей ртути и серебра.
Итогом трудов Н.Н. Бекетова явился так называемый вытеснительный ряд металлов:
K, Na, Ca, Mg, Al, Mn, Zn, Fe, Ni, Sn, Pb, H2, Cu, Hg, Ag, Au.
Все металлы, стоящие в этом ряду левее водорода, вытесняют водород из разбавленных кислот.
Современное название этого ряда — «Электрохимический ряд напряжений», так как положение каждого металла в этом ряду определяется величиной так называемого электродного потенциала.
Что же такое электродный потенциал? Как он возникает?
Напомним, что электрическим потенциалом называют величину, соответствующую энергии, которую нужно затратить (и тогда потенциал положителен) или которую можно получить (и тогда потенциал отрицателен) при переносе единицы электричества из бесконечности в данную точку.
Согласно современным представлениям, в узлах кристаллических решеток металлов находятся атомы и ионы, причем нейтральных атомов очень мало, подавляющее число частиц находится в виде ионов. Электроны, подчиняясь законам квантовой теории, движутся в поле положительных зарядов, создавая своеобразный «электронный газ». Таким образом, в металле существует подвижное равновесие, которое можно выразить уравнением.
Если погрузить пластинку металла в воду, то под действием полярных молекул воды часть катионов перейдет в жидкость Me z + + mH2O ? [Me(H2O)m] z+ , а электроны останутся на пластинке металла, в результате чего металл зарядиться отрицательно.
Катионы, перешедшие в жидкость, располагаются вблизи поверхности отрицательно заряженной пластинки металла, в результате чего образуется двойной электрический слой, что схематически можно представить так (рис.1):
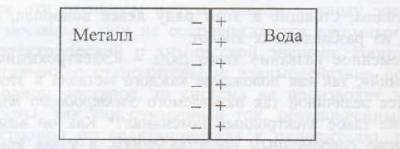
Рис.1. двойной электрический слой на границе металл–вода
Таким образом, на границе соприкосновения жидкости с металлом электрический потенциал? резко изменяется и наблюдается скачок (или разность) потенциала ??, который принято называть электродным потенциалом.
. В большинстве современной химической литературы скачки потенциалов обозначаются просто ?.
Ясно, что чем активнее металл, тем легче будут диссоциировать его атомы, тем большее количество катионов перейдет в жидкость и тем, следовательно, б?льшим будет отрицательный заряд металла, что, в свою очередь, обусловит б?льшую разность потенциалов на границе металл—жидкость.
Процесс перехода ионов металла в жидкость является обратимым процессом. Поэтому, если погрузить пластинку металла не воду, а в раствор соли этого металла, то равновесие будет смещено: из металла в раствор будет переходить меньше ионов и разность потенциалов на границе металл—раствор будет несколько иной, чем в первом случае.
На рис. 2. представлена схема возникновения двойного электрического слоя в случае цинковой и медной пластинок, погруженных в растворы их солей.
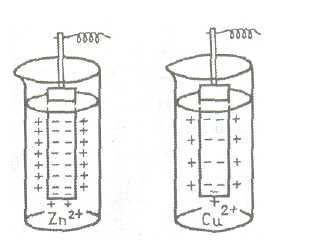
Рис.2. Схема возникновения электродного потенциала
Видно, что величина электродного потенциала определяется прежде всего природойметалла. Кроме того она зависит от температуры, концентрации раствора и других факторов. Поэтому для сравнения электродных потенциалов необходимо выбрать некоторые стандартные условия. Обычно сравнение производят при 25°С, давлении 101,3 кПа и в растворе с концентрацией одноименного иона, равной единице (1 моль/л).
Таким образом, стандартным электродным потенциалом называется электродный потенциал при концентрации иона металла 1 моль/л.
Абсолютное значение электродного потенциала измерить невозможно (поскольку введение любых измерительных зондов неизбежно приводит к появлению новой контактной разности потенциалов). Вместе с тем не представляет труда измерение величины относительного электродного потенциала.
Относительные электродные потенциалы металлов измеряют относительно стандартного водородного электрода, потенциал которого произвольно принят за нуль.
Поскольку водород при температуре 298 К является газом, из него невозможно, как из металла, изготовить пластинку. В качестве твердой фазы в стандартном водородном электроде используют инертный металл (например, Pt).
Конструктивно водородный электрод (рис.3) состоит из платиновой пластинки, покрытой слоем мелкозернистой платины — платиновой чернью, частично погруженной в раствор кислоты с концентрацией ионов водорода, равной 1 моль/л. Обычно берут раствор нелетучей кислоты — серной H2SO4 или хлорной HClO4. К пластинке подают чистый газообразный водород под постоянным давлением 101,3 кПа.
Возникновение потенциала на стандартном водородном электроде можно представить следующим образом. Газообразный водород, адсорбируясь платиной, переходит в атомарное состояние, поэтому в поверхностном слое платины устанавливается равновесие Н2 ? 2Н, а на границе платины и раствора серной кислоты — равновесие Н ? Н + + е.
Суммарный процесс выражается уравнением:
Таким образом, водородный электрод можно обозначить как Н2/Н + , Pt, где вертикальная черта означает поверхность раздела фаз.
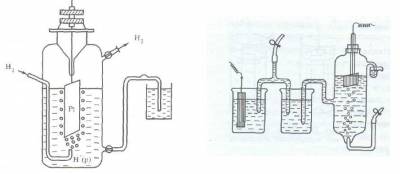
Рис. 3. Схема водородного электрода или так
Если пластинку некоторого металла, погруженную в раствор его соли с концентрацией иона металла 1 моль/л, соединить электролитным мостиком с водородным электродом (рис.3), то получится гальванический элемент, т.е. в полученной системе пойдет электрический ток, обусловленный разностью электродныхпотенциаловводородногоэлектродаи изучаемогометалла.
Вот эту величину — разность электродных потенциалов катода и анода — в разомкнутом (незамкнутом) гальваническом элементе называют электродвижущей силой (ЭДС или Е) элемента:
ЭДС= ??1 –??2 или ЭДС = ??к –??А
В замкнутом гальваническом элементе, т.е. при измеряемом значении силы тока в элементе (т.е. при соединении платины с некоторым металлом металлическим проводником) разность потенциалов катода и анода называют напряжением:
Прямым измерением разности потенциалов на клеммах гальванического элемента с помощью обычного вольтметра можно получить значение напряжения U,которое не равноЭДСэлемента, т.е. U < ЭДС.
Разница между ЭДС и напряжением обусловлена падением напряжения внутри элемента при прохождении тока (в физике ЭДС = I·R + I·rвнутр.., где rвнутр– внутреннее сопротивление электродов. При I ~ 0 произведение I·rвнутр.. = 0, но выражение I·R хоть и очень мало, но все-таки оно есть и равно ЭДС). Поэтому измерение ЭДС обычно проводят компенсационным методом, при котором ток, протекающий через элемент, близок к нулю. Более простой и менее точный метод измерения ЭДС заключается в прямом измерении напряжения на клеммах гальванического элемента вольтметром, имеющим высокое сопротивление (высокоомным вольтметром). Вследствие высокого сопротивления вольтметра мал ток, протекающий через элемент, поэтому не велика разница между ЭДС и напряжением элемента.
Измеренная ЭДС цепи, составленной из стандартного водородного электрода и стандартного металлического электрода является электродным потенциалом последнего.
Если измерить стандартные электродные потенциалы различных металлов по отношению к потенциалу стандартного водородного электрода и расположить их в порядке увеличения, то получим ряд напряжений металлов:
?? 0 , ВK, Na, Ca, Mg, Al, Mn, Zn, Fe, Ni, Sn, Pb, H2, Cu, Hg, Ag, Au
(или просто ? 0 ) –2,92 –2,38 0,0 0,8 1,2
Ряд напряжений характеризует химические свойства металлов:
1. Чем меньшей алгебраической величиной ? 0 обладает металл, тем он химически активнее, т.е. тем больше его восстановительная способность.
2. Чем дальше расположены друг от друга в ряду напряжений два металла, тем б?льшую электродвижущую силу будет иметь построенный из них гальванический элемент, причем катодом всегда будет являться тот электрод, потенциал которого больше.
Стандартный электродный потенциал
Электродный потенциал не может быть получен эмпирически. Потенциал гальванической ячейки вытекает из «пары» электродов. Таким образом, невозможно определить величину для каждого электрода в паре, используя эмпирически полученный потенциал гальванической ячейки. Для этого установлен водородный электрод, для которого этот потенциал точно определён и равен 0,00 В, и любой электрод, для которого электронный потенциал ещё неизвестен, может быть соотнесён со стандартным водородным электродом с образованием гальванической ячейки — и в этом случае потенциал гальванической ячейки даёт потенциал неизвестного электрода.
Так как электродные потенциалы традиционно определяют как восстановительные потенциалы, знак окисляющегося металлического электрода должен быть изменён на противоположный при подсчёте общего потенциала ячейки. Также нужно иметь в виду, что потенциалы не зависят от количества передаваемых электронов в полуреакциях (даже если оно различно), так как они рассчитаны на 1 моль переданных электронов. Отсюда при расчёте какого-либо электродного потенциала на основании двух других следует проявлять внимательность.
Fe 3+ + 3e − → Fe(тв) −0.036 В
Fe 2+ + 2e − → Fe(тв) −0.44 В
Fe 3+ + e − → Fe 2+ (+0.77 В)
следует умножить потенциал первого уравнения на 3, перевернуть второе уравнение(поменять знак) и умножить его потенциал на 2. Сложение этих двух потенциалов даст стандартный потенциал третьего уравнения.
Чем больше стандартные восстановительные потенциалы, тем легче их можно восстановить, другими словами, тем более сильными окислителями они являются. И наоборот: низкий отрицательный потенциал означает, что данная форма является сильным восстановителем. Например, F2 имеет 2,87 В, а Li + имеет −3,05 В, фтор — окислитель, литий — восстановитель. Таким образом, Zn 2+ , стандартный восстановительный потенциал которого равен −0,76 В, может быть окислен любым другим электродом, стандартный потенциал которого больше −0,76 В. (напр., H + (0 В), Cu 2+ (0,16 В), F2(2,87 В)) и может быть восстановлен любым электродом, стандартный потенциал которого меньше −0,76 В (напр., H − (−2,23 В), Na + (−2,71 В), Li + (−3,05 В)).
В гальванической ячейке, где самопроизвольная окислительно-восстановительная реакция заставляет ячейку производить электрический потенциал, Энергия Гиббса ΔG o должна быть отрицательной, в соответствии со следующим уравнением:
Стандартные электродные потенциалы даны при стандартных условиях. Однако, реальные ячейки могут действовать и при нестандартных условиях. При данном стандартном потенциале, потенциал при нестандартных эффективных концентрациях может быть вычислен с использованием уравнения Нернста:
\ln\frac>>>>" />
Величины E 0 зависят от температуры (кроме стандартного водородного электрода) и обычно относятся к стандартному водородному электроду при этой температуре. Для конденсированных фаз величины потенциалов также зависят от давления.
- Таблица стандартных электродных потенциалов
- Восстановительный потенциал
- Абсолютный электродный потенциал
- Равновесный электродный потенциал
- Электрохимическая ячейка
- Гальваническая ячейка
Смотреть что такое "Стандартный электродный потенциал" в других словарях:
Стандартный электродный потенциал — Standard electrode potential Стандартный электродный потенциал. Обратимый потенциал для электродного процесса, где все продукты и реакции находятся на шкале активности, на которой потенциал полуэлемента водорода равен нулю. (Источник: «Металлы и… … Словарь металлургических терминов
Электродный потенциал — У этого термина существуют и другие значения, см. Потенциал. Электродный потенциал разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом (чаще всего между металлом и раствором электролита). Возникновение… … Википедия
Нормальный электродный потенциал — В электрохимии стандартный электродный потенциал, обозначаемый Eo, E0, или EO, является мерой индивидуального потенциала обратимого электрода (в равновесии) в стандартном состоянии, которое осуществляется в растворах при эффективной концентрации… … Википедия
Потенциал электростатический — Классическая электродинамика Магнитное поле соленоида Электричество · Магнетизм Электростатика Закон Кулона … Википедия
СТАНДАРТНЫЙ ЭЛЕКТРОД — (эталонный ЭЛЕКТРОД), в ЭЛЕКТРОХИМИИ ПОЛУЭЛЕМЕНТ, состоящий из других полуэлементов и служащий эталоном. Главным стандартным электродом является водородный электрод платиновый электрод, погруженный в молярный раствор ионов водорода и покрытый… … Научно-технический энциклопедический словарь
Электростатический потенциал — У этого термина существуют и другие значения, см. Потенциал. Классическая электродинамика … Википедия
Окислительно-восстановительный потенциал — (редокс потенциал от англ. redox reduction oxidation reaction, Eh или Eh) мера способности химического вещества присоединять электроны (восстанавливаться[1]). Окислительно восстановительный потенциал выражают в милливольтах (мВ).… … Википедия
Читайте также:
