Что показывает ряд активности металлов
Обновлено: 16.05.2024
Химические свойства металлов определяются их активностью. Простые вещества – металлы в химических реакциях всегда являются восстановителями . Положение металла в ряду активности характеризует то, насколько активно данный металл способен вступать в химические реакции (т. е. то, насколько сильно у него проявляются восстановительные свойства).
Среди металлов традиционно выделяют несколько групп.
благородные металлы (серебро, золото, платина, иридий);
щелочные металлы – I(A) группа ;
щелочноземельные металлы – II(A) группа , кроме Be, Mg.
Металлы встпают в реакции с простыми веществами – неметаллами (кислород, галогены, сера, азот, фосфор и др.) и сложными веществами (вода, кислоты, растворы солей)
Взаимодействие с простыми веществами-неметаллами
1. Металлы взаимодействуют с кислородом, образуя оксиды:
4Li + O 2 = обыч. усл . = 2Li 2 O
2Mg + O 2 = t, °C = 2MgO
Серебро, золото и платина с кислородом не реагируют
2. Металлы взаимодействуют с галогенами (фтором, хлором, бромом и йодом), образуя галогениды – Ме +n Г -1 n
2Na + Cl 2 = 2NaCl
3. Металлы взаимодействуют с серой, образуя сульфиды.
4. Активные металлы при нагревании реагируют с азотом, фосфором и некоторыми другими неметаллами.
3Na + P = t, °C = Na 3 P
Взаимодействие со сложными веществами
I. Взаимодействие воды с металлами
1). Взаимодействие с самыми активными металлами, находящимися в периодической системе в I(А) и II(А) группах (щелочные и щелочноземельные металлы) и алюминий . В результате образуются основание и газ водород .
Me + H 2 O = Me(OH) n + H 2 (р. замещения)
Внимание! Алюминий и магний ведут себя также:
Магний (в горячей воде):
2) Взаимодействие воды с менее активными металлами, которые расположены в ряду активности от алюминия до водорода.
Металлы средней активности, стоящие в ряду активности до (Н 2 ) – Be, Fe, Pb, Cr, Ni, Mn, Zn – реагируют с образованием оксида металла и водорода
Me + Н 2 О = Ме х О у + Н 2 (р. замещения)
Бериллий с водой образует амфотерный оксид:
Be + H 2 O = t°C = BeO + H 2
Раскалённое железо реагирует с водяным паром, образуя смешанный оксид — железную окалину Fe 3 O 4 и водород:
3) Металлы, стоящие в ряду активности после водорода, не реагируют с водой.
Cu + H 2 O ≠ нет реакции
II. Взаимодействие растворов кислот с металлами
Металлы, стоящие в ряду активности металлов левее водорода, взаимодействуют с растворами кислот ( раствор азотной кислоты – исключение ), образуя соль и водород.
Кислота (раствор) + Me до (Н2) = Соль + H 2 ↑
III. Взаимодействие кислот-окислителей с металлами
Металлы особо реагируют с серной концентрированной и азотной кислотами:
H 2 SO 4 (конц.) + Me = Сульфат + H 2 O + Х
HNO 3 + Me = Нитрат + H 2 O + Х
4Zn + 10HNO 3 (раствор горячий) = t˚C = 4Zn(NO 3 ) 2 + N 2 O + 5H 2 O
4Zn + 10HNO 3 (оч. разб. горячий) = t˚C = 4Zn(NO 3 ) 2 + NH 4 NO 3 + 3H 2 O
IV. С растворами солей менее активных металлов
Ме + Соль = Новый металл + Новая соль
Активность металла в реакциях с кислотами, водными растворами солей и др. можно определить, используя электрохимический ряд, предложенный в 1865 г русским учёным Н. Н. Бекетовым: от калия к золоту восстановительная способность (способность отдавать электроны) уменьшается, все металлы, стоящие в ряду левее водорода, могут вытеснять его из растворов кислот; медь, серебро, ртуть, платина, золото, расположенные правее, не вытесняют водород.
Ряд активности металлов

Химия
Что же из себя представляет ряд активности металлов давайте разбираться. Металлы — группа химических элементов, обладающих сходными свойствами. Среди них — электропроводность, пластичность, температурная зависимость сопротивления. По виду металлы можно отличить по характерному блеску, который так и назвали — металлический. Но химические свойства элементов отличаются в зависимости от строения их молекул и кристаллической решетки. Особенно ярко отличия проявляются по отношению взаимодействия с кислотами и щелочами. Всего на данный момент насчитывается 96 металлов. Общие свойства металлов показаны в таблице:
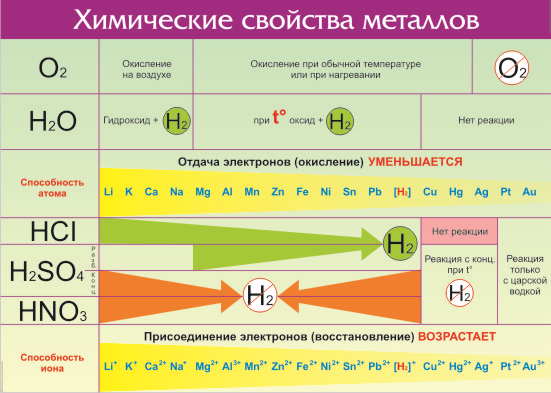
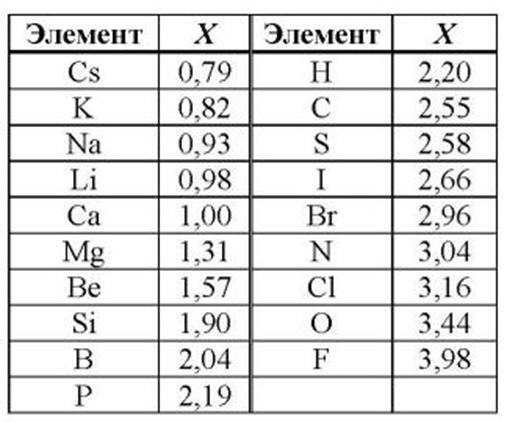
Все металлы в той или иной степени являются восстановителями, то есть, отдают электроны при течении окислительно-восстановительных реакций. Таблица электроотрицательности металлов показывает, какой металл является наиболее активным восстановителем. Если цифра напротив элемента больше 2, то это окислитель с характерными свойствами и выходит из ряда металлов, проявляя типичные свойства неметалла.
Электрохимический ряд активности металлов показывает, какие из металлов более активные, какие менее. Расположение элементов в горизонтальном ряду слева направо показывает направление снижения восстановительной способности и возрастание окислительной.
Восстановительная способность — свойство отдавать электроны в химических реакциях с водными растворами солей и щелочей.
Окислительная способность — свойство присоединять электроны в реакциях с теми же веществами.

Металлы в правой стороне более слабые восстановители, они вытесняются при реакциях с солевыми растворами металлами, расположенными левее. Пример реакции — Zn + Cu 2+ → Zn 2+ + Cu, которая протекает только в одном направлении. Цинк вытесняет медь, реагируя с водным раствором любой соли меди. Цинковая пластинка, при этом, растворяется, а медная восстанавливается.
Такую последовательность элементов еще называют ряд напряженности металлов, или ряд Бекетова. На всех вариантах записи ряда можно заметить, что последовательность металлов разделена знаком водорода (гидрогена), который металлом никак не является. Это своеобразный маркер, показывающий, что стоящие левее металлы вытесняют водород из водных растворов кислот, не обладающих окислительными свойствами. Некоторые металлы, например, литий, кальций, барий и остальные, стоящи до алюминия, вытесняют водород и при реакции с водой.
2Al +3H2SO4 = Al2(SO4)3 + 3H2↑
Fe + 2HCl = FeCl2 + H2↑
Стоящие правее знака водорода металлы с кислотами-неокислителями не взаимодействуют при нормальных условиях.
Шкала активности металлов широко используется для практических целей, например, в гальванике. Если электроды сделаны из разных металлов, то разрушаться будет тот, который стоит левее. Чем больше промежуток между металлами в ряду, тем активнее проходит процесс коррозии.
Например, метод оцинковки позволяет защитить железо именно потому, что цинк находится левее железа в ряду активности. Пока он не разрушится, то ржавчина на железе не появится. При электролизе, расположенные за водородом металлы осаживаются на катоде, а самые активные, занимающее места до алюминия, выделить из солевых растворов в не получится при нормальных температуре и давлении.
Малоактивные металлы, так называемые переходные элементы с электроотрицательностью в пределах 1,5 – 2. Это:
- Ртуть;
- Олово;
- Серебро;
- Никель;
- Рений;
- Медь;
- Марганец и еще несколько элементов.
К металлам средней активности относятся элементы с числом электроотрицательности от 1 до 1,5. В эту группу входят такие известные элементы, как магний, плутоний, неодим, кальций. Остальные элементы обладают высокой химической активностью. Лидирует в этом списке Франций, который практически не встречается в чистом виде. Из более известных можно назвать калий и натрий, которые приходится хранить в керосине, чтобы они не взаимодействовали с водой и воздухом. Если извлечь их из керосина, то металлы практически мгновенно сгорают.
Реакции кальция и натрия с водой при комнатной температуре выглядят так:
2Na + 2H2O = 2NaOH + H2↑
Сa + 2H2O = Сa(OH)2 + H2↑Стоящие в ряду электронапряжения металлов правее элементы тоже взаимодействуют с водой, но реакция протекает при более высокой температуре с образованием оксида и водорода.
3Fe + 4H2O = Fe3O4 + 4H2↑
Если вступает в реакцию металл и неметалл, то электрический ряд напряжений металлов тоже дает возможность заранее узнать, в каком направлении будет протекать реакция. Скорость реакции зависит как от восстановительной активности металла, так и от окислительных свойств неметалла. Стоящие до водорода металлы реагируют с кислородом уже при комнатной температуре, некоторые — достаточно бурно, например, литий и кальций.
4Li + O2 = 2Li2O
2Ca + O2 = 2CaO.
При таком взаимодействии образуются оксиды. Менее активные металлы, например железо, реагируют с кислородом спокойнее, а некоторые, например, золото и серебро, платина не окисляются вовсе, благодаря чему получили определение благородных.
С хлором реагируют практически все активные металлы с выделением теплоты.
2Fe + 3Cl2 = 2FeCl3
Также выделяется теплота при реакции активных металлов с серой, но начинается она при нагревании. После начала реакции нагрев не нужен — образовавшегося тепла достаточно для поддержания реакции.
2Al + 3S = Al2S3
Внимательно изучив ряд металлов, несложно определить тип реакции при контакте с другими элементами в зависимости от места в последовательности. Также легко назвать основные характеристики металла, как химического элемента, и возможность его использования на практике.
Электрохимический ряд напряжений (пример)
Что такое электрохимический ряд напряжений металлов
Электрохимический ряд напряжений это последовательность, где металлы расположены в порядке увеличения их стандартных электрохимических потенциалов, отвечающих полу-реакции восстановления катиона металла.
На основании взаимодействия металлов (например, магния, цинка, железа, олова, свинца, меди, серебра) с растворами соответствующих солей, а также с кислотой (например, хлороводородной) располагают металлы в ряд: Mg, Zn, Fe, Ni, Sn, Pb, Cu, Ag.

Каждый последующий металл вытесняется из раствора его соли предыдущим металлом. В этом ряду помещают и водород между свинцом и медью. В свете электронной теории де лается вывод, что тенденция отдавать электроны и переходить в водный раствор в виде положительно заряженных ионов у металлов как простых веществ ослабевает при переходе в указанном ряду слева направо.
Почему назвали электрохимическим рядом напряжений
Этот ряд называют также электрохимическим рядом напряжений металлов, желая этим подчеркнуть, что он установлен в растворах электролитов и принципиально отличается от рядов, устанавливаемых термохимическим путем, например по вытеснению одних металлов другими из их оксидов (хлоридов, фторидов и т. д.).
Название «электрохимический ряд напряжений металлов» неточное! Речь должна идти об определении стандартных электродных потенциалов металлов, т. е. потенциалов, возникающих на границе между металлом и раствором с одномолярной концентрацией ионов этого металла. Потенциалы эти определяют по нормальному водородному электроду, условно принятому за ноль. В качестве потенциала сравнения берут потенциал одного из металлов, погруженного в раствор его соли (например, медь или серебро).

Рис. 2 . Установка для определения электрохимического ряда напряжений металлов:
1—вертикальная рама, 2 — ванночка для электролита, 3 — стеклянные трубки, 4 — пружинящие хомутики, 5 — пористые диафрагмы, 6 — полихлорвиниловые трубки, 7 — штекерные гнезда, 8 — проводники, 9 — зажимы, 10 — символы металлов, 11 — пластины металлов, 12 — резиновые кружки-держатели пластин, 13 — проводники для подключения прибора к гальванометру.
Как определяют ряд напряжений
В настоящее время установка для определения электрохимического ряда напряжений металлов осваивается промышленностью. До появления промышленного образца ограничимся некоторыми рекомендациями по его самодельному изготовлению (рис. 2). Для прибора нужна вертикальная рама 1 из металла, пластмассы, фанеры или другого материала размером 350X300X Х15 мм, на которой крепят ванночку для электролита 2 (310Х X30X60 мм) и стеклянные трубки (l=150 мм и 25 мм, 3— 6 шт.).
Ванночку изготавливают из оргстекла, а стеклянные трубки— из демонстрационных пробирок или подбирают готовые трубки соответствующих длину и диаметра. Ванночку и стеклянные трубки закрепляют на раме с помощью пружинящих хомутиков 4, расположенных на поперечной планке рамы. Нижние отверстия стеклянных трубок герметично закрывают пористыми диафрагмами 5, которые представляют собой плоские диски из необожженной керамики, имеющие диаметр, соответствующий диаметру стеклянной трубки.
Для закрепления диафрагмы на стеклянной трубке изготовляют специальное приспособление: диафрагму зажимают между двумя уплотнительными резиновыми шайбами и стягивают накидной гайкой из оргстекла. Устройство для закрепления диафрагмы герметично соединяют со стеклянной трубкой при помощи отрезка хлорвиниловой или резиновой трубки 6 (длина отрезка 40 мм).
Для изготовления диафрагмы можно воспользоваться рекомендациями, данными в статье Л. В. Буглая [4]. На верхней панели рамы размещены штекерные гнезда 7 (0 4 мм) с проводниками 8, заканчивающимися зажимами 9. На передней стенке рамы нанесены химические знаки металлов 10 в той же последо вательности, в какой они размещаются в электрохимическом ряду напряжений металлов: цинк, железо, никель, олово, медь, серебро. В комплект с прибором должны входить пластинки перечисленных выше металлов 11 (размер пластинок 100X8X15 мм). В связи с тем, что серебро — дефицитный и дорогостоящий металл, можно использовать посеребренную пластинку или ограничиться пятью металлами (серебро исключить).
Чтобы пластинки металлов не проваливались в трубки, их следует вставить в резиновые кружочки 12, диаметр которых чуть больше диаметра трубок. Для соединения пар металлических пластинок с гальванометром используют два проводника 13, один конец которых имеет штекер (диаметр его соответствует диаметру штекерного гнезда рамы), а второй конец — лепесток для подсоединения к клеммам гальванометра.
Предлагаемый в данном пособии прибор имеет преимущества перед вышеупомянутым; он более надежен и удобен в работе и дает более точные результаты. В приборе, показанном в школьном учебнике, происходит подсыхание полосок фильтровальной бумаги, нередко неравномерное, что отрицательно сказывается на результатах опыта. Прибор позволяет демонстрировать опыты в нескольких параллельных классах без перезарядки.
Для иллюстрации электрохимического ряда напряжений металлов с помощью данного прибора стеклянные трубки 3 заполняют растворами солей соответствующих металлов одинаковой молярной концентрации и погружают в них металлические пластинки. Ванночку 2 заполняют раствором соли любого электролита, например хлорида калия. С помощью проводников со штекерами 13 соединяют попарно металлические пластинки 11 с гальванометром. Отклонение стрелки гальванометра будет тем большим, чем дальше отстоят друг от друга металлы.
Аналогичные опыты могут быть спроецированы на экран с помощью графопроектора, а также используют чашки Петри для раствора солей и соответствующие металлы в виде стерженьков.
Статья на тему Электрохимический ряд напряжений
Похожие страницы:
Электрохимический способ очистки золота или Электрохимический аффинаж золота Используют для получения золота очень высокой пробы , а именно кто может.
КАК ОЧИСТИТЬ РТУТЬ В химических лабораториях часто возникает необходимость очистить жидкий металл. Метод, описанный в этой заметке, пожалуй, самый простой.
Содержание статьи1 Химические свойства металлов1.1 Удельный вес и температура плавления некоторых металлов1.2 Почему типичные металлы восстановители1.3 Вытеснение металлов из соединений.
Определение молекулярного веса пара На основе закона Авогадро можно определять молекулярные веса не только газов, но и всех веществ, переходящих.
РЕЗОНАНС НАПРЯЖЕНИЙ Если по неразветвленной цепи (рис. 5-30), состоящей из активного сопротивления r, индуктивности L и емкости С, проходит ток i = Iм sin ωt то напряжение.
Атомарный водород это химический элемент который неустойчив почти сразу переходит в обычный водород выделяя при этом некоторую температуру. Даже при.
Ряд активности металлов это последовательность в которой металлы расположены в порядке увеличения их стандартных электрохимических потенциалов.
Примером может служить расширенный ряд активности металлов:

Что такое ряд активности металлов и окислительно-восстановительные реакции
Отправным пунктом при изучении ряда активности металлов следует взять периодическую систему элементов.
Устанавливается, что активность металла определяется степенью лёгкости отдачи атомом электронов: чем легче атомы металла отдают электроны, тем металл является активнее.
Ряд активности металлов показывает их сравнительную активность в реакциях окисления или восстановления (сверху вниз восстановительная активность уменьшается) металл, находящийся в ряду напряжений левее (или выше) водорода, способен вытеснить водород из кислот.

О сравнительной активности металлов можно судить по их положению в периодической системе: внутри периодов при передвижении справа налево нарастает активность металлов, и самые активные металлы (литий, натрий, калий, рубидий, цезий и франций) стоят в начале периодов.
Рис. Трубка для опытов по вытеснению металлов водородом под давлением
В главных подгруппах при передвижении сверху вниз тоже нарастает активность металлов, в чём можно убедиться на примере тех же щелочных металлов.
Ряд Бекетова
Но если металлы стоят в разных периодах и в разных группах, как, например , цинк и свинец, то на основе положения их в периодической системе быстро и правильно охарактеризовать их сравнительную активность довольно трудно.
Это можно выполнить на основе ряда активности металлов, установленного русским учёным Н. Н. Бекетовым и впервые названного им «вытеснительным рядом металлов». Наиболее выдающимся трудом Н. Н. Бекетова являются его «Исследования над явлениями вытеснения одних элементов другими» (Харьков, 1865).
Для наиболее важных металлов ряд активности металлов имеет следующий вид:

1. В этом ряду металлы расположены в определённой системе, а именно в порядке убывающей активности. Из двух металлов, стоящих рядом, легче отдают электроны атомы металла, стоящего левее.
2. Каждый металл этого ряда вытесняет все следующие за ним металлы из растворов их солей, иначе говоря, каждый металл окисляется ионами всех следующих за ним металлов, например :

При этом, как видно из уравнений, металл переходит в состояние иона, а ион — в состояние металла.
3. Если в ряду двигаться слева направо, т. е. от калия к золоту, то способность атомов отдавать электроны будет убывать, т. е. будет убывать восстановительная способность атомов и нарастать окислительная способность ионов металлов. Таким образом, в приведённом ряду активности металлов атомы калия и натрия являются очень сильными восстановителями, а ионы серебра и золота — сильными окислителями.
4. Как следствие из изложенного вытекает, что водород из разбавленных кислот может вытеснять только металлы, которые в ряду стоят левее его. Металлы же, стоящие вправо от водорода, наоборот, вытесняются водородом, находящимся под давлением, из растворов их солей умеренных концентраций:
Для определения места водорода в ряду активности металлов Н. Н. Бекетов производил такие опыты:
В колена изогнутой стеклянной трубки (рис.) помещались раздельно соли металла, кислота и цинк. Трубка запаивалась, потом наклонялась так, что цинк падал в кислоту и выделяющийся водород действовал под давлением на раствор соли. По явлениям, происходящим в колене трубки с раствором соли, можно было судить о том, вытесняется ли металл водородом или нет.
На основании подобных опытов Н. Н. Бекетов пришёл к выводу, что в «вытеснительном ряду» водород должен занимать место после свинца, а за водородом идут медь, ртуть, серебро, золото и платиновые металлы.
5. Из двух металлов, образующих электроды гальванического элемента, отрицательным электродом, катодом, будет тот из них, который стоит левее в ряду, а положительным электродом, анодом, — тот, который стоит правее.
Зависимость окислительно восстановительных реакций в ряду активности металлов
Окислительно-восстановительная реакция в гальваническом элементе протекает тем энергичнее, чем эти металлы дальше отстоят друг от друга в ряду активности металлов.
Следует в заключение подчеркнуть, что ряд активности металлов нельзя рассматривать как абсолютную характеристику свойств металлов, действительную во всех случаях и при всяких условиях.
1) Так, например , в растворах цианистого калия он существенно отличается от обычного ряда, что видно из приводимого ниже сопоставления (при 10°):
а) Обычный ряд: Zn, Fe, Sn, Сu, Ag. Аu;
б) 0,6% раствор KCN: Zn, Сu, Sn, Ag, Аu, Fe;
в) 30% раствор KCN: Zn, Сu, Аu, Ag, Sn, Fe.
При изменившихся условиях активность, например , железа резко снижается, активность меди заметно повышается и т. д.
Пример взаимодействия хлороводорода с серебром
2) Хотя серебро в ряду активности стоит после водорода, но при нагревании металлического серебра в атмосфере хлористого водорода протекает обратимая реакция:
2Ag + 2HCl ⇄ 2AgCl + H2,
причём вытеснение водорода серебром сопровождается выделением тепла. Если эту реакцию проводить в замкнутом сосуде под атмосферным давлением, то при 600° газовая смесь содержит по объёму 92,8 % НСl и 7,2 Н2, а при 700° соответственно 95% и 5%. Подобным же образом протекает реакция при тех же условиях и с медью.
Несмотря на свой относительный характер и имеющиеся некоторые исключения, ряд активности металлов всё же очень важен в практическом отношении, так как в большинстве случаев он позволяет правильно ориентироваться в направлении окислительно-восстановительной реакции при взаимодействии металла с водным раствором того или иного электролита.
Часто задаваемые вопросы ответы о ряде активности металлов?
Что показывает ряд активности металлов?
Это ряд металлов химическая активность(электрохимический потенциал), которых располагается в порядке увеличения силы
Используется для оценки активности металлов в водных растворах, и для процессов, происходящих при электролизе.
Что такое ряд напряжений металлов?
Электрохимический ряд активности металлов (ряд напряжений, ряд стандартных электродных потенциалов) — последовательность, в которой металлы расположены в порядке увеличения их стандартных электрохимических потенциалов φ0, отвечающих полуреакции восстановления катиона металла Men + : Men + + nē → Me.
Ряд напряжений характеризует сравнительную активность металлов в окислительно-восстановительных реакциях в водных растворах.
Как пользоваться рядом активности металлов?
Это ряд металлов, в котором их химическая активность уменьшается. Это чудесная шпаргалка, которой нужно уметь пользоваться: металлы, которые стоят до водорода, могут вытеснять водород из растворов кислот.
Статья на тему Ряд активности металлов
Вытеснительный ряд металлов Бекетова Рассматривая способы получения водорода, мы уже отмечали, что одни металлы легко вытесняют из воды водород, другие —.
Легкие металлы это Легкими металлами принято называть цветные металлы, имеющие небольшую плотность. К ним относят алюминий, магний, бериллий, кальций, стронций.
Химические свойства металлов

Основным химическим свойством металлов является способность их атомов легко отдавать свои валентные электроны и переходить в положительно заряженные ионы.
Типичные металлы никогда не присоединяют электронов; их ионы всегда заряжены только положительно. Поэтому металлы называются «электроположительными» элементами, в отличие от «электроотрицательных» элементов — металлоидов, для которых более характерна способность при соединять электроны.
Удельный вес и температура плавления некоторых металлов
Почему типичные металлы восстановители
Легко отдавая при химических реакциях свои валентные электроны, типичные металлы являются энергичными восстановителями.
Способность к отдаче электронов проявляется у отдельных металлов далеко не в одинаковой степени. Чем легче металл отдает свои электроны, тем он активнее, тем энергичнее вступает во взаимодействие с другими веществами.
Для сравнительного изучения активности металлов можно воспользоваться различными реакциями. Особенно удобны для этой цели реакции вытеснения металлов из их солей другими металлами. Опустим, например, кусочек цинка в раствор какой-нибудь свинцовой соли. Цинк начинает растворяться, а из раствора выделяется свинец. Реакция выражается уравнением
или в ионной форме
Zn + Pb •• = Pb + Zn ••
Из уравнения видно, что эта реакция является типичной реакцией окисления-восстановления. Сущность ее сводится к тому, что атомы цинка отдают свои валентные электроны ионам Рb •• , тем самым превращаясь в ионы Zn •• , а ионы Рb •• разряжаются и выделяются в виде металлического свинца. Если поступить наоборот, т. е погрузить кусочек свинца в раствор цинковой соли, то никакой реакции не произойдет. Это показывает, что цинк более активен, чем свинец, что его атомы легче отдают, а ионы труднее присоединяют электроны, чем атомы и ионы свинца.
Сравнивая таким же способом активность свинца и меди, легко убедиться, что свинец более активен, чем медь, так как он вытесняет медь из ее солей, а медь не может вытеснять свинец:
Рb + Cu •• = Сu + Рb ••
Следовательно, из трех сравниваемых металлов — цинка, свинца и меди — наиболее активным, легче других отдающим электроны, является цинк, менее активен свинец и еще менее активна медь.
Вытеснение металлов из соединений металлами
Вытеснение одних металлов из их соединений другими металлами впервые было подробно изучено Н. Н. Бекетовым (1865 г.), расположившим металлы по их убывающей химической активности в так называемый «вытеснительный ряд». В настоящее время вытеснительный ряд Бекетова носит название ряда напряжений, так как положение каждого металла в ряду точно определяется величиной электрического напряжения, или разности потенциалов, возникающей при погружении данного металла в раствор его соли. Об измерении этих величин и их значении будет сказано несколько позже.
Для наиболее важных металлов ряд напряжений, как уже было указано , имеет следующий вид:
Уменьшение химической активности нейтральных атомов
К, Na, Са, Mg, Al, Mn, Zn, Fe, Ni, Sn, Pb, H2, Cu, Hg, Ag, Au
Уменьшение способности ионов к присоединению электронов
В этом ряду помещен и водород, так как он тоже может вытеснять некоторые металлы из растворов их солей и в свою очередь вытесняется многими металлами из растворов кислот.
Определения положения водорода в вытеснительном ряду
Для определения положения водорода в «вытеснительном ряду» Бекетовым производились следующие опыты. В колена изогнутой стеклянной трубки (рис.) помещали отдельно друг от друга раствор соли металла, кислоту и цинк. Трубку запаивали» затем наклоняли ее так, что цинк падал в кислоту и выделяющийся водород действовал под давлением на раствор соли.
Наблюдая явления, происходящие в колене трубки, наполненном раствором соли, можно было судить о том, вытесняется ли металл водородом. На основании проведенных опытов Бекетов пришел к заключению, что в «вытеснительном ряду» водород занимает место после свинца и может вытеснять(восстанавливать) следующие за ним металлы: медь, ртуть, серебро, золото из растворов их солей.
Бекетов был убежден, что реакции вытеснения водорода металлами являются обратимыми и что для каждого металла должно существовать такое давление, при котором направление реакции меняется на обратное, т. е. водород начинает вытеснять металл из раствора его соли.
Взгляды Бекетова получили позднее полное подтверждение.
Рассмотрим, например, реакцию вытеснения водорода цинком:
Константа равновесия этой реакции выражается следующей формулой:
где вместо концентрации водорода взято его давление рн2 в атмосферах. Вычисление показывает, что при обычной температуре К = 36 • 10 24 . Значит, потребовалось бы недостижимое при современной технике давление водорода, чтобы сделать ощутимой обратную реакцию, т. е. вытеснение цинка водородом. При обычном же давлении равновесие реакции практически нацело смещено вправо.
Однако для реакции
Sn + 2H • ⇄ Sn •• + H2
Это значит, что равновесие будет достигнуто, например, при концентрациях: [Sn •• ]= l г-ион/л,[Н • ] = 0,01 г-ион/л и давлении водорода рн2 = 4 ат. Следовательно, при сравнительно небольшом давлении водород может вытеснить олово из раствора его соли.
Электрохимический ряд напряжений
Ряд напряжений дает много общих указаний относительно химического поведения отдельных металлов при реакциях в растворах:
- Каждый металл этого ряда, а также и водород, находящийся под давлением, вытесняет (восстанавливает) все следующие за ним металлы из растворов их солей. В свою очередь сам он может быть вытеснен (восстановлен) любым из металлов, стоящих впереди него.
- Только те металлы, которые стоят в ряду напряжений впереди водорода, могут вытеснять его из разбавленных кислот («солей водорода»). Металлы, стоящие вправо от водорода, не способны вытеснять водород из кислот.
- Чем левее в ряду напряжений стоит металл, тем он активнее, тем больше его восстановительная способность в отношении ионов других металлов, тем легче он сам превращается в ионы, тем труднее восстанавливаются его ионы.
Вы читаете, статья на тему Химические свойства металлов
Ряд активности металлов это последовательность в которой металлы расположены в порядке увеличения их стандартных электрохимических потенциалов. Примером может служить расширенный.
Химические свойства воды Из химических свойств воды прежде всего следует отметить большую устойчивость ее молекул по отношению к нагреванию. Однако.
Водород в природе Водород (Hydrogenium; ат. вес 1,008) в свободном состоянии встречается в природе лишь в незначительных количествах, главным образом.
Содержание статьи1 Химические уравнения и расчеты по ним1.1 Что такое химические уравнения1.2 Для чего нужны химические уравнения1.3 Пример решения химического.
Соединения фосфора с водородом и галогенами С водородом фосфор образует три соединения: РН3 — газообразный фосфористый водород, Р2Н4 — жидкий фосфористый.
Читайте также:
