Что произойдет если резко охладить металл
Обновлено: 17.05.2024
Взрывы, возникающие в ходе технологического процесса производства металлов и сплавов, называются технологическими. К ним относятся взрывы при контакте расплавленного металла и шлака с водой, взрывы газо- и пыле-воздушных смесей, а также порошков металлов и сплавов. Высокая вероятность возникновения взрыва существует во всех основных металлургических цехах. Так, в доменном производстве взрывы возникают при контакте расплавленных металла и шлака с водой, при о воде доменного газа и подаче в доменную печь природного газа (взрывы газо-воздушных смесей). При применении в ряде случаев угольной пыли и вдувании ее в доменную печь возможны взрывы пылевоздушных смесей и т. п.
В сталеплавильном производстве возможны взрывы газов, порошков металлов и сплавов-раскислителей, экзотермических смесей, утепляющих засыпок; в прокатном производстве — взрывы паров смазочных материалов, газо-воздушных смесей и др. Взрывы паров смазочных материалов, строго говоря, нельзя отнести к категории технологических, однако они влияют на ход технологического процесса.
Технологический взрыв отличается рядом характерных особенностей от других видов взрывов, даже если последние вызывают аварийную остановку оборудования или технологического процесса. При возникновении технологического взрыва в нем непосредственно участвуют компоненты технологического процесса, обусловливающие обычно нормальное протекание процесса и работу оборудования. Технологический взрыв приводит к резкому изменению параметров процесса, неустойчивой работе оборудования, что вызывает необходимость его остановки. Экономические потери вследствие технологического взрыва в связи с потерями производства во много раз выше затрат на восстановление оборудования и ликвидацию последствий разрушения.
Технологические взрывы органически связаны с технологией производства и работой оборудования, поэтому их следует рассматривать как экстремальные отклонения параметров безопасности производственного процесса.
1. Взрывы при контакте расплавленных металла и шлака с водой
1.1 Механизм и кинетика взрыва
При контакте расплавленных металла и шлака .с водой происходит взрыв, что объясняется физико-химическими свойствами воды, изучение которых позволяет раскрыть сущность механизма и кинетику такого рода взрыва. Соприкосновение воды с расплавленным металлом и шлаком приводит к мгновенному испарению ее, сопровождающемуся резким увеличением объема и давления.
При атмосферном давлении вода закипает при 100° С и весь процесс парообразования идет при температуре кипения. При нагревании воды выше 100° С в замкнутом пространстве интенсивность испарения несколько снижается, что объясняется свойством воды при высоких температурах изменять режим кипения. Так, в интервале 100—300° С режим кипения имеет пузырьковый характер, т. е. на поверхности идут образование мелких пузырьков пара, их отрыв, поднятие на поверхность и переход в газовую фазу. При более высокой температуре режим кипения усиливается и переходит в пленочный; при этом паровые пузыри сливаются в сплошную паровую прослойку между поверхностью нагрева и водой, что препятствует передаче тепла другим слоям воды.
Температура кипения воды зависит от давления над ее поверхностью: с ростом давления температура кипения повышается. Так, при давлении 490 кПа вода начинает закипать при температуре 151,1° С. Если внезапно давление над поверхностью воды снизится до атмосферного, вода окажется перегретой на 51°С и мгновенно превратится в пар, объем которого примерно в 1600 раз больше объема воды. Такое превращение носит взрывообразный характер.
Энергия взрыва при контакте расплавленного металла или шлака во много раз превышает энергию рабочего пара при расширении даже при коэффициенте полезного действия, равном 100%. Это объясняется физико-химическими свойствами воды. Соотношение масс водорода и кислорода в воде составляет 11,19 и 88,81%, т. е. содержание кислорода в воде больше, чем в любом другом соединении. При нормальных условиях (атмосферном давлении и температуре 20° С) диссоциация воды не протекает. При повышении температуры до 1500° С скорость разложения воды возрастает, однако до 2000° С интенсивность разложения незначительна, так как вода является химически стойким соединением. Лишь при достижении 4000° С вода разлагается на газообразные водород и кислород, что сопровождается взрывом. В этом случае содержание водорода значительно больше, чем при диссоциации воды, в связи с тем, что взаимодействие водяного пара с железом, нагретым до высоких температур, приводит к выделению свободного водорода: Fe+H2O=FeO+H2.
Эта реакция протекает достаточно энергично уже при температуре нагрева железа 350° С, а при более высокой температуре — практически мгновенно. В производственных условиях при контакте расплавленных металла и шлака с водой одновременно протекают процессы испарения, диссоциации воды и ее взаимодействия с железом, сопровождающиеся выделением водорода, который при определенных условиях образует с кислородом взрывчатую смесь. Воспламенение этой смеси приводит ко взрыву, энергия которого изменяется в широких пределах и зависит от многих факторов. При этом взрыв происходит только при взаимодействии жидких фаз — расплавленных металла, шлака и воды. Контакт воды с металлом или шлаком в твердом состоянии при температуре, близкой к температуре солидуса, взрыва не вызывает.
При взаимодействии расплавленных металла и шлака с водой контакт может быть поверхностным и внутренним. В первом случае возможны два варианта: взаимодействие незначительных масс расплава и воды либо больших масс. В первом случае при контакте наблюдается интенсивное кипение и свободное удаление пара, а также образовавшихся в результате диссоциации воды и реакции окисления железа водорода и кислорода в окружающую среду. Такой контакт металла с водой взрыва не вызывает.
Во втором случае, когда взаимодействуют большие массы металла и воды, у поверхности контакта образуется парогазовая прослойка, содержащая пары воды, водород и кислород, выделяющиеся вследствие диссоциации воды и окисления железа. Контактирующая с водой часть расплава в твердой фазе в результате действия охлаждения при испарении воды и возникновении напряжений может растрескиваться, что приводит к контакту расплавленного металла с водой. Это явление усугубляется при наличии на поверхности металла расплавленного шлака, контакт которых с взрывоопасной газовой смесью повышает вероятность взрыва. Критическими параметрами в этом случае являются масса металла или шлака, масса воды и продолжительность контакта металла с водой.
Потери тепла металлом складываются из тепла, выделяющегося при охлаждении металла от начальной температуры до температуры плавления, и тепла, выделяющегося при затвердевании металла. Так как масса жидкого металла незначительна, процесс образования твердой фазы в пограничном слое необратим.
В данном случае массы металла и воды находятся в соотношении, обеспечивающем взаимодействие между ними без возникновения взрыва.
Внутренний контакт расплава с водой возможен в двух случаях: при поступлении жидких металла или шлака в воду и при поступлении материалов, содержащих воду, в расплав. Отметим, что капельное тонко-струйное поступление жидкого металла в воду взрыва не вызывает. Увеличение массы жидкого металла, поступающего в воду, приводит к взрыву. При контакте с водой жидкого шлака взрывоопасность значительно ниже. Вероятность взрыва при поступлении жидкого шлака в воду резко возрастает при наличии в шлаке жидкого металла. Контакт жидкого металла и шлака с водой, вызванный попаданием в расплав пористых материалов, пропитанных влагой, как правило, приводит ко взрыву.
1.2. Виды взрывов и их предотвращение
В металлургических цехах возможны случаи, когда жидкий металл или шлак попадают на влажные пол, почву, материалы или конструкции. Такие явления обычно сопровождаются взрывами с выбросом жидкого металла или шлака. Взрывы происходят также и при выпуске металла по непросушенным желобам или при сливе в ковш с плохо просушенной футеровкой. Причины этих взрывов — образование пара вследствие контакта жидких раскаленных масс с водой и взрывоопасных смесей.
Если расплавленный металл касается влажного песка, между ним и поверхностью песка образуется паровая прослойка, через которую в дальнейшем и будет происходить переход тепла от металла к влажному песку.
Пар имеет очень низкую теплопроводность. При таких условиях потери тепла металлом во влажный песок будут относительно небольшими и на поверхности металла, прилегающей к песку, корка будет образовываться очень медленно. Давление пара в прослойке из-за отсутствия свободного выхода для него все время повышается.
В любой точке, лежащей в центре паровой прослойки между металлом и влажным песком, образовавшийся пар не может уйти вниз через влажный песок и через контактную поверхность между металлом и песком. Минимальное сопротивление для выхода пара наружу будет оказывать жидкий металл. При толщине металла 30 см гидростатическое давление жидкого чугуна на песок
Ρ = 0,098*hΜ*γ = 0,098*30*7 = 2,0594 кПа,
где hΜ — высота слоя металла, см; γ — плотность чугуна, г/см 2 .
Давление же пара в прослойке легко может достигнуть 4900 кПа и более. В конечном счете давление пара прослойки достигает такой величины, что он пробьет слабую, еще не окрепшую металлическую корку и в виде отдельных пузырьков проникнет в толщу жидкого металла. В металле пар нагревается, переходит из влажного в сухой и взаимодействует с окружающей металлической оболочкой. На нагрев пара в пузырьках и на химическое взаимодействие его с оболочкой затрачивается много тепла, что приводит к затвердеванию окружающей металлической оболочки. Размеры пузырьков при этом становятся фиксированными.
Нагревание пара и водорода в изолированном пузырьке будет продолжаться до тех пор, пока давление их не достигнет предела прочности затвердевшей окружающей металлической оболочки. Как только оно достигнет этого значения, оболочка разорвется на части и газы будут с большой силой выброшены наружу, т. е. произойдет взрыв. Сила взрыва зависит от вязкости металла и толщины его слоя: чем больше вязкость, т. е. чем больше металл охладится и чем толщина его слоя больше, тем взрыв сильнее. В результате разрыва металлической оболочки пузырьки пара и водорода выбрасываются в окружающую атмосферу, водород смешивается с воздухом и образует смесь взрывоопасной концентрации, которая в зависимости от условий либо сгорает голубоватым пламенем, либо взрывается.
2. Взрывы в доменных цехах.
Распространенными видами взрывов в доменных цехах являются взрывы вследствие соприкосновения жидкого чугуна, шлака с водой или влажными материалами. Взрыв такого вида возникает главным образом при прогарах стенок горна или лещади, в зонах леток. Особенно опасны взрывы в фурмах, шлаковых фурмочках и шлаковых ковшах. Взрывы в фурмах весьма опасны, потому что при этом открывается горн и через фурменное отверстие выбрасываются на рабочую площадку раскаленные кокс и газы, которые в атмосфере воспламеняются и горят, образуя длинные языки пламени. Взрывы в фурмах происходят главным образом из-за повышения давления пара, образовавшегося внутри полости фурмы, и возникновения взрывоопасных газо-воздушных смесей в канале фурмы.
Взрывы, вызываемые повышением давления пара, происходят вследствие внезапного прекращения поступления воды в полость фурмы. Такие условия создаются, если водоподводящая и водоотводящая трубки фурмы или обе одновременно почему-либо забиваются и не пропускают воду. Тогда оставшаяся в полости фурмы вода испаряется, давление пара, не имеющего выхода, превышает предел прочности фурмы, и она разрушается. При таких взрывах отбрасывается часть фурменного прибора, состоящая из фурменного колена, сопла и самой фурмы.
Образование взрывоопасных газо-воздушных смесей происходит в канале фурмы при остановках доменных печей или при осадках шихтовых материалов, когда давление газов и дутья выравнивается; иногда давление газов в горне становится даже выше, чем давление горячего дутья в фурменных приборах. В такие периоды газы из горна проникают в фурменные рукава и здесь встречаются с воздухом дутья, который так же, как и газы, нагрет до высокой температуры; встреча их приводит к воспламенению и горению, которое иногда происходит со взрывом.
Особенно опасна встреча газов с воздухом дутья в присутствии воды (вследствие течи фурм). Температура газов и дутья в фурменном приборе может оказаться ниже температуры их воспламенения вследствие потери тепла на испарение воды. В результате образуются взрывоопасные газо-воздушные смеси.
В арматуре шлаковой летки фур мочка является отверстием для выпуска шлака из горна доменной печи. Отливаются фурмочки из бронзы и обрабатываются на токарных станках. Через отверстие шлаковой фурмочки выпускается только шлак. Если по каким-либо причинам вместе со шлаком из летки начинает выходить чугун, то немедленно произойдет прогар фурмочки, и охлаждающая вода начнет поступать в шлаковый канал. Обычно это заканчивается соприкосновением воды с жидким чугуном или шлаком и взрывом с выбросом фурмочки. Взрывы в шлаковых ковшах происходят сравнительно редко. Они возникают вследствие скопления воды на дне чаши. Вода на дне чаши может оказаться также под слоем остывшего, неслитого остатка шлака.
3.Взрывы в мартеновских цехах.
Взрывы, вызываемые водой или влажными материалами, загружаемыми в мартеновские печи, являются наиболее частыми. Вода попадает в печи вместе с шихтовыми материалами в виде отдельных кусков льда, снега, обледенелых руд и металлического лома и т. д.
Взрывы, вызываемые попавшей в печь водой, бывают двух видов: глухой — с выбросом через завалочные окна части полурасплавленных шихтовых материалов и длинных языков горящих газов и звонкий, при котором, кроме того, взрывной волной повреждается кладка печи— свод, стенки или головки. Глухие взрывы происходят в период прогрева и плавления шихтовых материалов твердой завалки, а звонкие — во время загрузки в печь добавочных материалов — руды, известняка, лома или холодного чугуна, когда уже все шихтовые материалы расплавлены и в печи находится жидкий металл, покрытый шлаком.
Первый вид взрыва вызывается испарением воды, скопившейся под шихтовыми материалами. Вследствие прогрева сверху заваленных на подину материалов находящаяся в них влага постепенно начинает стекать вниз, собираясь в тех местах, где шихта плохо прогрета. Испарение этой влаги происходит, когда сильно прогревается вся масса шихтовых материалов. Образующийся пар в местах скопления воды не имеет свободного выхода, вследствие чего давление его повышается и достигает такой величины, что он поднимает лежащий над ним слой шихты и с силой прорывается в рабочее пространство печи. Сила взрыва зависит от количества воды, проникшей в печь вместе с шихтовыми материалами, толщины и плотности слоя материалов, лежащих на подине печи.
Второй вид взрывов, вызываемых водой, объясняется сложными физико-химическими процессами, протекающими в мартеновской печи над ванной. В печи во время нормального процесса плавки находится расплавленный металл, покрытый сверху слоем шлака. Загрузка в такую ванну добавочных шихтовых материалов не всегда приводит к их глубокому погружению в ванну; многие из них погружаются в шлак и находятся на поверхности металла.
Причины взрывов, происходящих в печах при попадании воды па раскаленный шлак или при завалке влажных шихтовых материалов, изучены недостаточно.
Вода, попавшая на поверхность шлака в печи, нагревается и переходит в пар; одновременно происходят процессы химического взаимодействия образующего пара со шлаком по реакции: 2FeO + H2O = Fe2O3 + H2
Водород и водяной пар поднимаются с поверхности шлака, смешиваются с газовой атмосферой печи; в результате этого взрываемость окиси углерода в газовой атмосфере печи сильно повышается. Так как газы в печи нагреты до температуры, превышающей точку их самовоспламенения, и имеют избыток кислорода, то происходит взрыв смеси.
Большая Энциклопедия Нефти и Газа
Очень резкое охлаждение в воде деталей и инструментов из углеродистых сталей сопряжено с опасностью возникновения закалочных трещин, особенно если деталь или инструмент имеют сложную конфигурацию или неравномерную толщину стенок. Более же мягкую закалку в масле нельзя применить, потому что твердость углеродистых сталей, закаленных в масле, получается низкой. В таких случаях применяют закалку через воду в масло. Этот способ состоит в том, что деталь или инструмент сначала охлаждают в воде, а спустя несколько секунд, когда деталь или инструмент потемнеют, их переносят для окончательного охлаждения в масло. [1]
При очень резком охлаждении жидкого ж-ксилола иногда образуется конгломерат кристаллов, двупреломление которых несколько отличается от обычного. Это фазовое превращение аналогично превращению, наблюдаемому в кристаллах толуола вблизи температуры плавления. Для проверки этого предположения может быть исследована кристаллизация ж-ксилола с малыми добавками других изомеров ксилола, которые чаще всего являются загрязнениями продажного препарата. Смесь ж-ксилола уже с 5 % - ксилола при резком охлаждении жидким азотом затвердевает в виде аморфной массы. [3]
При соприкосновении с холодным защищаемым металлом частицы подвергаются очень резкому охлаждению , что фиксирует содержание газов в частицах, соответствующих жидкому состоянию, и оказывает соответствующее влияние на структурные превращения. [4]
Однако при литье под давлением изменения в плотности обычно меньше, чем изменения, достигаемые специально при очень медленном или очень резком охлаждении расплава термопласта . Уменьшение скорости охлаждения может быть достигнуто не только за счет повышения температуры формы, но и при увеличении толщины изделия. [6]
Если перегрев так высок, что превышена температура начала превращения перлита в аустенит ( 727 для углеродистой стали), то в микроструктуре металла разрушенных труб из углеродистой и низколегированных перлитных сталей около места разрушения можно наблюдать участки образования мартенсита. Это происходит потому, что аустенит при очень резком охлаждении струей воды или пара, вырывающейся с большой скоростью из разрыва, закаливается на мартенсит. [7]
Бели перегрев так высок, что превышена температура начала превращения перлита в аустенит ( 727 С для углеродистой стали), то в микроструктуре металла разрушенных труб поверхностей нагрева из углеродистой и низколегированных перлитных сталей около места разрушения можно наблюдать участки образования мартенсита. Это происходит потому, что аустенит при очень резком охлаждении струей воды или пара, вырывающейся с большой скоростью из разрыва, закаливается на мартенсит. [8]
Время охлаждения зависит от температуры формы, температуропроводности и толщины стенки изделия. Чем ниже температура охлаждающей поверхности, тем меньше время охлаждения, однако при очень резком охлаждении может произойти коробление изделий, особенно при изготовлении их из полиэтилена высокой плотности. При низкой температуре формы затрудняется оформление ребер или острых углов, при высокой температуре формы на изделии после его извлечения могут появиться гофры или складки, вызванные неравномерной усадкой. Температура формы при переработке кристаллизующихся полимеров влияет на скорость кристаллизации, степень кристалличности и соответственно на качество изделий. [9]
Контроль скорости охлаждения в лабораторном прессе несложен, но он не экономичен и не практичен. В отличие от этого применяют термообработку или кондиционирование после обычного цикла плавления, включающего очень резкое охлаждение . Из-за трудностей выдержки структуры и свойств процедура термообработки разрабатывалась постепенно, пока не приобрела современный вид. [10]
В общем случае увеличение скорости отвода тепла вызывает повышение прочностных и пластических свойств. Поэтому механические свойства отливок, полученных литьем в песча-но-глинистые формы и по выплавляемым моделям, оказываются более низкими, чем при литье в кокиль, а при литье под давлением свойства настолько повышаются из-за очень резкого охлаждения , что, например, для силуминов оказывается ненужным модифицирование натрием. По этой же причине при литье в кокиль и под давлением допускается большее содержание вредной примеси железа. [11]
При охлаждении фенилциклопропана образуется конгломерат кристаллов неправильной формы. Даже при очень резком охлаждении соединение не стеклуется, а кристаллизуется. В слоях фиксированной толщины растут преимущественно кристаллы двух типов, отличающиеся двупреломлением. Спектры этих кристаллов, полученные в поляризованном свете, отличаются одной из компонент. Вероятно, развитые плоскости этих кристаллов соответствуют двум срезам кристаллической решетки, имеющим одно общее ребро. [13]
Термическая обработка дисперсионно-упрочняемых электродных сплавов включает операции закалки и отпуска. При нагреве под закалку легирующие элементы переходят в твердый раствор. Степень изменения электропроводности, контролируемая прибором ИЭ-1, который используется практически для любых деталей диаметром или размерами более 15 мм и толщиной более 3 - 5 мм может служить технологическим средством контроля качества операций закалки. Для более полного перевода в твердый раствор легирующих элементов необходима высокая температура нагрева ( 850 - 1000 С), близкая к эвтектической, для создания метастабильного пересыщенного твердого раствора и очень резкое охлаждение . Замедление охлаждения приводит к преждевременному выпадению растворенных элементов и снижению эффекта закалки. Выделение упрочняющих фаз из пересыщенного твердого раствора в дисперсном состоянии значительно увеличивает твердость и электропроводность сплава. Это выделение происходит в процессе отпуска, температура которого для медных сплавов обычно находится в пределах 400 - 480 С. [14]
Быстрое охлаждение металла при закалке всегда вызывает внутренние напряжения, которые могут повести к короблению и даже трещинам в детали, и сообщает металлу хрупкость. Для устранения этих дефектов производят отпуск. [1]
Применяют обычное, замедленное, ускоренное и быстрое охлаждение металла после прокатки. [2]
Ввиду быстрого охлаждения металла в металлической форме литниковые системы делаются с большим сечением каналов. Длина каналов берется возможно меньшей и в них не допускаются острые углы, повороты или резкие изменения сечений. [3]
При очень быстром охлаждении металла скорость диффузии углерода из 7 -фазы оказывается недостаточной для удаления из нее лишнего углерода, в результате чего аустенит стали превращается в феррит с избыточным ( против естественного предела растворимости) содержанием углерода. Пересыщенный твердый раствор углерода в я-железе называется мартенситом. Таким образом, при быстром охлаждении стали, нагретой до аустенитного состояния, в ней происходит мартенситное превращение аустенита. [4]
Эти условия иногда осуществляются при быстром охлаждении металлов , что приводит к появлению ячеек правильной гексагональной формы. Подобные же процессы, как полагают, имеют место при затвердевании ряда полимеров, например полиэтилена. При достаточно высокой степени конституционного переохлаждения возможен дендритный рост кристаллов. [5]
Для предотвращения сквозняков в трубе и быстрого охлаждения металла шва торцы свариваемых звеньев или секции следует закрывать инвентарными заглушками или иными приспособлениями. Запрещается опускать в снег стыки газопровода после сварки. [6]
Явление переохлаждения особенно часто происходит при быстром охлаждении металлов и органических веществ. [8]
В условиях сварки гидридное превращение смещается в сторону комнатной температуры из-за очень быстрого охлаждения металла . При комнатной температуре релаксация внутренних напряжений затруднена, и по этой причине гидридное превращение, происходящее в условиях сварки, сильнее способствует возникновению трещин, чем при охлаждении титановых изделий после отжига. [9]
Физическая идея закалочных методов [24] состоит в том, что при быстром охлаждении металлов можно зафиксировать в решетке высокотемпературную равновесную концентрацию вакансий. Избыточные вакансии вызывают изменение некоторых физических свойств закаленных металлов. Эти изменения обычно пропорциональны концентрации вакансий, а скорость восстановления свойств в процессе отжига избыточных вакансий характеризует подвижность вакансий. [10]
Алюминиевые сплавы в расплавленном состоянии активно растворяют водород, который при быстром охлаждении металла не успевает покинуть сварочную ванну и образует в наплавленном металле поры и раковины. Основным источником появления водорода в наплавленном металле является влага, поэтому перед сваркой детали рекомендуется прогреть, а гигроскопичный флюс просушить. [11]
Алюминиевые сплавы в расплавленном состоянии активно растворяют водород, который при быстром охлаждении металла не успевает покинуть сварочную ванну и образует в наплавленном металле поры и раковины. Основным источником появления водорода в наплавленном металле является влага, поэтому перед сваркой детали рекомендуется прогреть, а гигроскопичный флюс просушить. [12]
Алюминиевые сплавы в расплавленном состоянии активно растворяют водород, который при быстром охлаждении металла не успевает покинуть сварочную ванну и образует в наплавленном металле поры и раковины. [13]
Старение после закалки является результатом фиксирования в состоянии пересыщенного твердого раствора при быстром охлаждении металла от температуры 720 С до комнатной температуры примесей ( углерода и азота) в количествах, соответствующих их максимальной растворимости при температуре 720 С. В процессе последующего вылеживания происходит распад пересыщенного твердого раствора и выделение избыточного количества углерода и азота в виде тонкодисперсных карбидов и нитридов, скапливающихся вокруг участков решетки. [14]
Сварка чугуна сопровождается отбеливанием материала, что объясняется большим содержанием углерода, выгоранием кремния и быстрым охлаждением металла . Из-за усадки материала возникают значительные внутренние напряжения. [15]
Превращения, происходящие в железе и стали при нагреве и охлаждении
Внимательно всмотревшись в излом металла, ясно можно увидеть, что он представляет собой нагромождение (совокупность) отдельных кристаллов (зерен), крепко сцепленных между собой. Мельчайшей частицей металла, как и всякого другого вещества, является атом. В элементарных ячейках, из которых состоят кристаллы железа, атомы расположены в определенном порядке. Это расположение изменяется в зависимости от температуры нагрева. При любой температуре ниже 910° атомы в ячейках кристаллов располагаются в виде куба, образуя так называемую кристаллическую решетку альфа-железа. В этом кубе восемь атомов расположены в углах решетки и один в центре.
При нагреве свыше 910° происходит перегруппировка атомов и кристаллическая решетка представляет собою форму куба с четырнадцатью атомами; условно ее называют решеткой гамма-железа. При температуре 1390° решетка гамма-железа перестраивается в решетку с девятью атомами, носящую название дельта-железо. Эта решетка отличается от решетки альфа-железа несколько большим расстоянием между центрами атомов и сохраняется до момента расплавления железа, т. е. до 1535° (Рис. 1).
Перестройка кристаллической решетки при медленном охлаждении происходит в обратном порядке: дельта-железо при 1390° превращается в гамма-железо, а гамма-железо при 898° превращается в альфа-железо.
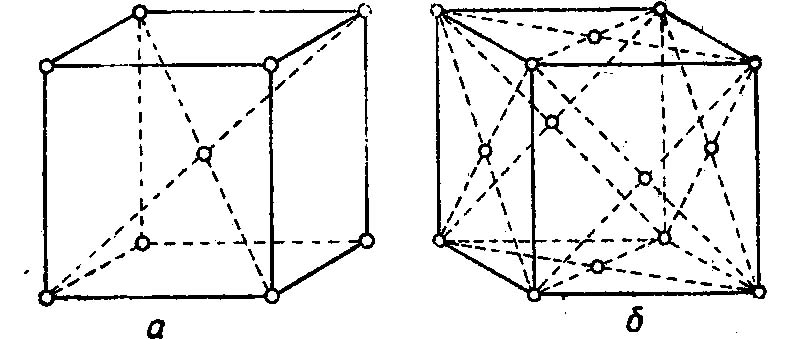
Рис. 1. Строение кристаллической решетки: а — альфа и дельта железа; б — гамма железа.
Критические точки превращения
На рис.2 показаны кривые охлаждения и нагревания чистого железа. Как видно из этих кривых, в процессе перестройки одной решетки в другую, а также при расплавлении и затвердевании железа происходят температурные остановки, являющиеся результатом выделения дополнительного количества тепла при охлаждении и поглощении дополнительного количества тепла при нагревании.
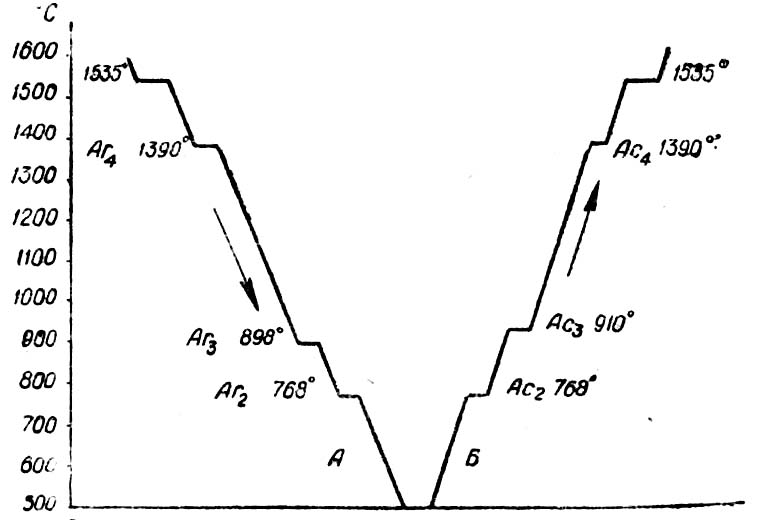
Рис. 2. Кривые охлаждения и нагрева чистого железа.
Температурные остановки, при которых происходят перестройки решеток, называются критическими температурами или критическими точками и обозначаются Аrпри охлаждении и Ас при нагревании. В точках Аr2и Ас2,не происходит перестройка атомной решетки, а изменяются магнитные свойства железа. При температуре выше 768° железо теряет способность притягиваться магнитом. При очень малой скорости нагревания и охлаждения критические точки А с3и Аr3не совпадают друг с другом на 12°. При увеличении скорости охлаждения несовпадение критических точек увеличивается, так как температура значительно снижается и железо переохлаждается. Это явление, носит название гистерезис.
При нагревании и охлаждении стали происходит также перестройка атомной решетки, но температуры критических точек не постоянны. Они зависят от содержания углерода и легирующих примесей в стали, а также от скорости нагревания и охлаждения.
На рис. 3 представлена диаграмма состояния углеродистой стали при медленном охлаждении и нагревании.
Рис.3. Диаграмма состояния углеродистых сталей.
Структура стали
Структурой стали называется внутреннее ее строение. Углерод в стали находится в виде химического соединения с железом, и это соединение называется — цементит. Кроме цементита, в стали имеется феррит, представляющий собой почти чистое железо. В зависимости от содержания углерода большая или меньшая часть феррита находится в механической смеси с цементитом, образуя новую структуру — перлит. Если небольшой кусок металла прошлифовать, отполировать и протравить в специальном реактиве, то под микроскопом можно различить структуры. Ниже приводится описание структур железоуглеродистых сплавов.
Аустенит представляет собою твердый раствор углерода и других элементов в гамма-железе. Наибольшее содержание углерода, которое может раствориться в ау-стените — это 2%. Аустенит образуется при затвердевании жидкой стали и при нагреве твердой стали выше критических температур.
В обычных сталях аустенит устойчив только лишь при температуре выше критических точек. При охлаждении, даже самом быстром, с этих температур аустенит превращается в другие структуры. При комнатной температуре аустенит полностью сохраняется в ряде марок нержавеющих сталей, в высокомарганцовистой стали и в незначительном количестве остается при закалке некоторых марок инструментальной и конструкционной сталей.
Аустенит мягок, пластичен, тягуч, мало упруг. Твердость его по Бринелю находится в пределах 170—220.
Аустенит немагнитен, обладает невысокой электропроводностью.
Феррит представляет собой твердый раствор углерода и других элементов в альфа-железе. Наибольшее содержание углерода, которое может раствориться в феррите, это 0,04%. Феррит устойчив при температурах ниже критической точки AC1. Он выделяется из аустенита при медленном охлаждении последнего ниже A6i. Феррит мягок, сильно тягуч. Твердость HB= 60—100. Феррит магнитен до 768°. Свыше этой температуры он теряет магнитные свойства.
Цементит представляет собой химическое соединение железа с углеродом Fe3C—карбид железа. Цементит содержит углерода 6,67%. Выделяется из жидкого и твердого раствора при медленном охлаждении. Цементит весьма тверд и хрупок. Твердость его НB= 800—820. Он магнитен до 210°. Выше этой температуры цементит теряет магнитные свойства.
Перлит представляет собой механическую смесь феррита и цементита. Он образуется из аустенита при медленном его охлаждении. Температура превращения аустенита в перлит 723°С. При весьма медленном переходе через эту температуру цементит образуется в виде зерен (глобулей), и тогда перлит называется зернистым. При более быстром охлаждении цементит приобретает форму пластинок, и такой перлит называется пластинчатым. При весьма быстром охлаждении в результате значительного переохлаждения аустенита вместо перлита получаются другие структуры, о которых речь будет ниже.
Перлит магнитен, прочен и пластичен. Твердость его находится в пределах от 160 до 230 кг/мм 2 по Бринелю. При обработке резанием наиболее чистую поверхность дает структура зернистого перлита.
Мартенсит образуется в результате весьма быстрого охлаждения (закалки) аустенита. При быстром охлаждении успевает произойти перестройка кристаллической решетки гамма-железа в решетку альфа-железа, выделение же углерода в карбид железа не успевает произойти, и он весь остается растворенным в решетке альфа-железа. Так как нормально альфа-железо может растворить в себе не более 0,04% углерода, то такой раствор называют пересыщенным. Он отличается весьма большой твердостью (свыше Rc= 60) и хрупкостью. Следует указать, что решетка альфа-железа, получающаяся в результате закалки, имеет искаженную форму. Так, размеры ее граней не одинаковы — в одном направлении они удлинены за счет других (см. рис. 4). Такая решетка называется тетрагональной. Чем больше в стали углерода, тем больше тетрагональность решетки и тем более велики внутренние напряжения. При нагревании до температур 100—200° тетрагональность мартенсита уменьшается, форма кристаллической его решетки приближается к форме правильного куба, и вместе с этим уменьшаются внутренние напряжения. Мартенсит магнитен.
Рис. 4. Строение кристаллической решетки стали, закаленной на мартенсит.
Троостит представляет собой высокодисперсную (мелкораздробленную) смесь феррита и карбидов. Он образуется при охлаждении аустенита с замедленной против закалки скоростью или в результате нагрева (отпуска) мартенсита в пределах 250—400°.
При нагреве закаленной стали происходит постепенное выделение углерода из кристаллической решетки с образованием карбидов. Троостит менее прочен, более пластичен, чем мартенсит. Твердость его НB330—400. При охлаждении аустенита в горячих средах в интервале 250—400° (изотермическое превращение аустенита) происходит образование игольчатого троостита, несколько более прочного, чем обычный троостит.
Сорбит представляет собой дисперсную смесь феррита и карбидов. Он образуется при охлаждении аустенита с небольшой скоростью или при нагреве (отпуске) мартенсита до 400—650°. Карбиды сорбита более крупные, чем троостита. Сорбит пластичен, вязок и магнитен. Твердость НВ 270—320.
Ледебурит представляет собой эвтектическую смесь аустенита и цементита. Он содержит углерода 4 3% Образуется ледебурит при затвердевании жидкого сплава с содержанием углерода свыше 2%. Ледебурит хрупок.
На рис. 5. представлены фотоснимки структур стали с различным содержанием углерода.
Структура стали с содержанием углерода 0,83% состоит из сплошного перлита и называется эвтектоидной; при меньшем содержании углерода структура стали состоит из перлита и феррита и носит название доэвтектоидной, а при большем содержании углерода — из перлита и цементита и называется заэвтектоидной. Температура 723°, при которой перлит переходит в аустенит, также называется критической и обозначается Ас.
Для того чтобы доэвтектоидную и эвтектоидную сталь полностью отжечь, нормализовать или закалить, их нужно нагреть до такой температуры, при которой они перешли бы в аустенитное состояние.
Рис. 5. Микроструктура отожженной углеродистой стали:
а - с содержанием углерода -0,1%
б - с содержанием углерода -0,85%
в - с содержанием углерода -1,1%
Превращения, происходящие в стали при нагревании
По диаграмме на рис. 3 можно проследить за изменениями структуры трех разных марок стали при нагревании:
- Сталь с содержанием углерода 0,83%. Структура стали представляет собой перлит. При температуре 723° в точке Aс1 перлит переходит в аустенит.
- Сталь с содержанием углерода 0,4%. Структура стали представляет собой перлит и феррит. При температуре 723° в точке К1 перлит переходит в аустенит, и по мере повышения температуры происходит растворение свободного феррита в аустените. При пересечении линии GS в точке К2 закончится растворение феррита и структура будет полностью состоять из аустенита. Для этой стали точка К1на диаграмме будет нижней критической точкой Ас1,а К2— верхней критической точкой Ас1,.
- Сталь с содержанием углерода 1,2%. Структура стали представляет собой перлит и цементит. При температуре 723° в точке Pi перлит переходит в аустенит, и при дальнейшем повышении температуры происходит постепенное растворение цементита в аустените. При пересечении линии SEв точке Р2 это растворение закончится. Для этой стали точка Р1 явится нижней критической точкой Ас1, а точка Ρ2 — верхней критической точкой, которая для заэвтектоидных сталей обозначается Асm.
Линия на диаграмме, обозначенная буквами GS, соответствует окончанию растворения феррита в аустените в доэвтектоидных сталях, а линия SE соответствует окончанию растворения цементита в аустените в заэвтектоидных сталях.
Следует указать, что заэвтектоидные стали при операциях термической обработки не нагревают выше линии Аcт(такая высокая температура нагрева приведет к перегреву и ухудшению свойств стали), а ограничиваются нагревом выше первой критической точки ACl, что полностью обеспечивает получение необходимых свойств.
Превращения, происходящие в стали при медленном охлаждении
В сталях, нагретых до аустенитного состояния, при весьма медленном охлаждении произойдут обратные превращения, а именно:
а) в стали с содержанием углерода 0,83% аустенит превратится в перлит;
б) в стали с содержанием углерода 0,4% сначала из аустенита начнет выделяться феррит, а затем в районе температуры 700° оставшийся аустенит превратится в перлит и
в) в стали с содержанием углерода 1,2% сначала из аустенита выделится цементит, а затем в районе температуры 700° оставшийся аустенит превратится в перлит.
Даже при весьма медленном охлаждении температура распада аустенита не совпадает с теми температурами, при которых аустенит образовался при нагревании. Чем скорость охлаждения больше, тем больше становится гистерезис, т. е. разница между критическими температурами (точками) при нагревании и охлаждении.
Превращения, происходящие в стали при быстром охлаждении
Как указывалось выше, при быстром охлаждении не успевает произойти превращение аустенита в перлит с выделением избыточного феррита или цементита, а в зависимости от скорости охлаждения аустенит превращается в новые структуры - мартенсит, троостит или сорбит. Сталь с этими структурами отличается от сталей со структурами перлита и феррита повышенной твердостью, прочностью и уменьшенной пластичностью. Если углеродистую сталь, нагретую выше критических температур, охладить очень быстро, то аустенит превратится в мартенсит и это превращение начнется лишь при температуре около 200°. При несколько меньшей скорости охлаждения образуется структура троостит, а при еще меньшей — сорбит.
В производственных условиях при охлаждении углеродистой инструментальной стали в воде образуется мартенсит, при охлаждении в масле — троостит и при охлаждении в струе воздуха -сорбит. На рис. 6 показаны микроструктуры закаленной стали.
Рис. 6. Микроструктура закаленной стали:
а — игольчатый мартенсит;
В легированных сталях, благодаря присутствию специальных элементов, для образования мартенсита не требуется столь большой скорости охлаждения, как для углеродистых сталей, и мартенсит образуется при охлаждении в масле, а для быстрорежущих сталей — и при охлаждении на воздухе.
Троостит и сорбит можно получить не только в результате ускоренного охлаждения, нои путем нагрева закаленной стали, имеющей структуру мартенсита, до температуры ниже Aс1, т. е. путем отпуска стали. В этом случае троостит получается при нагреве стали до 400°, а сорбит—при нагреве до 650°. При нагреве до промежуточных температур получаются смешанные структуры: при нагреве от 250—400° — мартенсит и троостит и при нагреве от 400—650° — троостит и сорбит. В производственных условиях троостит и сорбит получают путем отпуска закаленной стали.
Превращения, происходящие в стали при охлаждении в среде, имеющей температуру выше 200° (изотермическое превращение)
Если деталь, нагретую выше критической точки, поместить в среду, имеющую температуру от 700 до примерно 200°, и выдержать в ней до выравнивания температуры по всему сечению, то аустенит превратится в ту структуру, которая соответствует превращению при данной температуре.
О поведении стали при изотермической обработке, выборе температуры и времени выдержки судят по кривым изотермического превращения, построенным для разных марок стали.
Рис. 7. Диаграмма изотермического превращения аустенита углеродистой стали.
На рис. 7 дан вид диаграммы изотермического превращения в стали. На горизонтальной оси отложено время начала и конца превращения, а на вертикальной— температура, при которой оно происходит. Линия А с соответствует переходу аустенита в перлит, а линия Мн — образованию мартенсита из аустенита. На кривой I начинаются, а на кривой II заканчиваются структурные превращения.
Если углеродистую инструментальную сталь, нагретую до 800°, поместить в масло, расплавленную соль или щелочь при температуре 250°, в ней образуется игольчатый троостит с высокой твердостью Rc=45—55. Если эту же сталь охладить в среде, имеющей температуру свыше 600°, в ней образуется перлит и такая сталь легко обрабатывается на станках. При охлаждении стали в среде с промежуточными температурами образуются структуры троостита и сорбита с соответствующей твердостью.
Изотермический отжиг нашел большое применение при термической обработке инструментальных сталей как процесс, резко уменьшающий время по сравнению с другими видами отжига.
Изотермическая закалка в инструментальном деле применяется редко из-за недостаточной для инструмента твердости, достигаемой при этом процессе.
Источник:
Остапенко Н.Н.,Крапивницкий Н.Н. Технология металлов. М. Высшая школа,1970г.
Каменичный И.С. Практика термической обработки инструмента. Киев, 1959 г.
Читайте также:
