Что такое двухвалентный металл
Обновлено: 02.05.2024
Ионы двухвалентного металла Ме2 и трехвалентного железа Fe3 в решетке ферритов MeO - Fe2O3 могут быть расположены по-разному, образуя при этом один из двух типов шпинели: прямую ( нормальную) или обращенную. [31]
Хлориды двухвалентных металлов , особенно ZnCl2, действуют менее эффективно. Определенное влияние оказывает также характер аниона. Сульфаты по сравнению с хлоридами в меньшей степени снижают выход левоглкжозана. Изменение содержания Na2SO4 с 0 05 до 0 3 % вызывает некоторое возрастание выхода продуктов глубокого распада, дальнейшее же увеличение соли не оказывает влияния на направление процесса деструкции. Примерно такая же закономерность наблюдается для других солей. [33]
Сульфонаты двухвалентных металлов могут образовываться и в результате обменной реакции между сульфонатами натрия и солями жесткости при приготовлении водных СОЖ на жесткой воде. В этом случае целесообразно вводить в СОЖ сульфонаты натрия с высокой солюбилизирую-щей способностью; они поглощают нерастворимые в воде мазеобразные сульфонаты поливалентных металлов внутримицеллярно, сохраняя стабильность эмульсий длительное время. [34]
Соли двухвалентных металлов плохо растворимы в воде, в связи с чем при растворении 2 4-дихлорфеноксиуксусной кислоты в жесткой воде могут выделяться осадки. [35]
Соли двухвалентных металлов плохо растворимы в воде, в связи с чем при растворении 2 4 - Д в жесткой воде могут выделяться осадки. [36]
Соли двухвалентных металлов плохо растворимы в воде, в связи с чем при растворении 2, 4 - Д в жесткой воде могут выделяться осадки. [37]
Катионы двухвалентных металлов даже в незначительном количестве ( следы) могут значительно уменьшить стабильность вискозы и снизить г и / С при данном значении Ycs2 - так как эти катионы образуют межмолекулярные связи, увеличивают т ] стр и тем самым снижают устойчивость вискозы. [38]
Ионы двухвалентного металла Ме2 и трехвалентного железа Fes в решетке ферритов MeO - Fe2O3 могут быть расположены по-разному, образуя при этом один из двух типов шпинели: прямую ( нормальную) или обращенную. [39]
У двухвалентных металлов имеется два внешних электрона в s - состоянии на атом ( например, у магния два Ss-электрона), поэтому зона s - уровней будет целиком заполнена. В этом случае Ss-зона также перекрывается с более высокими зонами, однако сначала мы рассмотрим, что получилось бы, если бы зоны не перекрывались. Если бы Ss-зона была отделена от следующей более высокой зоны запрещенной областью энергий, то невозможно было бы ускорить какой-либо из электронов этой зоны приложением электрического поля обычной величины, так как в этой зоне нет свободных уровней с немного большей энергией, на которые мог бы перейти электрон. Таким образом, хотя в таком твердом теле имелось бы много движущихся электронов, ни один из них не мог бы участвовать в электропроводности, поскольку только очень сильное электрическое поле может вызвать переход электрона в следующую, более высокую зону, если зазор между зонами не очень мал. При температурах, не слишком высоких ( до 2000 К), только очень небольшое количество электронов переходит в более высокую зону. Итак, если бы зоны не перекрывались, двухвалентные элементы в твердом состоянии представляли бы собой диэлектрические кристаллы, у которых валентные электроны целиком заполняют одну из зон. В действительности же у всех двухвалентных элементов в твердом состоянии зоны перекрываются, поэтому часть валентных электронов может ускоряться электрическим полем, вследствие чего двухвалентные элементы в твердом состоянии являются металлами. У некоторых четырехвалентных элементов в твердом состоянии заполненные зоны не перекрываются, поэтому, например, углерод в виде алмаза и не содержащие примесей кремний и германий имеют очень малую электропроводность. [40]
Окислы двухвалентных металлов гораздо менее эффективны в устранении расслаивания. Добавление катионов с высоким зарядом может даже привести-к разделению фаз в первоначально гомогенном расплаве. [42]
Окисел двухвалентного металла содержит 12 5 % кислорода. [43]
Из производных двухвалентных металлов подобное положение не наблюдается у аммиакатов двухвалентной платины и некоторых аналогичных производных с органическими аминами. [44]
Сульфаты двухвалентных металлов Mg , Mn, Fe, Ni, Co и Zn, кристаллизующиеся обычно с семью молекулами воды, называются купоросами. Последнюю молекулу воды ( связанную водородной связью с ионом SO -) купо-росы теряют с трудом, только при нагревании. [45]
Валентность

Из этой статьи вы узнаете, что называется валентностью в химии, научитесь находить ее значение и использовать для составления химических формул.
О чем эта статья:
Понятие валентности
Валентность — это способность атома химического элемента образовывать определенное число химических связей с другими атомами.
Рассмотрим структурную формулу H2SO4, с помощью которой можно определить, как атомы связаны между собой в веществе:
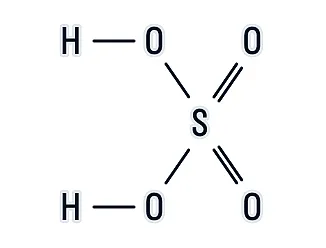
Исходя из структуры, можно сделать выводы:
атомы водорода H имеют одну химическую связь, то есть одновалентны;
сера S имеет шесть химических связей, то есть шестивалентна;
каждый атом кислорода O имеет две химические связи — двухвалентен.
Валентность обозначается римской цифрой над знаком химического элемента в формуле. Например:
Атом натрия имеет валентность, равную 1, а атом кислорода — равную 2.
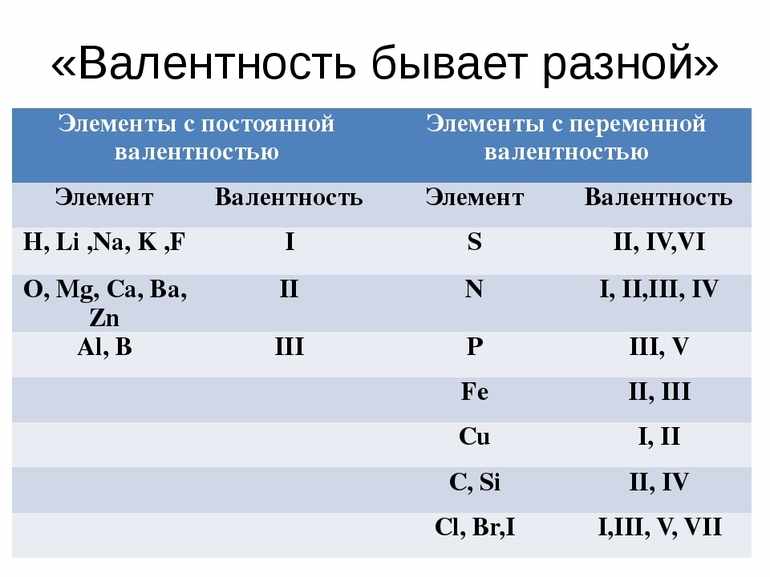
Постоянная и переменная валентность
Среди всех элементов выделяют две группы: с постоянной и переменной валентностью.
У элементов с постоянной валентностью в любом соединении она одинакова. Эти элементы и проявляемую ими валентность придется выучить.
O, Be, Mg, Ca, Ba, Zn
Переменная валентность меняется в зависимости от соединения. Элементов с переменной валентностью большинство. Как правило, они характеризуются высшей, промежуточной и низшей валентностью:
высшая валентность для элементов главных подгрупп совпадает с номером группы (№гр);
низшая валентность вычисляется по формуле: 8 − №гр;
промежуточная валентность — число между низшей и высшей валентностью. Обычно промежуточные валентности соответствуют четности группы.
Пример: как определить валентность по таблице Менделеева
Сера S располагается в группе VIА таблицы Менделеева. Значит:
высшая валентность серы равна VI;
вычислим низшую валентность: 8 − 6 = 2. Низшая валентность равна II;
сера расположена в группе VI — это четное число. Значит, промежуточными валентностями будут все четные числа между низшей и высшей валентностью. В случае с серой между числами 2 и 6 расположено только одно четное число — 4. Промежуточная валентность серы — IV.
В таблице собрали все возможные валентности для некоторых химических элементов.
Понятия «степень окисления» и «валентность» — это не одно и то же, хотя в большинстве случаев они численно совпадают. Степень окисления — это условный заряд атома, он бывает положительным или отрицательным. А валентность — способность атома образовывать связи, она не может принимать отрицательные значения.
Как определить валентность химического элемента с переменной валентностью в соединении
Определим валентность азота в соединении N2O3.
Над элементами с постоянной валентностью подпишем ее значение, в нашем случае это кислород:
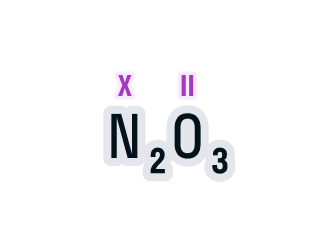
Общее число валентностей каждого элемента в соединении должно совпадать. Находится общее число валентностей с помощью умножения валентности на число атомов данного химического элемента в соединении.
Считаем: общее число валентностей кислорода равно 2 · 3. Значит, общее число валентностей азота в данном соединении будет равно x · 2. Получаем уравнение: х · 2 = 2 · 3.
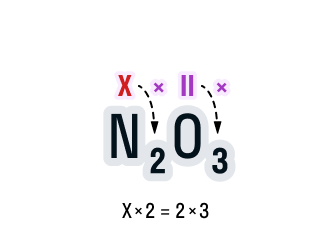
Вычислим х в получившемся уравнении:
Валентность азота в данном химическом соединении равна трем.
Встречаются бинарные соединения (то есть соединения, состоящие только из двух видов атомов), в которых неизвестны валентности обоих атомов элементов. Как найти валентности химических элементов в этом случае?
Для определения значения валентности необходимо запомнить, что неметаллы в бинарных соединениях, расположенные на втором месте, проявляют свою низшую валентность.
Например, в сульфидах (FeS) сера расположена на втором месте и проявляет низшую валентность, равную двум.
Тогда валентность железа в данном сульфиде можно рассчитать по приведенному выше алгоритму — ее значение равно двум.
В хлоридах (например, AgCl) хлор проявляет низшую валентность, равную единице.
Как составить формулу химического соединения по значениям валентностей элементов
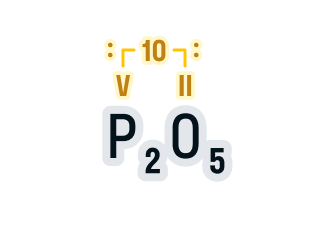
Составим формулу оксида фосфора (V).
Записываем обозначения элементов и над ними указываем валентности. Валентность фосфора в данном соединении указана в названии вещества (V), а валентность кислорода всегда равна II.
Находим НОК валентностей, в нашем случае 5 · 2 = 10. Для удобства запишем его над формулой:
Делим НОК на валентность каждого элемента, а результат записываем в индекс:
10 : 5 = 2 — индекс фосфора;
10 : 2 = 5 — индекс кислорода.
Вопросы для самопроверки
Что такое валентность в химии? Можно ли сказать, что валентность и степень окисления — это одно и то же?
Как узнать высшую и низшую валентность какого-либо химического элемента?
Назовите три химических элемента с валентностью, равной единице.
Среди перечисленных химических элементов выберите те, у которых валентность переменная: K, S, Al, Cu, Ca, P, Si, Mn, Mg, O.
Определите значения валентностей каждого химического элемента в следующих соединениях: FeCl3, Cl2O7, CuS, AlP.
Составьте химические формулы веществ:
Хлорид железа (II).
Оксид углерода (IV).
Верно ли, что значение высшей валентности химических элементов увеличивается по периоду слева направо в таблице Менделеева?
Степень окисления и валентность химических элементов
В научной среде валентностью химических элементов принято называть способность атомов образовывать определённое количество связей. Этот термин неоднократно подвергался изменениям, что связано с развитием теории химической связи. Общее количество атомов у одного и того же элемента отличается. Итоговое значение должно находиться в пределах от I до VIII.

Впервые понятие о валентности было введено в химию задолго до того, как учёные смогли определить строение атома. Этот термин в 1853 году предложил использовать английский химик Франкленд. Сегодня науке достоверно известно, что численная характеристика элементов связана с общим количеством внешних электронов атомов. Это обусловлено тем, что электроны внутренних оболочек не принимают участия в образовании химических связей.
Немногие элементы обладают постоянной численной характеристикой. Например, калий и натрий во всех соединениях остаются одновалентными. К категории двухвалентных элементов относятся:
Трёхвалентным является алюминий. Многие вещества проявляют переменное значение, так как всё зависит от условий протекания химической реакции. В сочетании с хлоридом железо может образовывать сразу два соединения — FeCl3, FeCl2. Валентность железа будет равна III и II соответственно. Численная характеристика перманганат калия (KMnO4) — VII, углекислый газ (СО2) — IV, оксид серы (SO3, SO2) — VI.
Степень окисления является сложным понятием, которое характеризует состояние элемента в химическом соединении. Дополнительно можно проследить за окислительно-восстановительной реакцией. Значение окисления будет соответствовать формальному заряду, который также можно приписать элементу, руководствуясь тем, что все электроны перешли к более электроотрицательному атому. Но и в этом случае есть свои нюансы.
Нужно разбираться в общих тенденциях изменения электроотрицательности. В любом элементе атом стремится заполучить устойчивую конфигурацию внешнего электронного слоя (октетная оболочка инертного газа). За счёт этого электроотрицательность химических элементов в периоде будет увеличена. Для лучшего понимания этого правила следует рассмотреть пример. Сера (S) будет более электроотрицательна, нежели фосфор (Р) и кремний (Si). Окислительное число принято обозначать арабской цифрой.
Применение формул
В таблице валентности можно посмотреть значение любого химического вещества. Это самый простой вариант, так как не нужно проводить никаких математических расчётов. Численной характеристикой водорода является единица, так как это вещество может связываться с другими атомами. В остальных случаях используемое число указывает на то, какое именно количество атомов водорода можно присоединить в конкретном случае.

К примеру, валентностью Н в молекуле HCl является единица. В этом случае использование индекса не предусмотрено, так как численная характеристика водорода и хлора равна единице. Эти химические вещества относятся к разряду одновалентных элементов.
Но также можно рассмотреть другой пример. Валентность C в CH4 — IV, а H — I. Поэтому вместе с водородом нужно указать цифру 4. Формулу метана можно записать так: СН4. Многие элементы отлично взаимодействуют с кислородом, который при любых условиях остаётся двухвалентным. Именно поэтому в формуле Н2О, в которой присутствует одновалентный водород и двухвалентный кислород, рядом с Н указан индекс 2. С помощью такой записи можно показать, что молекула воды включает в себя 2 атома водорода и всего 1 атом кислорода.
Примеры решения задач
Для корректного определения валентности и степени окисления химических элементов нужно руководствоваться правилами электронейтральности. Благодаря изучению примеров можно повысить уровень знаний по этой теме.
Задача № 1. Нужно рассчитать окислительное число веществ, которые присутствуют в соединении N205. Больше всего притягивает к себе электронные пары атом кислорода, степень окисления которого составляет -2. Атом N2 обладает значением +5. Итоговая сумма степеней окисления будет близка к нулю. Принцип решения этой задачи выглядит следующим образом: 2*(+5) + 5*(-2) = 0.

Задача № 2. Предстоит узнать окислительное число всех веществ, которые участвуют в соединении K2Cr2O7. Калий расположен в первой группе главной подгруппы. Показатель его окисления составляет +1. Cr относится к VI побочной подгруппе, из-за чего у него переменная валентность, которую нужно рассчитать. Окислительное число кислорода равно -2. Для поиска правильного ответа числовую характеристику серы можно обозначить как х. Нужно учесть, что нулю будет соответствовать сумма окисления. Формула будет выглядеть так: 2*(+1) + 2*х + 7 (-2) = 0. Получается, что х = +6.
Задача № 3. Нужно узнать степень окисления соединения Na2SO4. Максимальная валентность Na составляет +1. Этот химический элемент относится к первой группе. Окислительное число кислорода -2. Сера является элементом VI группы, из-за чего используется переменное значение.
Если нужно указать валентность серы в первом возбуждённом состоянии, тогда обозначить это вещество можно как х. Нулю будет равна итоговая сумма окисления. Если учесть количество атомов каждого элемента, тогда можно будет получить следующее уравнение: 2*(+1) + х + 4 (-2) = о. Ответ: х = +6.
Ключевые нюансы
О валентности уместно говорить только в том случае, если речь касается элементов молекулярной природы. Это понятие не может быть задействовано для описания химических связей в соединениях ионного, кластерного, а также кристаллического типа. Нужно запомнить, что в элементе молекулярной природы конечное число валентностей обоих веществ будет равно. Лучше всего использовать наименьшее кратное. Например:

- Если по условиям задачи есть химическая формула Mn2O7 и достоверно известна валентность кислорода, тогда можно легко определить, что наименьшим общим кратным будет — 14. Из этого получается, что валентность Mn — VII.
- Если нужно правильно записать формулу оксида фосфора, тогда следует учесть, что численная характеристика фосфора V, а кислорода — II. Наименьшим общим кратным для Р и О будет 10. Формулу можно записать следующим образом: Р2О5.
Понимание принципов валентности помогает не только решать сложные задачи, но и проводить различные опыты, в том числе на уроках химии.
Читайте также:
