Что такое галогениды металлов
Обновлено: 18.05.2024
Ключевое различие между Галогеном и Галогенидом металла состоит в том, что Галоген представляет собой химический элемент 17-й группы периодической таблицы химических элементов, тогда как Галогенид металла представляет собой соединение, содержащее металл и галоген.
Галогениды металлов представляют собой ионные или ковалентные соединения галогенов. Галоген является химическим элементом, из 17-й группы периодической таблицы химических элементов, более того все эти химические элементы из 17-й группы являются галогенами.
Содержание
- Обзор и основные отличия
- Что такое Галоген
- Что такое Галогенид металла
- В чем разница между Галогеном и Галогенидом металла
- Заключение
Что такое Галоген?
Галогены — это химические элементы 17-й группы периодической таблицы химических элементов. Эта г руппа содержит пять химических элементов: Фтор (F), Хлор (Cl), Бром (Br), Йод (I) и Астат (At). Часто используется символ X, чтобы символизировать галоген. Термин галоген относится к «производству соли». Это означает, что эти химические элементы имеют тенденцию образовывать соли при взаимодействии с металлами. Реакция между галогеном и металлом дает широкий спектр солевых соединений. Галогеновая группа содержит элементы, которые существуют в разных фазах вещества. Например, фтор и хлор являются газами, бром — жидкий, а йод — твердый при комнатной температуре.

Хлор, Бром и Йод
По группе галогенов в периодической таблице химических элементов снижается реакционная способность, увеличивается размер атома, уменьшается электроотрицательность, фаза вещества переходит из газа в твердое вещество и т.д.
Используются галогены в качестве дезинфицирующих средств, например в галогенных лампах, а также в качестве ингредиентов в некоторых медицинских препаратах.
Что такое Галогенид металла?
Галогениды металлов — это ионные или ковалентные соединения металлов и галогенов. Некоторые соединения галогенидов ковалентных металлов встречаются либо в виде отдельных молекул, либо в виде полимерных структур. Все галогены имеют тенденцию реагировать с металлами, образуя галогениды металлов.

Химическая структура галогенида металла — Пентафторид сурьмы
Теоретически, п олучить галогенид металла можно посредством реакции между химическими элементами, но этот тип реакции является практически экзотермическим. Поэтому необходимо использовать другие методы, такие как реакция нейтрализации оксидов и гидроксидов металлов.
Ионные галогениды металлов очень стабильны, таким образом, они имеют тенденцию иметь высокие температуры плавления и кипения. Однако эти соединения свободно растворяются в воде. Некоторые соединения также распадаются. Но они плохо растворимы в органических растворителях. Более того, отдельные молекулы галогенидов металлов имеют сравнительно низкие температуры плавления и кипения.
В чем разница между Галогеном и Галогенидом металла?
Ключевое различие между Галогеном и Галогенидом металла заключается в том, что Галоген представляет собой химический элемент 17-й группы периодической таблицы химических элементов, тогда как Галогенид металла представляет собой соединение, содержащее металл и галоген. Другими словами, Галоген — это химический элемент, а Галогенид металла — это химическое соединение.
Кроме того, еще одно различие между Галогеном и Галогенидом металла состоит в том, что Галоген может существовать в различных фазах вещества, во фторе и хлоре в газовой фазе, в броме в жидкой фазе и в йоде в твердой фазе, но Галогениды металлов существуют только в твердой фазе.
Заключение — Галоген против Галогенида металла
Таким образом, ключевое различие между Галогеном и Галогенидом металла заключается в том, что Галоген представляет собой химический элемент 17-й группы периодической таблицы химических элементов, тогда как Галогенид металла представляет собой соединение, содержащее металл и галоген. По сути, Галоген — это химический элемент, а Галогенид металла — это химическое соединение.
Что такое галогениды металлов
§ 14. Галогениды халькогенов.
Среди различных классов соединений халькогенов их галогениды наиболее многочисленны и разнообразны. Синтезированы и выделены галогенидные соединения, содержащие атомы халькогенов в различных степенях окисления - от низших (SnCl2 и SnBr2 (n = 3-8), Te3Cl2, S2X2 и Se2X2 (X = F, Cl, Br), TeI) до высших (ЭF6). Прочность химических связей сера-галоген (табл.10) понижается от F к I, благодаря чему, например, не образуются бинарные иодиды серы и селена:
Таблица 10.Энергия связи сера-галоген.
| Связь Энергия, кДж/моль | S-F 327 | S-Cl 271 | S-Br 218 | S-I ~170 |
Галогениды халькогенов преимущественно синтезируют взаимодействием простых веществ, либо восстановлением высших галогенидов свободными халькогенами: SeX4 + Se Se2X2.
Фториды во многом отличаются от других галогенидов по устойчивости, химической активности и составу. Соединения FSSF (1,2-дифтородисульфид) и SSF2 (1,1-дифтородисульфид или тионилфторид) и аналогичные S2Cl2 и Se2F2 представляют редкие в неорганической химии примеры структурной изомерии F-S-S-F и . В воде они быстро гидролизуются с выделением S8, HХ и смеси политионовых кислот, например,
S2Cl2 широко используется в качестве вулканизатора резины и хлорирующего реагента при вскрытии некоторых минералов.
Дигалогениды ЭХ2 можно получить галогенированием молекул Э2X2:
ЭХ2 характеризуются низкими температурами кипения. Молекулы ЭХ2 имеют угловую форму. Устойчивость дигалогенидов возрастает к Ро.
Наиболее многочисленны тетрагалогениды, которые синтезируют различными путями: Э + Х2, ЭО2 + Х2, CCl4 + ЭО2 и т.д. Структуры газообразных молекул SF4 и SeF4 описываются по методу отталкивания валентных электронных пар и представляют собой тригональную бипирамиду с экваториальной позицией, занятой неподеленной электронной парой. Благодаря этому структура сильно искажается: экваториальный угол между связями F- S- F уменьшается от идеального 120 о до 103 о и аксиальные атомы Fакс отталкиваются к атомам Fэкв.. При этом идеальный угол Fакс-S-Fакс 180 о уменьшается до 179 о , а длина связей S- Fакс и S- Fэкв оказывается разной (рис.11а). Влияние неподеленной электронной пары у SeF4 еще более сильное: угол Fакс- Sе- Fакс уменьшается до 169.2 о . Тетрахлорид серы SCl4 весьма неустойчив и распадается выше -20 о С. Для твердых галогенидов SeX4 и TeX4 характерно образование тетрамеров. Тетрагалогениды полония имеют солеобразный характер. Тетрагалогениды S, Se, Te и Po, будучи кислотными соединениями, сравнительно легко гидролизуются с образованием соответствующих кислот: SeCl4 + 3H2O H2SeO3 + 4HCl и взаимодействуют с галогенидами металлов: TeF4 + KF K[TeF5] (рис.11б) и TeF4 + 2KF K2[TeF6]. Образование комплексных галогенидов свойственно также и полонию: PoCl4 + 2KCl K2[PoCl6] (рис.11в).
Рис.11. Пространственное строение молекул и ионов галогенидов халькогенов:
Геометрическая форма комплексных ионов [SeCl6] 2- и [TeF6] 2- соответствует правильному октаэдру, а иона [TeF5]- - пирамиде, поскольку одна из вершин октаэдра занята неподеленной электронной парой Te (IV).
Из галогенидов халькогенов в высшей степени окисления получены гексафториды SF6, SeF6 и TeF6. Среди всех галогенидов SF6 выделяется устойчивостью и химической инертностью. Газообразный при комнатной температуре SF6 не имеет запаха и вкуса, не горит, выдерживает нагревание до 500 о С без разложения, не взаимодействует с большинством металлов и неметаллов даже при нагревании. По отношению к воде SеF6 напоминает SF6, но разлагается водными растворами KI и Na2S2O3. TeF6 в течение суток гидролизуется полностью.
Относительная устойчивость SF6 по сравнению с SF4, обусловлена кинетическими факторами. Шесть атомов фтора стерически экранируют атом серы и мешают приближению возможных атакующих групп. Термодинамически же гидролиз SF6: SF6(газ) + 3 H2O(газ) SO3(газ) + 6HF(газ) возможен, поскольку изменение энергии Гиббса этого процесса составляет G о = - 301.2 кДж/моль. В связи с инертностью и исключительными диэлектрическими свойствами SF6 широко используется в качестве газообразного изолятора в высоковольтных аппаратах.
Помимо описанных, синтезированы низшие галогениды SnX2 (X = Cl, Br, n =3-8).
Благодаря меньшей электроотрицательности Cl и Br по сравнению с F и меньшей энергии связей S-Cl и S-Br по отношению к S-F в низших хлоридах и бромидах проявляется способность серы к катенации. С помощью реакций типа: H2Sn + 2S2Cl2 = S4+nCl2 + 2HCl, выделены индивидуальные соединения SnCl2 и SnBr2 (n = 3-8). В смесях существуют дихлоросульфаны до S100Cl2, при этом олигомеры-Sn- стабилизируются образованием концевых связей S-Cl..
У Te существует несколько субгалогенидов, полученных по реакциям Te + X2 и характеризующихся наличием зигзагообразных гомоатомных цепей из атомов Te. Эти цепи во многом аналогичны цепям в свободном теллуре.
Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
Разница между Галогеном и Галогенидом металла
ГАЛОГЕНИДЫ
ГАЛОГЕНИДЫ, хим. соед. галогенов с др. элементами. К галогенидам обычно относят соед., в к-рых атомы галогена имеют большую электроотрицательность, чем др. элемент. Галогенидов не образуют Не, Ne и Аг. К простым, или бинарным, галогенидам ЭХn (n-чаще всего целое число от 1 у моногалогенидов до 7 у IF7 и ReF7, но м. б. и дробным, напр. 7 /6 у Bi6Cl7) относят, в частности, соли галогеноводородных к-т и межгалогенные соединения (напр., галогенфториды). Существуют также смешанные галогениды, полигалогениды, гидрогалогениды, оксогалогениды, оксигалогениды, гидроксогалогениды, тиогалогениды и комплексные галогениды.
По характеру связи элемент-галоген простые галогениды подразделяют на ионные и ковалентные. В действительности связи имеют смешанный характер с преобладанием вклада той или иной составляющей. Галогениды щелочных и щел.-зем. металлов, а также многие моно- и дигалогениды др. металлов-типичные соли, в к-рых преобладает ионный характер связи. Большинство из них относительно тугоплавки и малолетучи, хорошо растворимы в воде; в водных р-рах почти полностью диссоциируют на ионы. Св-вами солей обладают также тригалогениды Р3Э. Р-римость в воде ионных галогенидов, как правило, уменьшается от иодидов к фторидам. Хлориды, бромиды и иодиды Ag + , Сu + , Hg + и Pb + плохо растворимы в воде.
Увеличение числа атомов галогенов в галогенидах металлов или отношения заряда металла к радиусу его иона приводит к повышению ковалентной составляющей связи, снижению р-римости в воде и термич. устойчивости галогенидов, увеличению его летучести, повышению окислит. способности и склонности к гидролизу. Эти зависимости наблюдаются для галогенидов металлов одного и того же периода и в ряду галогенидов одного и того же металла. Их легко проследить на примере термич. св-в. Напр., для галогенидов металлов 4-го периода т-ры плавления и кипения составляют соотв. 771 и 1430°С для КС1, 772 и 1960°С для СаС12, 967 и 975 °С для ScCK, - 24,1 и 136°С для Т1С14. Для UF3 т. пл. ~ 1500°С, UF4 1036 °С, UF5 348 °С, UF6 64,0 °С В рядах соед. ЭХn при неизменном п ковалентность связи обычно увеличивается при переходе от фторидов к хлоридам и уменьшается при переходе от последних к бромидам и иодидам. Так, для A1F3 т. возг. 1280°С, А1С13 180°С, т. кип. А1Вг3 254,8 °С, АlI3 407 °С. В ряду ZrF4, ZrCl4, ZrBr4, ZrI4 т-ра возгонки равна соотв. 906, 334, 355 и 418°С. В рядах MF,, и МС1„, где М-металл одной подгруппы, ковалентность связи уменьшается с ростом атомной массы металла. Фторидов и хлоридов металлов с примерно одинаковым вкладом ионной и ковалентной составляющей связи немного.
Галогениды неметаллов более ковалентны, чем галогениды металлов. Так, т-ры возгонки SiF4 ( - 95 °C и GeF4 ( - 36 °C гораздо ниже, чем у TiF4 и ZrF4, также и т-ры кипения SiCl4 (57,0 °С) и GeCl4(83,12°C) ниже, чем у Т1С14 и ZrCl4. Ковалентные SiF4 и GeF4, в отличие от TiF4 и ZrF4, почти мгновенно гидролизуются водой.
Средняя энергия связи элемент - галоген уменьшается при переходе от фторидов к иодидам и с повышением п (см. табл.).
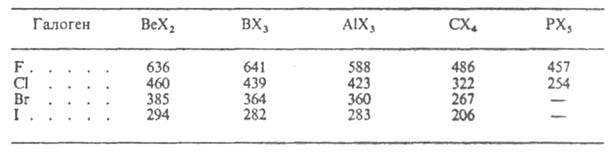
ЭНЕРГИЯ СВЯЗИ В НЕКОТОРЫХ ГАЗООБРАЗНЫХ ГАЛОГЕНИДАХ, кДж/моль
К смешанным галогенидам, содержащим наряду с атомами к.-л. элемента атомы двух или большего числа галогенов, относятся, напр., хлоропентафторид серы SC1F5, бромохлороди-фторид углерода CBrClF2, к межгалогенным соед. ХХn' (п = = 1, 3, 5 или 7)-ClF, BrF3, BrF5, IF7 и др. Полигалогениды содержат анионы Хn - (X == Вг, I; п = 3, 5, 9), напр. КВr3, К19. Гидрогалогениды МНn Хn+1 , или МНn Хn+2 - продукты присоединения галогеноводородов к галогенидам металлов; содержат ионы HnX - n+1. Наиболее устойчивы гидрофториды металлов.
Многие металлы и неметаллы образуют галогениды, содержащие изолированные или мостиковые атомы О (соотв. оксо-и оксигалогениды), напр. оксотрифторид ванадия VOF3, диоксифторид ниобия NbO2F, диоксодииодид вольфрама WO2I2, карбонилгалогениды СОХ2, нитрилгалогениды NO2X, нитрозилгалогениды NOX, тионилгалогениды SOX2. Характер связей элементов с галогенами в окси-и оксогалогенидах неметаллов более ковалентный, чем в соответствующих соед. металлов.
Комплексные галогениды (галогенометаллаты) содержат комплексные анионы, в к-рых атомы галогенов являются лигандами, напр. гексахлороплатинат(IV) калия K2[PtCl6], гептафторотанталат(V) натрия Na[TaF7], гексафтороарсенат(V) лития Li[AsF6]. наиб. термич. устойчивостью обладают фторо-, оксофторо- и хлорометаллаты. По характеру связей к комплексным галогенидам близки ионные соед. с катионами NF4 + , N2F3 + , C1F2 + , XeF + и др.
Для многих галогенидов характерны ассоциация и полимеризация в жидкой и газовой фазах с образованием мостиковых связей. наиб. склонны к этому галогениды металлов I и II групп, А1С13, пентафториды Sb и переходных металлов, оксофториды состава MOF4. Известны галогениды со связью металл - металл, напр. Hg2Cl2.
Фториды значительно отличаются по св-вам от др. галогенидов. Однако в простых галогенидах эти отличия выражены менее резко, чем в самих галогенах, а в комплексных галогенидах-слабее, чем в простых.
Многие ковалентные галогениды (особенно фториды)-сильные к-ты Льюиса, напр. AsF5, SbF5, BF3, A1C13. Фториды входят в состав сверхкислот. Высшие галогениды восстанавливаются металлами и Н2, напр.:Галогениды металлов V-VIII групп, кроме Сr и Мn, восстанавливаются Н2 до металлов, напр.:
Многие ковалентные и ионные галогениды металлов взаимодействуют между собой с образованием комплексных галогенидов, напр.:
Более легкие галогены могут вытеснять более тяжелые из галогенидов. Кислород может окислять галогениды с выделением С12, Вr2 и I2. Одна из характерных р-ций ковалентных галогенидов-взаимод. с водой (гидролиз) или ее парами при нагр. (пирогидролиз), приводящее к образованию оксидов, окси- или оксогалогенидов, гидроксидов и галогеноводородов. Исключение составляют CF4, CC14 и SF6, устойчивые к парам воды при высоких т-рах.
Галогениды получают непосредственно из элементов, взаимод. галогеноводородов или галогеноводородных к-т с элементами, оксидами, гидроксидами или солями, а также обменными р-циями.
Галогениды широко используют в технике как исходные в-ва для получения галогенов, щелочных и щел.-зем. металлов, как компоненты стекол и др. неорг. материалов; они являются промежут. продуктами в произ-ве редких и нек-рых цветных металлов, U, Si, Ge и др.
В природе галогениды образуют отдельные классы минералов, в к-рых представлены фториды (напр., минералы флюорит, криолит) и хлориды (сильвин, карналлит). Бром и иод входят в состав нек-рых минералов в виде изоморфных примесей. Значительные кол-ва галогенидов содержатся в воде морей и океанов, в соляных и подземных рассолах. Некоторые галогениды, напр. NaCl, К.С1, СаС12, входят в состав живых организмов.
О псевдогалогенидах см., напр., Галогены, об орг. галогенидах-Галогенангидриды карбоновых кислот, Галогензамещенные углеводородов. Э.Г. Раков.
===
Исп. литература для статьи «ГАЛОГЕНИДЫ» : нет данных
Читайте также:
