Что такое ион металла
Обновлено: 18.05.2024
Ионы металла , накапливаясь в растворе, вступают во взаимодействие со средой. Бели получающиеся соединения растворимы и таким образом выводятся из сферы реакций, то может происходить глубокое разрушение металла. В случае образования нерастворимых соединений последние осаждаются на поверхности образца в виде пленки, которая затрудняет как переход ионов металла в раствор, так подход электролита к металлу, что приводит к замедлению процесса растворения, а подчас и к полному прекращению коррозии. [19]
Ионы металлов , обычно несущие положительный заряд больше единицы, легко могут образовывать хелаты, и их можно рассматривать как надкислоты, которые могут существовать в нейтральном растворе. [20]
Ионы металлов не катализируют Декарбоксилирование монокарбоно-вых кислот, вероятно, потому, что координирование ионом металла более устойчиво в основном состоянии, чем в переходном. Однако, с другой стороны, можно предположить, что ионы металлов могут катализировать карбоксили-рование веществ, имеющих активные атомы водорода, поскольку комплекс иона металла должен быть более устойчив в переходном состоянии, чем в основном. Основным состоянием мог бы быть метилкарбонат металла или, как было найдено, метоксид магния. [21]
Ионы металлов из препаратов РНК удается удалить только частично, причем для этого требуется либо длительный ( не менее 24 час) диализ против раствора двунат-риевой соли этилендиамннтетрауксусной кислоты ( 2 - ЭДТА), либо применение ионообменных смол. [22]
Ион металла в реакциях такого рода может вести себя по-разному: 1) экранировать ( гасить) отрицательные заряды на фосфатной группе, которые в противном случае стремились бы препятствовать атаке электронной пары нуклеофила, особенно в случае анионного нуклео-фила: 2) увеличивать реакционную способность атакуемого атома, оттягивая на себя электроны; 3) способствовать улучшению свойств уходящей группы; 4) служить связующим звеном между нуклеофилом и субстратом; 5) изменять рК и реакционную способность нуклеофила; 6) изменять, по-видимому, геометрию молекулы субстрата таким образом, чтобы облегчить протекание реакции. Катализ ионами металлов является важным для многих ферментативных процессов и включает, по-видимому, эти же факторы. Кроме того, ион металла может участвовать и в связывании субстрата на ферменте в правильном положении. [23]
Ионы металлов сильно различаются по эффективности действия, что проявляется в разной растворимости их комплексов, в различающемся сродстве металлов по отношению к АТФ и фосфатам ( присоединение металла к фосфату уменьшает, как правило, его нуклеофильную реакционную способность), а также в том, что в случае разных металлов в равновесии присутствуют различные относительные количества металлохелатов с разной структурой и реакционной способностью. Собственная каталитическая эффективность связанного металла также зависит от его природы. Скорость реакции увеличивается быстрее, чем возрастает концентрация иона металла. Кроме того, реакция в присутствии двухвалентных металлов ускоряется также однозарядными катионами, например катионами калия и в меньшей степени натрия. Поэтому можно полагать, что наблюдаемый катализ обусловлен главным образом образованием реакционноспособного комплекса, который содержит два иона металла и в котором заряд АТФ почти полностью экранирован. [24]
Ионы металла в растворе окружены лигандами или молекулами растворителя и образуют внутреннюю координационную сферу, которая, в свою очередь, окружена внешней сферой, состоящей из менее прочно связанных молекул растворителя. [25]
Ионы металла могут быть удалены из сферы реакции при действии сульфида любого из тех металлов, которые в этом ряду находятся впереди данного металла. Количество примесей, которые остаются в растворе после такой очистки, определяется произведением растворимости сульфида удаляемого металла. [26]
Ионы металлов взаимодействуют с комплоксолами в большинстве случаев практически мгновенно с образованием растворимых, малодиссоциированных соединений постоянного состава. Этим методом можно определять практически все катионы и многие анионы. [27]
Ионы металлов обычно располагаются в узлах решетки, а в пространстве между ионами находятся свободные ( валентные) электроны. [29]
Ионы металлов проявляют либо окислительные, либо восстановительные свойства. [30]
Урок 6. Простые ионы
В уроке 6 «Простые ионы» из курса «Химия для чайников» познакомимся с простыми ионами и выясним, чему равен его заряд; также рассмотрим как образуется ионная химическая связь; научимся определять степень окисления и валентность элементов. Данный урок очень важный, и чтобы его лучше понять, обязательно просмотрите прошлые уроки, особое внимание уделяя уроку 1 «Схема строения атомов», а также уроку 3 «Схема образования молекул».
Ионная химическая связь
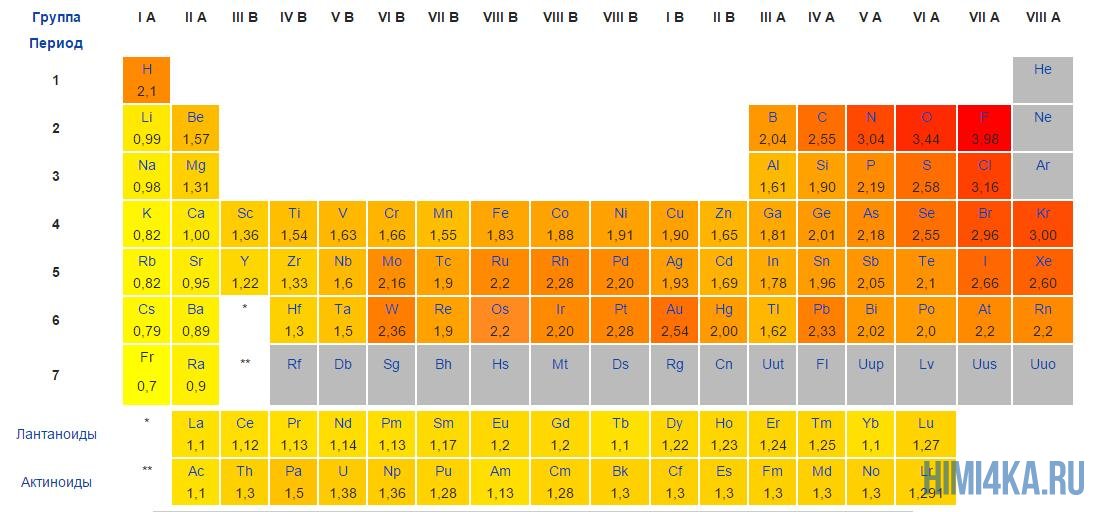
Мы уже кратко рассматривали ковалентную полярную химическую связь, в которой из-за незначительного различия в электроотрицательности атомов (0.4-2.0) электронная пара распределяется между ними не равномерно. Для тех, кто забыл, напоминаю, что электроотрицательность — это способность атомов притягивать к себе электроны.
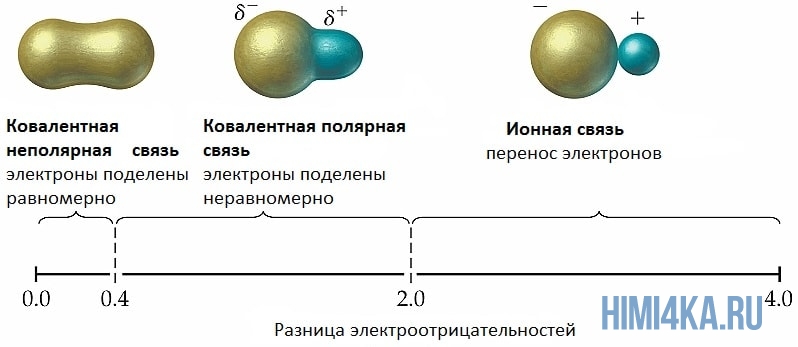
Однако, если электроотрицательность атомов различается больше чем на 2 по таблице электроотрицательности, то электронная пара полностью переходит к более электроотрицательному атому, и в результате образуется ионная химическая связь. Ионная химическая связь образуется только между атомами типичных металлов (т.к. они легко теряют внешние электроны) и неметаллов (т.к. они обладают большой электроотрицательностью).
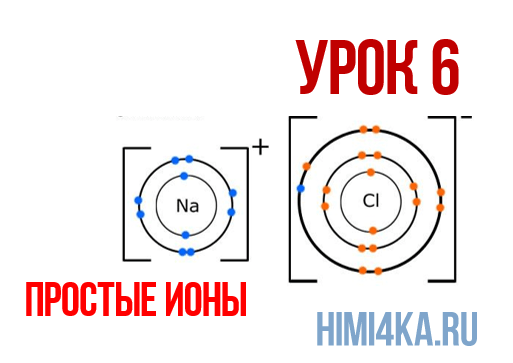
Положительные и отрицательные ионы
Наглядным примером ионной химической связи может служить обычная поваренная соль NaCl, которая присутствует на каждой кухне. Атомы натрия (и вообще всех металлов) слабо удерживают внешние электроны, тогда как атомы хлора напротив, обладают очень большой способностью притягивать к себе электроны, т.е обладают большой электроотрицательностью.
Поэтому при образовании молекулы NaCl каждый атом Na теряет один электрон (e — ), образуя положительный ион натрия Na + , а каждый атом Cl, наоборот, приобретает этот потерянный электрон натрия, образуя отрицательный ион хлора Cl — . Это записывается в виде двух реакций:
Записать ½Cl2 пришлось потому, что газообразный хлор в природе состоит из двухатомных молекул, а не из свободных одиночных атомов хлора.
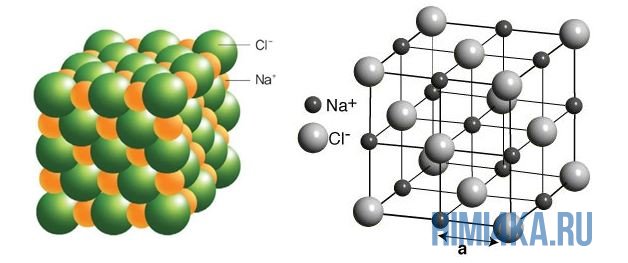
На рисунке выше, изображена кристаллическая решетка NaCl, где каждый хлорид-ион Cl — окружен со всех сторон соседними положительными ионами натрия Na + ; ионы натрия Na + точно также окружены ближайшими хлорид-ионами Cl — . Подобное расположение ионов обладает высокой устойчивостью.
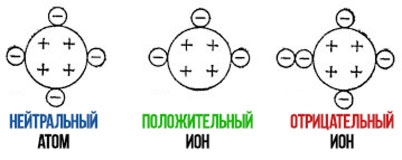
Положительно заряженные ионы называются катионами. К ним в основном относятся металлы, так как они легко отдают от одного до трех электронов. Ниже приведены примеры катионов:

Анионами являются неметаллы, поскольку с радостью присоединяют к себе электроны, превращаясь в отрицательно заряженные ионы. Примеры анионов:

Степень окисления веществ
Заряд простого, одноатомного иона, например Mg 2+ или F 2- , называется его степенью окисления. Степень окисления — это такое число электронов, которое необходимо прибавить (восстановить) к иону или отнять (окислить) у него, чтобы он превратился обратно в нейтральный атом.
- Реакция восстановления: Mg 2+ + 2e — → Mg
- Реакция окисления: F 2- → F + 2e —
Процесс присоединения электронов к атому или просто их смещение в сторону данного атома называется реакцией восстановления, а оттягивание электронов от атома или их полное удаление называется реакцией окисления. Вот вам отличная шпаргалка со степенями окисления простых ионов:

Пример 12. Окисляется или восстанавливается хлор при образовании хлорид-иона? Какова степень окисления этого иона?
Решение: Хлор восстанавливается, поскольку к каждому атому хлора необходимо присоединить один электрон, чтобы образовался хлорид-ион. Хлорид-ион, Сl — , имеет степень окисления -1.
Пример 13. Окисляются или восстанавливаются металлы при образовании ими ионов? Какова степень окисления иона алюминия?
Решение: При образовании ионов металлов последние окисляются, поскольку при этом происходит удаление электронов от атомов металла. Ион алюминия, Аl 3+ , имеет степень окисления +3.
Валентность химических элементов
Валентностью называют число химических связей, которые данный атом образует с другими атомами в молекуле. Однако, если говорить простыми словами, то под валентностью понимается все та же степень окисления, но в отличии от нее валентность не имеет знака и не равна нулю.
| Молекулярная формула | Валентность | Степень окисления |
| H2O | H(I), O(II) | H +1 , O -2 |
| CS2 | C(IV), S(II) | C +4 , S -2 |
| CH4 | C(IV), H(I) | C -4 , H +1 |
Название ионов
Ионы металлов, которые имеют различные (переменные) степени окисления, записываются следующим образом:
- Fe 2+ железо(II) или ион двухвалентного железа
- Fe 3+ железо(III) или ион трехвалентного железа
- Сu + медь(I) или ион одновалентной меди
- Cu 2+ медь (II) или ион двухвалентной меди
- Sn 2+ олово(II) или двухвалентного олова
- Sn 4+ олово(IV) или ион четырехвалентного олова
Пример 2: Окисление или восстановление происходит при превращении иона трехвалентного железа в ион двухвалентного? Запишите уравнение этого процесса.
Решение: Уравнение реакции имеет следующий вид: Fe 3+ + e — → Fe 2+ . Она представляет собой процесс восстановления, поскольку к исходному иону присоединяется электрон.
Надеюсь урок 6 «Простые ионы» оказался для вас понятным и полезным. Если у вас возникли вопросы, пишите их в комментарии.
Что такое ион металла
Атом или группа атомов, который за счет потери или приобретения одного или более электронов приобрел электрический заряд. Если ион получен из атома водорода или атома металла, он обычно положительно заряжен; если ион получен из атома неметалла или из группы атомов, он обычно отрицательно заряжен. Число зарядов электрона, которые имеет ион, названо электровалентностью. Заряды обозначаются верхними индексами, которые показывают их знак и величину; например ион натрия, который несет один положительный заряд, обозначен как Na + ; ион серы, который несет два отрицательных заряда — SO – .
(Источник: «Металлы и сплавы. Справочник.» Под редакцией Ю.П. Солнцева; НПО "Профессионал", НПО "Мир и семья"; Санкт-Петербург, 2003 г.)
Смотреть что такое "Ион" в других словарях:
ИОН — У этого термина существуют и другие значения, см. Ион (значения). «ИОН» Тип Частная компания … Википедия
ион — Атом или группа атомов, который за счет потери или приобретения одного или более электронов приобрел электрический заряд. Если ион получен из атома водорода или атома металла, он обычно положительно заряжен; если ион получен из атома неметалла… … Справочник технического переводчика
Ион — а, муж. Разг. к (см. Иона).Отч.: Ионович, Ионовна; разг. Ионыч. Словарь личных имён. Ион См. Ивон. День Ангела. Справочник по именам и именинам. 2010 … Словарь личных имен
Ион — (Ion, Ιων). Сын Ксуфа, родоначальник ионийского племени. (Источник: «Краткий словарь мифологии и древностей». М.Корш. Санкт Петербург, издание А. С. Суворина, 1894.) ИОН (Ίων), в греческой мифологии афинский царь, сын Креусы. Отцом И. большинство … Энциклопедия мифологии
ИОН — ИОН, йон муж. лад, толк, смысл, пригодность. Он несуразый, иону в нем нет. Окно не к иону было прорублено, я его и заделал. Толковый словарь Даля. В.И. Даль. 1863 1866 … Толковый словарь Даля
ИОН — (от греч. ion идущий), электрически заряж. ч ца, образующаяся при потере или присоединении эл нов атомами, молекулами, радикалами и т. д. И. соответственно могут быть положительными (при потере эл нов) и отрицательными (при присоединении эл нов) … Физическая энциклопедия
ион — сущ., кол во синонимов: 17 • адденд (1) • амфион (2) • анион (1) • … Словарь синонимов
ИОН — [icov идущий] атом (или гр. атомов комплексный ион), несущий положительный (катион) или отрицательный (анион) электрический заряд и являющийся самостоятельной или относительно самостоятельной составной частью (строительной единицей) к лов или… … Геологическая энциклопедия
Ион — Ион, Ion, с Хиоса, ок. 490 ок. 421 гг. до н. э., греческий поэт. Часто бывал в Афинах, хотя и не поселился там навсегда. Состоял в дружеских отношениях с Тимоном и Фемистоклом, знал также Эсхила и Софокла. Первую трагедию поставил в 451 г. Нам… … Античные писатели
ИОН — в греческой мифологии внук Эллина, сын Ксуфа (или Аполлона); родоначальник племени ионийцев. Стал афинским царем; его сыновья Гоплет, Гелеонт, Эгикорей, Аргад эпонимы четырех древнейших фил Аттики … Большой Энциклопедический словарь
Ион — (Аин) (возм., руины ), город и равнина, находящиеся сев. истока Иордана (3Цар 15:20; 4Цар 15:29). И. был завоеван арам. (сир.) царем Венададом, а позднее Тиглатпаласаром III (библ. Феглаффелласар). В 3Цар 15:20 названия местностей перечислены в… … Библейская энциклопедия Брокгауза
Ио́н (др.-греч. ἰόν — идущее) — одноатомная или многоатомная электрически заряженная частица, образующаяся в результате потери или присоединения атомом или молекулой одного или нескольких электронов. Ионизация (процесс образования ионов) может происходить при высоких температурах, под воздействием электрического поля, ионизирующего излучения и т.п.
В виде самостоятельных частиц, ионы встречаются во всех агрегатных состояниях вещества — в газах (в частности, в атмосфере), в жидкостях (в расплавах и растворах), в кристаллах и в плазме (в частности, в межзвёздном пространстве).
Заряд иона кратен заряду электрона. Понятие и термин «ион» ввёл в 1834 году Майкл Фарадей, который, изучая действие электрического тока на водные растворы кислот, щелочей и солей, предположил, что электропроводность таких растворов обусловлена движением ионов. Положительно заряженные ионы, движущиеся в растворе к отрицательному полюсу (катоду), Фарадей назвал катионами, а отрицательно заряженные, движущиеся к положительному полюсу (аноду) — анионами.
Являясь химически активными частицами, ионы вступают в реакции с атомами, молекулами и между собой. В растворах ионы образуются в результате электролитической диссоциации и обусловливают свойства электролитов.
См. также
Источники
Wikimedia Foundation . 2010 .
Полезное
(от греч. ion — идущий), электрически заряж. ч-ца, образующаяся при потере или присоединении эл-нов атомами, молекулами, радикалами и т. д. И. соответственно могут быть положительными (при потере эл-нов) и отрицательными (при присоединении эл-нов), заряд И. кратен заряду эл-на. И. могут входить в состав молекул и существовать в несвязанном состоянии (в газах, жидкостях, плазме).
Физический энциклопедический словарь. — М.: Советская энциклопедия . Главный редактор А. М. Прохоров . 1983 .
ИОН (от греч. ion - идущий) - электрически заряженная частица, образующаяся при отрыве или присоединении одного или неск. электронов (или др. заряж. частиц) к атому, молекуле, радикалу и др. иону. Положительно заряженные И. наз. катионами, отрицательно заряженные - анионам и. И. обозначают хим. символом с индексом (вверху справа), указывающим знак и величину заряда - кратность И.- в единицах заряда электрона (напр., Li + , H 2 + , SO 4 2- ). Атомные И. обозначают также хим. символом элемента с римскими цифрами, указывающими кратность И. (напр., NI, NII, NIII, что соответствует N, N + , N 2+ ; в этом случае римские цифры являются спектроскопич. символами Z, они больше заряда иона Z i на единицу: Z=Z i +l). Последовательность И. различных хим. элементов, содержащих одинаковое число электронов, образует изоэлектронный ряд (см. напр., Водородоподобные атомы). Понятие и термин "И." (а также "катион" и "анион") введены в 1834 М. Фарадеем (М. Faraday). Для удаления электрона из нейтрального атома или молекулы необходимо затратить определ. энергию, к-рая наз. энергией ионизации. Энергия ионизации, отнесённая к заряду электрона, называется ионизационным потенциалом. Характеристика, противоположная энергии ионизации - сродство к электрону - равна энергии связи дополнит, электрона в отрицат. И. Нейтральные атомы и молекулы ионизируются под действием квантов оптич. излучения, рентг. и g-излучения, электрич. поля при столкновениях с др. атомами, электронами и др. частицами и т. п. + в водном растворе поваренной соли NaCl очень устойчивы, т. к. координированы с молекулами воды, образующими прочную околоионную оболочку и препятствующими сближению их с С1 - ).Молекула, содержащая неск. групп, переходящих в ионизованное состояние, наз. полиэлектролитом (напр., молекула ДНК, несущая в каждой своей повторяющейся единице отрицательно заряженную фосфатную группу РО 4 - ). Нек-рые молекулы, находящиеся в растворах и кристаллах, остаются в целом электронейтральными, хотя и содержат в разл. её участках противоположно заряженные группы, их наз. цвиттерионами. Так, молекула аминокислоты H 2 N - СНР-СООН (Р - боковой радикал) переходит в цвиттерионную форму H 3 N-СНР-СОО - , что сопровождается переносом протона с группы СООН на группу H 2 N. Комплекс, состоящий из неск. нейтральных атомов или молекул и простого И. образует сложный И., наз. кластерным ионом. В газах при обычных условиях образующиеся И. недолговечны, однако при высоких темп-pax и давлениях степень ионизации газа растёт с ростом темп-ры и давления и при очень высоких темп-pax и давлениях газпереходит в плазму. В жидкостях, в зависимости от природы растворителя и растворённого вещества, катионы и анионы могут располагаться на практически бесконечном расстоянии друг от друга (в том случае, когда они окружены молекулами растворителя), но могут оказаться и достаточно близко друг от друга и, сильно взаимодействуя, образовывать т. н. ионные пары. Соли в твёрдом состоянии обычно образуют ионные кристаллы. Энергия взаимодействия атомных И. как ф-ции расстояния между ними может быть вычислена с помощью разл. приближенных методов (см. Межмолекулярное взаимодействие). Уровни энергии атомных и молекулярных И. и нейтральных частиц различны и в принципе могут быть рассчитаны методами квантовой механики, как и энергии ионизации. Оптич. спектры атомных И. аналогичны спектрам нейтральных атомов с тем же числом электронов, они только смещаются в коротковолновый диапазон, т. к. длины воли спектральных линий, соответствующих квантовым переходам между уровнями энергии с различными значениями гл. квантового числа, пропорциональны квадрату заряда ядра. В спектрах И. появляются т. наз. сателлитные линии, анализ к-рых позволяет исследовать структуру и свойства многозарядных ионов. Ионная компонента оказывает существенное влияние на параметры лабораторной и астрофизической плазмы. Изучение И. важно для различных областей физики и химии плазмы, астрофизики, квантовой электроники, для исследования строения веществ п т. д. И. широко используются в эксперим. исследованиях и приборах (масс-спектрометры, Вильсона камеры, ионный проектор, ионные пучки и т. д.). Лит.: Смирнов Б. М., Отрицательные ионы, М., 1978; Пресняков Л. П., Шевелько В. П., Янев Р. К., Элементарные процессы с участием многозарядных ионов, М., 1986. В. Г. Дашевский.
Физическая энциклопедия. В 5-ти томах. — М.: Советская энциклопедия . Главный редактор А. М. Прохоров . 1988 .
Читайте также:
