Что такое металлический блеск металлов
Обновлено: 03.05.2024
Металлический блеск проявляют лишь компактные массы металла. Так, при восстановлении водородом окиси меди медь получается в виде порошка, лишенного металлического блеска, но достаточно утрамбовать этот порошок и отшлифовать его, чтобы метал лический блеск появился. [1]
Металлический блеск , сильное поглощение света, возрастающее с переходом в инфракрасную область спектра, является естественным следствием наличия в металлах большой концентрации свободных электронов. [2]
Металлический блеск металлы проявляют в компактной своей массе. Так, пластинка платины имеет серебристо-белый цвет и металлический блеск, тогда как в мелкораздробленном состоянии этот металл черного цвета и без металлического блеска. Металлы, отражающие примерно в одинаковой степени все лучи видимого спектра, имеют серебристо-белый цвет. [3]
Металлический блеск , появляющийся на некоторых пленках красок, не содержащих металлических пигментов, и маскирующий обычный цвет покрытия при наблюдении его вблизи к углам возникновения блеска68, называется бронзированием, так как отраженный свет при этом окрашен обычно в желтоватый цвет. Это, по-видимому, обусловлено очень высоким показателем преломления пигмента по отношению к узкому диапазону длин волн падающего света33, вследствие чего для этих длин волн пигмент более непрозрачен, чем для других. [5]
Металлический блеск - сильный блеск, свойственный металлам. Им обладают непрозрачные минералы, дающие в большинстве случаев черную черту на фарфоровой пластинке. Таким блеском обладают самородные металлы ( золото, серебро, платина), многие сульфиды и окислы железа. [6]
Металлический блеск имеют, например, галенит пирит. Все минералы с металлическим блеском непрозрачные, цвет их черты черный или темноокрашенный. [7]
Металлический блеск обусловлен отражением световых лучей от электронного газа, который несколько выходит за границу положительно заряженных ионов. [8]
Металлический блеск , сильное поглощение света, возрастающее с переходом в инфракрасную область спектра, является естественным следствием наличия в металлах большой концентрации свободных электронов. [9]
Металлический блеск наблюдается обычно только в том случае, когда металл образует компактную массу. Только магний и алюминий в виде порошков имеют металлический блеск. Блеск металлов обусловлен отражением падающего на металл света от электронов в его поверхностном слое. [11]
Металлический блеск проявляют лишь компактные массы металла. Так, при восстановлении водородом окиси меди медь получается в виде порошка, лишенного металлического блеска, но достаточно утрамбовать-этот порошок и отшлифовать его, чтобы металлический блеск - появился. Лишь два металла сохраняют металлический блеск и в порошкообразном состоянии: магний и алюминий. Поэтому алюминиевая пыль применяется в качестве серебряной краски. [13]
Металлическим блеском различной степени интенсивности обладают некоторые минералы, например графит, пирротин, пирит, никелин, арсенопирит. [14]
Кроме металлического блеска и пластичности, все металлы обладают выср-кой электропроводностью и теплопроводностью. [15]
Физические свойства металлов

Металлическая связь и особенности кристаллического строения обуславливают особые физические свойства металлов.
Металлическая связь основана на обобществлении электронов, входящих в состав атомов металла. Все электроны на внешних энергетических уровнях атомов металлов обобществленные, т.е. принадлежат всем атомам вещества. И эти электроны легко отрываются и попадают на энергетические уровни таких же атомов металлов. Постоянно перемещаясь по кристаллической решетке, электроны компенсируют силы электростатического отталкивания между положительно заряженными ионами и тем самым связывают их в устойчивую металлическую решетку.
Содержимое разработки
9. Физические свойства металлов
Металлическая связь основана на обобществлении электронов, входящих в состав атомов металла. Все электроны на внешних энергетических уровнях атомов металлов обобществленные, т.е. принадлежат всем атомам вещества. И эти электроны легко отрываются и попадают на энергетические уровни таких же атомов металлов. Постоянно перемещаясь по кристаллической решетке, электроны компенсируют силы электростатического отталкивания между положительно заряженными ионами и тем самым связывают их в устойчивую металлическую решетку.
Металлическая связь – это связь в металлах и сплавах между атом-ионами посредством обобществленных электронов.
Разобраться в том, какой электрон принадлежал какому атому, просто невозможно, так как все оторвавшиеся электроны становятся общими, соединяясь с ионами. Эти электроны временно образуют атомы, потом снова отрываются и соединяются с другим ионом. Этот процесс продолжается бесконечно. Таким образом, в металлических соединениях атомы непрерывно превращаются в ионы и наоборот.
Именно строением металлической связи обусловлены физические свойства металлов.
К физическим свойствам металлов относятся:
Металлический блеск.
Электропроводность и теплопроводность.
Пластичность.
Высокая плотность и температура плавления.
Рассмотрим каждое из свойств более подробно.
Металлический блеск обусловлен металлической связью между атомами, для которой свойственны обобществленные электроны. Они как раз и испускают под воздействием света свои, вторичные волны излучения, которые мы воспринимаем как металлический блеск.
В порошкообразном состоянии большинство металлов теряют металлический блеск и приобретают серую или черную окраску.
Металлический блеск в порошкообразном состоянии сохраняют алюминий и магний.
Прекрасно отражают свет палладий Pd, ртуть Hg, серебро Ag, медь Cu.
Из алюминия, серебра и палладия, основываясь на их отражательной способности, изготавливают зеркала, в том числе и применяемые в прожекторах.
Все металлы хорошо проводят электрический ток и имеют высокую теплопроводность, также благодаря наличию металлической связи. При нагревании металла, увеличивается скорость движения электронов. Быстро движущиеся по кристаллической решетке электроны выравнивают температуру по всей поверхности металла, проводя тепло. Высокая теплопроводность металлов используется для изготовления из них посуды.
Высокая электропроводность металлов обусловлена направленным движением электронов в кристаллической решетке при воздействии электрического тока. Серебро Ag, медь Cu, золото Au и алюминий Al обладают наибольшей электропроводностью, поэтому медь Cu и алюминий Al используют в качестве материала для изготовления электрических проводов.
Наименьшей электропроводностью обладают марганец Mn, свинец Pb, ртуть Hg и вольфрам W.
Пластичность – это физической свойство вещества изменять форму под внешним воздействием и сохранять принятую форму после прекращения этого воздействия.
Большинство металлов пластично, так как слои атом-ионов металлов легко смещаются относительно друг друга и между ними не происходит разрыва связи.
Наиболее пластичные металлы – золото Au, серебро Ag, медь Cu. Из золота Au можно изготовить тонкую фольгу толщиной 0,003 мм, которую используют для золочения изделий.
Именно на пластичности металлов основано кузнечное дело и возможность изготавливать различные предметы с помощью механического воздействия на металл.
Все металлы (кроме ртути) при нормальных условиях представляют собой твердые вещества. Твердость металлов различна. Наиболее твердыми являются металлы побочной подгруппы шестой группы Периодической системы Д.И. Менделеева. Наименее твердыми являются щелочные металлы.
По плотности металлы классифицируют на легкие (их плотность от 0,53 до 5 г/см 3 ) и тяжелые (плотность этих металлов от 5 до 22,6 г/см 3 ). Самым легким металлом является литий Li, плотность которого 0,53 г/см 3 . Самыми тяжелыми металлами в настоящее время считают осмий Os и иридий Ir (плотность около 22,6 г/см 3 ).
Температура плавления.
Температура плавления металлов находится в диапазоне от 39 (ртуть Hg) до 3410 о С (вольфрам W). Температура плавления большинства металлов высока, однако некоторые металлы, например, олово Sn и свинец Pl, можно расплавить на электрической плите.
Физические свойства металлов и в настоящее время широко используются в промышленности и электронике.
В технике все металлы делятся на черные, к ним относятся железо и его сплавы, и цветные.
Изделия из различных видов металлов используются повсеместно благодаря их пластичности, но чаще всего в сплавах.
К драгоценным металлам относят золото, серебро, платину и некоторые другие редко встречающиеся металлы.

-82%
Базовые понятия. Запись 7 (физические свойства металлов)

В данной статье ознакомимся с основными физическими свойствами металлов. Вашему вниманию будут представлены пластичность, электропроводность, теплопроводность, металлический блеск, твёрдость, плотность, температура плавления.
Начнём с пластичности.
Пластичность — это свойство вещества изменять форму под внешним воздействием, не разрушаясь, и сохранять принятую форму после прекращения этого воздействия.
Почему у металлов так выходит? Это происходит из-за их строения, виновной выступает кристаллическая решётка. Она состоит из узлов и свободных электронов, которые бегают между углами, никому не принадлежа. В узлах могут быть атомы, молекулы или ионы. Электроны то присоединяются к ним, то уходят. Именно взаимосвязью между бегающими по всему веществу электронами и узлами объяснятся свойство пластичности: слои смещаются друг с другом без разрыва.

Как же определить и сравнить пластичность разных металлов? Она определяется при испытании на растяжение. Под действием нагрузки образцы разных металлов в различной степени удлиняются, а их поперечное сечение уменьшается. Чем больше способен образец удлиняться, а его поперечное сечение сужаться, тем пластичнее образец.
Существуют две единицы измерения: относительное удлинение и относительное сужение при разрыв.

По степени пластичности металлы принято подразделять следующим образом:
-высокопластичные (относительное удлинение превосходит 40 %) — металлы, составляющие основу большинства конструкционных сплавов (алюминий, медь, железо, титан, свинец) и «легкие» металлы (натрий, калий, рубидий и др.);
-пластичные (относительное удлинение лежит в диапазоне между 40 и 3%) — магний, цинк, молибден, вольфрам, висмут и др. (наиболее обширная группа);
-хрупкие (относительное удлинение меньше 3%) — хром, марганец, кобальт, сурьма.
Электропроводность — свойство проводить электрический ток.
Электрическим током зовём упорядоченное движение частиц. В нашем случае под действие некого поля начинают двигаться в одном направлении все свободные электроны в образце.

Электропроводность металлов обусловлена концентрацией электронов и их подвижностью. Чем сильнее металл нагрет, тем сильнее прыгающие узлы будут мешать электронам свободно передвигаться в выбранном направлении. Чем больше столкновений, тем сильнее нагревается металл. Данный эффект применяется в нагревательных приборах и в лампах накаливания.

Теплопроводность — свойство металлов переносить энергию от одной части тела к другой.
Оно связано с высокой подвижностью электронов: сталкиваясь с колеблющимися в узлах решётки ионами, атомами, электроны обмениваются с ними энергией. Как видим, данное свойство связано с предыдущим.

Металлический блеск — способность металлов отражать световые лучи.
Данное свойство обуславливается несколькими причинами. Во-первых, от гладкости поверхности, т.е. падающая электромагнитная волна (свет) не застревала в неровностях, а могла отразиться обратно.

Во-вторых, свет попадает на металл, поглощается электронами и через некое малое время излучается обратно, при этом количество энергии, которое может уйти на нагревание, небольшое. Отражённую волну воспринимает наш глаз, цвет волны определяется из величины «длина волны».

Твёрдость — свойство твёрдого тела сопротивляться проникновению в него другого тела.
Если хотите много теории по данному свойству, то прошу сюда:
Оценка металла по шкале Мооса берёт за основу то, насколько легко образец может быть поцарапан другими металлами. Например, коэффициент твердости золота — 2,5-3, что значительно ниже коэффициента твердости большинства других материалов. В то время как графит и некоторые виды пластика стоят на одном конце шкалы, имея значение 1, то на другой её конец ставится алмаз, одно из самых твердых веществ на Земле. Он оценивается в 10 баллов.
Олово: 1.5
Цинк: 2.5
Золото: 2.5-3
Серебро: 2.5-3
Алюминий: 2.5-3
Медь: 3
Медь: 3
Бронза: 3
Никель: 4
Платина: 4-4.5
Сталь: 4-4.5
Железо: 4.5
Палладий: 4.75
Родий: 6
Титан: 6
Укрепленная сталь: 7-8
Вольфрам: 7.5
Карбид вольфрама: 8.5-9
Плотность — это отношение массы на объём.
Тяжело расшифровать определение, но я попробую. Оно значит, что при равном объёме разные металлы будут проявлять разную инерцию. Конечно, если и стало понятнее, то на чуток.
-лёгкие (плотность не более 5 г/см 3 ) — магний, алюминий, титан и др.:
-тяжёлые — (плотность от 5 до 10 г/см 3 ) — железо, никель, медь, цинк, олово и др. (это наиболее обширная группа);
-очень тяжёлые (плотность более 10 г/см 3 ) — молибден, вольфрам, золото, свинец и др.
Таблицы с плотностями:
Температура плавления — температура, при которой осуществляется процесс перехода вещества из твёрдого состояния в жидкое.
При увеличении внутренней энергии начинают сильнее колебаться узлы, решётка теряет свою структуру, нарушаются связи. Примерно такой процесс можно назвать переходом в жидкое состоянии.
Делят металлы на несколько групп:
-легкоплавкие (температура плавления не превышает 600 o С) — цинк, олово, свинец, висмут и др.;
-среднеплавкие (от 600 o С до 1600 o С) — к ним относятся почти половина металлов, в том числе магний, алюминий, железо, никель, медь, золото;
-тугоплавкие ( более 1600 o С) — вольфрам, молибден, титан, хром и др.
Что такое металлы и их строение
Определение металлов можно дать с позиций химии, физики и техники.
В химии металлы — это химические элементы, находящиеся в левой части периодической системы элементов Д. И. Менделеева, которые обладают особым механизмом взаимодействия валентных электронов (ионов) с ядром как в самих металлах, так и при вступлении в химические реакции с другими элементами, в том числе с металлами.
Физика характеризует металлы как твердые тела, обладающие цветом, блеском, способностью к плавкости (расплавлению) и затвердеванию (кристаллизации), тепло- и электропроводностью, магнитными и другими свойствами.
В технике металлы — это конструкционные материалы, обладающие высокой обрабатываемостью (ковкостью, штампуемостью, обрабатываемостью резанием, паяемостью, свариваемостью и др.), прочностью, твердостью, ударной вязкостью и рядом других ценных свойств, благодаря которым они находят широкое применение.
Русский ученый М. В. Ломоносов (1711 — 1765), исследуя металлы и неметаллы в своем труде «Первые основания металлургии или рудных дел», дал металлам определение: «Металлом называется светлое тело, которое ковать можно. Таких тел находим только шесть: золото, серебро, медь, олово, железо и свинец». Это определение М. В. Ломоносов дал в 1773 г., когда известны были только шесть металлов.
Из металлов, добываемых из недр земли, получают большую группу конструкционных материалов, применяемых в различных отраслях промышленности. В природе одни металлы встречаются в чистом, самородном виде, другие — в виде оксидов (соединений металла с кислородом), нитридов и сульфидов, из которых состоят различные руды этих металлов.
Самыми распространенными металлами, применяемыми в качестве конструкционных материалов, являются железо, алюминий, медь и сплавы на основе этих металлов.
К металлам относятся более 80 элементов периодической системы Менделеева. Все эти металлы подразделяются на две большие группы: черные металлы и цветные металлы.
Характерными признаками черных металлов являются темно-серый цвет, блеск, высокие плотность и температура плавления, твердость, прочность, вязкость и полиморфизм (аллотропия). По физикохимическим свойствам черные металлы подразделяют на пять групп:
- железистые (железо, кобальт, никель, марганец);
- тугоплавкие (вольфрам, рений, тантал, молибден, ниобий, ванадий, хром, титан и др.);
- урановые — актиниды (уран, торий, плутоний и др.);
- редкоземельные — лантаниды (лантан, церий, иттрий, скандий и др.);
- щелочно-земельные (литий, натрий, калий, кальций и др.).
Из этих пяти групп черных металлов особенно широкое применение в промышленном производстве находят железистые и тугоплавкие металлы.
Железистые металлы, кроме марганца, называют еще ферромагнетиками. Ферромагнетики способны намагничиваться и притягивать металлы своей группы.
К тугоплавким относятся металлы, которые имеют температуру плавления выше температуры плавления железа (1 539 °С): титан — 1 667 °С, ванадий — 1 902 °С, хром — 1 903 °С, молибден — 2 615 °С, ниобий — 2 460 °С, тантал — 2 980 °С, вольфрам — 3 410 °С. Тугоплавкие металлы в основном применяются как легирующие элементы в производстве жаропрочных, жаростойких, теплостойких и специальных сплавов, в том числе твердых сплавов и высоколегированных сталей.
2. Строение металлов
Атомно-кристаллическая структура металлов. Как известно, все вещества состоят из атомов, в том числе и металлы. Каждый металл (химический элемент) может находиться в газообразном, жидком или твердом агрегатных состояниях. Каждое агрегатное состояние будет иметь свои особенности, отличные друг от друга. В газообразном металле расстояние между атомами велико, силы взаимодействия малы и атомы хаотично перемещаются в пространстве; газ стремится к расширению в сторону большего объема. При понижении температуры и давления вещество переходит в жидкое состояние. Свойства жидкого вещества резко отличаются от свойств газообразного. В жидком металле атомы сохраняют лишь так называемый ближний порядок атомов, т. е. в объеме расположено небольшое количество атомов, а не атомы всего объема. При понижении температуры жидкий металл переходит в твердое состояние, которое имеет строгую закономерность расположения атомов.
Если условно провести вертикальные и горизонтальные линии связи через центры атомов, можно увидеть, что у металлов в твердом состоянии атомы расположены в строго определенном порядке и представляют собой множество раз повторяющиеся элементарные геометрические фигуры — параллелепипеды (рис. 1). Наименьшую геометрическую фигуру называют элементарной ячейкой. Элементарные ячейки, расположенные на горизонтальных и вертикальных кристаллографических плоскостях (рис. 2), образуют пространственную кристаллическую решетку.
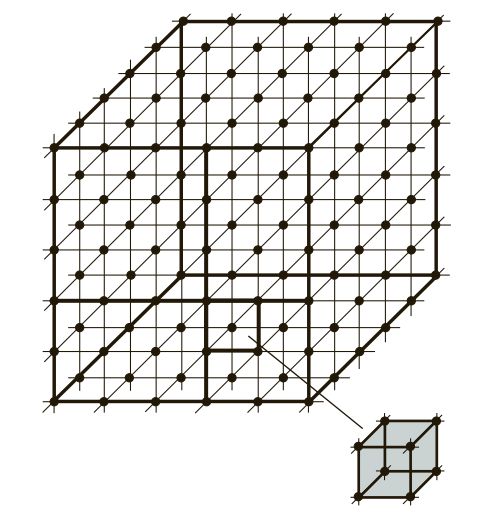
Рис. 1. Схема расположения элементарных геометрических ячеек в атомных решетках металлов и сплавов
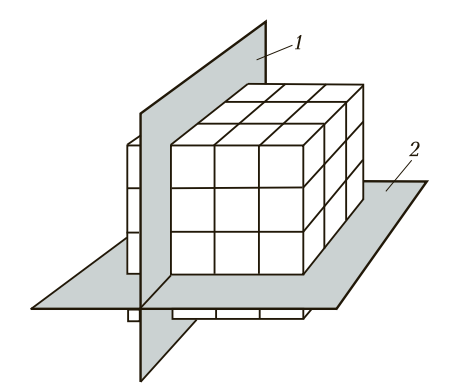
Рис. 2. Расположение кристаллографических плоскостей: 1 и 2 — соответственно горизонтальная и вертикальная кристаллографические плоскости
Элементарные кристаллические решетки характеризуют следующие основные параметры: расстояние между атомами по осям координат (по линиям связи), углы между линиями связи, координационное число — число атомов, находящихся на наиболее близком и равном расстоянии от любого атома в решетке. Форму элементарной ячейки рассматривают по кристаллографическим плоскостям в трех измерениях.
Таким образом, любой металл можно представить не как однородную цельную массу, а как массу, сложенную из множества элементарных ячеек. Блок элементарных атомных кристаллических ячеек образует атомно-кристаллическую ячейку (решетку). Если выделить эту элементарную ячейку, то в зависимости от металла получим следующие типы кристаллических ячеек (рис. 3): куб (К), объемно-центрированный куб (ОЦК), гранецентрированный куб (ГЦК), гексагональная плотноупакованная ячейка (ГПУ), гексагональная простая ячейка (Г) и др.
Простая кубическая ячейка (рис. 3, а) характерна для неметаллов, которые обладают наибольшими плотностью и удельным весом, и имеет восемь атомов, которые расположены в каждой вершине куба.
Объемно-центрированная кубическая ячейка (рис. 3, б ) состоит из восьми атомов, которые расположены по одному атому в каждой вершине куба, и одного, находящегося в центре куба на равных расстояниях от его граней. Эту форму атомной кристаллической ячейки имеют железо модификации Fe-α, ванадий, вольфрам, молибден, тантал и хром, т. е. в основном черные металлы.
Гранецентрированная кубическая ячейка (рис. 3, в) имеет 14 атомов — по одному атому в каждой вершине куба (восемь атомов) и по одному атому в центре каждой грани (шесть атомов). Гранецентрированную кубическую ячейку имеют алюминий, железо модификации Fe-γ, золото, кобальт, медь, никель, платина и серебро, в основном это цветные металлы и часть черных металлов.
Гексагональная плотноупакованная ячейка (рис. 3, г) состоит из 17 атомов. Форма геометрического тела, которую образуют эти атомы, является шестигранной призмой. При этом по шесть атомов расположены в каждой вершине верхнего и нижнего оснований, по одному атому в центре этих оснований и три атома в центре одной их трех граней (через грань). Гексагональную плотноупакованную ячейку имеют бериллий, кадмий, магний, ванадий, тантал.
Простая гексагональная ячейка (рис. 3, д) состоит из 12 атомов, которые расположены в вершинах верхнего и нижнего оснований шестигранной призмы. Такую кристаллическую ячейку имеют ртуть и цинк.
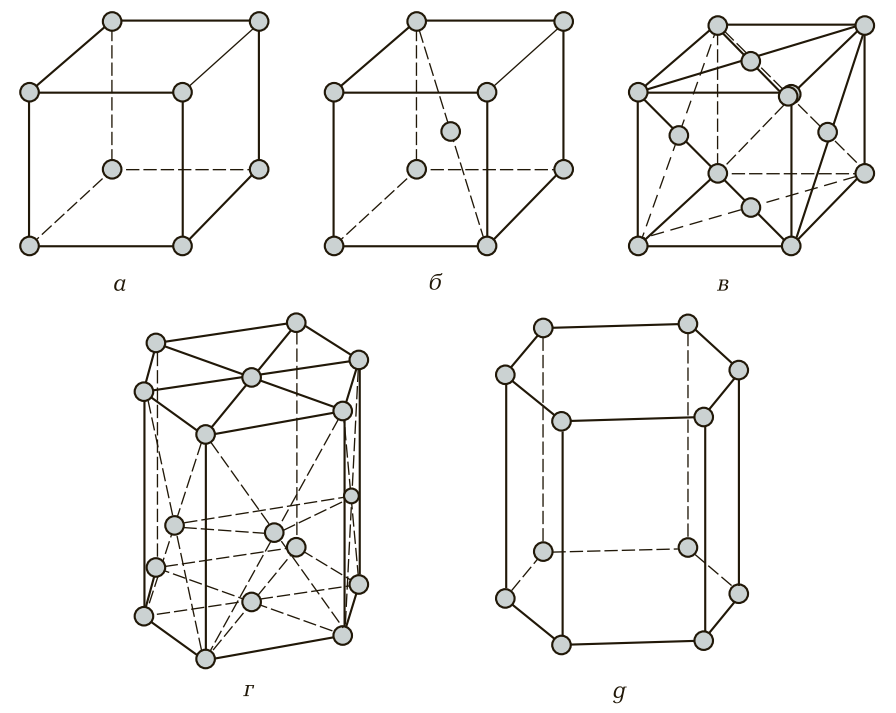
Рис. 3. Геометрические формы элементарных кристаллических ячеек: а — куб; б — объемно-центрированный куб; в — гранецентрированный куб; г — гексагональная плотноупакованная ячейка; д — гексагональная простая ячейка
Связь между атомами в кристаллической решетке и между решетками осуществляется за счет так называемой металлической связи. От прочности этой связи зависят прочность и твердость металлов. Чем выше эта связь, тем бо´льшую прочность и твердость имеют металлы. Механизм связи между атомами в решетке и между решетками имеет сложную физико-химическую природу.
В практике идеальное расположение кристаллических решеток обычно не наблюдается. Кристаллы, образуемые кристаллическими решетками, имеют искаженную геометрическую форму и различную величину.
Анизотропия металлов. Анизотропия (от гр. anisos — неравный и tropos — направление) — неодинаковость физических свойств среды (тела) в различных направлениях. Анизотропия предполагает зависимость свойств металлов от направления по плоскостям атомно-кристаллических решеток. Чем больше в плоскости атомов, тем выше свойства металлов. В горизонтальных плоскостях в любой форме атомно-кристаллических решеток больше, чем в вертикальных плоскостях. Следовательно, прочность металлов, испытанная в горизонтальном направлении, выше, чем в вертикальном. Анизотропия проявляется в процессе обработки конструкционных материалов давлением (проката, волочения, штамповки и других технологических способов получения заготовок и изделий).
На рис. 2 кристаллографические плоскости совпадают с линиями связи, проходящими через атомы металла. Форма элементарной кристаллической ячейки, расстояние между атомами и прочность металлической связи определяют физические, механические и технологические свойства металлов. Если исследуемый металл рассматривать по трем кристаллографическими плоскостям, по линиям связи между атомами, то можно заметить, что свойства по этим трем измерениям будут различны. Число атомов в этих плоскостях неодинаково. Металлическая связь между горизонтально и вертикально расположенными атомами также неодинакова. Это, в свою очередь, приводит к различной прочности металлов в продольном и поперечном направлениях. Например, предел прочности меди в продольном направлении будет в 2 раза больше, чем в поперечном.
Все металлы анизотропны, так как они состоят из кристаллов. Кристаллическое строение металлов обусловливает пластическую деформацию, т. е. изменение внешней формы и размеров под действием нагрузок без разрушения. Способность металлов и сплавов пластически деформироваться положена в основу их обработки давлением (прокатка, волочение, ковка, штамповка и прессование). При обработке давлением, например прокатке (рис. 4, а), происходит перемещение одного слоя атомных решеток по другому по кристаллографическим плоскостям (рис. 4, б).
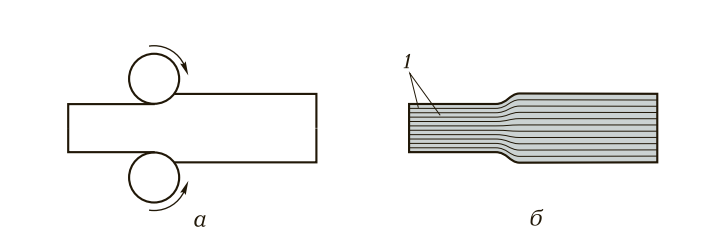
Рис. 4. Схема деформации металлов и сплавов (прокатка): а — деформация; б — скольжение металлов по кристаллографическим плоскостям в процессе деформации; 1 — кристаллографические плоскости
В процессе деформации металла при прокатке происходит не только изменение поперечных и продольных размеров заготовок, но и изменение микроструктуры металла.
Зерна под действием давления прокатных валков искажаются, приобретая продолговатую или пластинчатую форму, а затем преобразуются в волокна. Изменение микроструктуры металла в процессе деформации условно показано на рис. 5.
Процесс кристаллизации. Рассмотрим, как происходит образование кристаллов у чистых металлов. Установлено, что процесс кристаллизации металлов из жидкого состояния в твердое идет в две стадии:
- образование центров кристаллизации;
- рост кристаллов вокруг этих центров (рис. 6).
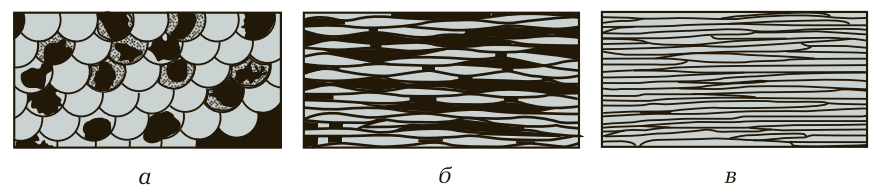
Рис. 5. Изменение микроструктуры металла в процессе деформации: а — микроструктура металла до деформации; б — микроструктура металла после первой операции деформации; в — микроструктура металла после окончательной деформации
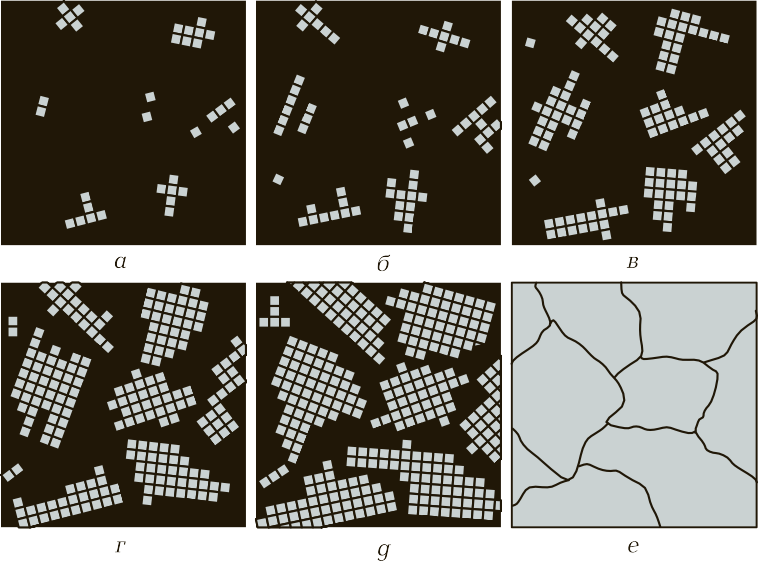
Рис. 6. Процесс кристаллизации металлов и сплавов: а — е — последовательные этапы процесса
Далее вновь появляются новые центры, и происходит рост твердой фазы вокруг первичных и вторичных центров. Процесс происходит до того момента, пока образованные таким образом кристаллы не будут соприкасаться друг с другом и не будет наличия жидкой фазы металла (см. рис. 6, г — е). Когда образование кристалла идет в жидкой фазе (в расплавленном металле), он будет иметь правильную форму, т. е. состоять из определенных геометрических фигур правильной формы. Когда кристаллы начинают соприкасаться друг с другом, а процесс затвердевания еще не закончен, тогда происходят искажения формы зерен. В практике замечено, что когда идет быстрое охлаждение, образуются мелкие зерна — мелкозернистая структура. При медленном охлаждении появление новых центров кристаллизации замедляется, но происходит рост зерна вокруг первичных центров кристаллизации. В этом случае металл будет иметь крупнозернистую структуру.
Процесс образования кристаллов в жидком состоянии и перехода металла в твердое состояние называется первичной кристаллизацией. Величина и форма зерна влияет на механические свойства металлов. Чем зерна мельче и чем правильнее их форма, тем большую твердость и прочность будет иметь металл. Чем зерна больше и чем искаженнее их форма, тем ниже твердость и прочность металла.
Аллотропия металлов. Такие металлы, как железо, кобальт, никель и др., обладают способностью изменять кристаллическую решетку при нагревании в твердом состоянии. Процесс изменения кристаллических решеток в твердом состоянии называется вторичной кристаллизацией, или аллотропией, а состояние вещества (металла) при наличии нескольких кристаллических решеток при изменении параметров (давления, температуры) — аллотропическими модификациями, или полиморфизмом. Такие металлы, как железо, молибден, вольфрам, литий в твердом состоянии при нормальной температуре имеют объемно-центрированную кубическую ячейку; алюминий, медь, серебро в твердом состоянии при нормальной температуре имеют форму гранецентрированной кубической ячейки.
На рис. 7 представлены кривые нагрева и охлаждения металла (на примере марганца). Аллотропные состояния (модификации), имеющие те или иные кубические ячейки, обозначаются греческими буквами. Первоначальное аллотропное состояние при нормальной температуре обозначается буквой α, при дальнейших повышении температуры и перекристаллизации металла — буквами β, γ, δ и т. д. При охлаждении металлов и сплавов процесс аллотропного превращения происходит в обратном порядке, как правило при тех же температурах.
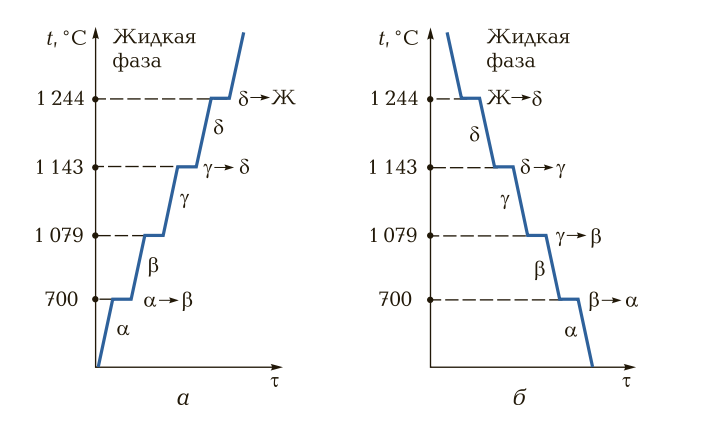
Рис. 7. Кривые нагрева (а) и охлаждения (б) марганца: t — температура; τ — время
Характеристика физических и химических свойств металлов
Занимая в таблице Менделеева I-II группы, а также побочные подгруппы III-VIII групп, атомы металлов способны отдавать валентные электроны, тем самым окисляться. По группе сверху вниз число электронных слоев увеличивается, радиус атомов растет, как и способность отдавать электроны (металлические свойства атомов). В периодах слева направо радиус атомов уменьшается, металлические свойства снижаются. Поэтому самыми активными металлами в периодах являются металлы I-II групп.
Физические и химические свойства металлов
Своими физическими, как и химическими, свойствами металлы обязаны строению кристаллической решетки. Она состоит из положительно заряженных ионов, которые постоянно колеблются вокруг определенного положения равновесия. Кроме того, имеются свободные электроны, которые перемещаются по всему объему. Именно благодаря им, для металлов характерны следующие свойства: металлический блеск, ковкость, пластичность, тепло- и электропроводность.
Из металлов изготавливают детали и инструменты, корпуса машин, зеркала, бытовую и промышленную химию.
Такое широкое применение на практике металлы нашли благодаря своим особым свойствам:
- Пластичность. Могут легко менять свою форму в нужном направлении, от вытягивания в проволоку до прокатывания в листы.
- Характерный блеск и отсутствие прозрачности. Объяснение этому свойству кроется во взаимодействии электронов с падающим на поверхность светом.
- Электропроводность. При появлении разности потенциалов движение свободных электронов становится направленным: от отрицательного полюса к положительному. Электропроводность металлов уменьшается с повышением температуры. Происходит это по причине усиления интенсивности колебаний атомов и ионов в узлах кристаллической решетки, что значительно затрудняет осуществление направленного движения частиц.
- Теплопроводность. Свободные электроны очень подвижны. Поэтому наблюдается быстрое выравнивание температуры по всей массе металлического тела. Наибольшей теплопроводностью обладают висмут и ртуть.
- Твердость. Благодаря такому свойству, металлы нашли применение для изготовления режущих инструментов. Самым твердым металлом является хром, самыми мягкими являются металлы щелочной группы (рубидий, цезий, калий, натрий, литий). Их можно резать обычным ножом. Твердость металла можно определить по специальной шкале Мооса, для металлов эта характеристика находится в интервале от 0,2 до 6,0.
- Плотность. Значение плотности зависит от массы и радиуса атома. Самым легким является литий, самым тяжелым — осмий. Для сравнения, их плотность равна 0 , 53 г / с м 3 и 22 , 6 г / с м 3 соответственно. Если плотность металла менее 5 г / с м 3 , то он относится к группе легких.
- Температура плавления. Существует металлы легкоплавкие, к примеру, ртуть, и тугоплавкие, например, вольфрам. В целом, те металлы, которые имеют температуру плавления более 1000 о С , отнесены к тугоплавким. Те, для которых она ниже, считаются низкоплавкими.
Подробное описание механических свойств
Механические свойства металлов не определяются расчетным путем. Для них существуют специальные экспериментальные процедуры, в ходе которых проверяется степень деформации, характер прочности, способность к пластичности и т.д.
К основным механическим свойствам относят:
- Прочность. Когда говорят, что металл прочен, понимают, что под действием механических факторов он способен сохранять свою кристаллическую структуру. Среди таких факторов числятся: статические (нагрузка в статике), динамические (нагрузка в движении), ударные. Чем выше прочность испытуемого металла, тем конструкция из него будет долговечнее. Это особенно важно в отраслях промышленности, изготавливающих оборудование для использования в жизни людей.
- Пластичность. В нуждах производства либо быта часто нужна металлическая пластичность. Это способность металла либо сплавов с его участием изменять свою геометрию, увеличиваться либо уменьшаться в объеме. Такое видоизменение не должно разрушить нормальную кристаллическую решетку.
- Твердость. Металлические конструкции почти невозможно повредить либо изменить руками. И все же ощущения от надавливания на алюминий либо железо будут различными. Испытать твердость можно с помощью прибора Бриннеля (как вариант, изобретения Ровелла). Прибор Бриннеля подразумевает определение твердости путем вдавливания в образец металла шара сильной закалки. В изобретении Ровелла используется алмазная пирамида.
Размер следа, возникшего при давлении, позволяет установить твердость исследуемого состава.
Важно обратить внимание на то, что понятие «прочность» не является синонимом «твердости». Не редки варианты, когда твердые предметы являются хрупкими.
- Ударная вязкость. Свойство свидетельствует о способности тела противостоять ударам. Единицей измерения является джоуль на с м 3 .
- Упругость. На твердое тело могут воздействовать различные силы, в т.ч. вызывающие его деформацию. Упругие материалы способны по окончании воздействия силы восстанавливать свою форму. Это также можно объяснить особенностями строения кристаллической решетки.
К механическим свойствам металлов, например, железа, практики относят также такие характеристики, как наличие надежности, долговечности, практичности, живучести.
Эксплуатационные характеристики
Кроме общих физических свойств, металлы обладают такой особенностью, как эксплуатационные характеристики. Под этим понятием понимается показатель, демонстрирующий надежность, долговечность и практичность детали, конструкции, изготовленной из металла либо его сплава. Такой показатель формируется на основании обобщения результатов технических испытаний, разнопрофильных замеров.
К такой категории показателей относят жаропрочность, хладостойкость, стойкость к коррозии, антифрикционные характеристики, циклическая вязкость и т.п.
Под «износостойкостью» понимают способность материала, из которого изготовлены различные конструкции, противостоять абразивному износу, в т.ч. при наличии процессов трения поверхностей деталей (инструментов) при работе.
Группа металлов с циклической вязкостью способны выдерживать знакопеременные динамические давления. При этом они не разрушаются. Детали, изготовленные из таких металлов, — идеальный вариант для изготовления рессор автомобилей, пружин различных вариаций. Детали, изготовленные из металлов с циклической вязкостью, способны функционировать в неблагоприятных условиях длительные отрезки времени.
Определение понятия «Демпфирование» гласит, что металл способен гасить колебания, рассеивать их, а также противостоять направленным нагрузкам. К таким материалам относят серые литейные чугуны. Они годны для изготовления станин станков, кронштейнов и т.п.
Одной из общих эксплуатационных характеристик является жаропрочность. Краткое описание сводится к способности материалов выдерживать серьезные механические нагрузки, особенно при высоких температурах. Показатель жаропрочности определяется тугоплавкостью химических веществ. Для современных двигателей такая характеристика очень важна. В ходе самого процесса происходит ослабление химических связей, поэтому снижаются упругость, вязкость, твердость. В результате этого деталь постепенно приходит в негодность. Если в не жаропрочные углеродистые стали добавить в определенных количествах алюминий (магний, титан), они повысят жаропрочность до 600оС. Если же в состав материала вводить никель (кобальт), он будет устойчив вплоть до 1000оС.
Жаростойкость характеризует способность металла не подвергаться коррозии. Насколько велика жаростойкость, можно определить по глубине коррозии. Высокой устойчивостью обладают легированные стали, чугуны, сплавы с хромом, никелем, вольфрамом, ванадием. Эти элементы проявляют жаростойкость при 800-1000оС и выше.
Хладностойкость показывает, насколько материал может сохранить вязкость при отрицательных температурах.
Антифрикционность является свойством, показывающим, насколько материал способен снизить трение между соприкасающимися поверхностями в механизмах и деталях. Антифрикционные материалы используют для изготовления подшипников для различных механизмов.
Прирабатываемость — возможность конструкций, изготовленных из определенных материалов, «подстраиваться» в рабочем процессе, например, увеличивать площадь соприкосновения, уменьшать температуру поверхности или давление на нее.
Таблица, примеры
Физические свойства металлов изучались давно и серьезно. Сегодня существуют различные таблицы, содержащие обобщенные данные о химических свойствах, механических и эксплуатационных характеристиках. Например, в электрохимическом ряду напряжения металлов они расположены в порядке уменьшения своей восстановительной способности.
Прочие свойства металлов отражены в таблице.
ρ > 5000 к г / м 3 – тяжелые металлы: Zn, Fe, Ni, Cr, Pb, Ag, Au, Os
Самый легкий металл — литий:
ρ = 530 к г / м 3 ;
самый тяжелый — осмий:
ρ = 22600 к г / м 3
Твердость некоторых металлов по шкале Мооса:
Самые мягкие металлы: K, Rb, Cs, Na
самый твердый металл — Cr (режет стекло)
Au, Ag, Cu, Sn, Pb, Zn, Fe
В ряду наблюдается уменьшение пластичности
Из пластичного золота можно изготовить фольгу толщиной
Тпл > 1000°С – тугоплавкие металлы: Au, Cu, Ni, Fe, Pt, Ta, Nb, Mo, W;
Самая низкая температура плавления у ртути — 39°С,
самая высокая — у вольфрама — 3410°С
Ag, Cu, Au, Al, W, Fe
В ряду наблюдается уменьшение теплопроводности
В ряду наблюдается уменьшение электропроводности
Существуют таблицы, которые связывают общие физические свойства и электронное строение их атомов, а также положение в таблице Д.И.Менделеева.
Читайте также:
