Что такое ряд стандартных электродных потенциалов металлов
Обновлено: 04.07.2024
Первоначально Бекетов предполагал, что способность одних металлов вытеснять из растворов солей другие металлы связана с их плотностью: более лёгкие металлы способны вытеснять металлы более тяжелые. Но опыты говорили о ином. Непонятно было и то, как связан “вытеснительный ряд” с рядом напряжений Алессандро Вольта. Со временем накапливалось всё больше экспериментальных данных того, что некоторые правила вытеснения нарушаются при определенных условиях. Бекетов обнаружил, что водород под давлением 10 атмосфер вытесняет серебро из раствора нитрата серебра. Английский химик Уильям Одлинг (1829-1921) описал множество случаев подобных аномалий. Например, медь вытесняет олово из концентрированного подкисленного раствора хлорида олова (II) и свинец – из кислого раствора хлорида свинца (II). Медь, олово и свинец находятся в ряду правее кадмия, однако могут вытеснять его из кипящего слабо подкисленного раствора хлорид кадмия.
Теоретическую основу ряда активности (и ряда напряжений) заложил немецкий физикохимик Вальтер Нернст (1864-1941). Вместо качественной характеристики – “склонности” металла и его иона к тем или иным реакциям – появилась точная количественная величина. Такой величиной стал стандартный электродный потенциал металла, а соответствующий ряд, выстроенный в порядке изменения потенциалов, называется рядом стандартных электродных потенциалов.
Электрохимический ряд напряжений металлов (ряд Бекетова) это последовательность расположения металлов и их ионов в порядке возрастания стандартных электродных потенциалов в растворах электролитов. Электродом сравнения обычно служит стандартный водородный электрод, электродный потенциал которого условно принимается равным нулю.
| Восстановленная форма | Число отданных електронов | Окисленная форма | Стандартный электродный потенциал, В |
| Li | 1e | Li + | -3,05 |
| K | 1e | K + | -2,925 |
| Rb | 1e | Rb + | -2,925 |
| Cs | 1e | Cs + | -2,923 |
| Ba | 2e | Ba 2+ | -2,91 |
| Sr | 2e | Sr 2+ | -2,89 |
| Ca | 2e | Ca 2+ | -2,87 |
| Na | 1e | Na + | -2,71 |
| Mg | 2e | Mg 2+ | -2,36 |
| Al | 3e | Al 3+ | -1,66 |
| Mn | 2e | Mn 2+ | -1,18 |
| Zn | 2e | Zn 2+ | -0,76 |
| Cr | 3e | Cr 3+ | -0,74 |
| Fe | 2e | Fe 2+ | -0,44 |
| Cd | 2e | Cd 2+ | -0,40 |
| Co | 2e | Co 2+ | -0,28 |
| Ni | 2e | Ni 2+ | -0,25 |
| Sn | 2e | Sn 2+ | -0,14 |
| Pb | 2e | Pb 2+ | -0,13 |
| Fe | 3e | Fe 3+ | -0,04 |
| H2 | 2e | 2H + | 0,00 |
| Cu | 2e | Cu 2+ | 0,34 |
| Cu | 1e | Cu + | 0,52 |
| 2Hg | 2e | Hg2 2+ | 0,79 |
| Ag | 1e | Ag + | 0,80 |
| Hg | 2e | Hg 2+ | 0,85 |
| Pt | 2e | Pt 2+ | 1,20 |
| Au | 3e | Au 3+ | 1,50 |
Место каждого элемента в ряду напряжений условно, т.к. величина электродного потенциала зависит от температуры и состава раствора, в который погружены электроды, в частности от концентрации ионов. Большое значение также имеет состояние поверхности электрода (гладкая, шероховатая). Стандартный электродный потенциал относится к водным растворам при температуре 25 °С, давлении газов 1 атмосфера и концентрации ионов 1 моль/л.
Из электрохимического ряда напряжений металлов вытекает ряд важных следствий:
- Каждый металл способен вытеснять (замещать) из растворов солей все другие металлы, стоящие правее данного металла;
- Все металлы, расположенные левее водорода, способны вытеснять его из кислот;
- Чем дальше расположены друг от друга два металла в ряду напряжений, тем большее напряжение может давать созданный из них гальванический элемент.
Восстановление водородом из оксидов
Металлы, которые водород не восстанавливает из их оксидов
Урок 8. Химические источники тока. Ряд стандартных электродных потенциалов
Перечень вопросов, рассматриваемых в теме: урок посвящён устройству и принципу работы гальванического элемента и других химических источников тока. Учащиеся получат представление о ряде электродных потенциалов и возможностях его использования.
Гальванический элемент - химический источник электрического тока, основанный на взаимодействии двух металлов и/или их оксидов в электролите, приводящем к возникновению в замкнутой цепи электрического тока.
Электрод - электрический проводник, имеющий электронную проводимость и находящийся в контакте с ионным проводником — электролитом. В электрохимии — это часть электрохимической системы, включающая в себя проводник и окружающий его раствор
Анод - электрод, на котором происходит процесс окисления
Катод - электрод, на котором происходит процесс восстановления
Аккумулятор - химический источник тока многоразового действия
Топливный элемент - устройство, обеспечивающее прямое преобразования химической энергии в электрическую
Электрохимия - наука, которая изучает закономерности взаимного превращения химической и электрической форм энергии
Ряд стандартных электродных потенциалов - ряд металлов, расположенных в порядке возрастания значения их стандартных потенциалов
Стандартные условия - температура 25 о С, концентрация солей 1моль/л, давление 0,1МПа
Стандартный водородный электрод - электрод, использующийся в качестве электрода сравнения при различных электрохимических измерениях
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
Дополнительная литература:
1. Рябов, М.А. Сборник задач, упражнений и тестов по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс : учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М. : Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
Химические источники тока
Рассмотрим знакомую нам окислительно-восстановительную реакцию. В раствор сульфата двухвалентной меди опустим цинковую пластинку. Со временем на поверхности цинка образуется красноватая пленка кристаллической меди. Синяя окраска раствора постепенно ослабевает. Это говорит о том, что протекает химическая реакция.
Cu 2+ + Zn = Zn 2+ + Cu
Молекулы воды отрывают ион цинка. Отдавая электроны, цинк является восстановителем. Ион меди – окислитель - принимает электроны. Электроны передаются от цинка к меди в месте соприкосновения металлов.
Давайте немного изменим условия проведения реакции. Цинковую пластинку опустим в сосуд с раствором сульфата цинка. Медную поместим в другой сосуд с раствором сульфата меди. Соединим пластинки с помощью металлического проводника. Теперь на цинковой пластинке идет окисление атомов цинка, а на медной восстанавливаются ионы меди. Электроны для их восстановления передаются теперь не напрямую, а по проводнику. Направленное движение электронов по этой внешней цепи и есть не что иное, как электрический ток.
Таким образом, произошло превращение энергии, полученной в результате химической реакции в электрическую. Устройство, в котором это осуществилось, получило название гальванический элемент.
Металлические пластинки или стержни называются электродами. Электроны перемещаются по внешней цепи от анода (цинка) к катоду (меди).
Образовавшиеся на аноде ионы цинка выходят в раствор и придают ему избыточный положительный заряд. В это же время у катода катионы меди восстанавливаются (принимают электроны), а оставшиеся в растворе анионы SO4 2- заряжают раствор отрицательно. Это препятствует дальнейшему течению процесса.
Чтобы не допустить этого, соединим сосуды стеклянной трубкой, которую заполним раствором хлорида калия с желатином. Теперь анионы будут двигаться в сторону цинка, а катионы – наоборот. Так будет поддерживаться электронейтральность растворов.
Гальванический элемент будет продолжать работу до полного растворения цинкового электрода или до восстановления всех ионов меди.
Впервые установку, в которой химическая реакция породила электрический ток, собрал Алессандро Вольта в 1800 году. Название «гальванический элемент» она получила позднее.
Теперь наука, которая изучает химические процессы, проходящие под действием электрического тока, а также процессы, в результате которых энергия химических реакций преобразуется в электрическую энергию, называется электрохимия.
Химические источники тока применяются очень широко. Знакомые нам «батарейки» - это разные варианты гальванических элементов. К сожалению, разрядившаяся батарейка уже не может быть восстановлена.
Этого недостатка лишены аккумуляторы, которые тоже представляют собой химические источники тока. Они устроены так, что израсходовав в процессе работы материалы электродов и электролит, способны вновь восстановить рабочие свойства после зарядки.
В свинцовом аккумуляторе чередуются решетчатые пластины, заполненные губчатым свинцом и диоксидом свинца. Электролитом служит серная кислота. Во время работы аккумулятора металлический свинец окисляется, а диоксид свинца восстанавливается.
Когда аккумулятор заряжают, то подключают его таким образом, чтобы ток шёл в направлении, противоположном тому, в котором двигались электроны во время работы. Благодаря этому, процессы окисления и восстановления на электродах поворачивают вспять. Теперь протекают обратные реакции, в результате которых снова появляются свинец, диоксид свинца и серная кислота.
Аккумулятор снова готов к работе.
Еще один источник преобразования химической энергии в электрическую – топливный элемент. Он подобен гальваническому элементу с той лишь разницей, что реагенты постоянно поступают в него извне. Поэтому он не разряжается и не требует электричества для повторной зарядки. Примером может служить водородный топливный элемент, перспективный для водородной энергетики.
Ряд стандартных электродных потенциалов
Вернемся к электродам и посмотрим поближе, что происходит там, где металл граничит с раствором.
Молекулы воды поляризованы и способны отрывать ионы металла. Удерживающиеся на поверхности электроны образуют отрицательно заряженный слой. К нему притягиваются из раствора катионы, образуя второй слой - положительный. Возникающую в двойном слое разность потенциалов называют электродным потенциалом, но определить его величину напрямую невозможно.
Однако есть такой электрод, которым пользуются для сравнения электродных потенциалов разных металлов. Он сделан из платины, но называется водородным, потому что водород пропускается через кислоту, в которой находится электрод. Благодаря платине, выступающей как катализатор, часть молекул водорода распадаются на атомы, которые окисляются на границе с кислотой. Одновременно идет и обратная реакция.
Разность потенциалов, возникающая в двойном электрическом слое водородного электрода, условно принимается за ноль.
Потенциал металла, измеренный относительно стандартного водородного электрода при концентрации ионов металла 1 моль/л и температуре раствора, равной 25 о С, называют стандартным электродным потенциалом металла.
Соберём гальванический элемент, соединив электрод из исследуемого металла со стандартным водородным электродом. Электролитом для металлического электрода послужит раствор соли этого металла, а для водородного, как всегда, кислота.
Зная, что электродвижущая сила вычисляется как разность потенциалов двух электродов, и, подставив ноль в случае водородного электрода, мы видим, что измеренная ЭДС и будет потенциалом исследуемого электрода.
Металлы, расположенные в порядке возрастания значений их стандартных потенциалов, составляют электрохимический ряд напряжений металлов или ряд стандартных электродных потенциалов. Еще одно название – ряд активности металлов.
Имея в своем распоряжении ряд напряжений, мы можем характеризовать химические свойства металлов:
- Чем меньше значение электродного потенциала металла, тем больше его восстановительная способность;
- Каждый металл, начиная с магния, вытесняет все следующие за ним металлы из растворов их солей (это касается металлов, не взаимодействующих с водой);
- Металлы, стоящие в ряду напряжений до водорода, вытесняют его из разбавленных кислот (кроме азотной).
ПРИМЕРЫ И РАЗБОР РЕШЕНИЯ ЗАДАНИЙ ТРЕНИРОВОЧНОГО МОДУЛЯ
- Решение задачи на использование электрохимического ряда напряжений металлов
Условие задачи: Учитель загадал металл и дал ученикам три подсказки:
- из соли ртути он вытеснит ртуть;
- но не вытеснит водород из растворов кислот;
- вам отгадать поможет вполне таблица, висящая на стене.
- Конечно, это ___, - засмеялись ученики, - только один металл подходит под ваше описание.
Вставьте в текст название металла.

Шаг первый: из таблиц выбираем «Электрохимический ряд напряжений металлов»
Шаг второй: находим металлы левее ртути, т.к. они вытесняют ртуть из растворов солей.
Шаг третий: из выбранных металлов находим те, что расположены правее водорода, т.к. они не вытесняют водород из растворов кислот.
Этим условиям отвечает только один металл – медь.
2. Решение задачи на расчеты по уравнению реакции
Условие задачи: Мастер решил покрыть железную фигурку слоем меди и поместил её в сосуд с раствором медного купороса. Он знал, что на изготовление фигурки было использовано ровно 120 г железа. Когда мастер достал фигурку из раствора, её масса оказалась уже 121,56 г. Сколько граммов меди осело на фигурке?
Шаг первый: Запишем уравнение реакции
Шаг второй: Выразим массу железа через массу меди.
Из уравнения реакции следует, что количество вещества выделившейся меди равно количеству вещества прореагировавшего железа
m(Fe)/56 = m(Cu)/64, тогда
Шаг третий: Рассчитаем массу меди.
Так как масса пластинки уменьшилась на величину массы прореагировавшего железа и увеличилась на величину массы выделившейся меди, можно записать равенство:
Ряд стандартных электродных потенциалов
Стандартные электродные потенциалы металлов указывают на меру окислительно-восстановительной способности металла и его ионов. Металлы в виде простых веществ – восстановители, ионы металлов – окислители.
Чем наиболее отрицателен электродный потенциал, тем выше способность металла посылать ионы в раствор и тем сильнее проявляет себя металл как восстановитель (например, Li, Na, K). И наоборот, чем наиболее положителен потенциал металлического электрода, тем большей окислительной способностью обладают его ионы.
Активные металлы начала ряда, а также щелочные и щелочноземельные вытесняют водород из воды, Например,
Металлы, расположенные между магнием и кадмием, обычно не вытесняют водород из воды. На поверхности этих металлов образуются оксидные пленки, обладающие защитным действием.
Все металлы, стоящие в ряду стандартных электродных потенциалов до водорода, вытесняют его из растворов кислот с концентрацией (активностью) ионов водорода 1 моль/л. Например,
Если электродный потенциал металла имеет положительный знак, то металл является окислителем по отношению к водороду и не вытесняет его из растворов кислот с концентрацией ионов водорода 1 моль/л.
Металлы способны вытеснять друг друга из растворов солей. Направление реакции определяется при этом их взаимным положением в ряду напряжений. Например,
Чем дальше расположены друг от друга в ряду напряжений два данных металла, тем наибольшую ЭДС будет иметь составленный из них гальванический элемент.
Уравнение Нернста
Потенциал металлического электрода зависит от природы металла, концентрации (активности) ионов металла в растворе, температуры.
Если условия отличаются от стандартных, например, если концентрация ионов металла в растворе не равна 1 моль/л, то электродный потенциал металла не является стандартным и его либо определяют экспериментально, либо вычисляют.
При экспериментальном определении составляется гальванический элемент, одним из электродов которого является измеряемый, а вторым – стандартный водородный электрод (рис 8.2):
(катод) Pt, H2/2H + || Me n+ /Me (анод),
и определяется его электродвижущая сила как разность равновесных потенциалов катода и анода (ЭДС=│Ек−Еа│). Так как потенциал стандартного водородного электрода равен нулю (Е o =0,00 В), то ЭДС элемента будет равна потенциалу измеряемого электрода.
Для вычисления электродного потенциала в нестандартных условиях применяют уравнение Нернста:
Так как металл – твердое вещество и вступает в реакцию только с поверхности, его концентрация постоянна и не должна входит в уравнение. Поэтому для вычисления электродных потенциалов металла уравнение Нернста приобретает более простой вид:
где Е о – стандартный электродный потенциал, В; R – газовая постоянная, равная 8,314 Вт-с/моль∙К; Т − температура, К; n − число электронов, участвующих в окислительно-восстановительном процессе; F –число Фарадея, равное 96500 Кл/моль; – активность ионов металла,моль/л.
При подстановке числовых значений R, F и стандартной температуры Т = 298 К и при переходе к десятичным логарифмам, уравнение Нернста принимает еще более простой вид:
Уравнение Нернста для разбавленных растворов, в которых активности мало отличаются от концентраций ( [Me n + ]), имеет вид:
Ряд стандартных потенциалов металлических
Располагая металлы в порядке возрастания алгебраической величины их стандартных электродных потенциалов (Е°), получают ряд стандартных потенциалов металлических электродов (табл. 1), которая является одновременно и рядом стандартных электродных потенциалов.
Стандартные потенциалы металлических
Электродов при 298 К
| Электродная реакция | Е°, в | Электродная реакция | Е°, в |
| Li + + `e Û Li | - 3,045 | Cd 2+ + 2`e Û Cd | - 0,403 |
| K + + `e Û K | - 2,924 | Co 2+ + 2`e Û Co | - 0,277 |
| Rb + + `e Û Rb | - 2,925 | Ni 2+ + 2`e Û Ni | - 0,250 |
| Cs + + `e Û Cs | - 2,928 | Sn 2+ + 2`e Û Sn | -0,136 |
| Ca 2+ + 2`e Û Ca | - 2,866 | Pb 2+ + 2`e Û Pb | - 0,126 |
| Na + + `e Û Na | - 2,714 | 2H + + 2`e Û H2 | 0,000 |
| Mg 2+ + 2`e Û Mg | - 2,363 | Cu 2+ + 2`e Û Cu | +0,337 |
| Al 3+ + 3`e Û Al | - 1,662 | Hg 2+ + 2`e Û Hg | + 0,788 |
| Mn 2+ + 2`e Û Mn | - 1,179 | Ag + + `e Û Ag | + 0,799 |
| Zn 2+ + 2`e Û Zn | - 0,763 | Pd 2+ + 2`e Û Pd | + 0,990 |
| Cr 3+ + 3`e Û Cr | - 0,744 | Pt 2+ + 2`e Û Pt | + 1,190 |
| Fe 2+ + 2`e Û Fe | - 0,440 | Au 3+ + 3`e Û Au | + 1,498 |
Ряд стандартных потенциалов металлических электродов позволяет сделать следующие выводы относительно химических свойств металлов:
1. Чем меньше алгебраическая величина стандартного потенциала, тем выше восстановительная способность этого металла и тем ниже окислительная способность его ионов. Как следует из ряда стандартных потенциалов, металлический литий – самый сильный восстановитель, а золото –самый слабый. И, наоборот, ион золота Au 3+ - самый сильный окислитель, а ион лития Li + - самый слабый (табл. 1).
2. Каждый металл в ряду стандартных потенциалов способен вытеснять все следующие за ним металлы из растворов их солей. Однако это не означает, что такое вытеснение будет происходить во всех случаях. Так, алюминий вытесняет медь из раствора хлорида меди (II), но не вытесняет её из раствора сульфата меди (II). Это происходит потому, что хлорид – ион способен разрушать поверхностную оксидную пленку алюминия, а сульфат – ион этого сделать не может.
3. Все металлы с отрицательными значениями стандартных потенциалв, т.е. расположенные в ряду стандартных потенциалов до водорода, вытесняют водород из разбавленных кислот, анионы которых не проявляют окислительных свойств. При этом образуется соль соответствующего металла и кислоты и выделяется водород. Однако свинец в серной кислоте практически не растворяется, так как на поверхности образуется защитный слой из малорастворимой соли PbSO4, и реакция приостанавливается (при концентрациях серной кислоты > 80 % свинец растворяется в H2SO4, так как при этом образуется растворимая кислая соль Pb(HSO4)2).
4. Чем дальше отстаят друг от друга металлы в ряду стандартных потенциалов, тем больше ЭДС гальванического элемента, построенного из этих металлов.
Однако, пользуясь рядом стандартных потенциалов металлических электродов, следует иметь в виду, что этот ряд применим только к водным растворам и характеризует восстановительную активность металлов лишь в окислительно-восстановительных реакциях, протекающих в водных растворах.
Знание величин стандартных электродных потенциалов металлов позволяют рассчитать ЭДС гальванических элементов при стандартных условиях температуре 25°С (298 К) и концентрации ионов металла в растворе, равной 1 моль/л. Для расчёта ЭДС гальванических элементов при различных температурах и концентрациях ионов металла в растворах можно воспользовавшись уравнением Нернста
E = E° + RT/nF ln CMe n + , где (4)
Е – потенциал металла, В;
E° - стандартный потенциал металла, В (табл. 1);
R – универсальная газовая постоянная , равная 8,314 Дж/моль×К;
Т – температура, К;
F – число Фарадея, равное 96487 Кл;
n – заряд иона металла;
CMe n + - концентрация ионов металла в растворе, моль/л.
Подставив в уравнение Нернста значения R, F и T = 298 К (25°С) и, переведя натуральный логарифм в десятичный (коэффициент перевода 2,303), получим
E = E° + 0,059/n lg CMe n + (5).
Пользуясь уравнением (5), можно рассчитать величину потенциала любого металла при 298 К и концентрации ионов металла больше или меньше 1 моль/л. При CMe n + = 1 моль/л, E = E°, т.е. потенциал металлического электрода равен его стандартному потенциалу.
При точных расчётах потенциалов металлов в уравнении (5) следует lg CMe n + заменить lg a, где а – активность ионов металла в растворе.
Пример 1. Рссчитать величину электродного потенциала цинка в растворе его соли с концентрацией ионов Zn 2+ , равной 0,01 моль/л.
Решение. Согласно уравнению (5)
ЕZn 2+ /Zn = - 0,76 + 0,059/2 lg 10 -2 = - 0,82 B
Электролиз
Электролизом называется окислительно-восстановительный процесс, происходящий при прохождении постоянного электрического тока через раствор или расплав электролита. При электролизе происходит превращение электрической энергии в химическую.
Электролиз осуществляется в особых аппаратах – электролизёрах (электролитических ваннах), которые заполняются раствором или расплавом электролита. В расплав или раствор электролита погружают инертные электроды, являющиеся лишь проводниками электронов и не принимающие участие в окислительно-восстановительных электродных процессах. Один из электродов присоединяется к отрицательному полюсу внешнего источника постоянного напряжения и называется катодом. На катоде происходит процесс восстановления. Другой электрод присоединяется к положительному полюсу и называется анодом. На аноде происходит процесс окисления.
Как в растворах, так и в расплавах электролитов существуют беспорядочно движущиеся ионы. При подключении электродов к внешнему источнику постоянного напряжения движение ионов приобретает направленный характер. К катоду движутся положительные ионы электролита – катионы, а к аноду – отрицательные ионы, называемые анионами.
При электролизе в большинстве случаев инертные электроды бывают металлическими (например, платиновые), но применяются и неметаллические, проводящие ток электроды, например, графитовые.
Рассмотрим схему электролиза водного раствора хлороводорода с платиновыми инертными электродами (Рис.5). В процессе электролиза водного раствора HCl на катоде выделяется водород, а на аноде – хлор
катод (-) 2H + + 2 `e ® H2
анод (+) 2Cl - - 2 `e ® Cl2
ЭДС данного гальванического элемента в стандартных условиях будет равна
Очевидно, чтобы начался процесс разряда ионов на электродах, необходимо от внешнего источника электричества приложить к электродам напряжение, равное 1,358 В. Знак прилагаемого к электродам напряжения должен быть противоположен знаку ЭДС образовавшегося гальванического элемента. В действительности, прилагаемое от внешнего источника электричества напряжение должно превышать вычисленное значение ЭДС гальванического элемента. Это связано с тем, что для осуществления электродных процессов необходимо, чтобы ионы подошли к электродам, адсорбировались на них, после разрядки объединились в молекулы и десорбировались. Эти процессы протекают с определёнными скоростями и на их осуществление требуется затрата дополнительной энергии, т.е. необходимо повысить прилагаемое напряжение. Это дополнительное напряжение называется перенапряжением.
Стандартные электродные потенциалы металлов
В 1865 г. (т.е. за 4 года до открытия Д.И. Менделеевым переодического закона) металлы уже были классифицированы по их активности. Это сделал известный русский ученый Н.Н. Бекетов, который изучал действие различных металлов на разбавленные кислоты и воду и заметил, что наиболее активно ведут себя щелочные металлы. Некоторые же металлы, такие, как Cu, Hg, Ag, Au, вообще не вытесняли водород из растворов кислот, даже наоборот — водород сам способен вытеснять металлы из солей ртути и серебра.
Итогом трудов Н.Н. Бекетова явился так называемый вытеснительный ряд металлов:
K, Na, Ca, Mg, Al, Mn, Zn, Fe, Ni, Sn, Pb, H2, Cu, Hg, Ag, Au.
Все металлы, стоящие в этом ряду левее водорода, вытесняют водород из разбавленных кислот.
Современное название этого ряда — «Электрохимический ряд напряжений», так как положение каждого металла в этом ряду определяется величиной так называемого электродного потенциала.
Что же такое электродный потенциал? Как он возникает?
Напомним, что электрическим потенциалом называют величину, соответствующую энергии, которую нужно затратить (и тогда потенциал положителен) или которую можно получить (и тогда потенциал отрицателен) при переносе единицы электричества из бесконечности в данную точку.
Согласно современным представлениям, в узлах кристаллических решеток металлов находятся атомы и ионы, причем нейтральных атомов очень мало, подавляющее число частиц находится в виде ионов. Электроны, подчиняясь законам квантовой теории, движутся в поле положительных зарядов, создавая своеобразный «электронный газ». Таким образом, в металле существует подвижное равновесие, которое можно выразить уравнением.
Если погрузить пластинку металла в воду, то под действием полярных молекул воды часть катионов перейдет в жидкость Me z + + mH2O ? [Me(H2O)m] z+ , а электроны останутся на пластинке металла, в результате чего металл зарядиться отрицательно.
Катионы, перешедшие в жидкость, располагаются вблизи поверхности отрицательно заряженной пластинки металла, в результате чего образуется двойной электрический слой, что схематически можно представить так (рис.1):
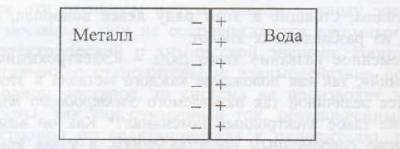
Рис.1. двойной электрический слой на границе металл–вода
Таким образом, на границе соприкосновения жидкости с металлом электрический потенциал? резко изменяется и наблюдается скачок (или разность) потенциала ??, который принято называть электродным потенциалом.
. В большинстве современной химической литературы скачки потенциалов обозначаются просто ?.
Ясно, что чем активнее металл, тем легче будут диссоциировать его атомы, тем большее количество катионов перейдет в жидкость и тем, следовательно, б?льшим будет отрицательный заряд металла, что, в свою очередь, обусловит б?льшую разность потенциалов на границе металл—жидкость.
Процесс перехода ионов металла в жидкость является обратимым процессом. Поэтому, если погрузить пластинку металла не воду, а в раствор соли этого металла, то равновесие будет смещено: из металла в раствор будет переходить меньше ионов и разность потенциалов на границе металл—раствор будет несколько иной, чем в первом случае.
На рис. 2. представлена схема возникновения двойного электрического слоя в случае цинковой и медной пластинок, погруженных в растворы их солей.
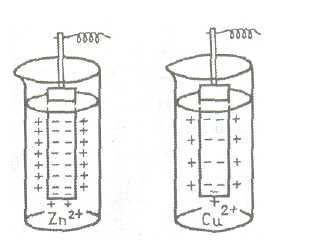
Рис.2. Схема возникновения электродного потенциала
Видно, что величина электродного потенциала определяется прежде всего природойметалла. Кроме того она зависит от температуры, концентрации раствора и других факторов. Поэтому для сравнения электродных потенциалов необходимо выбрать некоторые стандартные условия. Обычно сравнение производят при 25°С, давлении 101,3 кПа и в растворе с концентрацией одноименного иона, равной единице (1 моль/л).
Таким образом, стандартным электродным потенциалом называется электродный потенциал при концентрации иона металла 1 моль/л.
Абсолютное значение электродного потенциала измерить невозможно (поскольку введение любых измерительных зондов неизбежно приводит к появлению новой контактной разности потенциалов). Вместе с тем не представляет труда измерение величины относительного электродного потенциала.
Относительные электродные потенциалы металлов измеряют относительно стандартного водородного электрода, потенциал которого произвольно принят за нуль.
Поскольку водород при температуре 298 К является газом, из него невозможно, как из металла, изготовить пластинку. В качестве твердой фазы в стандартном водородном электроде используют инертный металл (например, Pt).
Конструктивно водородный электрод (рис.3) состоит из платиновой пластинки, покрытой слоем мелкозернистой платины — платиновой чернью, частично погруженной в раствор кислоты с концентрацией ионов водорода, равной 1 моль/л. Обычно берут раствор нелетучей кислоты — серной H2SO4 или хлорной HClO4. К пластинке подают чистый газообразный водород под постоянным давлением 101,3 кПа.
Возникновение потенциала на стандартном водородном электроде можно представить следующим образом. Газообразный водород, адсорбируясь платиной, переходит в атомарное состояние, поэтому в поверхностном слое платины устанавливается равновесие Н2 ? 2Н, а на границе платины и раствора серной кислоты — равновесие Н ? Н + + е.
Суммарный процесс выражается уравнением:
Таким образом, водородный электрод можно обозначить как Н2/Н + , Pt, где вертикальная черта означает поверхность раздела фаз.
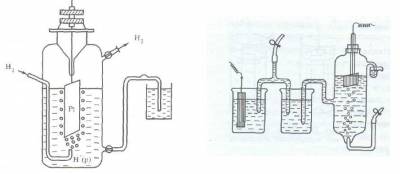
Рис. 3. Схема водородного электрода или так
Если пластинку некоторого металла, погруженную в раствор его соли с концентрацией иона металла 1 моль/л, соединить электролитным мостиком с водородным электродом (рис.3), то получится гальванический элемент, т.е. в полученной системе пойдет электрический ток, обусловленный разностью электродныхпотенциаловводородногоэлектродаи изучаемогометалла.
Вот эту величину — разность электродных потенциалов катода и анода — в разомкнутом (незамкнутом) гальваническом элементе называют электродвижущей силой (ЭДС или Е) элемента:
ЭДС= ??1 –??2 или ЭДС = ??к –??А
В замкнутом гальваническом элементе, т.е. при измеряемом значении силы тока в элементе (т.е. при соединении платины с некоторым металлом металлическим проводником) разность потенциалов катода и анода называют напряжением:
Прямым измерением разности потенциалов на клеммах гальванического элемента с помощью обычного вольтметра можно получить значение напряжения U,которое не равноЭДСэлемента, т.е. U < ЭДС.
Разница между ЭДС и напряжением обусловлена падением напряжения внутри элемента при прохождении тока (в физике ЭДС = I·R + I·rвнутр.., где rвнутр– внутреннее сопротивление электродов. При I ~ 0 произведение I·rвнутр.. = 0, но выражение I·R хоть и очень мало, но все-таки оно есть и равно ЭДС). Поэтому измерение ЭДС обычно проводят компенсационным методом, при котором ток, протекающий через элемент, близок к нулю. Более простой и менее точный метод измерения ЭДС заключается в прямом измерении напряжения на клеммах гальванического элемента вольтметром, имеющим высокое сопротивление (высокоомным вольтметром). Вследствие высокого сопротивления вольтметра мал ток, протекающий через элемент, поэтому не велика разница между ЭДС и напряжением элемента.
Измеренная ЭДС цепи, составленной из стандартного водородного электрода и стандартного металлического электрода является электродным потенциалом последнего.
Если измерить стандартные электродные потенциалы различных металлов по отношению к потенциалу стандартного водородного электрода и расположить их в порядке увеличения, то получим ряд напряжений металлов:
?? 0 , ВK, Na, Ca, Mg, Al, Mn, Zn, Fe, Ni, Sn, Pb, H2, Cu, Hg, Ag, Au
(или просто ? 0 ) –2,92 –2,38 0,0 0,8 1,2
Ряд напряжений характеризует химические свойства металлов:
1. Чем меньшей алгебраической величиной ? 0 обладает металл, тем он химически активнее, т.е. тем больше его восстановительная способность.
2. Чем дальше расположены друг от друга в ряду напряжений два металла, тем б?льшую электродвижущую силу будет иметь построенный из них гальванический элемент, причем катодом всегда будет являться тот электрод, потенциал которого больше.
Читайте также:
