Что такое трабекулярный металл
Обновлено: 17.05.2024
Компания Zimmer Biomet, мировой лидер в области разработок решений для лечения и профилактики заболеваний опорно-двигательного аппарата, огласил результаты применения ацетабулярных чашек из трабекулярного металла у 9 500 пациентов при ревизионном эндопротезировании тазобедренного-сустава. Источником информации был отчет Национального регистра эндопротезирования Великобритании (National Joint Registry (NJR) for England, Wales, Northern Ireland and the Isle of Man), где были приведены сведения о том, применение ацетабулярных чашек из трабекулярного металла достоверно имело меньший риск развития инфекции после операции и снижало риск необходимости повторного оперативного вмешательства.
Независимый анализ, проведенный NJR, продемонстрировал следующее:
- Ацетабулярные чашки из трабекулярного металла, применявшиеся при ревизионных операциях тотального эндопротезирования тазобедренного сустава имели на 21% меньший риск необходимости повторной операции по причине развития инфекционных осложнений (статистически достоверно, p=0.036).
- У пациентов высокого риска с уже проведенной ревизионной операцией по причине развития инфекционных осложнений, использование чашек из трабекулярного металла имело на 35% меньший риск необходимости выполнения еще одной операции также по причине инфекции. Ввиду ограниченного количества демо-имплантатов, размер выборки не достиг статистически значимого объема (p=0.108).
- Использование ацетабулярных чашек из трабекулярного металла при ревизионных операциях снижало риск необходимости выполнения еще одной операции по любой причине на 11% (статистически значимо, p=0.015).
“Инфекция, расшатывание имплантата, боль и дислокация – наиболее распространенные причины необходимости проведения ревизионной операции,” заявил Дэн Уильямсон, президент подразделения эндопротезирования компании Zimmer Biomet. “Наши продукты из трабекулярного металла созданы для долгих лет службы пациентам после эндопротезирования тазобедренного сустава. Данные отчета регистра Великобритании подтверждают значительное снижение частоты ревизии у большого количества пациентов, вместе с улучшением клинических исходов по сравнению со случаями применения ацетабулярных чашек из не-трабекулярного металла.”
Трабекулярный металл компании Zimmer Biomet это уникальный биоматериал высокой порозности, выполненный из тантала и имеющий структурно, функционально и физиологически схожие с костью характеристики. Материал, особенностью которого является наличие 100% открытых и соединенных между собой пор для лучшего костного врастания и васкуляризации, применяется при различных вмешательствах ортопедического спектра уже более 19 лет.
“Инфекции после ортопедических процедур стали центром внимания,” заявил Джавад Парвизи, ортопедический хирург из Института Ротмана Университета Томаса Джефферсона в Филадельфии. “Основываясь на недавно полученных из различных источников данных, имплантаты из трабекулярного металла имеют уникальные характеристики, позволяющие им снизить частоту встречаемости инфекции после ревизионной тотальной артропластики тазобедренного сустава. Эта новость очень воодушевляет и должна стать стимулом для нас для проведения дальнейших исследований противо-инфекционных свойств имплантатов из трабекулярного металла.”
О компании Zimmer Biomet
Компания была основана в 1927 со штаб-квартирой в Warsaw, Indiana, USA. В настоящее время компания Zimmer Biomet является мировым лидером в области разработок для профилактики и лечения заболеваний опорно-двигательного аппарата. Мы разрабатываем, производим и выводим на рынок широкий спектр продуктов: эндопротезы, фиксаторы для спортивной медицины, имплантаты для металлостеосинтеза (коррекция травматических повреждений костей конечностей), дегенеративных повреждений и деформаций позвоночника, сопутствующие технологии, имплантаты для ЧЛХ, ортодонтии и других смежных хирургических специальностей.
Мы сотрудничаем с врачами-специалистами о всему миру для того, чтобы вместе развивать медицинские технологии. Наши продукты и решения помогают пациентам, страдающим от заболеваний и травм костей, суставов и мягких тканей опорно-двигательного аппарата. Вместе с медицинскими специалистами, мы помогаем улучшить качество жизней миллионов людей по всему миру.
___________________________________
1 According to NJR data from 2003 to 2015 where 9,573 Trabecular Metal and 30,452 non-Trabecular Metal cups were used in revision THA and based on hazard ratios adjusted by patient gender, age group, and indications (osteoarthritis/non-osteoarthritis).
2 NJR data shows a higher percentage of Trabecular Metal cups were used with antibiotic bone cement compared to all other non-Trabecular Metal cementless cups.
3 According to NJR data from 2003 to 2015 where 628 Trabecular Metal and 2,114 non-Trabecular Metal cups were used in revision THA and based on hazard ratios adjusted by patient gender, age group, and indications (osteoarthritis/non-osteoarthritis).
4 Karageorgiou, V. and Kaplan, D. “Porosity of 3D Biomaterial Scaffolds and Osteogenesis.” Biomaterials, 26 (27): 5474-91, September 2005
Трабекуллярный металл и инфекция
Ревизионная ацетабулярная система Trabecular Metal

Материал Trabecular Metal обладает гораздо более высоким коэффициентом трения с губчатой костью, чем любые другие материалы имплантатов. Это свойство способствует прямой аппозиции кости, что повышает первичную стабильность посадки имплантата.
Сопротивление сдвигу (МПа) поверхности кости в месте соприкосновения с материалом Trabecular Metal выше, чем при соприкосновении с поверхностями для фиксации других материалов. Материал Trabecular Metal изготавливается из тантала, одного из наиболее биологически инертных металлов. Материал Trabecular Metalо бладает свойствами, которые подобны свойствам губчатого вещества кости. Его трехмерная архитектура обеспечивает поверхность с большим коэффициентом трения в зоне соприкосновения с костью, что гарантирует получение надежного склерометрического соединения и превосходную первоначальную стабильность посадки имплантата. Кроме того, сообщающиеся поры обеспечивают быстрое и обширное образование костной ткани и врастание биологических тканей, за счет чего достигается долгосрочная фиксация.
Ревизионная чашка Trabecular Metal
Ревизионная чашка из материала Trabecular Metal обеспечивает как первоначальную, так и долгосрочную стабильность за счет высокого коэффициента трения о кость, при котором, благодаря пористости материала до 80%, происходит врастание костной ткани
Низкий модуль упругости материала Trabecular Metal облегчает нормальное распределение физиологической нагрузки на кость, снижая тем самым эффект стресс-шилдинга.
Цельная конструкция, создаваемая посредством цементной фиксации вкладыша, исключает проблемы, связанные с износом задней части впадины.
За счет эллиптической геометрии создается плотное соединение с пресс-фитом 2-мм на периферии чашки, максимально повышающее контакт с костью, что обеспечивает первичную стабильность.
чашка предназначена для использования при первичном и ревизионном эндопротезировании. Ее уставливают в положении, обеспечивающем максимальный контакт с костью, в то время как вкладыши с уклоном 10 градусов и с нейтральным уклоном 0 градусов позволяют выбрать нужный угол наклона.
Отверстия для винтов в куполе обеспечивают возможность дополнительной фиксации в кости.
Вкладыши из высокосшитого полиэтиленаLongevity® доступны в разных конфигурациях, что позволяет удовлетворить индивидуальные потребности пациента.
Материал Trabecular Metal по физическим и механическим свойствам, обусловленным высокой прочностью на сжатие и низким модулем продольной упругости, подобен губчатому веществу кости.
Аугменты Trabecular Metal
Ревизионная ацетабулярная система Trabecular Metal фирмы Zimmer® устанавливает для хирургов новые стандарты ревизионного эндопротезирования. Она объединяет в себе технологию Trabecular Metal с возможностью подбирать индивидуальные решения для каждого пациента — сочетание, которое не может предложить ни одна другая аналогичная система.
Аугменты Trabecular Metal:
- полностью изготовлена из материала Trabecular Metal без субстрата.
- Предназначенаы для использования при обширных сегментарных дефектах верхнего края впадины (дефекты типа IIIA по Paprosky)
- Используется в качестве альтернативы аллотрансплантату, которая исключает вероятность резорбции кости или расширения дифекта
- Обеспечивает технически простую процедуру по сравнению с использованием структурного аллотрансплантата
- Поверхности цементируются, за счет чего создается монолитная структура, исключающая микроподвижность
- Кость-реципиент сохраняется, поскольку размер, положение и ориентация имплантата выбираются в зависимости от дефекта
- Позволяет воссоздать центр головки, что оптимизирует кинетику сустава
Кейдж к ревизионной чашке Trabecular Metal
Ни один другой материал для протезирования не имитирует кость так, как материал Trabecular Metal. Не только покрытие, но и сам материал обладает объемной пористостью. Кроме того, это один из самых биосовместимых материалов, применяющихся в ортопедии.
Кейдж к ревизионной чашке Trabecular Metal имеет следующие характеристики:
Что такое трабекулярный металл
ФГБУ "Эндокринологический научный центр" Минздрава РФ, Москва
ФГУ Эндокринологический научный центр Минздравсоцразвития Российской Федерации, Москва
ФГБУ "Эндокринологический научный центр" Минздрава РФ
ФГБОУ ВО «Уральский государственный медицинский университет» Минздрава России, Екатеринбург, Россия
ФГБУ «Эндокринологический научный центр» Минздрава России, Москва, Россия
ФГУ Эндокринологический научный центр, Москва
Центр костных заболеваний, Университетский госпиталь Лозанны, Швейцария
ГБОУ ВПО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздрава России, Москва, Россия
ФГБУ «Эндокринологический научный центр» Минздрава России
Исследование трабекулярного индекса кости как один из новых способов неинвазивной оценки микроархитектоники костной ткани у пациентов с эндогенным гиперкортицизмом
Журнал: Проблемы эндокринологии. 2015;61(4): 9‑16
Цель — изучить значение трабекулярного индекса кости и факторы риска переломов у пациентов с эндогенным гиперкортицизмом (ЭГ). Материал и методы. В исследование включены 182 пациента с лабораторно подтвержденным ЭГ, проходивших лечение в ФГБУ ЭНЦ. У всех пациентов измеряли минеральную плотность кости с использованием DXA Prodigy (GEHC Lunar, Мэдисон Висконсин, США). Трабекулярный индекс кости оценивали ретроспективно по имеющимся изображениям остеоденситометрии с помощью программного обеспечения TBS iNsight software v2.1 (Medimaps, Merignac, Франция). Каждый пациент был опрошен по поводу низкотравматичных переломов в период заболевания; всем была выполнена боковая рентгенография грудного и поясничного отделов позвоночника ТhVI—LV. Уровень свободного кортизола в суточной моче измеряли с помощью иммунохемилюминисцентного метода с экстракцией диэтиловым эфиром на аппарате VITROS ECi (референсные значения 60—413 нмоль/сут). Результаты. Среди 182 пациентов с ЭГ (149 женщины; 33 мужчины) болезнь Иценко—Кушинга была подтверждена в 151 случае, у 9 больных диагностирована доброкачественная кортикостерома надпочечников и у 22 пациентов выявлен синдром эктопической продукции АКТГ. Медиана возраста пациентов составила — 35 (Q25—Q75 27—49) лет, индекс массы тела — 29 (26—33) кг/м2. Медиана уровня свободного кортизола в суточной моче — 1760 (985—2971) нмоль/сут. Переломы были подтверждены в 80 (44%) случаях, 70 пациентов страдали от переломов позвонков, которые были множественными в 53 случаях; 23 пациента имели внепозвоночные переломы. Медиана трабекулярного индекса кости составила 1,205 (1,102—1,307), что значительно ниже ожидаемого у здоровых добровольцев (>1,350), тогда как снижение минеральной плотности кости (МПК) не соответствовало тяжести остеопороза и распространенности переломов: LI—LIV Z-критерий –1,7 (–2,5— –0,73); шейка бедренной кости Z-критерий –1 (–1,6— –0,4). С помощью метода бинарной логистической регрессии с включением в качестве переменных пола, возраста, индекса массы тела, МПК, трабекулярного индекса кости и свободного кортизола в суточной моче установлено, что наиболее значимым предиктором переломов является уровень свободного кортизола в суточной моче (р=0,001). На результаты ретроспективного исследования трабекулярного индекса кости и его способность прогнозировать переломы повлияла скорее всего высокая распространенность переломов тел позвонков у пациентов с ЭГ. Заключение. Пациенты с ЭГ имеют низкие показатели трабекулярного индекса кости, который лучше отражает поражение скелета при ЭГ, чем МПК. Наиболее значимым прогностическим фактором низкотравматичных переломов у пациентов с ЭГ является уровень свободного кортизола в суточной моче, отражающий тяжесть течения заболевания.
Определение трабекулярного индекса кости (trabecular bone score, TBS) — метод косвенной оценки микроархитектоники скелета по данным рутинной рентгеновской двухэнергетической остеоденситометрии поясничного отдела позвоночника [1]. Метод основан на оценке вариаций серых 2D- изображений остеоденситометрии. При более пористой структуре кости изображение будет иметь меньшее число пикселей с большей амплитудой, тогда как хорошо структурированная костная ткань будет иметь большее количество пикселей с меньшей амплитудой [2]. Низкое значение TBS соответствует нарушенной внутренней структуре костной ткани, а высокие значения типичны для хорошей внутренней структуры кости [2]. Результаты определения TBS коррелируют с данными прямой оценки микроархитектоники, в частности микрокомпьютерной томографии [2]. Значения TBS коррелируют с результатами высокоразрешающей периферической компьютерной томографии [3]. TBS дает независимую от показателей денситометрии информацию о риске низкотравматичных переломов позвонков и бедра у женщин в постменопаузе и у мужчин, и его применение перспективно у пациентов с вторичным остеопорозом, особенно при преимущественном нарушении микроархитектоники кости [3, 4].
Эндогенный гиперкортицизм (ЭГ) — тяжелое многосимптомное заболевание, характеризующееся избыточной секрецией кортизола надпочечниками и, как следствие, множественными осложнениями со стороны различных органов и систем [5, 6]. Избыток кортизола приводит к развитию вторичного остеопороза и низкотравматичных переломов [7]. Распространенность низкотравматичных переломов у пациентов с ЭГ варьирует от 20 до 70% [8—12]. Несмотря на тяжелое течение и высокую частоту переломов, показатели минеральной плотности кости (МПК) у пациентов с эндогенным и экзогенным гиперкортицизмом в ряде случаев соответствуют лишь остеопении или даже остаются нормальными [13]. Оценка TBS наряду с показателями МПК у пациентов с гиперкортицизмом может дать существенную дополнительную информацию о нарушении микроархитектоники костной ткани у этих больных.
Цель настоящего исследования — определение трабекулярного индекса кости, сопоставление его значений с показателями МПК и другими факторами риска переломов у пациентов с ЭГ.
Материал и методы
Исследование с участием 182 пациентов, находящихся в активной стадии эндогенного гиперкортицизма (ЭГ), подтвержденного лабораторно и клинически, выполнено в отделении нейроэндокринологии и остеопатий ФГБУ «Эндокринологический научный центр» МЗ РФ. С целью подтверждения диагноза у всех пациентов определяли уровень свободного кортизола в суточной моче (референсные значения 60—413 нмоль/л), проводили малую пробу с дексаметазоном (исследование уровня кортизола в крови в утренние часы на фоне действия 1 мг дексаметазона, принятого накануне вечером). Дополнительно определяли уровень свободного кортизола в вечерней слюне (референсные значения 0,5—9,4 нмоль/л) [14]. Измеряли рост пациентов и рассчитывали индексы массы тела. У всех пациентов оценивали рентгенограммы поясничного и грудного отдела позвоночника в боковой проекции Th IV —L IV , согласно рекомендациям H. Genant и соавт. [15]. Исследование выполнялось на аппарате Axiom Icons R200 «Siemens». МПК измеряли с помощью двухэнергетической рентгеновской абсорбциометрии (DXA) на аппарате GE LUNAR Prodigy в поясничном отделе позвоночника (L I —L IV ), шейке бедра (Neck) и в проксимальном отделе бедренной кости в целом (Total hip). Оценка показателей остеоденситометрии проводилась по Z-критерию, так как большинство пациентов находились в пременопаузе или были моложе 50 лет. Z-критерий -2,0 SD и ниже, в соответствии с разработанными ранее показателями, определялся как «ниже ожидаемого диапазона для данного возраста». Z-критерий, превышающий -2,0 SD, определялся как «в пределах ожидаемого диапазона для данного возраста» [16, 17]. Оценка TBS проводилась ретроспективно с помощью программного обеспечения TBS v2.1 («Medimaps, MERIGNAC», Франция) на основании данных остеоденситометрии пациентов. TBS ≤1,2 соответствовал нарушенной микроархитектонике кости, TBS между 1,20 и 1,35 отражал частично поврежденную микроархитектонику, а TBS ≥1,35 определялся как нормальный показатель [4]. Исследование остеокальцина (ОК), С-терминального телопептида коллагена 1-го типа (CTх), кортизола в сыворотке крови и слюне проводилось электрохемилюминесцентным методом на аппарате Cobas E601 Рош. Анализ свободного кортизола в суточной моче выполнялся иммунохемилюминесцентным методом с предварительной экстракцией диэтиловым эфиром на аппарате VITROS ECi.
Количественные значения признаков представлены как медианы и (Q25—Q75) интерквартильный интервал; приведены также минимальное (Min) и максимальное (Max) значения. Качественные параметры представлены в процентах с 95% доверительным интервалом (ДИ). Для оценки различий по количественным параметрам в двух независимых выборках использовался тест Манна—Уитни. Для сравнения групп по качественному признаку использовался тест Фишера. Для оценки связи между количественными переменными использовали коэффициент ранговой корреляции Спирмена. Для оценки наиболее значимого предиктора низкотравматичных переломов проводился бинарный логистический регрессионный анализ с наличием или отсутствием перелома в качестве зависимой переменной и возрастом пациентов, полом, ИМТ, МПК, TBS, свободным кортизолом в суточной моче и уровнем остеокальцина в качестве независимых переменных. Анализ кривых операционных характеристик использовался для выбора точки разделения для уровня кортизола в суточной моче. Выбор точки разделения осуществлялся по принципу оптимизации чувствительности и специфичности. для количественной оценки влияющего фактора рассчитывали отношение шансов (ОШ) с 95% ДИ, как рекомендовано A. Glas и соавт. [18]. Различия при p
Для статистического анализа использовалось программное обеспечение SPSS 16.0.
Результаты
Характеристики 182 пациентов представлены в таблице 1.

Таблица 1. Основные характеристики пациентов, включенных в исследование

Таблица 2. Трабекулярный индекс кости и показатели МПК (n=182)

Рис. 2. Значения трабекулярного индекса кости (TBS) и минеральной плотности кости (МПК), выраженные в стандартных отклонениях от возрастной нормы (Z-критерий) у пациентов с эндогенным гиперкортицизмом. Количество пациентов с определенными показателями TBS и МПК представлено в процентах (%) от общего количества включенных в исследование (n=182). В целом 152 (88,5%) пациентов имели нарушенную (TBS≤1.2) и частично нарушенную микроархитектонику (TBS > 1,2 и <1,35) в поясничном отделе позвоночника. Снижение МПК ниже ожидаемого для данного возраста (Z-score ≤–2) было выявлено только у 74 (40,9%) пациентов в поясничных позвонках, 12,3% в шейке бедра и 8,1% в бедре в целом.
Таким образом, TBS в большей степени, чем МПК, отражает негативное влияние избыточной секреции кортизола на костную ткань. Результаты анализа наиболее значимых факторов риска низкотравматичных переломов при ЭГ представлены в табл. 3.

Таблица 3. Клинические и биохимические показатели больных с ЭГ с низкотравматичными переломами и без них
Анализ проводили отдельно для переменных с выраженной корреляционной зависимостью с частотой переломов (МПК в различных участках скелета, Z-критерий и ИМТ). Переменные, имеющие высокие значения частной корреляции с другими независимыми факторами, во избежание мультиколлинеарности исключались. Регрессионный анализ показал, что основным предиктором переломов является уровень свободного кортизола в суточной моче (р=0,001); прирост этого показателя на каждые 100 нмоль/сут увеличивал частоту переломов на 1,041 (95% ДИ: 1,019—1,063) случая. С помощью анализа ROC-кривой был рассчитан уровень свободного кортизола в суточной моче (1472 нмоль/сут), с которого этот параметр начинал влиять на частоту переломов. С поправкой на пол и МПК отношение шансов возникновения переломов у пациентов с уровнем свободного кортизола в суточной моче >1472 нмоль/сут составило 3,002 (95% ДИ 1,522—5,921; р=0,002), т. е. шансы были значимо выше, чем у пациентов с более низким содержанием свободного кортизола в суточной моче.
Уровень ОК у пациентов с переломами был значимо ниже, чем у пациентов без переломов [6,2 (3,3—8,0) нг/мл против 8,3 (4,8—12,1 нг/мл; р=0,005], тогда как уровни CTх практически не зависели от наличия переломов [0,42 (0,23—0,53) нг/мл и 0,36 (0,24—0,54) нг/мл соответственно (р=0,45)]. Выявлена выраженная корреляционная зависимость между уровнем свободного кортизола в суточной моче и содержанием ОК [ρo=–0,5 (р <0,001)] и менее выраженная — между уровнем свободного кортизола в суточной моче и СТх [ρo=–0,325 (р<0,05)]. Тем не менее логистический регрессионный анализ подтвердил, что уровень свободного кортизола в суточной моче является основным фактором риска возникновения переломов (р<0,001), тогда как ОК в данном случае не имеет существенного значения (р=0,943).
Необходимо отметить, что поскольку TBS оценивают по данным денситометрии, любое «дополнительное изображение» может повлиять на значение этого показателя. Нельзя также использовать различные денситометры. Искажать результат может и развитая подкожно-жировая клетчатка передней брюшной стенки, поэтому оценку TBS лучше проводить при ИМТ 15—35 кг/м 2 [26]. В нашем исследовании суммарный результат не зависел от включения в анализ пациентов с ИМТ >35 кг/м 2 , хотя развитый подкожно-жировой слой передней брюшной стенки, характерный для пациентов с ЭГ, мог играть роль «артефакта». У пациентов без вторичного остеопороза TBS снижается с возрастом [26]. Эта тенденция не наблюдается при вторичном остеопорозе.
Наше исследование показало, что наиболее значимым предиктором низкотравматичных переломов является уровень кортизола в суточной моче. Все другие показатели, в том числе и TBS, зависели от этого параметра. При его увеличении на каждые 100 нмоль/сут риск переломов возрастал на 4,1%. Интересно, что при анализе основных предикторов низкотравматичных переломов у пациентов, получающих супрафизиологические дозы глюкокортикоидов, именно доза препарата была основным предиктором переломов, независимо от пола, возраста и МПК [27, 28].
Как и в других исследованиях [29—31], нами был обнаружен сниженный уровень маркера костеобразования (ОК) у пациентов с Э.Г. При наличии переломов содержание ОК было ниже, чем в их отсутствие. Однако уровень ОК зависел от содержания кортизола в суточной моче и, как показал многофакторный анализ, снижение этого уровня было вторичным по отношению к тяжести гиперкортицизма.
Преимуществом нашего исследования можно считать относительно большую для этого редкого заболевания когорту пациентов, что позволило провести многофакторный анализ и выделить наиболее значимый фактор риска низкотравматичных переломов. Кроме того, всем пациентам проводилась боковая рентгенография позвоночника, что дало возможность зарегистрировать все низкотравматичные переломы. У всех пациентов определяли также МПК. С другой стороны, ограничением исследования является ретроспективный анализ TBS по уже существующим сканам денситометрии. Множественные компрессионные деформации тел позвонков могли нивелировать различия TBS между пациентами с низкотравматичными переломами и без них.
Из-за тяжести состояния пациентов с активным ЭГ все они должны получать лечение, что делает невозможным и неэтичным проспективное наблюдение. Кроме того, не всегда возможно точно установить истинную продолжительность гиперкортицизма, так как многие симптомы неспецифичны.
Заключение
Для пациентов с эндогенным гиперкортицизмом характерна высокая частота низкотравматичных переломов (44%), преимущественно переломов тел позвонков. При развитии низкотравматичного перелома вероятность нового перелома значительно возрастает и большинство пациентов имеют множественные компрессионные деформации тел позвонков. На момент диагноза у пациентов определяется значительное снижение TBS и уровня маркеров костеобразования, но только небольшое снижение МПК. Наиболее значимым предиктором низкотравматичного перелома является тяжесть гиперкортицизма, оцениваемая по уровню кортизола в суточной моче; вес этого фактора превосходит значимость всех других потенциальных факторов риска, таких как возраст, пол, ИМТ, МПК, TBS и снижение уровня маркеров костеобразования.
Авторы декларируют отсутствие конфликта интересов при написании данной статьи.
Работа проведена при поддержке Гранта Президента Р.Ф. для молодых ученых МД-3332.2015.7.
МРТ после эндопротезирования сустава: влияние магнитных полей на состав импланта, как узнать можно или нет
Распространенным является мнение, что людям с имплантами нельзя делать МРТ. На самом деле так было несколько десятилетий назад, когда пациентам ставили протезы из стали, никеля и кобальта. В те годы проведение магнитно-резонансной томографии могло нанести здоровью человека серьезный вред.

Давайте с самого начала уясним, что лицам с эндопротезами, штифтами, винтами, фиксирующими пластинами, грудными и зубными имплантами МОЖНО делать МРТ.
С какими имплантами можно делать МРТ
МРТ разреш ается проводить людям, которым проведено эндопротезирование тазобедренного или коленного сустава. Важно, чтобы эндопротез или фиксатор для остеосинтеза был сделан из металлов или керамики с низкой магнитной восприимчивостью. Это позволяет избежать смещения или перенагрева конструкции во время обследования.
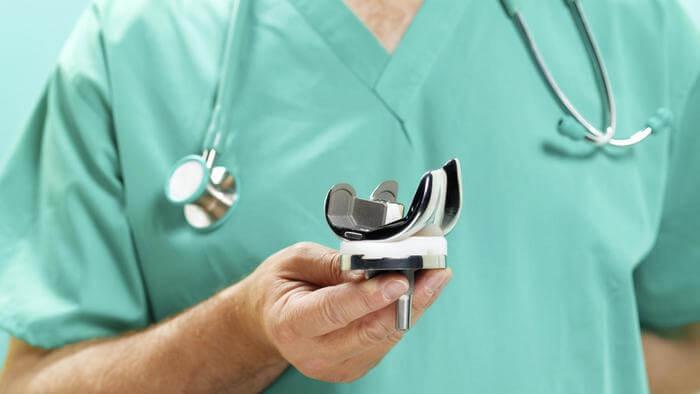
Эндопротез коленного сустава.
Людям с грыжевыми сетками, зубными, грудными и суставными эндопротезами также разрешается делать МРТ. Все эти импланты изготавливаются из материалов, не взаимодействующих с магнитным полем. Это делает исследование безопасным. Однако перед МРТ следует проконсультироваться со специалистом. Врач оценит возможные риски и порекомендует нужные меры предосторожности.
Взаимодействие разных металлов с магнитным полем
Различные металлы имеют свойство по-разному взаимодействовать с магнитами. Некоторые из них притягиваются в нему, другие – отталкиваются, третьи – вовсе никак не реагируют. Для изготовления эндопротезов используют все три вида металлов.
Таблица 1. Классы металлов.
| Класс | Представители | Описание |
| Диамагнетики | Медь Цирконий Серебро Цинк | Имеют отрицательную магнитную восприимчивость. Это значит, что при взаимодействии с магнитным полем они отталкиваются, а не притягиваются. |
| Парамагнетики | Титан Вольфрам Алюминий Тантал Хром Молибден | Для этих металлов характерно наличие низкой магнитной восприимчивости, не зависящей от напряженности магнитного поля. Протезы из парамагнетиков обычно хорошо переносят процедуру МРТ, не смещаются и не нагреваются. |
| Ферромагнетики | Железо Никель Кобальт Сталь | Имеют высокую магнитную восприимчивость, зависимую от напряженности магнитного поля. Импланты, содержащие большое количество этих металлов, могут смещаться или нагреваться во время проведения МРТ. |
Состав современных эндопротезов
Все пластины, штифты и эндопротезы, которые используются в современной травматологии и ортопедии, состоят из разнообразных сплавов. Отметим, что разные импланты содержат различное количество парамагнетиков и ферромагнетиков. Именно от состава и зависят свойства каждого эндопротеза, штифта или пластины.
Далеко не все протезы на 100% состоят из металла. Большая их часть имеет в составе керамику или полиэтилен. Последний не взаимодействуют с магнитным полем, следовательно – никак не влияет на результаты МРТ и ход процедуры. Однако керамика чаще всего содержит оксид алюминия, который все же имеет определенную магнитную восприимчивость.
Разрушенные компоненты импланта ТБС.
Возможные сочетания материалов в эндопротезах:
- ;
- керамика + полиэтилен;
- металл + полиэтилен;
- металл + керамика;
- металл + металл.
Факт! Пластины и штифты для фиксации костных фрагментов изготавливаются из металлических сплавов. То же самое касается аппаратов внешней фиксации (типа Иллизарова) и клипс, которые ставят на сосуды.
Состав искусственных суставов:
- кобальт;
- хром;
- молибден;
- титан;
- цирконий;
- тантал;
- ниобий.
Ознакомившись с составом, можно понять, как он поведет себя в резонансном томографе. М агнитные свойства каждого эндопротеза определяются не только материалом, из которого он изготовлен, но также его формой и размером. Р азогреваться выше допустимых пределом могут стальные штифты и пластины длиной более 20 см.
Факт! Изделия, содержащие большое количество никеля и кобальта, особенно активно взаимодействуют с магнитным полем. Это значит, что диагностику с такими эндопротезами следует выполнять с предельной осторожностью.
Компании — производители
На протяжении последних 20 лет в медицине использовались в основном импланты, изготовленные из хром-кобальтовых сплавов (как мы уже выяснили, эти металлы активно реагируют на магнитное поле). Н а рынке появилось множество моделей, изготовленных из более качественных материалов. Они лучше переносятся пациентами, не вызывают аллергии и проблем МРТ.
| Фирма-производитель | Характеристики и применение | Поведение имплантов при МРТ-диагностике |
| Biomet | Производит качественные импланты, которые хорошо приживаются и не вызывают развития аллергических реакций. | Благодаря небольшому размеру и низкой магнитной восприимчивости не мешают проведению МРТ. |
| Zimmer | Производит изделия не из титана, а из тантала. Импланты имеют пористое покрытие, идеально срастаются с костной тканью. | Не вызывают непредвиденных осложнений при магнитно-резонансной томографии и не искажают результаты исследования. |
| Johnson&Johnson | Компания занимается производством имплантов по всем имеющимся стандартам и технологиям. | Не взаимодействуют с магнитным полем. Проведение МРТ при их наличии абсолютно безопасно. |
| Smith&Nephew | Изготавливает эндопротезы из сплава, содержащего цирконий и ниобий. | Импланты компании Smith&Nephew гипоаллергенны и практически не взаимодействуют с магнитным полем. |
| Stryker | Всемирно известная фирма бета-титановых эндопротезов и фиксаторов для внутреннего остеосинтеза. | Обладателям имплатнов компании Stryker можно делать МРТ без каких-либо опасений. Дополнительные меры предосторожности могут понадобиться лишь при наличии нескольких протезов больших размеров. |
| Aesculap | Производит эндопротезы из титана, циркониевой керамики, хром-кобальтовых сплавов. | Большинство имплантов с легкостью переносят магнитно-резонансную томографию. |
Если у вас стоит протез одной из приведенных в таблице фирм, вы можете делать МРТ без малейших опасений. Однако проходить исследование без предварительной консультации врача вам в любом случае не стоит.
Противопоказания к процедуре
Если протезы, штифты и пластины прочно соединены с костной тканью и не могут двигаться, то импланты иной локализации способны с легкостью смещаться под воздействием магнита. Следовательно, проводить магнитно-резонансную томографию при их наличии КАТЕГОРИЧЕСКИ ЗАПРЕЩЕНО.
Импланты, при наличии которых нельзя делать МРТ:
- искусственные клапаны сердца;
- стенты и клипсы на сосудах любой локализации;
- имплантаты среднего или внутреннего уха;
- электрокардиостимуляторы;
- искусственный хрусталик;
- аппарат Иллизарова;
- инсулиновая помпа;
- большие металлические имплантаты.
Как узнать, можно ли вам делать МРТ
Запомните, что делать МРТ можно с разрешения специалиста. Только он определит, нужно ли вам это исследование и не навредит ли оно вам. Возможно врач поставит диагноз и без магнитно-резонансной томографии. Cпондилез позвоночника и деформирующий остеоартроз II-IV стадий можно выявить с помощью обычной рентгенографии.
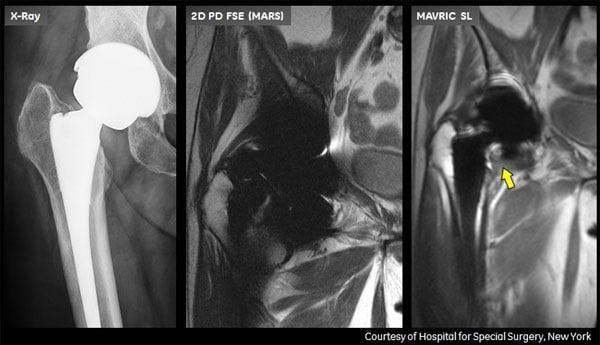
Сравнение способов визуальной диагностики. МРТ — справа.
Возможные осложнения и меры предосторожности
МРТ при наличии электронных имплантатов может всерьез навредить человеку или даже привести к его гибели. Выполнение исследования лицам с коронарными стенками и клипсами на сосудах головного мозга может спровоцировать массивное кровотечение, которое приведет к летальному исходу. Эндопротезы из некоторых сплавов во время МРТ могут смещаться с места или нагреваться, вызывая ожоги.
МРТ установка перед процедурой.
Людям с некоторыми видами имплантов делать магнитно-резонансную томографию категорически запрещено. А вот пациентам с имплантами из «опасных» сплавов все-таки можно попробовать выполнить исследование. В качестве меры предосторожности в руку человеку дают кнопку. Если он чувствует сильное жжение, то нажимает на нее, и исследование прекращают.
Факт! Металлические протезы склонны «фонить», делая изображение близрасположенных тканей нечетким. Поэтому бессмысленно пытаться получить МРТ-изображение замененного сустава или кости, скрепленной шрифтами или пластинами.
Читайте также:
