Что такое восстановление металлов
Обновлено: 05.07.2024
Металлургия — это наука о промышленных способах получения металлов. Различают черную и цветную металлургию.
Черная металлургия — это производство железа и его сплавов (сталь, чугун и др.).
Цветная металлургия — производство остальных металлов и их сплавов.
Широкое применение находят сплавы металлов. Наиболее распространенные сплавы железа — чугун и сталь.
Чугун — это сплав железа, в котором содержится 2-4 масс. % углерода, а также кремний, марганец и небольшие количества серы и фосфора.
Сталь — это сплав железа, в котором содержится 0,3-2 масс. % углерода и небольшие примеси других элементов.
Легированные стали — это сплавы железа с хромом, никелем, марганцем, кобальтом, ванадием, титаном и другими металлами. Добавление металлов придает стали дополнительные свойства. Так, добавление хрома придает сплаву прочность, а добавление никеля придает стали пластичность.
Основные стадии металлургических процессов:
- Обогащение природной руды (очистка, удаление примесей)
- Получение металла или его сплава.
- Механическая обработка металла
1. Нахождение металлов в природе
Большинство металлов встречаются в природе в виде соединений. Наиболее распространенный металл в земной коре — алюминий. Затем железо, кальций, натрий и другие металлы.
2. Получение активных металлов
Активные металлы (щелочные и щелочноземельные) классическими «химическими» методами получить из соединений нельзя. Такие металлы в виде ионов — очень слабые окислители, а в простом виде — очень сильные восстановители, поэтому их очень сложно восстановить из катионов в простые вещества. Чем активнее металл, тем сложнее его получить в чистом виде — ведь он стремится прореагировать с другими веществами.
Получить такие металлы можно, как правило, электролизом расплавов солей, либо вытеснением из солей другими металлами в жестких условиях.
Натрий в промышленности получают электролизом расплава хлорида натрия с добавками хлорида кальция:
2NaCl = 2Na + Cl2
Калий получают пропусканием паров натрия через расплав хлорида калия при 800°С:
KCl + Na = K↑ + NaCl
Литий можно получить электролизом расплава хлорида лития в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси):
2LiCl = 2Li + Cl2
Цезий можно получить нагреванием смеси хлорида цезия и специально подготовленного кальция:
Са + 2CsCl = 2Cs + CaCl2
Магний получают электролизом расплавленного карналлита или хлорида магния с добавками хлорида натрия при 720–750°С:
Кальций получают электролизом расплавленного хлорида кальция с добавками фторида кальция:
Барий получают из оксида восстановлением алюминием в вакууме при 1200 °C:
4BaO+ 2Al = 3Ba + Ba(AlO2)2
Алюминий получают электролизом раствора оксида алюминия Al2O3 в криолите Na3AlF6:
3. Получение малоактивных и неактивных металлов
Металлы малоактивные и неактивные восстанавливают из оксидов углем, оксидом углерода (II) СО или более активным металлом. Сульфиды металлов сначала обжигают.
3.1. Обжиг сульфидов
При обжиге сульфидов металлов образуются оксиды:
2ZnS + 3O2 → 2ZnO + 2SO2
Металлы получают дальнейшим восстановлением оксидов.
3.2. Восстановление металлов углем
Чистые металлы можно получить восстановлением из оксидов углем. При этом до металлов восстанавливаются только оксиды металлов, расположенных в ряду электрохимической активности после алюминия.
Например , железо получают восстановлением из оксида углем:
2Fe2O3 + 6C → 2Fe + 6CO
ZnO + C → Zn + CO
Оксиды металлов, расположенных в ряду электрохимической активности до алюминия, реагируют с углем с образованием карбидов металлов:
CaO + 3C → CaC2 + CO
3.3. Восстановление металлов угарным газом
Оксид углерода (II) реагирует с оксидами металлов, расположенных в ряду электрохимической активности после алюминия.
Например , железо можно получить восстановлением из оксида с помощью угарного газа:
3.4. Восстановление металлов более активными металлами
Более активные металлы вытесняют из оксидов менее активные. Активность металлов можно примерно оценить по электрохимическому ряду металлов:
Восстановление металлов из оксидов другими металлами — распространенный способ получения металлов. Часто для восстановления металлов применяют алюминий и магний. А вот щелочные металлы для этого не очень подходят – они слишком химически активны, что создает сложности при работе с ними.
Алюмотермия – это восстановление металлов из оксидов алюминием.
Например : алюминий восстанавливает оксид меди (II) из оксида:
3CuO + 2Al = Al2O3 + 3Cu
Магниетермия – это восстановление металлов из оксидов магнием.
CuO + Mg = Cu + MgO
Железо можно вытеснить из оксида с помощью алюминия:
При алюмотермии образуется очень чистый, свободный от примесей углерода металл.
Активные металлы вытесняют менее активные из растворов их солей.
Например , при добавлении меди (Cu) в раствор соли менее активного металла – серебра (AgNO3) произойдет химическая реакция:
2AgNO3 + Cu = Cu(NO3)2 + 2Ag
Медь покроется белыми кристаллами серебра.
При добавлении железа (Fe) в раствор соли меди (CuSO4) на железном гвозде появился розовый налет металлической меди:
CuSO4 + Fe = FeSO4 + Cu
При добавлении цинка в раствор нитрата свинца (II) на цинке образуется слой металлического свинца:
3.5. Восстановление металлов из оксидов водородом
Водород восстанавливает из оксидов только металлы, расположенные в ряду активности правее алюминия. Как правило, взаимодействие оксидов металлов с водородом протекает в жестких условиях – под давлением или при нагревании.
CuO + H2 = Cu + H2O
4. Производство чугуна
Чугун получают из железной руды в доменных печах.
Печь последовательно загружают сверху шихтой, флюсами, коксом, затем снова рудой, коксом и т.д.

1- загрузочное устройство, 2 — колошник, 3 — шахта, 4 — распар, 5 — горн, 6 — регенератор
Доменная печь имеет форму двух усеченных конусов, соединенных основаниями. Верхняя часть доменной печи — колошник, средняя — шахта, а нижняя часть — распар.
В нижней части печи находится горн. Внизу горна скапливается чугун и шлак и отверстия, через которые чугун и шлак покидают горн: чугун через нижнее, а шлак через верхнее.
Наверху печи расположено автоматическое загрузочное устройство. Оно состоит из двух воронок, соединенных друг с другом. Руда и кокс сначала поступают в верхнюю воронку, а затем в нижнюю.
Из нижней воронки руда и кокс поступают в печь. во время загрузки руды и кокса печь остается закрытой, поэтому газы не попадают в атмосферу, а попадают в регенераторы. В регенераторах печной газ сгорает.
Шихта — это железная руда, смешанная с флюсами.
Снизу в печь вдувают нагретый воздух, обогащенный кислородом, кокс сгорает:
Образующийся углекислый газ поднимается вверх и окисляет кокс до оксида углерода (II):
CO2 + С = 2CO
Оксид углерода (II) (угарный газ) — это основной восстановитель железа из оксидов в данных процессах. Последовательность восстановления железа из оксида железа (III):
Последовательность восстановления оксида железа (III):
FeO + CO → Fe + CO2
Суммарное уравнение протекающих процессов:
При этом протекает также частичное восстановление примесей оксидов других элементов (кремния, марганца и др.). Эти вещества растворяются в жидком железе.
Чтобы удалить из железной руды тугоплавкие примеси (оксид кремния (IV) и др.). Для их удаления используют флюсы и плавни (как правило, известняк CaCO3 или доломит CaCO3·MgCO3). Флюсы разлагаются при нагревании:
и образуют с тугоплавкими примесями легкоплавкие вещества (шлаки), которые легко можно удалить из реакционной смеси:
Восстановление металлов
процесс получения металлов из руд при помощи восстановительных реакций. Под В. м. первоначально понимались реакции получения металлов из их окислов путём применения веществ, отличающихся более высоким сродством к кислороду, чем металл. Простейший пример — получение металлического железа из его закиси:
где MeO — окисел металла, В — восстановитель. Если при этой реакции (при постоянных температуре и давлении) сумма свободных энергий Me и BO меньше, чем MeO и В, то процесс протекает слева направо с образованием металла. Процесс облегчается, если конечный продукт — металл — находится в виде раствора (твёрдого или жидкого), так как растворение сопровождается уменьшением свободной энергии. Этим объясняется, что при В. м. из некоторых особенно прочных окислов получают в качестве конечных продуктов соответствующие сплавы. Таким образом, для В. м. необходимо наличие определённого термодинамического стимула. Наряду с этим большое значение имеют и кинетические условия восстановления, которые определяются кристаллохимическими превращениями (в случае твёрдых окислов), механизмом химических реакций на границах фаз, условиями массопереноса реагентов, например диффузией (См. Диффузия).
В более общем, химическом смысле В. м. сводится к присоединению электронов к атому или группе атомов. Поэтому к В. м. относятся и процессы получения металлов электролизом из солевых расплавов или растворов на катоде, например для меди:
Наиболее важные примеры подобных процессов в технике — производство Al электролизом глинозёма из расплавов и Cu из водных растворов CuSO4. В. м. осуществляется в цветной металлургии при получении металлов из сульфидов, хлоридов и других соединений. Так как для восстановления необходимы электроны, которые отдаёт восстановитель, то восстановительные процессы неразрывно связаны с окислительными.
Лит.: Гельд П. В., Есин О. А., Процессы высокотемпературного восстановления, Свердловск, 1957; Полинг Л., Общая химия, пер. с англ., М., 1964.
Большая советская энциклопедия. — М.: Советская энциклопедия . 1969—1978 .
Полезное
Смотреть что такое "Восстановление металлов" в других словарях:
восстановление (металлургия) — восстановление 1. Присоединение эл нов атомом, молекулой или ионом, приводящее к понижению степени окисления. 2. Отнятие и связывание кислорода, хлора и т.п. из оксидов, хлоридов и др. соединений металлов, а также из руд с помощью восстановителей … Справочник технического переводчика
ВОССТАНОВЛЕНИЕ — ВОССТАНОВЛЕНИЕ, или редукция, химический процесс, заключающийся или в отнятии кислорода от данного вещества, или в замене кислорода водородом, или в присоединении к этому веществу водорода. Если реагирующее вещество находится в виде ионов, то под … Большая медицинская энциклопедия
Восстановление — Алхимики принимали, что металлы суть тела сложные, состоящие из духа, души и тела, или ртути, серы и соли; под духом, или ртутью, они понимали не обыкновенную ртуть, а летучесть и металлические свойства, напр., блеск, ковкость; под серою (душою)… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Восстановление — [reduction; recovery] 1. Присоединение электронов атомом, молекулой или ионом, приводящее к понижению степени окисления. 2. Отнятие и связывание кислорода, хлора и т. п. из оксидов, хлоридов и других соединений металлов, а также из руд с помощью… … Энциклопедический словарь по металлургии
Восстановление (химия) — Окислительно восстановительные реакции это химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом окислителем и атомом… … Википедия
Окисление - восстановление — Окисление восстановление, окислительно восстановительные реакции, химические реакции, сопровождающиеся изменением окислительных чисел атомов. Первоначально (со времени введения в химию кислородной теории горения А. Лавуазье, конец 18 в.)… … Большая советская энциклопедия
Окисление-восстановление — окислительно восстановительные реакции, химические реакции, сопровождающиеся изменением окислительных чисел (См. Окислительное число) атомов. Первоначально (со времени введения в химию кислородной теории горения А. Лавуазье, конец 18 в.)… … Большая советская энциклопедия
Электрохимический ряд активности металлов — Электрохимический ряд активности (ряд напряжений, ряд стандартных электродных потенциалов) металлов последовательность, в которой металлы расположены в порядке увеличения их стандартных электрохимических потенциалов φ0, отвечающих… … Википедия
металлотермическое восстановление — [metal lothermic (metallic) reduction] восстановление металлов и оксидов или других соединений, например, хлоридов, более активными металлами с выделением теплоты. Смотри также: Восстановление совместное восстановление прямое восстановление … Энциклопедический словарь по металлургии
Окисление - восстановление
Окисление - восстановление Окисление-восстановление, окислительно-восстановительные реакции, химические реакции, сопровождающиеся изменением окислительных чисел атомов. Первоначально (со времени введения в химию кислородной теории горения А. Лавуазье , конец 18 в.) окислением назывались только реакции соединения с кислородом, восстановлением ≈ отнятие кислорода. С введением в химию электронных представлений (1920≈30) оказалось возможным широко обобщить понятие О.-в. и распространить его на реакции, в которых кислород не участвует. Согласно электронной теории, окислением называется отдача электронов атомом, молекулой или ионом: Zn √ 2 = Zn 2+ .
═ Восстановлением называется присоединение электронов атомом, молекулой или ионом: Cl 2 + 2 = 2Cl √ .
══Окислителями называется нейтральный атом, молекула или ион, принимающие электроны (во втором примере молекула хлора Cl 2 ), восстановителями ≈ нейтральный атом, молекула или ион, отдающие электроны (в первом примере ≈ атом Zn). Окисление и восстановление ≈ взаимосвязанные процессы, которые всегда протекают одновременно. Когда одно вещество окисляется, то другое восстанавливается, и наоборот. Так, приведённые выше частные реакции окисления и восстановления составляют единый процесс О.-в.: Zn + Cl 2 = ZnCl 2 .
═ Здесь Zn окисляется до Zn 2+ , а Cl 2 восстанавливается до 2Cl √ .
═ В химии окислительно-восстановительные реакции принадлежат к числу наиболее распространённых. Например, на них, как правило, основано получение простых веществ (металлов и неметаллов)
CuO + H 2 =Cu + H 2 O,
2КВг + Cl 2 = Br 2 + 2KCl.
═ В основе технического производства таких важнейших химических продуктов, как аммиак , азотная кислота , серная кислота , процессов сжигания топлива и горения также лежат реакции О.-в. В гальванических элементах (см. Химические источники тока ) возникновение электродвижущей силы обусловлено протеканием реакции О.-в. При проведении электролиза на аноде происходит электрохимическое окисление, на катоде ≈ электрохимическое восстановление. Например, при производстве хлора электролизом раствора NaCl на аноде идёт реакция Cl √ √ 1 = 1/2Cl 2 (окисление аниона Cl √ ), на катоде Н + + 1 = 1 / 2 Н 2 (восстановление катиона Н + ). Коррозия металлов также связана с реакциями О.-в. и заключается в окислении металлов.
═ Дыхание, усвоение растениями углекислого газа с выделением кислорода (см. Фотосинтез ), обмен веществ и др. биологически важные явления представляют собой реакции О.-в. (см. Окисление биологическое ).
═ При составлении уравнений реакций О.-в. основная трудность заключается в подборе коэффициентов, особенно для реакций с участием соединений, в которых химическая связь носит не ионный, а ковалентный характер. В этом случае полезны понятия электроотрицательности и окислительного числа (степени окисления). Электроотрицательность ≈ способность атома в молекуле притягивать и удерживать около себя электроны. Степень окисления ≈ такой заряд, который возник бы на атоме в молекуле, если бы каждая пара электронов, связывающая его с др. атомами, была полностью смещена к более электроотрицательному атому (см. Валентность ). Нахождение степени окисления атома в молекуле основано на том, что молекула в целом должна быть электрически нейтральной. При этом учитывается, что степень окисления атомов некоторых элементов в соединениях всегда постоянна (щелочные металлы +1, щёлочноземельные металлы и цинк +2, алюминий +3, кислород, кроме перекисей, √2 и т.д.). Степень окисления атома в простых веществах равна нулю, а одноатомного иона в ионном соединении равна заряду этого иона. Например, рассчитаем степень окисления атома Cr в соединении K 2 Cr 2 O 7 . Пользуясь постоянными значениями степеней окисления для К и О, имеем 2·(+1) + 7·(√2) = √12. Следовательно, степень окисления одного атома Cr (чтобы сохранить электронейтральность молекулы) равна +6. На основе введённых понятий можно дать другое определение О.-в.: окислением называется увеличение степени окисления, восстановлением называется понижение степени окисления.
═ Восстановителями являются почти все металлы в свободном состоянии, отрицательно заряженные ионы неметаллов (S 2√ √ 2 = S°), положительно заряженные ионы металлов в низшей степени окисления (), сложные ионы и молекулы, содержащие атомы в промежуточной степени окисления (, ). В промышленности и технике широко используются такие восстановители, как углерод и окись углерода (восстановление металлов из окислов)
ZnO + С = Zn + СО, FeO +СО = Fe + СО 2 .
═ сульфит натрия Na 2 SO 3 и гидросульфит натрия NaHSO 3 ≈ в фотографии и красильном деле, металлический натрий и свободный водород ≈ для получения чистых металлов
TiCl 4 + 4Na = Ti + 4NaCI,
GeO 2 +2Н 2 = Ge + 2H 2 O.
═ Окислителями могут быть нейтральные атомы неметаллов (в особенности галогенов и кислорода), положительно заряженные ионы металлов в высшей степени окисления (Sn 4+ + 2 = Sn 2+ ), сложные ионы и молекулы, содержащие атомы элементов в более высокой степени окисления (,,). Промышленное значение как окислители имеют: кислород (особенно в металлургии), озон, хромовая и двухромовая кислоты и их соли, азотная кислота, перекись водорода, перманганат калия, хлорная известь и др. Самый сильный окислитель ≈ электрический ток (окисление происходит на аноде).
═ Для подбора коэффициентов в уравнениях реакций О.-в. служит общее правило: число электронов, отданных восстановителем, должно равняться числу электронов, принятых окислителем. Применяют обычно два метода подбора коэффициентов: метод электронного баланса и электронно-ионный метод.
═ В методе электронного баланса подсчёт числа принятых и отданных электронов производят на основании значений степеней окисления элементов до и после реакции. Например,
═ Таким образом, ═является окислителем, а ═≈ восстановителем. Составляют частные реакции окисления и восстановления:
═ В соответствии с приведённым выше правилом числа отданных и принятых электронов уравнивают. Полученные величины подставляют в исходное уравнение:
2KClO 3 = 2KCl + 3O 2 .
═ В электронно-ионном методе схему реакции записывают в соответствии с общими правилами составления ионных реакций, т. е. сильные электролиты записывают в виде ионов, а неэлектролиты, слабые электролиты, газы и осадки ≈ в виде молекул. Не изменяющиеся в результате реакции ионы в такую схему не входят. Например,
KMnO 4 + KI + H 2 SO 4 ® K 2 SO 4 + I 2 + MnSO 4 + H 2 O,
═ Рассчитав степени окисления, определяют окислитель и восстановитель и составляют частные реакции окисления и восстановления:
═ Во втором уравнении, перед тем как записать переход электронов, необходимо составить «материальный» баланс, т.к. в левой части уравнения есть атомы О, а в правой их нет. Избыточные атомы О связываются в молекулы воды ионами Н + , присутствующими в сфере реакции (кислая среда):
═ Далее, как и в первом методе, находят коэффициенты-множители к частным уравнениям для достижения электронного баланса (в приведённом примере 5 и 2 соответственно). Окончательное уравнение имеет вид:
═ Полученные коэффициенты подставляют в исходное уравнение:
═ 2KMnO 4 + 10KI + 8H 2 SO 4 = 6K 2 SO 4 + 5I 2 + 2MnSO 4 + 8H 2 O.
═ Аналогично составляют и уравнения реакций О.-в. в щелочной среде (вместо ионов Н + в частных уравнениях фигурируют ионы OH √ ). Т. о., в уравнивании реакций по второму методу учитывают характер реакционной среды (кислая или щелочная либо нейтральная), которая сильно влияет и на направление реакции О.-в. и на продукты, получаемые в результате реакции. Например, равновесие окислительно-восстановительной реакции ═══в кислой среде смещено влево, а в щелочной ≈ вправо. Сильный окислитель ион ═в кислой среде восстанавливается до иона Mn 2+ , в щелочной среде ≈ до иона , в нейтральной ≈ до молекулы . См. также Окисление металлов , Восстановление металлов .
═ Лит.: Кудрявцев А. А., Составление химических уравнений, М., 1968; Химия. Курс для средней школы, пер. с англ., 2 изд., М., 1972, гл. 12; Химия. Пособие для преподавателей средней школы, пер. с англ., ч. 1, М., 1973, гл. 12.
Смотреть что такое "Окисление - восстановление" в других словарях:
ОКИСЛЕНИЕ-ВОССТАНОВЛЕНИЕ — (редокс), химическая реакция, включающая одновременно ОКИСЛЕНИЕ (потерю атомом или молекулой одного или более электронов) и ВОССТАНОВЛЕНИЕ (приобретение этих электронов другим атомом или молекулой). В целом окисление и восстановление происходят… … Научно-технический энциклопедический словарь
окисление-восстановление — Химические реакции, сопровождающиеся изменением окислительных чисел атомов. Согласно кислородной теории горения А. Лавуазье (кон. XVIII в.) окислением называются только реакции соединения с кислородом, восстановлением — отнятие кислорода. С … Справочник технического переводчика
ОКИСЛЕНИЕ — ВОССТАНОВЛЕНИЕ — обширная гр. хим. реакций, в основе которых лежит частичное или полное перемещение электронов от одних атомов к др. Окисление хим. реакция, сопровождающаяся отдачей электронов атомом или гр. атомов и повышением их валентности; восстановление… … Геологическая энциклопедия
окисление-восстановление — окисление восстановление, окисления восстановления … Орфографический словарь-справочник
окисление-восстановление — [redox] химические реакции, сопровождаемые изменением окислительных чисел атомов. Согласно кислородной теории горения А. Лавуазье (кон. XVIII в.) окисление называл только реакции соединения с кислородом, восстановлением отнятие кислорода. С… … Энциклопедический словарь по металлургии
окисление-восстановление — окисл ение восстановл ение, окисл ения восстановл ения … Русский орфографический словарь
окисление-восстановление — ортохроматическая цветочувствительность … Cловарь химических синонимов I
ОКИСЛЕНИЕ — ОКИСЛЕНИЕ, химическая реакция присоединения кислорода или отнятия водорода. Для ионных процессов общепринята более расширенная формулировка: О. есть увеличение положительной валентности (заряда> или уменьшение отрицательной валентности… … Большая медицинская энциклопедия
ВОССТАНОВЛЕНИЕ — см. Окисление восстановление. Геологический словарь: в 2 х томах. М.: Недра. Под редакцией К. Н. Паффенгольца и др.. 1978 … Геологическая энциклопедия
Восстановление (химия)
Окисли́тельно-восстанови́тельные реа́кции — это химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем.
Содержание
Описание
В процессе окислительно-восстановительной реакции восстановитель отдаёт электроны, то есть окисляется; окислитель присоединяет электроны, то есть восстанавливается. Причём любая окислительно-восстановительная реакция представляет собой единство двух противоположных превращений — окисления и восстановления, происходящих одновременно и без отрыва одного от другого.
Окисление
При окисле́нии вещества в результате отдачи электронов увеличивается его степень окисления. Атомы окисляемого вещества, называются донорами электронов, а атомы окислителя — акцепторами электронов.
В некоторых случаях при окислении молекула исходного вещества может стать нестабильной и распасться на более стабильные и более мелкие составные части. При этом некоторые из атомов получившихся молекул имеют более высокую степень окисления, чем те же атомы в исходной молекуле.
Окислитель, принимая электроны, приобретает восстановительные свойства, превращаясь в сопряжённый восстановитель:
окислитель + e − ↔ сопряжённый восстановитель.
Восстановление
Восстановле́нием называется процесс присоединения электронов атомом вещества, при этом его степень окисления понижается.
При восстановлении атомы или ионы присоединяют электроны. При этом происходит понижение степени окисления элемента. Примеры: восстановление оксидов металлов до свободных металлов при помощи водорода, углерода, других веществ; восстановление органических кислот в альдегиды и спирты; гидрогенизация жиров и др.
Восстановитель, отдавая электроны, приобретает окислительные свойства, превращаясь в сопряжённый окислитель:
восстановитель - e − ↔ сопряжённый окислитель.
Виды окислительно-восстановительных реакций
- межмолекулярные - реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных веществ, например:
- внутримолекулярные - реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества, например:
- (самоокисление-самовосстановление) - реакции, в которых атомы с промежуточной степенью окисления превращаются в эквимолярную смесь атомов с более высокой и более низкой степенями окисления:
Примеры
Окислительно-востановительная реакция между водородом и фтором
>_ + \stackrel<\mbox
Разделяется на две полуреакции:Ы
_^ - 2<\mbox
_^ + 2<\mbox
Окисление, восстановление
В окислительно-восстановительных реакциях электроны от одних атомов, молекул или ионов переходят к другим. Процесс отдачи электронов — окисление. При окислении степень окисления повышается:
_^ - 2<\mbox
^ - 2<\mbox >^ \downarrow " />
^ - 3<\mbox
^ - <\mbox
^ - 2<\mbox
Процесс присоединения электронов — восстановление. При восстановлении степень окисления понижается:
_^ + 2<\mbox
_^ + 4<\mbox
^ + 5<\mbox
^ + 2<\mbox
^ + 6<\mbox
Атомы или ионы, которые в данной реакции присоединяют электроны являются окислителями, а которые отдают электроны — восстановителями.
Мнемонические правила
Для запоминания процессов окисления-восстановления, а также свойств окислителей и восстановителей существует несколько мнемонических правил:
ВОССТАНОВЛЕНИЕ МЕТАЛЛОВ
Металлы применяют в элементарном состоянии в виде сплавов и химических соединений. В рудах они связаны в окислы, сульфиды, хлориды, силикаты и иные соединения — минералы. Одна из главных задач металлургии состоит в получении свободных металлов восстановлением природных соединений. Из многих пригодных для этого химических реакций ниже рассмотрены только экономически целесообразные, применяемые в практике металлургии.
Восстановление углеродом или водородом
Наиболее доступный и дешевый восстановитель — углерод— составляет основную массу каменных углей. Восстановление углеродом, например окиси двухвалентного железа, можно записать следующими уравнениями:
Подобные реакции идут вправо — в сторону восстановления, если прочность химической связи кислорода с углеродом больше прочности связи его с металлом. Как известно, прочность химической связи называют сродством, которое в термодинамике измеряют величиной стандартного термодинамического изобар-но-изотермического потенциала, обозначаемого символом ΔZ°. Сродство выражают в Джоулях. Физический смысл его — максимальная работа, которую может совершить реакция. Ее условно считают отрицательной, поэтому отрицательная величина ΔZ° указывает на работоспособность реакции — возможность самопроизвольного ее протекания. Говоря ниже об увеличении термодинамического потенциала, мы будем понимать это, как сдвиг ΔZ в отрицательном направлении. Применение уравнений химической термодинамики часто затруднено отсутствием исходных данных и сложностью расчетов. Более удобны полуэмпирические зависимости ΔZ от температуры типа
здесь Т —абсолютная температура, К, а постоянные коэффициенты А, В, С приведены в справочниках. Для расчета сложных реакций формулу комбинируют с известным уравнением
Из этого легко определить, при какой температуре восстановление железа в стандартных условиях (при рсо = 101325 Па). Давления паров Fe и FeO приняты постоянными, поскольку они находятся в равновесии с соответствующими конденсированными твердыми или жидкими фазами. При равновесии реакции ΔZ 0 Т = 0.
Приведенный расчет сравнительно прост из-за отсутствия в нужных для него уравнениях члена, содержащего lg Т. В других случаях для получения ориентировочных результатов удобнее пользоваться графиками.
Разность получилась отрицательной, следовательно, реакция возможна. Заметим, что линии РbО и СО на рис. 4 пересекаются при температуре около 350° С. Влево от пересечения разность сродства окажется положительной, а восстановление — невозможным; эта точка определяет температуру начала восстановления свинца углеродом при стандартных условиях —(pсо = 101325 Па). Также по пересечению соответствующих линий можно определить температуры начала восстановления других, окислов; для SiO2, Аl2O3, CaO, MgO они выше 1500°C .
Очевидно, можно выбрать условия, при которых одни окислы восстанавливаются до металла, а другие остаются неизменными.
На этом основана, например, выплавка свинца из руд, содержащих окислы железа, кремния, кальция. При свинцовой плавке восстанавливается только свинец, имеющий сравнительно малое сродство к кислороду. Другие окислы сплавляются в жидкий шлак (плотность γ=3000÷3500 кг/м 3 ), всплывающий над свинцом (γРb≈ 10000 кг/м 3 ), подобно тому, как слой масла всплывает над водой.
Очень важна скорость восстановления: металлургические переделы должны быть производительными, а для этого надо, чтобы входящие в них реакции протекали быстро.
Твердые окислы восстанавливаются твердым углеродом медленно из-за малой поверхности контакта реагирующих веществ; даже при тонком измельчении частицы соприкасаются неплотно. К тому же продукт реакции — металл, возникающий в местах контакта, затрудняет дальнейшее взаимодействие. Твердый углерод может быть энергичным восстановителем только, если поверхность его омывается жидким или газообразным окислом. Твердые окислы восстанавливаются преимущественно газообразной окисью углерода:
В расплавах, плохо смачивающих углерод, а такие встречаются часто, частицы его окружены газовой пленкой из СО и СО2. Восстановление здесь происходит также через газовую фазу. Константу равновесия реакций надо записать отношением парциальных давлений СО2 и СО. Давления паров MeO, Me и углерода при их избытке постоянны, они входят в величину K р, поэтому
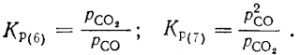
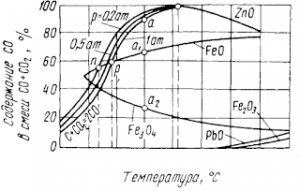
Обе константы равновесия можно выразить процентными соотношениями СО и СО2. Обозначив содержание в процентах СО в смеси через x, а СО2 — через 100— х, найдем
Величины K р зависят от давления и температуры, данные об этом приведены на рис. 5. Показанные здесь окислы могут восстанавливаться, если СО в равновесных газах реакции (7) больше, чем необходимо для реакции (6). Например, при температуре 800° С можно восстановить FeO и Fe3O4. точка а лежит выше а1 и а2, но нельзя получить цинк из его окиси. Точки n и р соот ветствуют началу восстановления FeO при общих давлеяниях смеси СО +СО2 соответственно 20265 и 101325 Па — при температурах около 630 и 680° С. Цинк восстанавливается при всех давлениях близ 930° С, различие, связанное с давлением, и здесь имеется, но оно невелико и неразличимо на графике.
Температуры начала восстановления Fe2О3 и РbО очень малы вследствие малого сродства к кислороду; однако в действительности они выше вычисляемых термодинамически из-за малых скоростей взаимодействия. Термодинамически получаются необходимые, а не достаточные условия восстановления, последние требуют еще и учета кинетики реакций. Например, углерод при обычных температурах практически не окисляется, уголь может лежать на воздухе веками, хотя термодинамический потенциал образования СO2 равен — 393,8 кДж уже при 25° С.
Теплоту, выделяемую реакцией, здесь и далее условимся считать отрицательной; ΔН 0 <0 — термодинамический признак экзотермичности. Заканчивая обсуждение рис. 5, заметим также, что для равновесия реакций восстановления РbО и Fe 2O3 с повышением температуры требуется более высокое содержание СО в газах, а для FeO и ZnO — меньшее.
По принципу Ле-Шаталье, при внешнем воздействии на равновесную систему в ней возникают противодействующие процессы. Если реакция экзотермическая [ΔН<0, уравнения (8) и (10)] при повышении температуры требуется большее содержание восстановителя — СО в газах. Наоборот, реакции восстановления Fe3О4 (9) и ZnO поглощают тепло (ΔН>0); при высоких температурах равновесное парциальное давление СО в газах здесь снижается.
Водород для восстановления окислов применяют реже, он дороже и взрывоопасен, но необходим в тех случаях, когда уг лерод может образовать с металлами иногда нежелательные карбиды, например при восстановлении вольфрама и молибдена:
Восстановителями окислов могут служить непредельные углеводороды, входящие в состав природного газа и нефти.
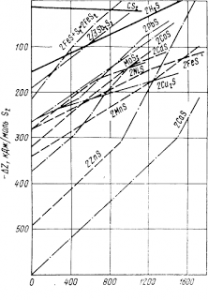
Многие металлы представлены в природе сульфидами, для оценки возможности восстановления которых по реакции 2MeS + C = Me + CS2
рассмотрим рис. 6, характеризующий сродство элементов к сере В большинстве случаев углерод не пригоден для непосредственного восстановления сульфидов. Также мало пригоден для и водород: линия H2S расположена высоко, что указывает редкую возможность реакций типа:
В металлургической практике природные сульфиды сначала обжигают: нагреванием при доступе воздуха переводят в окислы, которые затем восстанавливают углеродом. Например, сульфид свинца — галенит окисляют при температуре около 1000° С:
Окись свинца восстанавливают углеродом. Также получают из сульфида цинк. Надо отметить, что на рис. линия ZnO имеет излом, соответствующий точке кипения металла при 907° С. Восстанавливаясь при температуре около 930° С, цинк получается в виде паров, которые отводят из печи, охлаждают и конденсируют в виде жидкого или твердого металла (в зависимости от температуры в конденсаторе). Заметим попутно, что подобные изломы прямых на рис. указывают на изменение агрегатного состояния — плавление либо кипение металла или его соединения.
надо записать с учетом парциального давления паров цинка, которые здесь неравновесны с жидким металлом:

Связь между величинами ΔZ 0 и К выражается уравнением изотермы из которого при подстановке R = 8,326 Дж/ (град • моль) и замене натурального логарифма десятичным получим
Похожие страницы:
Восстановление алюминия углеродом Восстановление окиси алюминия углеродом может быть выражено следующим уравнением: Аl2O3 + 3С ⇄ 2Аl + 3СО —.
Что такое реакции восстановления окисления Окисление и восстановление Ионизационные потенциалы Ионное состояние Восстановитель Окислитель Реакции окисления восстановления Окислительно восстановительные реакции Окислительно.
Автоклавное восстановление металлов из растворов водородом и другими газами Восстановлению обязательно должно предшествовать образование водородного электрода, возможное при контакте газа.
Восстановление окислов сульфидами Некоторые металлы восстанавливаются из окислов сульфидами по общим схемам: MeS + 2MeO= 3Ме + SO2, MeS + O2 = Me + SO2. .
Термическое получение магния Сложность и вредность электролитического способа получения магния уже давно вынуждали изыскивать новые способы получения этого металла. Наиболее.
Металлотермия Некоторые окислы не удается превратить в удобные для электролиза легкоплавкие соединения или растворить в расплавах других солей. Вместе с.
Читайте также:
