Что такое железо металлическое
Обновлено: 17.05.2024
ЖЕЛЕЗО
Fe (ferrum),
химический элемент VIIIB подгруппы периодической системы элементов, металл, член триады железа (Fe, Co, Ni). Железо самородное редко встречается в природе, главным образом в минералах феррит, аваруит и метеоритах (т.н. метеоритное железо, которое содержит более 90% Fe). В соединениях с кислородом и другими элементами широко распространено в составе многих минералов и руд. По распространенности в земной коре (5,00%) это третий (после кремния и алюминия) элемент; считается, что земное ядро состоит в основном из железа. Основные минералы - гематит (красный железняк) Fe2O3; лимонит Fe2O3*nH2O (n = 1 - 4), содержащийся, например, в болотной руде; магнетит (магнитный железняк) Fe3O4 и сидерит FeCO3. Наиболее распространенным минералом железа, не являющимся, однако, источником его получения, является пирит (серный колчедан, железный колчедан) FeS2, который иногда называют за его желтый блеск золотом дураков или кошачьим золотом, хотя он в действительности часто содержит небольшие примеси меди, золота, кобальта и других металлов. СВОЙСТВА ЖЕЛЕЗА
Атомный номер 26 Атомная масса 55,847 Изотопы
Температура плавления, ° С 1535 Температура кипения, ° С 3000 Плотность, г/см3 7,87 Твердость (по Моосу) 4,0-5,0 Содержание в земной коре, % (масс.) 5,00 Степень окисления
Железо (элементное) известно и используется с доисторических времен. Первые изделия из железа, вероятно, были изготовлены из метеоритного железа в виде амулетов, драгоценностей и рабочего инструмента. Около 3500 лет назад человек открыл способ восстановления красной земли, содержащей оксид железа, в металл. С тех пор из железа было изготовлено огромное количество различных изделий. Оно сыграло важную роль в развитии материальной культуры человечества
(см. также ЖЕЛЕЗНЫЙ ВЕК; МЕТАЛЛЫ ЧЕРНЫЕ).
В наши дни железо в основном (95%) выплавляют из руд в виде чугунов и сталей и в сравнительно небольших количествах получают восстановлением металлизованных окатышей, а чистое железо - термическим разложением его соединений или электролизом солей. Железо - один из самых пригодных к эксплуатации металлов в сплаве с углеродом (сталь, чугун) - высокопрочная основа конструкционных материалов. Как материал, обладающий магнитными свойствами, железо используется для сердечников электромагнитов и якорей электромашин, а также в качестве слоев и пленок на магнитных лентах. Чистое железо - катализатор в химических процессах, компонент лекарственных средств в медицине. Железо является существенным химическим компонентом организмов многих позвоночных, беспозвоночных и некоторых растений. Оно входит в состав гема (пигмента эритроцитов - красных кровяных клеток) гемоглобина крови, мышечных тканей, костного мозга, печени и селезенки. Каждая молекула гемоглобина содержит 4 атома железа, которые способны создавать обратимую и непрочную связь с кислородом, образуя оксигемоглобин. Кровь, содержащая оксигемоглобин, циркулирует по телу, поставляя кислород к тканям для клеточного дыхания. Поэтому железо необходимо для дыхания и образования красных кровяных клеток. Миоглобин (или мышечный гемоглобин) снабжает кислородом мышцы. Общее количество железа в человеческом теле (средней массы 70 кг) составляет 3-5 г. Из этого количества 65% Fe находится в гемоглобине. От 10 до 20 мг Fe ежедневно требуется для обеспечения нормального метаболизма среднего взрослого. Красное мясо, яйца, желток, морковь, фрукты, любая пшеница и зеленые овощи в основном обеспечивают организм железом при нормальном питании; при анемии, связанной с недостатком железа в организме, принимают лекарственные препараты железа. См. также АНЕМИЯ; КРОВЬ.
Свойства. Металлическое железо представляет собой серовато-белое блестящее твердое пластичное вещество. Железо кристаллизуется в трех модификациях (a, g, d). a-Fe имеет объемноцентрированную кубическую кристаллическую решетку, химически устойчиво до 910° С. При 910° С a-Fe переходит в g-Fe, стабильное в интервале 910-1400° С; g-Fe кристаллизуется в гранецентрированной кубической кристаллической решетке (см. также АЛЛОТРОПИЯ). При температуре выше 1400° С образуется d-Fe с решеткой, в основном аналогичной решетке a-Fe. Железо - ферромагнетик, оно легко намагничивается, но теряет магнитные свойства при снятии магнитного поля. С повышением температуры магнитные свойства железа ухудшаются и выше 769° С оно практически не поддается намагничиванию (иногда железо в интервале 769-910° С называют b-Fe); g-Fe не является магнитным материалом. С химической точки зрения железо - довольно активный металл, проявляет характерные степени окисления +2, +3, реже +1, +4, +6. Непосредственно соединяется с некоторыми элементами, с S образует FeS - сульфид железа(III), с галогенами, кроме иода, - галогениды железа(III), такие, как FeCl3. Легко окисляется; с кислородом дает оксиды FeO, Fe2O3, Fe3O4 (FeO + Fe2O3), легко корродирует (ржавеет). Вытесняет водород из паров воды при высокой температуре. Растворяется в разбавленных кислотах (например, HCl, H2SO4, HNO3), вытесняя водород и образуя соли Fe(II) (соответственно FeCl2, FeSO4, Fe(NO3)2). В умеренно концентрированных H2SO4 и HNO3 железо растворяется с образованием солей Fe(III), а в сильноконцентрированных - пассивируется и не реагирует. Пассивность железа, по-видимому, объясняется образованием на его поверхности пленки оксида железа, которая, однако, легко разрушается при простом соскабливании. Ржавление железа (атмосферная коррозия железа) - это окисление его кислородом воздуха. Реакция происходит в присутствии ионов солей, растворенных в воде, и ионов, образующихся при диссоциации угольной кислоты - продукта взаимодействия атмосферного углекислого газа и влаги. В результате образуется рыхлая ржавчина красного цвета, или гидратированный оксид состава Fe2O3*nH2O.
См. также КОРРОЗИЯ МЕТАЛЛОВ.
Соединения. Соли железа(II) обычно зеленого цвета, легко окисляются на воздухе. Кристаллогидрат хлорида железа FeCl2Ч4H2O быстро впитывает влагу из окружающей среды. Его используют как протраву в текстильной промышленности и как вяжущее в медицине. Кристаллогидрат сульфата железа(II) FeSO4*7H2O (железный купорос) применяют в производстве чернил, красок, пигментов и как дезинфицирующее средство. При кристаллизации сульфата железа из раствора, содержащего также сульфат аммония, образуется двойной сульфат железа и аммония, или соль Мора FeSO4*(NH4)2*6H2O, устойчивая к окислению на воздухе; ее используют для получения растворов, содержащих ионы Fe(II), пригодные для длительного хранения. Соли Fe(III), обычно красного или желтого цвета, легко восстанавливаются и гидролизуются, образуя кислые растворы. Растворы FeCl3 в спирте или в воде используют для остановки кровотечения или как тонизирующие. FeCl3 применяют также в технологии пигментов и чернил и как протраву при крашении и набивке текстиля. Мелкодисперсный оксид железа(III) Fe2O3 (румяна, или венецианский кармин) - готовый абразив или пигмент.
Комплексные соединения. Ионы Fe(II) и Fe(III) образуют комплексные анионы, например гексацианоферрат(II)-ион Fe(CN)64- и гексацианоферрат(III)-ион Fe(CN)63-. Берлинская лазурь (синий пигмент) - гексацианоферрат(II) железа(III) Fe4[[Fe(CN)6]]3, турнбулева синь (также синий пигмент) - гексацианоферрат(III) железа(II) Fe3[[Fe(CN)6]]2. Комплексные ионы железа часто используют для обнаружения ионов железа(II) и железа(III) по результатам образования окрашенных комплексных соединений. Они применяются также в светокопировальной технике (цианотипная бумага): бумагу пропитывают раствором соли железа(III) и высушивают. При наложении на нее чертежа, выполненного на кальке, и выдержке на свету Fe(III) восстанавливается на освещенных местах до Fe(II) и после проявления бумаги в растворе гексацианоферрата образует комплексное соединение, окрашивающее засвеченные места бумаги в синий цвет. Цианотипная бумага передает изображение белыми линиями на синем фоне.
См. также ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ.
ЛИТЕРАТУРА
Конецкая Д.С. и др. Железо высокой степени чистоты. М., 1978 Пикеринг Ф. Физическое металловедение и разработка сталей. М., 1982
Энциклопедия Кольера. — Открытое общество . 2000 .
Полезное
Смотреть что такое "ЖЕЛЕЗО" в других словарях:
ЖЕЛЕЗО — ср. зале(и)зо южн., зап. металл, крушец, выплавляемый из руды в виде чугуна, и выковываемый из сего последнего под кричным молотом. В соединении с углеродом, оно образует сталь. В продажу железо идет в виде: полосового или сортового; первое прямо … Толковый словарь Даля
ЖЕЛЕЗО — ЖЕЛЕЗО, Ferrum (Fe), тяжелый металл, относящийся к VIII группе периодической системы Менделеева. Ат. в. 55,84(0=16), при чем известны два изотопа с ат. в. в 56 и 54. Чистое Ж. обладает серебристо белым цветом; уд. в. 7,88; оно мягче и более… … Большая медицинская энциклопедия
железо — ферро; феррум, крица; аппаратное обеспечение Словарь русских синонимов. железо сущ., кол во синонимов: 18 • автомобиль (369) • … Словарь синонимов
ЖЕЛЕЗО — см. ЖЕЛЕЗО (Fe). В поверхностных водах содержание железа колеблется в широких пределах. В подземных водоисточниках и водах болот его концентрация достигает десятков мг/л. Резкое повышение железа в водоемах происходит при загрязнении их сточными… … Болезни рыб: Справочник
железо — ЖЕЛЕЗО, а, с. 1. Надежный человек. Серега он железо, после трех бутылок приползет. 2. Металлический рок. 3. Мелочь, металлические деньги. 4. Приспособления для занятий атлетизмом (гири, гантели и т. п.). Заниматься железом. Я бросил железо,… … Словарь русского арго
ЖЕЛЕЗО — (символ Fe), распространенный ПЕРЕХОДНОЙ ЭЛЕМЕНТ, известный с древних времен. К основным железосодержащим рудам относятся: ГЕМАТИТ (Fе2О3), МАГНЕТИТ (Fe3O4) и КОЛЧЕДАН (FeS2). Выплавляют в ДОМЕННЫХ ПЕЧАХ, восстанавливая оксиды угарным газом из… … Научно-технический энциклопедический словарь
ЖЕЛЕЗО — ЖЕЛЕЗО, железа, мн. (только устар. поэт.) железы, ср. 1. только ед. Самый распространенный в природе тяжелый металл серебристого цвета, с примесью разных количеств углерода, образующий сталь и чугун. Изделия из железа. || Химический элемент из… … Толковый словарь Ушакова
ЖЕЛЕЗО — (Ferrum), Fe, химический элемент VIII группы периодической системы, атомный номер 26, атомная масса 55,847; металл, tпл 1535шC. Содержание в земной коре 4,65% по массе. Железо входит в состав гемоглобина. Его используют для выплавки чугуна и… … Современная энциклопедия
ЖЕЛЕЗО — (лат. Ferrum) Fe, химический элемент VIII группы периодической системы, атомный номер 26, атомная масса 55,847. Блестящий серебристо белый металл. Образует полиморфные модификации; при обычной температуре устойчиво ? Fe (кристаллическая решетка… … Большой Энциклопедический словарь
Железо — (евр. барзел; греч. сидерос): 1) в Быт 4:22 говорится о Тувалкаине, к рый был ковачом всех орудий из меди и железа . При первых попытках обработки этого металла использовалось железо метеоритного происхождения, однако оно с трудом поддавалось… … Библейская энциклопедия Брокгауза
Железо — Fe (a. iron; н. Eisen; ф. fer; и. hierro), хим. элемент VIII группы периодич. системы элементов Mенделеева, ат.н. 26, ат. м. 55,847. Природное Ж. состоит из 4 стабильных изотопов: 54Fe (5,84%), 56Fe (91,68%), 57Fe (2,17%) и 58Fe (0,31%).… … Геологическая энциклопедия
Железо

Железо — ковкий металл серебристо-белого цвета с высокой химической реакционной способностью: железо быстро корродирует при высоких температурах или при высокой влажности на воздухе. В чистом кислороде железо горит, а в мелкодисперсном состоянии самовозгорается и на воздухе. Обозначается символом Fe (лат. Ferrum). Один из самых распространённых в земной коре металлов (второе место после алюминия).
Смотрите так же:
СТРУКТУРА
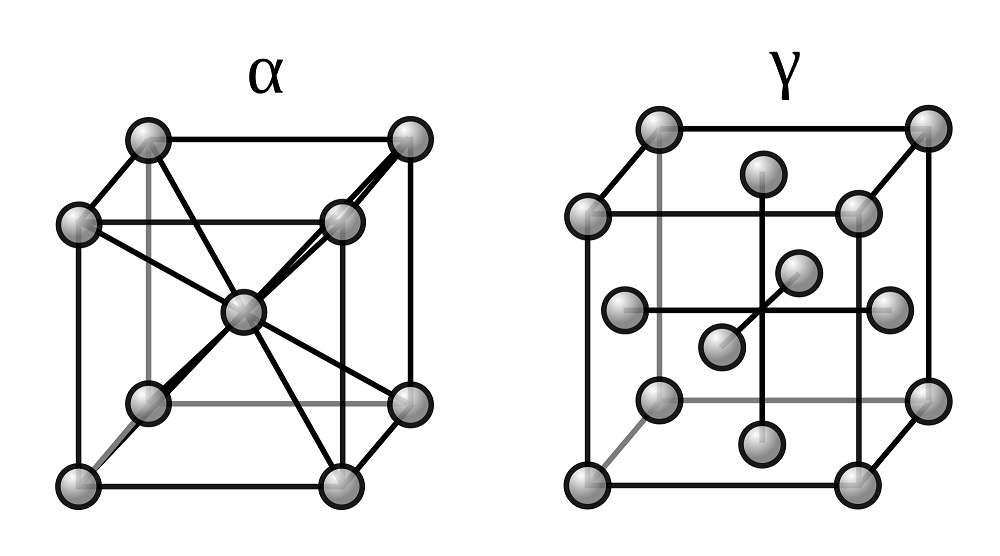
Две модификации кристаллической решетки железа
Для железа установлено несколько полиморфных модификаций, из которых высокотемпературная модификация – γ-Fe(выше 906°) образует решетку гранецентрированного куба типа Сu (а0 = 3,63), а низкотемпературная – α-Fe-решетку центрированного куба типа α-Fe (a0 = 2,86).
В зависимости от температуры нагрева железо может находиться в трех модификациях, характеризующихся различным строением кристаллической решетки:
- В интервале температур от самых низких до 910°С —а-феррит (альфа-феррит), имеющий строение кристаллической решетки в виде центрированного куба;
- В интервале температур от 910 до 1390°С — аустенит, кристаллическая решетка которого имеет строение гранецентрированного куба;
- В интервале температур от 1390 до 1535°С (температура плавления) — д-феррит (дельта-феррит). Кристаллическая решетка д-феррита такая же, как и а-феррита. Различие между ними только в иных (для д-феррита больших) расстояниях между атомами.
При охлаждении жидкого железа первичные кристаллы (центры кристаллизации) возникают одновременно во многих точках охлаждаемого объема. При последующем охлаждении вокруг каждого центра надстраиваются новые кристаллические ячейки, пока не будет исчерпан весь запас жидкого металла.
В результате получается зернистое строение металла. Каждое зерно имеет кристаллическую решетку с определенным направлением его осей.
При последующем охлаждении твердого железа при переходах д-феррита в аустенит и аустенита в а-феррит могут возникать новые центры кристаллизации с соответствующим изменением величины зерна
СВОЙСТВА

В чистом виде при нормальных условиях это твердое вещество. Оно обладает серебристо-серым цветом и ярко выраженным металлическим блеском. Механические свойства железа включают в себя уровень твердости по шкале Мооса. Она равна четырем (средняя). Железо обладает хорошей электропроводностью и теплопроводностью. Последнюю особенность можно ощутить, дотронувшись до железного предмета в холодном помещении. Так как этот материал быстро проводит тепло, он за короткий промежуток времени забирает большую его часть из вашей кожи, и поэтому вы ощущаете холод.
Дотронувшись, к примеру, до дерева, можно отметить, что его теплопроводность намного ниже. Физические свойства железа — это и его температуры плавления и кипения. Первая составляет 1539 градусов по шкале Цельсия, вторая — 2860 градусов по Цельсию. Можно сделать вывод, что характерные свойства железа — хорошая пластичность и легкоплавкость. Но и это еще далеко не все. Также в физические свойства железа входит и его ферромагнитность. Что это такое? Железо, магнитные свойства которого мы можем наблюдать на практических примерах каждый день, – единственный металл, обладающий такой уникальной отличительной чертой. Это объясняется тем, что данный материал способен намагничиваться под действием магнитного поля. А по прекращении действия последнего железо, магнитные свойства которого только что сформировались, еще надолго само остается магнитом. Такой феномен можно объяснить тем, что в структуре данного металла присутствует множество свободных электронов, которые способны передвигаться.
ЗАПАСЫ И ДОБЫЧА
Железо — один из самых распространённых элементов в Солнечной системе, особенно на планетах земной группы, в частности, на Земле. Значительная часть железа планет земной группы находится в ядрах планет, где его содержание, по оценкам, около 90 %. Содержание железа в земной коре составляет 5 %, а в мантии около 12 %.

В земной коре железо распространено достаточно широко — на его долю приходится около 4,1 % массы земной коры (4-е место среди всех элементов, 2-е среди металлов). В мантии и земной коре железо сосредоточено главным образом в силикатах, при этом его содержание значительно в основных и ультраосновных породах, и мало — в кислых и средних породах.
Известно большое число руд и минералов, содержащих железо. Наибольшее практическое значение имеют красный железняк (гематит, Fe2O3; содержит до 70 % Fe), магнитный железняк (магнетит, FeFe2O4, Fe3O4; содержит 72,4 % Fe), бурый железняк или лимонит (гётит и гидрогётит, соответственно FeOOH и FeOOH·nH2O). Гётит и гидрогётит чаще всего встречаются в корах выветривания, образуя так называемые «железные шляпы», мощность которых достигает несколько сотен метров. Также они могут иметь осадочное происхождение, выпадая из коллоидных растворов в озёрах или прибрежных зонах морей. При этом образуются оолитовые, или бобовые, железные руды. В них часто встречается вивианит Fe3(PO4)2·8H2O, образующий чёрные удлинённые кристаллы и радиально-лучистые агрегаты.
Содержание железа в морской воде – 1·10 −5 -1·10 −8 %
В промышленности железо получают из железной руды, в основном из гематита (Fe2O3) и магнетита (FeO·Fe2O3).
Существуют различные способы извлечения железа из руд. Наиболее распространённым является доменный процесс.
Первый этап производства — восстановление железа углеродом в доменной печи при температуре 2000 °C. В доменной печи углерод в виде кокса, железная руда в виде агломерата или окатышей и флюс (например, известняк) подаются сверху, а снизу их встречает поток нагнетаемого горячего воздуха.
Кроме доменного процесса, распространён процесс прямого получения железа. В этом случае предварительно измельчённую руду смешивают с особой глиной, формируя окатыши. Окатыши обжигают, и обрабатывают в шахтной печи горячими продуктами конверсии метана, которые содержат водород. Водород легко восстанавливает железо, при этом не происходит загрязнения железа такими примесями, как сера и фосфор, которые являются обычными примесями в каменном угле. Железо получается в твёрдом виде, и в дальнейшем переплавляется в электрических печах. Химически чистое железо получается электролизом растворов его солей.
ПРОИСХОЖДЕНИЕ

ПРИМЕНЕНИЕ

Кольцо из железа
Железо — один из самых используемых металлов, на него приходится до 95 % мирового металлургического производства.
Железо является основным компонентом сталей и чугунов — важнейших конструкционных материалов.
Железо может входить в состав сплавов на основе других металлов — например, никелевых.
Магнитная окись железа (магнетит) — важный материал в производстве устройств долговременной компьютерной памяти: жёстких дисков, дискет и т. п.
Ультрадисперсный порошок магнетита используется во многих чёрно-белых лазерных принтерах в смеси с полимерными гранулами в качестве тонера. Здесь одновременно используется чёрный цвет магнетита и его способность прилипать к намагниченному валику переноса.
Уникальные ферромагнитные свойства ряда сплавов на основе железа способствуют их широкому применению в электротехнике для магнитопроводов трансформаторов и электродвигателей.
Хлорид железа(III) (хлорное железо) используется в радиолюбительской практике для травления печатных плат.
Семиводный сульфат железа (железный купорос) в смеси с медным купоросом используется для борьбы с вредными грибками в садоводстве и строительстве.
Железо применяется в качестве анода в железо-никелевых аккумуляторах, железо-воздушных аккумуляторах.
Водные растворы хлоридов двухвалентного и трёхвалентного железа, а также его сульфатов используются в качестве коагулянтов в процессах очистки природных и сточных вод на водоподготовке промышленных предприятий.

Железо — ковкий металл серебристо-белого цвета с высокой химической реакционной способностью: железо быстро корродирует при высоких температурах или при высокой влажности на воздухе. В чистом кислороде железо горит, а в мелкодисперсном состоянии самовозгорается и на воздухе. Обозначается символом Fe (лат. Ferrum). Один из самых распространённых в земной коре металлов (второе место после алюминия).
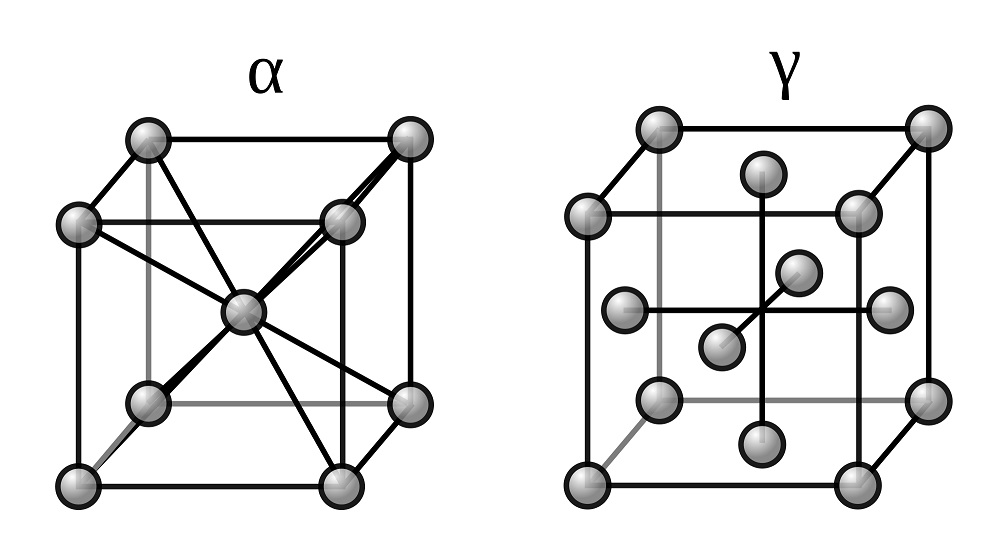
Для железа установлено несколько полиморфных модификаций, из которых высокотемпературная модификация — γ-Fe (выше 906°) образует решетку гранецентрированного куба типа Сu (а0 = 3,63), а низкотемпературная — α-Fe-решетку центрированного куба типа α-Fe (a0 = 2,86).
В зависимости от температуры нагрева железо может находиться в трех модификациях, характеризующихся различным строением кристаллической решетки:
В интервале температур от самых низких до 910°С — а-феррит (альфа-феррит), имеющий строение кристаллической решетки в виде центрированного куба;
В интервале температур от 910 до 1390°С — аустенит, кристаллическая решетка которого имеет строение гранецентрированного куба;
В интервале температур от 1390 до 1535°С (температура плавления) — д-феррит (дельта-феррит). Кристаллическая решетка д-феррита такая же, как и а-феррита. Различие между ними только в иных (для д-феррита больших) расстояниях между атомами.
При охлаждении жидкого железа первичные кристаллы (центры кристаллизации) возникают одновременно во многих точках охлаждаемого объема. При последующем охлаждении вокруг каждого центра надстраиваются новые кристаллические ячейки, пока не будет исчерпан весь запас жидкого металла.
В результате получается зернистое строение металла. Каждое зерно имеет кристаллическую решетку с определенным направлением его осей.
При последующем охлаждении твердого железа при переходах д-феррита в аустенит и аустенита в а-феррит могут возникать новые центры кристаллизации с соответствующим изменением величины зерна.
В чистом виде при нормальных условиях это твердое вещество. Оно обладает серебристо-серым цветом и ярко выраженным металлическим блеском. Механические свойства железа включают в себя уровень твердости по шкале Мооса. Она равна четырем (средняя). Железо обладает хорошей электропроводностью и теплопроводностью. Последнюю особенность можно ощутить, дотронувшись до железного предмета в холодном помещении. Так как этот материал быстро проводит тепло, он за короткий промежуток времени забирает большую его часть из вашей кожи, и поэтому вы ощущаете холод.
Дотронувшись, к примеру, до дерева, можно отметить, что его теплопроводность намного ниже. Физические свойства железа — это и его температуры плавления и кипения. Первая составляет 1539 градусов по шкале Цельсия, вторая — 2860 градусов по Цельсию. Можно сделать вывод, что характерные свойства железа — хорошая пластичность и легкоплавкость. Но и это еще далеко не все. Также в физические свойства железа входит и его ферромагнитность. Что это такое? Железо, магнитные свойства которого мы можем наблюдать на практических примерах каждый день, — единственный металл, обладающий такой уникальной отличительной чертой. Это объясняется тем, что данный материал способен намагничиваться под действием магнитного поля. А по прекращении действия последнего железо, магнитные свойства которого только что сформировались, еще надолго само остается магнитом. Такой феномен можно объяснить тем, что в структуре данного металла присутствует множество свободных электронов, которые способны передвигаться.
Железо — один из самых распространённых элементов в Солнечной системе, особенно на планетах земной группы, в частности, на Земле. Значительная часть железа планет земной группы находится в ядрах планет, где его содержание, по оценкам, около 90%. Содержание железа в земной коре составляет 5%, а в мантии около 12%.
В земной коре железо распространено достаточно широко — на его долю приходится около 4,1% массы земной коры (4-е место среди всех элементов, 2-е среди металлов). В мантии и земной коре железо сосредоточено главным образом в силикатах, при этом его содержание значительно в основных и ультраосновных породах, и мало — в кислых и средних породах.

Известно большое число руд и минералов, содержащих железо. Наибольшее практическое значение имеют красный железняк (гематит, Fe2O3; содержит до 70% Fe), магнитный железняк (магнетит, FeFe2O4, Fe3O4; содержит 72,4% Fe), бурый железняк или лимонит (гётит и гидрогётит, соответственно FeOOH и FeOOH·nH2O). Гётит и гидрогётит чаще всего встречаются в корах выветривания, образуя так называемые «железные шляпы», мощность которых достигает несколько сотен метров. Также они могут иметь осадочное происхождение, выпадая из коллоидных растворов в озёрах или прибрежных зонах морей. При этом образуются оолитовые, или бобовые, железные руды. В них часто встречается вивианит Fe3(PO4)2·8H2O, образующий чёрные удлинённые кристаллы и радиально-лучистые агрегаты.
Содержание железа в морской воде — 1·10−5-1·10−8%
В промышленности железо получают из железной руды, в основном из гематита (Fe2O3) и магнетита (FeO·Fe2O3).
Существуют различные способы извлечения железа из руд. Наиболее распространённым является доменный процесс.
Первый этап производства — восстановление железа углеродом в доменной печи при температуре 2000 °C. В доменной печи углерод в виде кокса, железная руда в виде агломерата или окатышей и флюс (например, известняк) подаются сверху, а снизу их встречает поток нагнетаемого горячего воздуха.

Кроме доменного процесса, распространён процесс прямого получения железа. В этом случае предварительно измельчённую руду смешивают с особой глиной, формируя окатыши. Окатыши обжигают, и обрабатывают в шахтной печи горячими продуктами конверсии метана, которые содержат водород. Водород легко восстанавливает железо, при этом не происходит загрязнения железа такими примесями, как сера и фосфор, которые являются обычными примесями в каменном угле. Железо получается в твёрдом виде, и в дальнейшем переплавляется в электрических печах. Химически чистое железо получается электролизом растворов его солей.
Почти чистое железо найдено в лунном грунте, что связывают как с падениями метеоритов, так и с магматическими процессами. Наконец, два класса метеоритов — железокаменные и железные содержат природные сплавы железа в качестве породообразующего компонента.
Железо — один из самых используемых металлов, на него приходится до 95% мирового металлургического производства.

Железо является основным компонентом сталей и чугунов — важнейших конструкционных материалов.
Железо может входить в состав сплавов на основе других металлов — например, никелевых.
Магнитная окись железа (магнетит) — важный материал в производстве устройств долговременной компьютерной памяти: жёстких дисков, дискет и т. п.
Ультрадисперсный порошок магнетита используется во многих чёрно-белых лазерных принтерах в смеси с полимерными гранулами в качестве тонера. Здесь одновременно используется чёрный цвет магнетита и его способность прилипать к намагниченному валику переноса.
Уникальные ферромагнитные свойства ряда сплавов на основе железа способствуют их широкому применению в электротехнике для магнитопроводов трансформаторов и электродвигателей.
Хлорид железа(III) (хлорное железо) используется в радиолюбительской практике для травления печатных плат.
Семиводный сульфат железа (железный купорос) в смеси с медным купоросом используется для борьбы с вредными грибками в садоводстве и строительстве.
Железо применяется в качестве анода в железо-никелевых аккумуляторах, железо-воздушных аккумуляторах.
Водные растворы хлоридов двухвалентного и трёхвалентного железа, а также его сульфатов используются в качестве коагулянтов в процессах очистки природных и сточных вод на водоподготовке промышленных предприятий.
Железо (англ. Iron) — Fe
Молекулярный вес – 55.85 г/моль
Происхождение названия – возможно англо-саксонского происхождения
IMA статус – действителен, описан впервые до 1959 (до IMA)
ФИЗИЧЕСКИЕ СВОЙСТВА
Цвет минерала – железно-черный
Цвет черты – серый
Прозрачность – непрозрачный
Блеск – металлический
Спайность – несовершенная по
Твердость (шкала Мооса) – 4,5
Излом – в зазубринах
Прочность – ковкий
Плотность (измеренная) – 7.3 — 7.87 г/см³
Радиоактивность (GRapi) – 0
Магнетизм – ферромагнетик
ОПТИЧЕСКИЕ СВОЙСТВА
Тип – изотропный
Цвет в отраженном свете – белый
Люминесценция в ультрафиолетовом излучении – не флюоресцентный
КРИСТАЛЛОГРАФИЧЕСКИЕ СВОЙСТВА
Точечная группа – m3m (4/m 3 2/m) — изометрический — гексаоктаэдральный
Пространственная группа – Im3m (I4/m 3 2/m)
Сингония – кубическая
Параметры ячейки – a = 2.8664Å
Двойникование – (111) также в пластинчатых массах
Морфология – в маленьких пузырьках
Физические характеристики, состав и особенности металла железа

Железо – первый по значимости и распространенности конструкционный материал. Известен он с глубокой древности, а свойства его таковы, что когда железо научились выплавлять в значимом количестве, металл вытеснил все остальные сплавы. Наступил век железа и, судя по области его применения, время это закончится нескоро. Данная статья расскажет вам, какова удельная плотность железа, какая у него температура плавления в чистом виде.
Состав и структура железа
Железо – типичный металл, причем химически активный. Вещество вступает в реакцию при нормальной температуре, а нагрев или повышение влажности значительно увеличивают его реакционноспособность. Железо корродирует на воздухе, горит в атмосфере чистого кислорода, а в виде мелкой пыли способно воспламениться и на воздухе.
Чистому железу присуща ковкость, однако в таком виде металл встречается очень редко. На деле под железом подразумевают сплав с небольшими долями примесей – до 0,8%, которому присущи мягкость и ковкость чистого вещества. Значение для народного хозяйства имеет сплавы с углеродом – сталь, чугун, нержавеющая сталь.
Железу присущ полиморфизм: выделяют целых 4 модификации, отличающиеся структурой и параметрами решетки:
При высоком давлении, а также при легировании металла некоторыми добавками образуется ε- фаза с гексагонической плотноупакованной решеткой.
Температура фазовых переходов заметно изменяется при легировании тем же углеродом. Собственно, сама способность железа образовать столько модификаций служит основой обработки стали в разных температурных режимах. Без таких переходов металл не получил бы столь широкого распространения.
Теперь настал черед свойств металла железа.
О структуре железа рассказывает этот видеосюжет:
Свойства и характеристики металла
Железо – достаточно легкий, умеренно тугоплавкий металл, серебристо-серого цвета. Легко реагирует с разбавленными кислотами и поэтому считается элементом средней активности. На воздухе – сухом, металл постепенно покрывается пленкой оксида, которая препятствует дальнейшей реакции.
Но при самой небольшой влажности вместо пленки появляется ржавчина – рыхлая и неоднородная по составу. Ржавчина дальнейшей коррозии железа не препятствует. Однако физические свойства металла, а, главное, его сплавов с углеродом таковы, что, несмотря на низкую коррозийную стойкость, использование железа более чем оправдано.
Далее вы узнаете, чему равна плотность железа (в кг на м3) в сравнении, например, с медью или алюминием.
Масса и плотность

Молекулярная масса железа составляет 55,8, что указывает на относительную легкость вещества. А какая же у железа плотность? Такой показатель определяется фазовой модификацией:
- α-Fe – 7,87 г/куб. см при 20 С, и 7,67 г/куб. см при 600 С;
- γ-фаза отличается еще более низкой плотностью – 7,59 г/куб см при 1000С;
- плотность δ-фазы составляет 7,409 г/куб см.
С повышением температуры плотность железа закономерно падает.
А теперь давайте узнаем, какова температура плавления железа по Цельсию, сравнивая ее, например, с медью или чугуном.
Температурный диапазон
Металл относится к умеренно тугоплавким, что означает сравнительно невысокую температуру изменения агрегатного состояния:
Читайте также:
