Что является одним из признаков металлической связи
Обновлено: 21.09.2024
Большинство металлов имеют общие свойства, которые отличны от свойств других простых или сложных веществ. Это такие свойства как:
- повышенные температуры плавления,
- значительные электро- и теплопроводность,
- способность отражать свет и
- способность прокатываться в листы
- характерный металлический блеск.
Эти свойства связаны с существованием в металлах металлической связи:
Металлическая связь — это связь между положительно заряженными ионами и атомами металлов и свободно движущимися по кристаллу электронами.
Образование металлической связи
Простое вещество — металл существует в виде кристалла, имеющим металлическую кристаллическую решетку, в узлах которой находятся атомы или ионы металлов.
Валентные атомные орбитали каждого атома металла в кристалле перекрываются сразу с орбиталями нескольких близлежащих соседей, и число этих атомных орбиталей чрезвычайно велико. Поэтому число возникающих молекулярных орбиталей тоже велико.
Мы уже знаем, что число валентных электронов атомов металлов небольшое, к тому же они достаточно слабо связаны с собственными ядрами и могут легко отрываться. Поэтому электроны заполняют всю зону взаимодействующих орбиталей образуя металлическую связь. Т.о. в кристаллической решетке металла перемещение электронов происходит свободно.
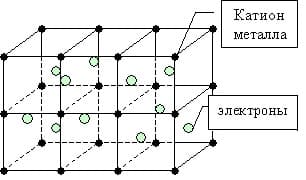
металлическая связь
Такие особенности, как тепло- и электропроводность металлов связано с существованием свободно движущихся электронов в кристаллической решетке.
Особенности металлической связи
Отличие металлической связи от ковалентной
- Несмотря на то, что металлическая связь как и ковалентная связь образована посредством обобществления электронов, однако в металлической связи электроны принадлежат всему множеству ионов/атомов металлов, а в ковалентной только двум атомам неметаллов.
- Важное отличие металлической связи от ковалентной – это то, что здесь не существует направленности связи, т.к. электроны по кристаллу распределены почти равномерно.
- Прочность металлической связи также отличается: ее энергия в 3-4 раза меньше энергии ковалентной связи.
Отличие металлической связи от ионной
В образовании как ионной связи, так и металлической принимают участие ионы — катионы. Однако ионная связь — это связь между катионами и анионами, а в металлической связи анионы отсутствуют, зато имеются электроны, свободно движущиеся между катионами/атомами металлов.
Прочность металлической связи
- Если рассмотреть щелочные металлы, то наиболее активный среди них – цезий, легче всего будет отдавать свои валентные электроны, а труднее всего – рубидий, наименее активный среди щелочных металлов.
Чем легче атом металла переходит в состояние иона, т.е. отдает электроны, тем менее прочна его решетка, вследствие отталкивания положительно заряженных ионов.
В связи с этим металл будет обладать пониженной температурой плавления и становится более мягким.
- Чем больше валентных электронов имеет атом металла, тем более прочна его кристаллическая решетка, и тем выше его температуры кипения и плавления
Ниже приведена зависимость температуры плавления металлов от их положения в периодической таблице и числа валентных электронов.

зависимость температуры плавления металлов от положения в периодической таблице и от числа валентных электронов
Металлическая связь
Металлической называется многоцентровая связь, которая существует в металлах и их сплавах между положительно заряженными ионами и валентными электронами, которые являются общими для всех ионов и свободно передвигаются по кристаллу.
Атомы металлов имеют небольшое количество валентных электронов и низкую энергию ионизации. Эти электроны вследствие больших радиусов атомов металлов достаточно слабо связаны со своими ядрами и могут легко отрываться от них и становиться общими для всего кристалла металла. В результате в кристаллической решетке металла возникают положительно заряженные ионы металла и электронный газ — совокупность подвижных электронов, которые свободно передвигаются по кристаллу металла .
В результате металл представляет собой ряд положительных ионов, локализованных в определенных положениях кристаллической решетки, и большое количество электронов, которые сравнительно свободно передвигаются в поле положительных центров. Пространственное строение металлов — это кристалл, который можно представить как клетку с положительно заряженными ионами в узлах, погруженную в отрицательно заряженный электронный газ. Все атомы отдают свои валентные электроны на образование электронного газа, они свободно перемещаются внутри кристалла, не нарушая химической связи.
Теория о свободном перемещении электронов в кристаллической решетке металлов была экспериментально подтверждена опытом Толмена и Стюарта (в 1916г.): при резком торможении предварительно раскрученной катушки с намотанным проводом, свободные электроны продолжали некоторое время двигаться по инерции, и в это время амперметр, включенный в цепь катушки, регистрировал импульс электрического тока.
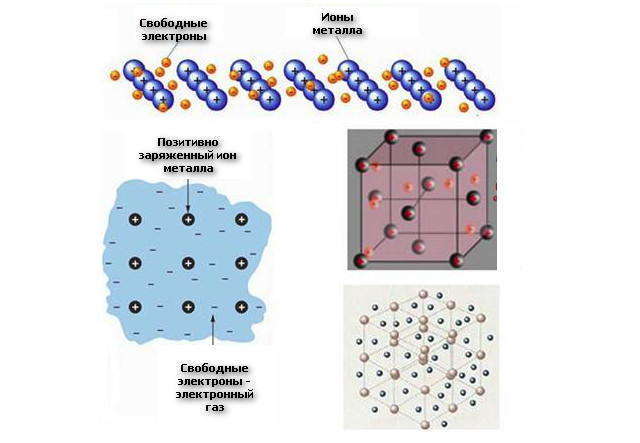
Разновидности моделей металлической связи
Признаками металлической связи являются такие характеристики :
- Многоэлектронность, поскольку в образовании металлического связи участвуют все валентные электроны;
- Многоцентровость, или делокализованность — связь соединяет одновременно большое количество атомов, содержащихся в кристалле металла;
- Изотропность, или ненаправленность — благодаря беспрепятственному передвижению электронного газа одновременно во все стороны металлическая связь является сферически симметричным.
Металлические кристаллы образуют, в основном, три вида кристаллических решеток, однако некоторые металлы в зависимости от температуры могут иметь разные структуры.
Металлическая связь существует в кристаллах и расплавах всех металлов и сплавов. В чистом виде она характерна для щелочных и щелочно-земельных металлов. У переходных d-металлов связь между атомами является частично ковалентной.
Металлическая связь вследствие наличия свободных электронов (электронного газа) и их равномерного распределения по кристаллу приводит к характерным общим свойствам металлов и сплавов, в частности, высокую тепло- и электропроводность, пластичность (т.е. способность без разрушения испытывать деформации при обычных или повышенных температурах), непрозрачность и металлический блеск, обусловленный их способностью отражать свет.
Металлическая связь. Зонная теория кристаллов
Металлическая связь - это особый вид химической связи, реализующейся в металлах, сплавах, в соединениях металлов друг с другом (интерметаллидах). Основной особенностью металлической связи является ее электронодефицитность: взаимодействие осуществляется с использованием значительно меньшего числа валентных электронов, чем это необходимо для образования двухцентровых связей. Так, например, в кристалле натрия каждый атом имеет в ближайшем окружении восемь таких же атомов, в то время как единственный валентный электрон позволяет ему образовать лишь одну двухцентровую связь. Совершенно очевидно, что существование кристалла натрия возможно лишь за счет образования делокализованных связей, охватывающих все атомы кристалла.
Таким образом, металлическая связь - это многоцентровая связь, объединяющая большое число атомов за счет обобществления валентных электронов в пределах всего кристалла.
Характерными особенностями металлической связи являются ее ненаправленность и ненасыщаемость. Вследствие этого веществам с металлической связью присущ ряд общих свойств. Кристаллы таких веществ обладают высокой электропроводность и теплопроводностью. Веществам с металлической связью присущи пластичность (ковкость) и характерный металлический блеск.
Заметим, что наряду с металлической связью в кристалле металла могут проявляться и иные виды взаимодействия, вплоть до образования локализованных связей. Так, в кристалле ниобия, атомы которого имеют пять валентных электронов, лишь около 25 % от их числа идет на образование металлической связи.
Наиболее удовлетворительно металлическую связь описывает зонная теория кристаллов, представляющая собой распространение метода молекулярных орбиталей на системы с переменным и очень большим числом атомов (порядка числа Авогадро).
В основе зонной теории кристаллов лежит представление об энергетических зонах. Познакомимся с этим понятием на примере формирования кристалла щелочного металла, например, натрия. В изолированном атоме натрия электроны находятся на дискретных энергетических уровнях в соответствии с электронной конфигурацией 1s 2 2s 2 2p 6 3s 1 . При сближении двух атомов натрия из двух 3s-орбиталей образуются связывающая ss и разрыхляющая ss * молекулярные орбитали (рис. 13).
Валентные электроны заполняют ss орбиталь, результатом чего является образование молекулы Na2. Взаимодействие трех атомов натрия приводит к образованию трех МО - связывающей, разрыхляющей и несвязывающей. Агрегату Na4 будет соответствовать формирование четырех МО (двух связывающей и двух разрыхляющих). По мере увеличения числа атомов в агрегате число молекулярных орбиталей будет расти, а отвечающие им энергетические уровни будут сближаться. При достаточно большом числе атомов (порядка числа Авогадро) формируется совокупность огромного числа энергетических уровней, в которой энергии двух соседних уровней отличаются на очень малую величину (порядка 10 -20 - 10 -22 кДж/моль). Подобные совокупности энергетических уровней называются энергетическими зонами.
Рис. 13. Формирование 3s-зоны в кристалле натрия.
Энергетические зоны подчиняются законам квантово-механической теории. Так, для энергетических зон справедлив принцип Паули: если кристалл состоит из N атомов, емкость s-зоны составляет 2N электронов, р-зоны - 6N электронов и т.д. Соблюдается также правило Хунда: если в зоне имеются вырожденные уровни, электроны распределяются таким образом, чтобы число параллельных спинов было максимальным. Зона, в которой располагаются валентные электроны, называется валентной зоной; ближайшая к валентной вакантная зона называется зоной проводимости.
Энергетические зоны распространяются на все атомы кристалла, в результате чего любой электрон, участвующий в образовании металлической связи, принадлежит всем атомам, что обеспечивает свободное перемещение электрона по кристаллу.
В кристалле металла возможно перекрывание энергетических зон, образованных орбиталями разных энергетических подуровней. Зоны являются перекрывающимися, если верхний край нижней валентной зоны выше нижнего края зоны проводимости. Если зоны не перекрываются, то энергетический зазор между нижним краем зоны проводимости и верхним краем валентной зоны называется запрещенной зоной.
Зонная теория объясняет характерные свойства металлов. Так, высокая электрическая проводимость типичных металлов связана со свободным перемещением электронов в пределах кристалла. Очевидно, что металлическая проводимость проявляется в двух случаях:
1. Если валентная зона укомплектована электронами не полностью.
2. Если валентная зона и зона проводимости перекрываются. В этом случае валентные электроны заполняют энергетические уровни не только валентной зоны, но и зоны проводимости.
Если заполненная электронами валентная зона отделена от зоны проводимости запрещенной зоной, то свойства кристалла будут определяться шириной запрещенной зоны. Если ширина запрещенной зоны (DЕ) больше 400 кДж/моль, то кристалл не будет проводить электрический ток. Такие вещества называются диэлектриками. Примером диэлектрика может служить алмаз, для которого DЕ = 580 кДж/моль, а удельное сопротивление r составляет 1×10 6 Ом×см -1 . При ширине запрещенной зоны, укладывающейся в интервал 10 - 400 кДж/моль, часть электронов, обладающих достаточной энергией, переходит в зону проводимости; такие вещества называются полупроводниками. Так, для кристаллического кремния DЕ = 105 кДж/моль, а r = 6×10 4 Ом×см -1 при комнатной температуре.
Понижение температуры по-разному влияет на проводимость металлических проводников и полупроводников: для первых проводимость с повышением температуры понижается, для вторых - повышается. Это явление также может быть объяснено в рамках зонной теории. В случае металлических проводников с повышением температуры электроны, поглощая тепловую энергию, перемещаются с низких уровней на вакантные уровни той же зоны или зоны проводимости. В результате уменьшается число незанятых уровней с относительно низкой энергией и, следовательно, проводимость кристалла. В случае полупроводника с повышением температуры возрастает доля электронов, способных преодолеть запрещенную зону, и проводимость кристалла увеличивается.
В результате обобществления электронов и свободного перемещения их в пределах всего кристалла в узлах кристаллической решетки металла находятся частицы, имеющие одноименный (положительный) эффективный заряд. В связи с этим слои атомов металла относительно легко смещаются друг относительно друга, Этим объясняется типичная для металлов пластичность.
Металлическая связь — это одновременное существование положительно заряженных атомов и свободного электронного газа.
Содержание
Механизм металлической связи
Во всех узлах кристаллической решётки расположены положительные ионы металла. Между ними беспорядочно, подобно молекулам газа, движутся валентные электроны, отцепившиеся от атомов при образовании ионов. Эти электроны играют роль цемента, удерживая вместе положительные ионы; в противном случае решётка распалась бы под действием сил отталкивания между ионами. Вместе с тем и электроны удерживаются ионами в пределах кристаллической решётки и не могут её покинуть. Силы связи не локализованы и не направлены. Поэтому в большинстве случаев проявляются высокие координационные числа (например, 12 или 8).



Так, щелочные металлы кристаллизуются в кубической объёмно-центрированной решётке, и каждый положительно заряженный ион щелочного металла имеет в кристалле по восемь ближайших соседей – положительно заряженных ионов щелочного металла (рис.1). Кулоновское отталкивание одноимённо-заряженных частиц (ионов) компенсируется электростатическим притяжением к электронам связывающих звеньев, имеющих форму искажённого сплющенного октаэдра – квадратной бипирамиды, высота которой и рёбра базиса равны величине постоянной трансляционной решётке aw кристалла щелочного металла (рис.2).
Связывающие электроны становятся общими для системы из шести положительных ионов щелочных металлов и удерживают последние от кулоновского отталкивания.
Величина постоянной трансляцонной решётки aw кристалла щелочного металла значительно превышает длину ковалентной связи молекулы щелочного металла, поэтому принято считать, что электроны в металле находятся в свободном состоянии:
| Щёлочный металл | Li | Na | K | Rb | Cs |
|---|---|---|---|---|---|
| Постоянная решётка aw,Å [1] | 3,5021 | 4,2820 | 5,247 | 5,69 | 6,084 |
| Длина ковалентной связи, Me2, Å [2] | 2,67 | 3,08 | 3,92 | 4,10 | 4,30 |
Математическое построение, связанное со свойствами свободных электронов в металле, обычно отождествляют с «поверхностью Ферми», которую следует рассматривать как геометрическое место, где пребывают электроны, обеспечивая основное свойство металла – проводить электрический ток [3] . Таким образом, электрический ток в металлах – это движение сорванных с орбитального радиуса электронов в поле положительно заряженных ионов, находящихся в узлах кристаллической решётки металла. Выход и вход свободных электронов в связывающее звено кристалла осуществляется через точки «0», равноудалённые от положительных ионов атомов (рис.2).
Свободное движение электронов в металле подтверждено в 1916 году опытом Толмена и Стюарта по резкому торможению быстро вращающейся катушки с проводом – свободные электроны продолжали двигаться по инерции, в результате чего гальванометр регистрировал импульс электрического тока. Свободное движение электронов в металле обусловливает высокую теплопроводность металла и склонность металлов к термоэлектронной эмиссии, происходящей при умеренной температуре.
Колебания ионов кристаллической решётки создаёт сопротивление движению электронов по металлу, сопровождающееся разогревом металла. В настоящее время важнейшим признаком металлов считается отрицательный температурный коэффициент электрической проводимости, то есть понижение проводимости с ростом температуры. С понижением температуры электросопротивление металлов уменьшается, вследствие уменьшения колебаний ионов в кристаллической решётке. В процессе исследования свойств материи при низких температурах Камерлинг-Оннес открывает явление сверхпроводимости. В 1911 году ему удаётся обнаружить уменьшение электросопротивления ртути при температуре кипения жидкого гелия (4,2 К) до нуля. В 1913 году Камерлинг-Оннесу присуждается Нобелевская премия по физике со следующей формулировкой: «За исследование свойств веществ при низких температурах, которые привели к производству жидкого гелия.»
Однако теория сверхпроводимости была создана позднее. В её основе лежит концепция куперовской электронной пары – коррелированного состояния связывающих электронов с противоположными спинамии и импульсами, и, следовательно, сверхпроводимость можно рассматривать как сверхтекучесть электронного газа, состоящего из куперовских пар электронов, через ионную кристаллическую решётку. В 1972 году авторам теории БКШ – Бардину, Куперу и Шрифферу присуждена Нобелевская премия по физике “За создание теории сверхпроводимости, обычно называемой БКШ-теорией».
Характерные кристаллические решётки
Большинство металлов образует одну из следующих высокосимметричных решёток с плотной упаковкой атомов: кубическую объемно центрированную, кубическую гранецентрированную и гексагональную.
В кубической объемно центрированной решётке (ОЦК) атомы расположены в вершинах куба и один атом в центре объёма куба. Кубическую объемно центрированную решётку имеют металлы: Pb, K, Na, Li, β-Ti, β-Zr, Ta, W, V, α-Fe, Cr, Nb, Ba и др.
В кубической гранецентрированной решётке (ГЦК) атомы расположены в вершинах куба и в центре каждой грани. Решётку такого типа имеют металлы: α-Ca, Ce, α-Sr, Pb, Ni, Ag, Au, Pd, Pt, Rh, γ-Fe, Cu, α-Co и др.
В гексагональной решётке атомы расположены в вершинах и центре шестигранных оснований призмы, а три атома — в средней плоскости призмы. Такую упаковку атомов имеют металлы: Mg, α-Ti, Cd, Re, Os, Ru, Zn, β-Co, Be, β-Ca и др.
Другие свойства
Свободно движущиеся электроны обусловливают высокую электро- и теплопроводность. Вещества, обладающие металлической связью, часто сочетают прочность с пластичностью, так как при смещении атомов друг относительно друга не происходит разрыв связей.
хим. связь, обусловленная взаимод. электронного газа (валентные электроны) в металлах с остовом положительно заряженных ионов кристаллич. решетки. Идеальная модель М. с. отвечает образованию частично заполненных валентными электронами металла зон энергетич. уровней (см. Твердое тело), наз. зонами проводимости. При сближении атомов, образующих металл, атомные орбитали валентных электронов переходят в орбитали, делокализованные по кристаллич. решетке аналогично делокализованным p-орбиталям сопряженных соединений. Количественно описать М. с. можно только в рамках квантовой механики, качественно образование М. с. можно понять исходя из представлений о ковалентной связи.
При сближении двух атомов металла, напр. Li, образуется ковалентная связь, при этом происходит расщепление каждого энергетич. уровня валентного электрона на два. Когда Nатомов Li образуют кристаллич. решетку, перекрывание электронных облаков соседних атомов приводит к тому, что каждый энергетич. уровень валентного электрона расщепляется на Nуровней, расстояния между к-рыми из-за большой величины Nнастолько малы, что их совокупность может считаться практически непрерывной зоной энергетич. уровней, имеющей конечную ширину. Поскольку каждый атом участвует в образовании большего числа связей, чем, напр., в двухатомной молекуле при том же числе валентных электронов, то минимум энергии системы (или максимум энергии связи) достигается при расстояниях больших, чем в случае двухцентровой связи в молекуле. Межатомные расстояния в металлах заметно больше, чем в соед. с ковалентной связью (металлич. радиус атомов всегда больше ковалентного радиуса), а координац. число (число ближайших соседей) в кристаллич. решетках металлов обычно 8 или больше 8. Для наиб. часто встречающихся кристаллич. структур координац. числа равны 8 (объемноцентрир. кубич.), 12 (гранецентрир. кубическая и гексаген. плотно-упакованная). Расчеты параметров металлич. решеток с использованием ковалентных радиусов дают заниженные результаты. Так, расстояние между атомами Li в молекуле Li 2 (ковалентная связь) равно 0,267 нм, в металле Li-0,304 нм. Каждый атом Li в металле имеет 8 ближайших соседей, а на расстоянии, в
Во мн. металлах М. с. между атомами включает вклады ионной или ковалентной составляющей. Особенности М. с. у каждого металла м. б. связаны, напр., с электростатич. отталкиванием ионов друг от друга с учетом распределения электрич. зарядовое них, с вкладом в образование связи электронов внутр. незаполненных оболочек переходных металлов, с корреляцией движения электронов в электронном газе и нек-рыми др. причинами.
М. с. характерна не только для металлов и их сплавов, но и для металлических соединений (см. также Интерметал-лиды), она сохраняется не только в твердых кристаллах, но и в расплавах и в аморфном состоянии.
Лит.: Блейкмор Дж., Физика твердого тела, пер. с англ., М., 1988. См. также лит. при ст. Металлы. Ю. С. Старк.
Химическая энциклопедия. — М.: Советская энциклопедия . Под ред. И. Л. Кнунянца . 1988 .
Полезное
Смотреть что такое "МЕТАЛЛИЧЕСКАЯ СВЯЗЬ" в других словарях:
Металлическая связь — Металлическая связь это одновременное существование положительно заряженных атомов и свободного электронного газа. Содержание 1 Механизм металлической связи 2 Характерные кристаллические решётки … Википедия
МЕТАЛЛИЧЕСКАЯ СВЯЗЬ — тип хим. связи атомов в в вах, обладающих металлич. св вами. М. с. обусловлена большой концентрацией в таких кристаллах эл нов проводимости. Отрицательно заряженный «электронный газ» удерживает положительно заряженные ионы на определённых… … Физическая энциклопедия
МЕТАЛЛИЧЕСКАЯ СВЯЗЬ — МЕТАЛЛИЧЕСКАЯ СВЯЗЬ, в химии связь, удерживающая вместе атомы МЕТАЛЛА. Внутри кристаллов металлов положительно заряженные ионы держаться посредством электростатического притяжения облака окружающих электронов, которые могут двигаться под… … Научно-технический энциклопедический словарь
МЕТАЛЛИЧЕСКАЯ СВЯЗЬ — особый тип хим. связи атомов в металлах и интерметаллических соединениях, обусловленный высокой концентрацией в кристаллах электронов проводимости. Отрицательно заряженное электронное облако удерживает положительно заряженные ионы на определённых … Большая политехническая энциклопедия
металлическая связь — [metal bond] межатомная связь, характерная для металлов с равномерной плотностью электронного газа. Металлическая связь обусловлена взаимодействием отрицательно заряженного электронного газа и положительно заряженных ионных остовов,… … Энциклопедический словарь по металлургии
металлическая связь — химическая связь, обусловленная взаимодействием «электронного газа» (валентные электроны) металлов с остовом положительно заряженных ионов кристаллической решётки. По природе близка к ковалентной связи. Характерна для металлов, их сплавов,… … Энциклопедический словарь
металлическая связь — metališkasis ryšys statusas T sritis chemija apibrėžtis Delokalizuoto cheminio ryšio tipas, esantis visuose metaluose. atitikmenys: angl. metallic bond rus. металлическая связь … Chemijos terminų aiškinamasis žodynas
металлическая связь — metališkasis ryšys statusas T sritis fizika atitikmenys: angl. metallic bond vok. metallische Bindung, f rus. металлическая связь, f pranc. liaison métallique, f … Fizikos terminų žodynas
МЕТАЛЛИЧЕСКАЯ СВЯЗЬ — связь, возникающая при образовании химического соединения из металлических элементов. Химический состав этих соединений из за нежесткой металлической связи непостоянен и не соответствует стехиометрическому соотношению элементов по формуле данного … Металлургический словарь
Металлическая связь — тип связи атомов в кристаллических веществах, обладающих металлическими свойствами (металлах (См. Металлы), металлидах (См. Металлиды)). М. с. обусловлена большой концентрацией в таких кристаллах квазисвободных электронов (электронов… … Большая советская энциклопедия
Читайте также:
