Цинковую пластинку поместили в раствор сульфата некоторого двухвалентного металла масса раствора
Обновлено: 20.09.2024
Настоящий пучок задач включает операции с цинковыми, медными и железными пластинками, погружаемыми в растворы солей CuSO4, AgNO3, Fe(NO3)3.
«Изюминки» представляют задания на определение неизвестного металла (Ж-7), составление уравнений реакций магния с растворами AlCl3 и AgNO3 (Ж-10), серебрение стальных колец (Ж-11).
Пучок задач Ж
Ж-1. Цинковая пластинка при погружении в раствор сульфата меди(II) покрывается слоем меди. Как изменяется при этом масса пластинки [1]?
Ж-2. Установлено, что масса медной пластинки, погруженной в раствор нитрата серебра, сначала увеличивается, а потом довольно быстро становится неизменной, несмотря на то, что раствор по-прежнему дает осадок при добавлении раствора поваренной соли. Объясните происходящее явление [2].
Ж-3. В раствор нитрата серебра погрузили медную пластинку. Через некоторое время пластинку вынули из раствора, промыли, высушили. Масса пластинки увеличилась на 0,440 г. Определите, сколько серебра отложилось на пластинке [1].
Ж-4. В раствор сульфата меди(II) была погружена железная пластинка. Через некоторое время масса пластинки увеличилась на 0,16 г. Сколько меди выделилось на пластинке [1]?
Ж-5. Железную пластинку погрузили в раствор сульфата меди(II). Через некоторое время ее вынули, промыли, высушили и взвесили. Масса пластинки увеличилась на 1,30 г. Найдите массу меди, которая выделилась на пластинке [3].
Ж-6. Цинковую пластинку поместили в раствор нитрата серебра. Какая масса цинка перешла в раствор, если масса раствора уменьшилась на 3,02 г [3]?
Ж-7. Раствор сульфата двухвалентного металла содержит 1,120 г металла в виде ионов. После полного выделения металла на цинковой пластинке ее масса увеличилась на 0,470 г. Установите неизвестный металл [3].
Ж-8. На железной пластинке, погруженной в раствор сульфата меди(II), выделилось 40 г меди. На сколько граммов изменилась масса железной пластинки [4, 5]?
Ж-9. Масса медной пластинки, находившейся некоторое время в растворе нитрата серебра, увеличилась на 2,18 г. Сколько граммов серебра выделилось на медной пластинке [4, 5]?
Ж-10. Смешали растворы трихлорида алюминия и нитрата серебра и поместили туда кусочек магния. Составьте молекулярные и ионные уравнения происходящих процессов [4].
Ж-11. При производстве серебряных колец, идущих на изготовление хрустальных ваз, стальное (железное) кольцо покрывают тонким слоем серебра. Пользуясь этой технологией, в раствор нитрата серебра погрузили стальное кольцо массой 40 г. Через некоторое время его вынули, промыли и высушили. Масса кольца стала 42 г. Сколько серебра отложилось на таком кольце [6]?
Ж-12. Медную пластинку массой 20 г погрузили в 300 мл раствора нитрата железа(III) с плотностью 1,3 г/см 3 и массовой долей соли 0,15. После некоторого выдерживания пластинки в растворе ее вынули, при этом оказалось, что массовая доля нитрата железа(III) стала равна массовой доле образовавшейся соли меди(II). Определите массу пластинки после того, как ее вынули из раствора [7].
Ж-13. Медную пластинку массой 20 г выдержали в растворе нитрата серебра до полного окончания реакции, после чего масса пластинки увеличилась на 19%. Вычислите массу нитрата серебра в исходном растворе.
Решения и ответы
Ж-1. Масса пластинки уменьшается. В реакции замещения со взятыми по 1 моль реагентами
Ж-2. Учтите, что серебро, выделяющееся на пластинке, покрывает ее равномерным слоем, плотно прилегающим к поверхности меди. Это делает невозможным дальнейшее осуществление реакции, хотя в растворе имеется еще достаточное количество нитрата серебра.
Ж-3. 0,625 г серебра.
Ж-5. На пластинке выделилось 10,4 г меди.
Ж-6. В раствор перешло 1,3 г цинка.
Ж-7. МSO4 + Zn = ZnSO4 + M,
где М – искомый металл.
Изменение массы пластинки равно:
m = –m(Zn) + m(М) = 0,47 г,
–m(Zn) = 0,47 – 1,12 г, m(Zn) = 0,65 г.
Отсюда можно предположить, что искомый металл – кадмий (М = 112 г/моль), т.к.
М(Zn) = 65 г/моль. Причем всех веществ, участвующих в реакции, было взято по 0,01 моль.
Ж-8. Масса пластинки изменилась на 5 г.
Ж-9. На пластинке выделилось 3,1 г серебра.
Ж-10. В водном растворе соль AlCl3 постепенно гидролизуется:
Поэтому с нитратом серебра могут реагировать три разные соли алюминия, например:
Магний, добавленный к такой смеси, реагирует с имеющейся в растворе соляной кислотой (если AlCl3 в избытке):
В результате кислота HCl выводится из раствора и гидролиз AlCl3, не прореагировавшего с AgNO3, может пройти полностью до Al(OH)3. Если в растворе избыток AgNO3, то идет другая реакция:
Еще одна реакция – вытеснение магнием алюминия из его соли:
Ж-11. Химизм серебрения железных колец может быть представлен следующим образом:
Пусть х г – масса серебра, отложившегося на кольце. Если бы растворилось 56 г железа, то образовалось бы 216 г серебра, при растворении же (х•56/216) г железа образуется х г серебра.
Уравнение баланса массы: х – х•56/216 = 2 (реальный прирост массы кольца составил 2 г).
Из этого уравнения х = 2,7 г, т.е. на кольце отложилось 2,7 г серебра.
Ж-12. Медь растворяется в растворе Fe(NO3)3 и восстанавливает ионы Fe 3+ до Fe 2+ :
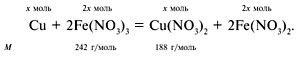
Найдем массу нитрата железа(III) в исходном растворе:
Обозначим через х моль – количество вещества меди. Тогда масса образовавшегося
нитрата меди(II):
а масса оставшегося нитрата железа(III):
По условию задачи:
58,5 – 484х = 188х.
Отсюда х = 0,09 моль.
Масса пластинки после реакции равна:
20 – 64•0,09 = 14,24 г.
ЛИТЕРАТУРА
1. Абкин Г.Л. Задачи и упражнения по химии. М., 1967, 88 с.
2. Чуранов С.С. Химические олимпиады в школе. М., 1982, 191 с.
3. Чмиленко Ф.В., Виниченко И.Г., Чмиленко Т.С. Подготовка к экзамену по химии с контролем на ЭВМ. М., 1994, 144 с.
4. Гуськова Л.Г. Задачи и упражнения по химии. М., 1976, 190 с.
5. Журин А.А. Сборник задач по химии. М., 1997, 254 с.
6. Решетова М.Д. Сборник задач по химии (с решениями). М., 1992, 58 с.
7. Янклович А.И. Химия. В помощь выпускнику школы и абитуриенту. СПб., 1999, 255 с.
" В РАСТВОР ПОГРУЖЕНА ПЛАСТИНКА. "
Задачи пучка Д подтверждают известный тезис о материальном балансе веществ пластинки и раствора: возрастание массы пластинки сопровождается уменьшением массы раствора. Кроме того, придется вспомнить о летучем металле (ртуть, tкип = 357 °С), о понятиях «ряд напряжений металлов», «эквивалент металла», «массовая доля» и др.
Пучок задач Д
Д-1. На каком свойстве металлов основано применение раствора медного купороса для разметки стальных деталей при их обработке? Напишите уравнение соответствующей реакции [1].
Д-2. Каплю раствора соли неизвестного металла поместили на медную пластинку. Через некоторое время пластинку тщательно промыли дистиллированной водой, при этом обнаружили, что на том месте, где была капля раствора, осталось ярко выраженное блестящее пятно, которое исчезло только после нагревания пластинки. Какой металл входил в состав соли? Какие соли, образованные ионами этого металла, могли содержаться в растворе [2–8]?
Д-3. Свинцовую пластинку погрузили на некоторое время в раствор медного купороса. Затем ее вынули из раствора, промыли, высушили и взвесили. Вес пластинки уменьшился на 1,43 г. Сколько граммов свинца перешло в раствор [9]?
Д-4. Что произойдет с железной пластинкой массой 5 г при выдерживании ее в растворе, содержащем сульфат меди(II) массой 1,6 г [7, 10, 12]?
Д-5. В раствор кислоты были погружены цинковая и кадмиевая пластинки. При соединении наружных концов пластинок металлическим проводником на поверхности кадмия началось выделение водорода. Какой из взятых металлов химически более активен и стоит в ряду напряжения левее? Выразите уравнениями происходящие на поверхности пластинок реакции [9].
Д-6. В раствор, содержащий 8,32 г сульфата кадмия, погрузили цинковую пластинку. После полного выделения кадмия масса пластинки увеличилась на 2,35%. Определите массу цинковой пластинки до начала реакции [12, 13].
Д-7. Цинковую пластинку погрузили в раствор нитрата некоторого двухвалентного металла. После того как прореагировало 0,03 моль нитрата металла, масса цинковой пластинки увеличилась на
1,41 г. Определите, нитрат какого металла был в растворе [14].
Д-8. В раствор сульфата меди(II) объемом 250 мл поместили железную пластинку массой 40 г. Определите массу выделившейся меди и молярную концентрацию сульфата железа(II) в образовавшемся растворе, если после реакции масса пластинки оказалось равной 42 г [7].
Д-9. В раствор, содержащий 3,2 г металла в виде хлорида, погрузили железную пластинку массой 50 г. После полного выделения металла масса пластинки увеличилась на 0,8%. Определите эквивалент металла [13].
Д-10. В раствор сульфата олова(II) массой 50 г с массовой долей вещества 21,5% поместили железные опилки массой 3,36 г. После окончания реакции металлический осадок собрали. Определите массу этого осадка [15].
Д-11. В раствор нитрата ртути(I) Hg2(NO3)2 массой 200 г поместили железные опилки. Массовая доля растворенного вещества первоначально составляла 20%. Через некоторое время массовая доля нитрата ртути(I) в растворе стала 10%. Какая масса ртути получена в результате реакции [15]?
Д-12. Железную пластинку массой 20 г поместили в раствор нитрата серебра массой 80 г с массовой долей вещества 12%. Через некоторое время массовая доля нитрата составила 8%. Определите, чему равна масса металлической пластинки, если все полученное серебро выделилось на ней [15].
Д-13. После погружения железной пластинки массой 8 г в 50 мл раствора нитрата свинца с массовой долей 15% (плотность – 1,32 г/см 3 ) количество нитрата свинца в растворе уменьшилось втрое. Какой стала масса пластинки [16]?
Д-2. Это мог быть любой металл, расположенный в ряду стандартных электродных потенциалов правее меди, но с учетом того, что металл испарился при нагревании, ответ только один: металл – ртуть. В растворе могли быть ионы одно- и двухвалентной ртути или такие растворимые соли, как Hg2(NO3)2 и Hg(NO3)2, Hg2SO4 и HgSO4, Hg2Cl2 и HgCl2.
Д-3. В раствор перешло 2,07 г свинца.
Д-4. Масса пластинки станет 5,08 г.
Д-5. Используя знания о ряде стандартных электродных потенциалов, можно составить следующее уравнение реакции:
2H + + Zn 0 = Zn 2+ + H2,
при этом водород будет выделяться на кадмиевой пластинке, цинковая же пластинка будет растворяться.
Д-6. Zn + CdSO4 = ZnSO4 + Cd;
m(Zn) = 65•0,04 = 2,6 г,
m(Cd) = 0,04•112 = 4,48 г,
m = 4,48 – 2,6 = 1,88 г – это 2,35%.
Отсюда m(пластинки) = 1,88/0,0235 = 80 г.
Пусть молярная масса металла М будет х, тогда мы можем составить и решить уравнение:
0,03х – 65•0,03 = 1,41.
Отсюда х = 112 г/моль, это – кадмий.
Д-8. Сначала запишем уравнение происходящей реакции:
Из уравнения понятно, что при выделении на железной пластинке 1 моль меди 1 моль железа переходит в раствор и масса пластинки увеличивается на 8 г (64 – 56 = 8). Зная по условию задачи, что масса пластинки увеличивается на 2 г, можно составить следующую пропорцию: при увеличении массы пластинки на 8 г выделяется 64 г меди, при увеличении массы пластинки на 2 г выделяется х г меди.
Отсюда х = 2•64/8 = 16 г.
Следовательно, n(Cu) = 16/64 = 0,25 моль.
Исходное уравнение показывает, что при выделении 1 моль меди в растворе образуется 1 моль сульфата железа. Значит, при выделении 0,25 моль меди в раствор выделится 0,25 моль сульфата железа. Соответственно в 1 л такого раствора должно было бы содержаться 0,25•4 = 1 моль сульфата железа. Следовательно, раствор будет одномолярным.
Д-9. MCl2 + Fe = M + FeCl2.
1-й способ. Пусть в реакцию вступило у моль металла М и у моль железа (в соответствии с уравнением). Тогда, найдя изменение массы пластинки m = 0,008•50 = 0,4 г, можно составить и решить уравнение: 3,2 – 56у = 0,4. Отсюда у = 0,05 моль, М(М) = 3,2/0,05 = 64 г/моль, это – медь. Эквивалент меди равен 32.
2-й способ. По условию задачи при замещении 3,2 г металла масса железной пластинки увеличилась на 50•0,008 = 0,4 г. Следовательно, в раствор перешло 2,8 г железа (3,2 – 0,4 = 2,8). Составляем следующую пропорцию: 2,8 г железа замещают 3,2 г неизвестного металла, 28 г железа замещают Э неизвестного металла (эквивалент железа замещает эквивалент неизвестного металла). Находим Э = 28•3,2/2,8 = 32.
Д-10. Масса осадка 6,51 г.
Д-11. Hg2(NO3)2 + Fe = 2Hg + Fe(NO3)2.
Вычислим массу m[Hg2(NO3)2]исх = 200•0,2 = 40 г, затем массу m[Hg2(NO3)2]ост = 200•0,1 = 20 г. Масса израсходовавшегося вещества равна 40 – 20 = 20 г. Это соответствует количеству вещества Нg2(NO3)2 0,038 моль (20/526 = 0,038).
Из уравнения следует, что n(Hg) = 2•0,038 = 0,076 моль.
Масса ртути: 0,076•201 = 15,28 г.
Д-12. Fe + 2AgNO3 = Fe(NO3)2 + 2Ag.
Обозначим за х количество вещества железа, тогда количество вещества нитрата серебра и серебра будет равно по 2х. В растворе было 9,6 г нитрата серебра, за время реакции из раствора ушло 2х•108 г ионов серебра и прибавилось 56х г ионов железа Fe 2+ . Масса веществ в растворе после реакции составила 0,08•(80 + 56х – 216х) г.
Зная материальный баланс в системе, составим и решим уравнение:
9,6 – 216х + 56х = 6,4 + 4,48х – 17,28х.
Отсюда х = 0,022 моль.
Найдем массу пластинки после реакции:
20 – 1,23 + 4,75 = 23,5 г.
Д-13. Масса пластинки стала 11,02 г.
1. Савицкий С.Н., Твердовский Н.П. Сборник задач и упражнений по неорганической химии. М., 1981, 112 с.
2. Гольдфарб Я.Л., Сморгонский Л.М. Задачи и упражнения по химии. М., 1953, 168 с.
3. Гольдфарб Я.Л., Сморгонский Л.М. Задачи и упражнения по химии. М., 1957, 144 с.
4. Гольдфарб Я.Л., Сморгонский Л.М. Задачи и упражнения по химии. М., 1963, 144 с.
5. Гольдфарб Я.Л., Ходаков Ю.В. Задачи и упражнения по химии. М., 1979, 190 с.
6. Гольдфарб Я.Л., Ходаков Ю.В., Додонов Ю.Б. Задачи и упражнения по химии. М., 1999, 271 с.
7. Ерохин Ю.М., Фролов В.И. Сборник задач и упражнений по химии с дидактическим материалом. М., 1988, 240 с.
8. Польские химические олимпиады (сборник задач). Под ред. С.С.Чуранова. М., 1980, 532 с.
9. Власов Ю.Г, Корольков Д.В., Чарыков А.К., Артемьев В.И. Знания – молодежи. Химия. Л., 1969, 157 с.
10. Кузьменко Н.Е., Еремин В.В., Попков В.А. Химия. М., 1999, 542 с.
11. Кузьменко Н.Е., Еремин В.В. Химия. 2400 задач для школьников и поступающих в вузы.
М., 1999, 560 с.
12. Лучинская М.Г., Михеева Н.Н. Методические указания по химии. М., 1991, 171 с.
13. Середа И.П. Конкурсные задачи по химии. Киев, 1978, 192 с.
14. Шамова М.О. Учимся решать расчетные задачи по химии: технология и алгоритмы решения.
М., 2001, 95 с.
15. Хомченко Г.П., Хомченко И.Г. Задачи по химии для поступающих в вузы. М., 1994, 302 с.
16. Сидельникова В.И. Сборник задач повышенной трудности и упражнений по химии. Тюмень,
1994, 151 с.
Рассмотрено растворение пластинок металлов в растворах солей менее активных металлов, сопровождаемое массопереносом (с пластинки в раствор и из раствора на пластинку). Взаимодействующие системы: Zn–р-р NiSO4 (H-1), Zn–р-р FeCl3 (H-2),
Zn–р-р CuSO4 (H-3, H-5), Mn–р-р SnSO4 (H-4) и др. Интересно, что в ряде случаев металлы растворяются и в растворах солей более активных металлов. Например: Zn–р-р AlCl3
(Н-2), Cu–р-р FeCl3 (H-6). Задачи H-12 и Н-13 – на определение металлов неизвестных солей в растворе.
Н-1. Будет ли взаимодействовать цинк со следующими водными растворами: а) 1М соляной кислоты; б) 1М сульфата никеля; в) 1М нитрата магния [1]?
Н-2. Известно, что металлический цинк растворяется в водном растворе дихлорида цинка (почему?). Будет ли цинк растворяться в водных растворах хлорида калия, дихлорида бария, трихлорида алюминия, трихлорида железа? Дайте мотивированный ответ и приведите уравнения возможных реакций [2].
Н-3. Цинковая пластинка массой 50 г была погружена в раствор сульфата меди(II). После окончания реакции промытая и высушенная пластинка имела массу 49,82 г. Объясните изменение массы пластинки и определите массу сульфата меди(II), находившегося в растворе [3].
Н-4. Деталь из марганца погрузили в раствор сульфата олова(II). Через некоторое время масса детали увеличилась на 2,56 г. Какая масса олова выделилась на детали? Какая масса марганца перешла в раствор [см. 1]?
Н-5. Цинковая пластинка массой 10 г была помещена в раствор сульфата меди(II). После окончания реакции, когда вся медь выделилась на пластинке, пластинку промыли, высушили и взвесили. Масса пластинки оказалась равной 9,9 г. Напишите уравнение реакции и определите массу сульфата меди(II), находившегося в исходном растворе [4].
Н-6. В раствор трихлорида железа погрузили медную пластинку. После полного растворения пластинки молярная концентрация исходной соли уменьшилась в 1,5 раза. В раствор внесли еще одну медную пластинку такой же массы, что и первая. Во сколько раз молярная концентрация трихлорида железа будет отличаться от молярной концентрации дихлорида меди после полного растворения второй пластинки [см. 1]?
Н-7. Магниевую пластинку погрузили в 40%-й раствор дихлорида цинка массой 68 г. Через некоторое время масса пластинки изменилась на 4,1 г. Во сколько раз изменилось содержание (по массе) дихлорида цинка в растворе? Во сколько раз изменилась массовая доля дихлорида цинка в растворе (изменением объема раствора можно пренебречь) [5]?
Н-8. В раствор дихлорида меди массой 130 г погрузили железную пластинку. Спустя некоторое время масса раствора уменьшилась на 3,2 г. Определите массу ионов меди, перешедших из раствора в виде металла на железную пластинку [6].
Н-9. В стакан, содержащий 200 г 10%-го раствора соляной кислоты, погрузили цинковую пластинку. После того как ее вынули, промыли и просушили, оказалось, что ее масса на 6,5 г меньше, чем до начала реакции. Определите концентрацию кислоты в оставшемся растворе [см. 3].
Н-10. В раствор сульфата меди(II) массой 248 г поместили порошок магния массой 20 г. Через некоторое время металлический осадок собрали и высушили. Его масса составила 28 г. Определите массовую долю сульфата магния в полученном растворе [см. 1].
Н-11. В 500 г раствора серной кислоты полностью растворился алюминий массой 8,1 г. После этого в раствор внесли магниевые опилки, часть которых растворилась, а массовая доля сульфата алюминия при этом в образовавшемся растворе стала 9,9%. Найдите массовую долю серной кислоты в исходном растворе [см. 5]. (Считайте, что магний не вытесняет алюминий из его сульфата Al2(SO4)3.)
Н-12. Две одинаковые цинковые пластинки массой по 10 г каждая были погружены одновременно в два раствора: один c солью неизвестного двухвалентного металла, а второй – содержащий соль железа(II). Спустя некоторое время пластинки были извлечены из растворов, промыты, просушены и взвешены. Масса первой из них оказалась равной 17,1 г, а второй – 9,55 г. Известно также, что в реакции вступили одинаковые количества веществ исходных металлов. Дайте объяснение всем происходившим процессам и определите металл, входивший в состав неизвестной соли [7].
Н-13. Цинковую пластинку погрузили в раствор сульфата некоторого металла. Масса раствора равна 50 г. Металл в сульфате находился в степени окисления +2. Через некоторое время масса пластинки увеличилась на 1,08 г. При этом массовая доля сульфата цинка в растворе стала равна 6,58%. Какой металл выделился на пластинке [см. 1]?
Н-1. Надо воспользоваться рядом стандартных электродных потенциалов и найти значения потенциалов цинкового, водородного, никелевого и магниевого электродов. Поскольку стандартный электродный потенциал цинкового электрода меньше стандартных потенциалов водорода и никеля, то цинк будет взаимодействовать с растворами соляной кислоты и сульфата никеля.
Потенциал магниевого электрода меньше, чем цинкового, поэтому цинк не будет взаимодействовать с растворами солей магния.
Н-2. Вследствие гидролиза хлорида цинка его раствор имеет кислую реакцию среды:
Zn 2+ + HOH = ZnOH + + H + .
Если в этот кислый раствор погрузить металлический цинк, то протекает следующая реакция:
Zn 0 + 2H + = Zn 2+ + H2,
приводящая к растворению цинка.
По этой же причине цинк будет растворяться в растворах трихлорида алюминия и трихлорида железа, которые вследствие гидролиза имеют кислый характер:
Al 3+ + HOH = AlOH 2+ + H + ,
Fe 3+ + HOH = FeOH 2+ + H + .
Кроме того, в растворе трихлорида железа возможно и такое окислительно-восстановительное взаимодействие:
Zn 0 + 2Fe 3+ = Zn 2+ + 2Fe 2+ .
Хлориды калия и бария в растворах не гидролизуются, поэтому цинк в них не растворяется.
Н-3. m(CuSO4) = 28,8 г.
m(Sn) = 4,76 г;
Н-6. Молярные концентрации солей будут равны.
Н-7. Cодержание ZnCl2 в растворе по массе уменьшится в 2 раза; массовая доля уменьшится в 1,88 раза.
Если в этом уравнении мы обозначим массу железа, перешедшего в раствор в виде ионов, через m(Fe), а массу меди – через m(Cu), то изменение массы пластинки можно записать так:
m = m(Cu) – m(Fe).
Количества вещества меди и железа равны (см. уравнение реакции):
m(Cu)/M(Cu) = m(Fe)/M(Fe). (а)
Массу меди выразим через массу железа:
m(Cu) = (m(Fe) + 3,2) г
и подставим в уравнение (а):
(m(Fe) + 3,2)/М(Cu) = m(Fe)/М(Fe).
Отсюда m(Fe) = 22,4 г, следовательно, m(Cu) = 25,6 г.
Н-9. (HCl) = 6,16%.
Н-12. Поскольку масса 1-й пластинки увеличивается, значит, M(M) > M(Zn). Железо выделяется на 2-й пластинке, и она становится легче, т.к. M(Fe) M(Zn). Неизвестный металл М – свинец.
Н-13. Уравнение этой реакции можно записать так:
Zn + MSO4 = ZnSO4 + M.
Если масса пластинки увеличилась на 1,08 г, то масса раствора в целом уменьшилась на столько же. Найдем массу раствора после окончания реакции:
m(р-ра) = 50 – 1,08 = 48,92 г.
Масса образовавшегося сульфата цинка:
m(ZnSO4) = m(р-ра)•(ZnSO4) = 48,92•0,0658 = 3,22 г.
Количество вещества сульфата цинка:
(ZnSO4) = m(ZnSO4)/M(ZnSO4) = 3,22/161 = 0,02 моль.
Из уравнения реакции следует:
(М) = (Zn) = (ZnSO4) = 0,02 моль.
Следовательно, в раствор перешло 0,02 моль цинка, а на пластинке осадилось такое же количество вещества металла М.
Масса цинка, перешедшего в раствор:
m(Zn) = (Zn)•М(Zn) = 0,2•65 = 1,3 г.
Масса металла, осевшего на пластинке:
m(М) = m(Zn) + 1,08 = 1,3 + 1,08 = 2,38 г.
Молярная масса неизвестного металла:
М(М) = m(М)/n(М) = 2,38/0,02 = 119 г/моль.
Неизвестный металл М – олово.
1. Хомченко Г.П., Хомченко И.Г. Задачи по химии для поступающих в вузы. М., 1994, 302 с.
2. Оржековский П.А., Медведев Ю.Н., Чураков А.В., Чуранов С.С. Всероссийская химическая олимпиада школьников: Книга для учителя. М., 1996, 184 с.
3. Чуранов С.С. Химические олимпиады в школе. М., 1982, 191 с.
4. Сборник задач по химии (авторский коллектив «Дельта»). М., 1991, 48 с.
5. Воловик В.Б., Крутецкая Е.Б. Неорганическая химия. Упражнения и задачи. СПб., 1999, 136 с.
6. Химия. Пособие для подготовки к вступительному экзамену (химико-фармацевтический институт). Сост. Н.Н.Беляев, Н.Г.Тихомирова. Л., 1991, 47 с.
7. Польские химические олимпиады (сборник задач). Под ред. С.С.Чуранова. М., 1980, 532 с.
Дидактический материал: "Решение расчетных задач на погружение металлической пластинки"

Предлагаемый дидактический материал может быть использован на уроках химии и во внеурочных или кружковых занятиях, как самостоятельный инструментарий, так и может быть интерпретирован и включен в другие разработки. Материал может быть использован на второй и третьей ступени обучения, как на базовых, так и на профильных занятиях.
Задачи с погружением металлической пластинки в раствор соли П р и м е р 1. Цинковую пластинку массой 22,5 г погрузили в раствор нитрата свинца (II). Через некоторое время масса пластинки стала равной 25,34 г. Определите массу цинка, который перешел в раствор в виде ионов, и массу свинца, который осел на пластинке. Решение. С п о с о б 1. 1. Цинк находится в ряду активности металлов левее свинца и вытесняет свинец из раствора его соли. 1 моль Zn + Pb(NO3)2 = Zn(NO3)2 + Pb↓ 1 моль М = 65 г/моль М = 207 г/моль m = 65 г 2. Находим изменение массы (∆ m1) цинковой пластинки, вытекающее из уравнения реакции. Из уравнения реакции следует, что при переходе в раствор (растворении) цинка количеством вещества 1 моль на пластинке осаждается свинец количеством вещества 1 моль (ν (Zn) = ν (Pb)). Это приводит к увеличению массы (∆ m1) цинковой пластинки: m = 207 г ∆ m1 = m (Pb) – m (Zn) = 207 – 65 = 142 (г). 3. Находим изменение массы (∆ m2) цинковой пластинки, исходя из условия задачи: ∆ m2 = 25,34 – 22,5 = 2,84 (г). 4. Вычисляем массу цинка, который перешел в раствор, и массу свинца, который осел на пластинке. По уравнению реакции ν (Zn) = ν (Pb), поэтому изменение количества веществ (∆ ν) цинка и свинца будет равным: m 2 m 1 84,2 142 = 0,02 (моль). ∆ ν (Zn, Pb) = Масса цинка, перешедшего в раствор, равна: m (Zn) = ν (Zn) ∙ M (Zn) = 0,02 ∙ 65 = 1,3 (г). Масса свинца, который осел на пластинке: m (Pb) = ν (Pb) ∙ М (Pb) = 0,02 ∙ 207 = 4,14 (г). С п о с о б 2. 1, 2, 3 пункты те же, что и в 1м способе. 4. Находим массу цинка, который перешел в раствор: при растворении 65 г Zn – ∆ m пластинки 142 г, при растворении х г Zn – ∆ m пластинки 2,84 г. Отсюда ; x 142 84,265 142 84,2 = 1,3 (г). 65 x 5. Находим массу свинца, который осел на пластинке: при осаждении 207 г Pb изменение массы пластинки составляет 142 г, при осаждении х г Pb изменение массы пластинки составляет 2,84 г; отсюда 207 x 84,2 142 142 84,2 207 ; x = 4,14 (г). П р и м е р 2. Цинковую пластинку массой 40 г погрузили в раствор массой 680 г с массовой долей нитрата серебра 4 %. Вычислите массу пластинки после окончания реакции. Решение. 1. Как следует из ряда активности металлов, цинк вытесняет серебро из раствора его соли: Zn + 2AgNO3 = 2Ag + Zn(NO3)2 1 моль 2 моль 2 моль М = 65 г/моль М = 170 г/моль М = 108 г/моль 2. Определяем массу нитрата серебра в растворе: m(AgNO3) = m (рра) ∙ (AgNO3) = 680 ∙ 0,04 = 27,2 (г). 3. Определяем количество вещества AgNO3: (m (M ) AgNO 3 ) AgNO 3 2,27 170 = 0,16 (моль). ν (AgNO3) = 4. Рассчитываем массу цинка, вступившего в реакцию. По уравнению реакции: ν (Zn) : ν (AgNO3) = 1 : 2, ν (Zn) = 2 m (Zn) = ν (Zn) ∙ M (Zn) = 0,08 ∙ 65 = 5,2 (г), то есть из цинковой пластинки массой 40 г в раствор перейдет в виде ионов 1 ν (AgNO3) ν (Zn) = 0,08 (моль), 5,2 г, поэтому масса пластинки уменьшится и составит (40 г – 5,2 г). 5. Вычисляем массу серебра, которая осела на пластинке. По уравнению реакции: ν (AgNO3) : ν (Ag) = 1 : 1, ν (Ag) = ν (AgNO3) ν (Ag) = 0,16 (моль), m (Ag) = ν (Ag) ∙ M (Ag) = 0,16 ∙ 108 = 17,28 (г). 6. Находим массу пластинки после окончания реакции: m (пластинки после реакции) = (40 – 5,2 + 17,28) = 52,08 (г). Реши самостоятельно: 1. Железную пластинку массой 61,26 г погрузили в раствор сульфата меди (II). Через некоторое время масса пластинки стала равной 62,8 г. Определите массу меди, которая осела на пластинке. (12,32 г.) 2. Железную пластинку погрузили вначале в разбавленную серную кислоту, а затем – в раствор сульфата меди (II). При этом выделился газ объемом 1,12 л (н. у.), а масса пластинки увеличилась на 2,4 г. Определите, сколько всего граммов железа прореагировало. (19,6 г.) 3. Никелевая пластинка массой 15 г опущена в раствор хлорида золота (III). Через некоторое время ее масса стала равной 15,651 г. Определите массу прореагировавшего хлорида золота (III). (1,82 г.) 4. В раствор сульфата меди (II) массой 248 г поместили порошок магния массой 20 г. Через некоторое время металлический осадок собрали и высушили. Его масса составила 28 г. Определите массовую долю сульфата магния в полученном растворе. (10 %.) 5. Железную пластинку массой 20,4 г опустили в раствор сульфата меди (II). Какая масса железа перешла в раствор к моменту, когда масса пластинки стала равной 22 г? (11,2 г.) 6. Цинковую пластинку массой 10 г опустили в раствор сульфата меди (II). После окончания реакции, когда вся медь выделилась на пластинке, ее масса стала равной 9,9 г. Определите массу сульфата меди (II) в исходном растворе. (16 г.) 7. Медную пластинку массой 40 г выдержали некоторое время в растворе нитрата ртути (II). Масса пластинки возросла до 45,48 г. После этого пластинку нагрели до постоянной массы без доступа воздуха. Определите окончательную массу пластинки. (37,46 г.) 8. Цинковую пластинку поместили в раствор сульфата некоторого двухвалентного металла. Масса раствора равна 49,457 г. Через некоторое время масса пластинки увеличилась на 0,537 г. Массовая доля сульфата цинка в этом растворе стала равной 3,29 %. Определите, какой металл выделился на пластинке. (Олово.) 9. Железную пластинку массой 5 г опустили в раствор объемом 50 мл ( = 1,2 г/мл) с массовой долей сульфата меди (II) 15 %. Когда пластинку вынули из раствора, то масса ее составила 5,16 г. Вычислите массу меди, которая осела на пластинке, и определите массовую долю (%) сульфата меди (II) в оставшемся растворе. (1,28 г; 9,67 %.) 10. Чтобы посеребрить медное изделие массой 10 г, его опустили в раствор массой 250 г с массовой долей нитрата серебра 46 %. Когда изделие вынули из раствора, то содержание нитрата серебра в растворе уменьшилось на 17 %. Определите массу изделия. (18,74 г.)
Цинковую пластинку поместили в раствор сульфата некоторого двухвалентного металла масса раствора

Цинковую пластинку поместили в 200 г 13,6 % раствора нитрата серебра (I) и извлекли, когда общее число ионов металлов в растворе стало равным 7,224·10²². Найти объём 14,04 % раствора хлорида натрия плотностью 1,09 г/мл, необходимый для полного осаждения ионов серебра (I) из раствора, полученного после извлечения пластинки.
При прокаливании смеси нитрата натрия и нитрата металла (II), проявляющего в соединениях постоянную степень окисления, получено 6,54 г смеси твёрдых оксида и соли, выделилась смесь газов объёмом 4,032 л (н/у) и плотностью 1,845 г/л. Установить металл в составе исходной смеси нитратов.
В каком массовом отношении необходимо смешать 90 % раствор
серной кислоты и 30 % олеум для получения безводной серной кислоты?
Имеется смесь кальция, оксида кальция и карбида кальция в молярном отношении 1:3:4. Масса этой смеси составляет 35 г. Найти массу воды, которая может вступить в реакцию с этой смесью.
При пропускании через 200 г 5 % раствора пероксида водорода некоторого количества хлора масса раствора увеличилась на 3,9 г. Найти массовые доли веществ в полученном растворе.
Фторид фосфора (V) внесли в 2 % раствор ортофосфорной кислоты, получив раствор, где массовая доля фтороводорода в 4,9 раза меньше массовой доли ортофосфорной кислоты. К этому раствору добавили 2020 г раствора избытка гидроксида стронция, выпал осадок массой 29 г. Найти массу конечного раствора.
Для окисления 3,19 г галогенида цинка в кислой среде требуется 10 мл
0,4 М раствора перманганата калия. Установить галоген в составе исходной соли.
Дигидрат сульфита щелочного металла обработали избытком пероксида водорода, из полученного раствора выделили соль, масса которой оказалась в 1,115 раз меньше массы исходного кристаллогидрата. Установить металл в составе солей.
В реактор ввели смесь сернистого газа и кислорода с равными массовыми долями. Как изменится давление в реакторе (температура постоянная) при 60 % выходе продукта?
К раствору, содержащему 29,9 г смеси нитрата хрома (III) и одного из нитратов железа, постепенно добавляли насыщенный раствор гидроксида натрия. Максимальная масса полученного осадка — 14,15 г. При добавлении избытка щёлочи масса осадка уменьшилась до 9 г и перестала изменяться при ещё большем избытке щёлочи. Установить состав исходного нитрата железа.
К 50 % раствору азотной кислоты добавили оксид меди (Ι), получив смесь двух газов плотностью 1,331 г/л при 98 кПа и 40 °C. В полученном растворе молярные концентрации кислоты и соли сравнялись. Чему равны их массовые доли?
При пропускании через слабощелочной раствор перманганата калия смеси этена и пропена получили 1,74 г осадка. Полученные спирты выделили в чистом виде и обработали 1,15 г натрия. Найти объём выделившегося газа (н/у).
При обработке при нагревании смеси железной окалины и оксида меди (I) избытком водорода масса твёрдого продукта уменьшилась на 1,76 г по сравнению с массой исходной смеси, а при обработке исходной смеси оксидов избытком кислорода её масса возрасла на 0,64 г. Найти массу исходной смеси.
При электролизе 120 г 12,5 % водного раствора иодида натрия с инертными электродами и применением полупроницаемой мембраны на катоде при н/у получено 448 мл газа, из анодного пространства продукт окисления полностью удалили, мембрану извлекли. Через полученный раствор пропустили углекислый газ, образовавшийся при прокаливании 8 г гидрокарбоната калия. Найти массовые доли веществ в конечном растворе.
Образец кристаллогидрата динитрата меди разделили на части в отношении 1:2. Первую часть прокалили до постоянной массы, получив 4 г твёрдого остатка. Вторую часть растворили в 41,92 г воды и провели электролиз раствора с инертным анодом до полного выделения меди на катоде, получив раствор с массовой долей растворённого вещества 23,42 %. Установить формулу кристаллогидрата.
520 г 16,1 % раствора сульфата цинка подвергли электролизу, процесс остановили когда объёмы газов, выделившихся на аноде и катоде стали равны. Массовая доля соли снизилась до 10,3 %. К получившемуся раствору добавили 212 г 10 % раствора карбоната натрия. Найти массовую долю сульфата цинка в итоговом растворе.
Белавин Иван Юрьевич «100 баллов по химии»
27. При прокаливании смеси нитратов двух металлов (I) суммарный объем выделившихся при этом газов оказался равным 8,96 л (н. у.). При обработке твердого остатка водой часть его растворилась. Нерастворимое в воде вещество обработали избытком концентрированной азотной кислоты. Объем выделившегося газа бурого цвета составил 4,48 л (н. у.). Определите исходные соли, если масса одного из нитратов равна 34,0 г, а второго – 20,2 г.
28. Соль А, окрашивающая пламя в желтый цвет, при нагревании до 300 °С плавится, при дальнейшем нагревании переходит в соль другой кислоты, одновременно выделяется газ Б, в котором очень быстро сгорает уголь. При нагревании соли В выделяется такой же объем газа Б, но наряду с этим образуется 40 г оксида, содержащего 80 % металла (II), и выделяется газ бурого цвета. При нагревании с концентрированной серной кислотой кристаллов как соли А, так и соли В отгоняется жидкость, в которой растворяется медь. Определите состав и количества исходный солей А и В.
Читайте также:
