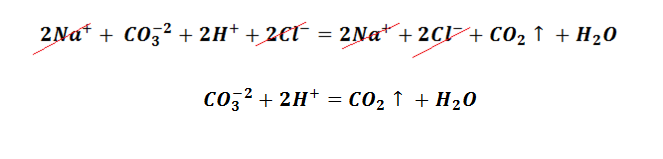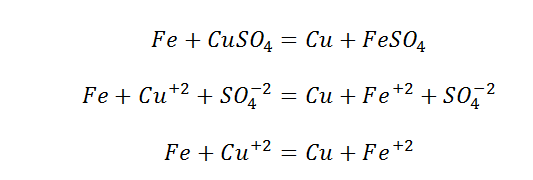Цвета ионов металлов в растворах
Обновлено: 17.05.2024
Вопросы части С объединяют знание всех тем химии. В случае Задания С2 ЕГЭ по химии — знание всех классов неорганических веществ и их качественных реакции.
Дается конкретный химический эксперимент, ход которого нужно описать химическими реакциями.
Для таких реакции обычно предлагаются какие-то внешние проявления — выделения газа, выпадение осадка или изменение окраски раствора.
Таблица качественных реакций для газов
2) взаимодействие металлов с азотной кислотой (концентрированной)
3) разложение нитратов
Взаимодействие активных металлов с концентрированной серной кислотой:
4Mg + 5H2SO4 = 4MgSO4 + H2S + 4H2O
Газ с резким запахом. Растворимый в воде
1) взаимодействие серасодежащих веществ с кислородом
2) взаимодействие некоторых металлов с концентрированной серной кислотой
1) горение азотсодержащих веществ;
2) разложение нитрита аммония:
Газы, поддерживающие горение:
(иногда, для озона — запах свежести);
Таблица качественных реакций для щелочных металлов:
Т.к. все соединения щелочных металлов хорошо растворимы в воде, то их определяют по цвету пламени:
(указан так же цвет пламени некоторых щелочно-земельных металлов)
Таблица качественных реакций
— цвета осадков
Осадки белого цвета
Качественная реакция
Белый творожистый
нерастворимый в воде;
нерастворимый в HNO3
качественная реакция на соли серебра;
качественная реакция на хлорид-ионы;
Белый осадок
нерастворимый в кислотах
качественная реакция на соли бария;
качественная реакция на сульфат-ионы;
образуется при пропускании газа без цвета с резким запахом через известковую воду;
растворяется при пропускании избытка газа;
растворяется в кислотах
растворение в кислотах:
CaSO3 + 2H + → SO2↑ + H2O + Ca 2+
образуется при добавлении щелочи;
растворяется в избытке щелочи
избыток щелочи : Al(OH)3 + NaOH =Na[Al(OH) 4 ];
образуется при пропускании газа без цвета и запаха через известковую воду;
растворение в кислотах:
Осадок светло-желтого цвета
(осадок кремового цвета)
образуется при приливании AgNO3;
нерастворим в HNO3;
качественная реакция на бромид-ионы;
(качественная реакция на соли серебра);
Осадок желтого цвета
качественная реакция на иодид-ионы;
растворим в кислотах;
Осадки коричневых цветов
Качественная реакция
Осадок бурого цвета
образуется при взаимодействии с растворами щелочей;
качественная реакция на соли железа
Осадки синих и зеленых цветов
Осадки зеленого цвета
Осадок голубого цвета
(осадок синего цвета)
образуется при взаимодействии с растворами щелочей
качественная реакция на соли меди ( II)
Осадок синего цвета
образуется при взаимодействии с раствором красной кровяной и желтой кровяной соли
качественная реакция на соли железа ( II) — с красной кровяной солью;
качественная реакция на соли железа ( III) — с желтой кровяной солью;
Осадки черного цвета
Осадок черного цвета
Образуется при взаимодействии с сульфидами или с H2S
качественная реакция на сульфид-ионы
Еще на эту тему:
а какого цвета осадок тетрагидроксоалюмината натрия?
а это не осадок, это растворимое вещество
Любой осадок возможно растворим другим веществом. В данной среде вещество ведет себя пассивно от того и осаждается.
порода, до этого промытая кислотами, была залита мною аптечным йодом и прокипела в нём целую ночь. После остывания была добавлена вода, раствор отстоялся и был декантирован. Раствор представляет собой очень тёмный, чёрно-коричневый золь. В луче фонаря видна мельчайшая, не оседающая, не фильтрующаяся пыль. При добавлении в золь соляной к-ты выпадает красно-коричневый осадок, а раствор светлеет до тёмно красного. В растворе появляется свободный йод обнаруживаемый крахмалом, до прибавления солянки йод не обнаруживался. Так вот, выпавший осадок не растворяется ни в кислотах, ни в щелочах, не реагирует с хлором, растворить его больше ни в чём не получается, на частицы породы уже не похож. Напоминает по цвету осадок смеси гидроксидов железа II и III, однако нерастворим в кислотах. Что это может быть, хотя бы класс соединения узнать? Подскажите пожалуйста.
напишите хотя бы примерно что за порода…
Это глинистая порода светло коричневого цвета. После травления указанной породы смесью соляной к-ты с гипохлоритом натрия был получен жёлтый раствор. Раствор был нейтрализован и осаждён гидрокарбонатом натрия, осадок отправлен на спектральный анализ, вот результат в массовых долях:
13Al 5.420±0.061
14Si 1.136±0.023
15P 0.597±0.019
16S 0.279±0.010
17Cl 77.974±0.066
20Ca 5.778±0.014
22Ti 0.157±0.017
26Fe 8.506±0.026
29Cu 0.152±0.002
Да, результат более чем странный, но ведь лаборатория анализ делала! В общем, эта же порода (поскольку растворилась лишь незначительная, незаметная на глаз её часть) была промыта водой и обработана указанным выше способом. Больше ничего не знаю))) Подскажите хотя бы возможные варианты полученного осадка.
После обработки смесью гипохлорита и соляной все указанные элементы должны были перейти в раствор. После реакции с гидрокарбонатом могло получиться:
Al(OH)3, CaCO3, Ca(OH)2, Ti(OH)2, возможно, Ti(OH)CO3, Fe(OH)2, Fe(OH)3, Cu(OH)2, возможно очень небольшие кол-ва карбонатов, хотя, после промывания водой они должны были раствориться
Дело в том, что полученный раствор после травления солянкой с гипохлоритом был декантирован с породы и только тогда обработан гидрокарбонатом, там действительно могли образоваться указанные вами осадки хоть это и противоречит результатам лаб. анализа. Но не в этом дело. Состав этого раствора я привёл лишь для понимания какие элементы могут там содержаться. Сама порода была промыта водой и затем обработана аптечным йодом, как я писал ранее в первом посте, вот осадок полученный после йода меня интересует.
Указанные осадки как раз по составу соответствуют анализу, ну да ладно. Смотрите по таблице растворимости, что дает с йодом осадок
Распознавание неорганических веществ
Мы знаем, что многие химические элементы добывают из минералов. Прежде чем понять, что есть в минерале, нужно это определить. К тому же, многие химические вещества похожи друг на друга, что затрудняет задачу. Оказывается, существуют реакции, идущие только с определенными элементами. Такие реакции называются качественными. В этой статье рассмотрим основные качественные реакции на ионы неорганических соединений.
План урока:
Основные понятия
Качественная реакция – это реакция, обладающая определенными признаками для того или иного соединения. К таким процессам предъявляется ряд требований: низкий порог чувствительности, специфичность, селективность.
Определять можно ионы. Это заряженные частицы. Если ион заряжен положительно – это катион, если отрицательно – анион. Ионы могут быть простыми и сложными, но у каждого есть специфическая качественная реакция.
Индикаторы
Индикаторы – вещества, которые дают специфический продукт реакции (осадок, газ, соль определенного цвета) с тем или иным ионом.
Определять можно не только конкретное соединение, но и класс, к которому оно относится. Одним из первых индикаторов являются индикаторы среды: фенолфталеин, метилоранж и лакмус. Молекулы этих веществ меняют свою конфигурацию в зависимости от кислотности раствора, на чем основана их индикаторная значимость.
В лабораториях и на производстве часто используют не сам раствор, а бумажку, пропитанную им – индикаторную бумагу. Существует несколько типов таких бумаг:
- Универсальная;
- Фенолфталеиновая;
- Лакмусовая;
- Свинцовая и т.д.
Для каждого вида индикаторных бумажек есть шкала цвета, по которому можно определить значение того или иного результата.
Распознавание катионов щелочных металлов
Для некоторых ионов есть несколько способов их идентификации. Например, ионы щелочных металлов определяются сухим способом – окрашиванием пламени и реакциями в растворах.
Каждый ион щелочного металла окрашивает пламя в определенный цвет:
- натрий – ярко-желтый,
- калий – розово-фиолетовый,
- литий – карминово-красный,
- рубидий – темно-фиолетовый.
Для определения наличия катиона щелочного металла можно провести качественную реакцию. Для каждого катиона используется определенный реактив.
Таблица. Характеристика качественных реакций на ионы щелочных металлов.
Распознавание ионов щелочноземельных металлов
Щелочно-земельные металлы расположены во второй группе таблицы Менделеева. Они, так же, активны, но меньше щелочных. Их распространенность в природе намного выше. К этим металлам относятся: бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba), радий (Ra).
Раньше первые два металла не относили к группе щелочно-земельных. Последние научные исследования подтвердили их принадлежность к этому ряду.
Эти металлы можно определять окрашиванием пламени, но различить правильный оттенок у некоторых из них довольно трудно:
- Be – красный;
- Mg – ярко-белый (сильное выделение тепла);
- Ca – оранжево-красный;
- Sr – карминово-красный;
- Ba – желтовато-зеленый;
- Ra – темно-красный.
Определение катионов бериллия
Бериллий имеет специфическое строение атома. Его электронная конфигурация больше свойственная инертным газам. Обычных химических реакций для определения этого катиона нет. Бериллий определяют электрометрическим титрованием. При этом, производится титрование (по каплям) бериллия фторидом аммония в кислой среде. Бериллий образует аквафторокомплексы [BeF4]2 - , удерживая до четырех молекул воды.
Еще одним инновационным способом определения бериллия является нефелометрический метод с применением гидроксида аммиака. При этом получают мутные спеси с дальнейшим определением оптической плотности.
Описанные методы основаны не на химической реакции, а на процессе образования комплексных соединений.
Определение катионов магния
Для определения магния используют сильные щелочи, карбонат аммония или гидрофосфат натрия в присутствии солей аммония.
В первых двух случаях выпадает белый аморфный осадок. Его кристаллы настолько малы, что практически не оседаю на дно, оставаясь взвешенными в водном растворе.
Во втором случае образуется, так же, белый осадок, но крупнокристаллический:
Определение катионов кальция
Для определения кальция чаще всего используют угольную или сернистую кислоту. Образующиеся соли белого цвета и не растворимы в вод. При этом, они хорошо растворимы в других кислотах:
Еще один способ – микрокристаллоскопическая реакция с серной кислотой. Образуются белые кристаллы игольчатой формы.
Определение ионов стронция
Стронций образует белые нерастворимые осадки с серной кислотой, карбонатом аммония:
Также, для индикации используют оксалат аммония. Образующийся белый осадок растворяется во всех кислотах:
Одной из самых ярких реакций на ион стронция является реакция с родизонатом натрия. При этом образуется красно-бурый осадок:
Определение катионов бария
В растворе ионы бария определяют с помощью серной кислоты или ее растворимых солей.
При реакции образуется белый нерастворимый в кислотах осадок. Это микрокристаллоскопическая реакция, можно рассмотреть форму кристаллов под микроскопом.
Определение ионов меди
Для обнаружения ионов меди в растворе соли в него добавляют концентрат аммиачного раствора.
При этом, медь образует комплексную соль ярко-синего цвета.
еще один способ - реакция с гидроксидом натрия. В результате реакции образуется синий студенистый осадок.
При его нагревании происходит разложение с образованием черного оксида меди.
Медь можно определить сухим способов в пламени горелки. Она приведет к окрашиванию пламени в зеленый цвет.
Определение ионов двух- и трехвалентного железа
Железо имеет два основных иона: Fe 2+ и Fe 3+ .
Ионы Fe 3+ можно идентифицировать с помощью трех реактивов. Первый из них – щелочь. При этом образуется красно-бурый нерастворимый осадок:
FeCl₃ + 3NaOH = Fe(OH)₃↓+ 3NaCl.
Другой вариант – желтая кровяная соль K₃[Fe(CN)₆], при взаимодействии с которой трехвалентное железо образует комплексное соединение синего цвета.
Третий вариант – роданид калия (ядовитое вещество). При реакции образуется красная густая соль. Это соединение часто использовали в кинематографе в качестве искусственной крови.
Для определения Fe 2+ используют красную кровяную соль K₄[Fe(CN)₆]. В результате образуется соединение синего цвета (берлинская лазурь).
Определение катионов аммония
Катион аммония необычен тем, что состоят из молекулы аммиака с присоединенным за счет донорно-акцепторной связи водородом. Так, ион имеет вид NH4 + . Соли аммония применяются в сельском хозяйстве, медицине.
Определить наличие этого катиона можно с помощью индикаторной бумаги. Над раствором соли аммония она синеет.
Значения цветов индикаторной бумаги
Гидроксид аммония – слабое соединение, которое распадается на аммиак и воду. Аммиак обладает характерным запахом (нашатырный спирт), по которому, так же, определяют наличие катиона аммония.
Качественная реакция на катион аммония: NH4Cl + NaOH → NaCl + NH3↑ + H2O
Другой способ индикации – с помощью реактива Несслера– K2[HgI4]. При взаимодействии с солями аммония образуется бурый цвет:
Реакция очень чувствительная. При малом содержании катионов аммония, цвет будет желтый.
Качественные реакции на анионы
Сульфат-ион и сульфит-ион
Ионы серной и сернистой кислот дают одинаковую реакцию с растворимыми солями бария – образуется белый осадок:
Различить их можно добавлением к полученному раствору азотной кислоты. Осадок сульфита бария растворится с образованием газа, а сульфата – нет.
Хлорид-, бромид-, йодид-ион
Для определения этих ионов используют один реактив – нитрат серебра. Во всех трех случаях выпадает творожистый осадок, но цвет у каждого – свой. Фторид-ион осадок с этим реактивом не дает.
Для индикации фторида используют нитрат кальция. При этом образуется белый осадок:
Карбонат-ион
Карбонат-ион определяется в две стадии. Первая – получение угольной кислоты:
Эта кислота слабая и быстро диссоциирует с образованием воды и углекислого газа.
Вторая реакция – пропускание выделяемого газа через известковую воду. Углекислый газ приводит к ее помутнению из-за образования нерастворимого карбоната кальция:
Фосфат-ион
Фосфат-ион определяется с помощью нитрата серебра. При взаимодействии образуется ярко-желтый осадок:
Особенности протекания реакций в растворе
Химия настолько уникальная и удивительная наука, что во время проведения опытов, иногда, кажется, что происходят чудеса. Сливая два раствора, можем наблюдать, как бурно выделяется газ, или меняется цвет, или выпадает яркий осадок. Однако бывают и такие случаи, что реакция не происходит. А выяснить причину этому поможет наш урок, в котором рассмотрим реакции ионного обмена.
Химические реакции, в отличие от физических, характеризуются образованием новых веществ. Судить об их получении, мы можем, наблюдая изменение окраски, либо выделение газа или осадка.
Вспомним, что происходит с веществом, когда оно попадает в воду. Оно распадается на ионы. Тем не менее, этот процесс характерен не для всех веществ, а только для сильных электролитов, к которым относятся растворимые соли и кислоты, а также щёлочи.
Также необходимо вспомнить, какие реакции относятся к типу обмена.
Судить произошла реакция или нет, мы можем, если будет выполняться хотя бы одно из условий.
Условия протекания реакций между ионами сложных веществ.
Рассмотрим подробно каждое условие и составим алгоритм написания уравнений.
Выпадение осадка является подтверждением того, мы визуально видим, что реакция произошла. Составим уравнение между щёлочью – гидроксидом калия и солью – сульфатом меди (II). Запишем молекулярное уравнение.
Выполняя данный опыт, Вы могли бы наблюдать образование осадка голубого цвета.
Чтобы понять, какое вещество выпало в осадок, воспользуемся таблицей растворимости, а также составим полное ионно-молекулярное уравнение, которое отображает все частицы, находящиеся в растворе, с учётом коэффициентов.
Таким образом, KOH, K2SO4 и CuSO4 – это сильные электролиты, которые запишем в ионном виде. Cu(OH)2 – нерастворимое вещество, будет в молекулярном виде со стрелкой ↓. Также обращаем внимание, что перед щёлочью КОН находится коэффициент 2. Значит, образуется по два моля ионов К + и ОН − .
При написании уравнений реакций, не забываем о законе сохранения вещества. Поэтому количество атомов, а также ионов, до реакции и после должны быть равны.
Следует отметить, что в полном ионно-молекулярном уравнении, слева и справа, имеются одинаковые частицы, их можно сократить.
Эти ионы при взаимодействии не образуют вещества, поэтому находятся в растворе в свободном виде как K + и SO4 −2 .
Сокращённая реакция ионного обмена отображает суть химического процесса, а именно, между какими частицами происходит реакция.
Следственно, Cu(OH)2 будет осадком в растворе состоящем из ионов SO4 2− и К + .
Вторым из условий является выделение газа. Эту реакцию Вы наблюдаете, когда гасите соду кислотой, не важно, какой уксусной, лимонной, яблочной, или же при добавлении к ней кефира, результат будет один и тот же, образование пузырьков углекислого газа. Для примера возьмём взаимодействие соды и соляной кислоты. Составим молекулярное уравнение.
Возникает закономерный вопрос, в уравнении отсутствует газ, однако раствор «шипит». Чтобы разобраться в этой проблеме, следует вспомнить, что угольная кислота относится к слабым электролитам и происходит выделение углекислого газа, а также образование молекулы воды. Поэтому полное молекулярно-ионное уравнение приобретает вид.
После сокращение одинаковых частиц левой и правой части, получаем сокращённое ионное уравнение.
Именно по причине наличия ионов водорода, сода «шипит» во всех кислотах.
И к третьему условию относится образование слабого электролита, зачастую это молекула воды, однако могут получаться и другие вещества. Ярким примером является реакция нейтрализации.
Почему этот тип реакции носит такое название? Рассмотрим на примере взаимодействия оснований КОН и Cu(OH)2 с раствором соляной кислоты.
В каждом случае происходит образование воды. В случае нерастворимых оснований, реакция идёт с образованием растворимой соли.
Уравнение реакции нейтрализации показывает, как два противоположных по свойствам класса неорганических соединений, отдавая по своей частице (Н + и ОН - ), образуют нейтральное вещество Н2О.
Кислоты и их свойства
Если посмотреть на состав этого класса соединений, то абсолютно во всех содержаться ионы водорода.
Следует заметить, что уравнение диссоциации кислот похожи, но отличие будет по кислотному остатку.Рассмотрим на примерах следующих многоосновных кислот –сернойН2SО4 и фосфорной Н3РО4.Характерной особенностью диссоциации многоосновных кислот – это ступенчатая диссоциация. Это означает, что ионы водорода будут отрываться не сразу все (2 или 3), а по одному.
Следствием этого является способность многоосновных кислот образовывать кислые соли.
Рассмотрим химические свойства кислот, за которые отвечают ионы Н + .
Каким образом можно доказать, что неизвестное вещество относится к кислотам. Для этих целей создали индикаторы, которые как настоящие сыщики, ищут ионы Н + или ОН - (в основаниях). Найдя их, они моментально меняют свою окраску. Кислая среда обусловлена наличием Н + .
В реакциях обмена на их место могут стать только ионы металла, поэтому кислоты реагируют со следующими веществами.
Следственно, при реакции кислот с основными оксидами образуется соль и вода.
Атомы металла входят в состав оснований, в результате реакции нейтрализации, аналогично, как и основными оксидами, продуктом реакции является соль (может быть и кислая, и средняя) и вода.
Исходя из этого, кислая соль образуется, если «не хватает» атомов металла, чтобы обменять их на атомы водорода.
Взаимодействие кислот с солями возможно только в случае, когда соль образована слабой или летучей кислотой, а также в продукте будет газ или осадок.
Особенно хочется отметить взаимодействие металлов с кислотами, поскольку это будет реакция замещения со сменой степени окисления. Не все металлы способны реагировать с кислотами, а только те, что стоят в ряду напряжения до водорода и способны его вытеснить.
Действие концентрированных серной и азотной кислот на металлы отличается от их растворов, при этом происходит образование не водорода, а воды и других продуктов. Детально со свойствами азотной кислоты Вы познакомитесь чуть позже, однако сейчас необходимо запомнить, что при реакции с раствором этой кислоты водород не выделяется.
Основания и их свойства
Данный класс веществ характеризуется наличием функциональной группы, которая отвечает за химические свойства, а именно группы ОН - . По растворимости основания делятся на щёлочи (растворимые) и нерастворимые основания. Соответственно они будут отличаться по химическим свойствам. Щелочная среда образуется, если есть свободные ОН - , которые образуются при диссоциации щелочей.
Для щелочей, подобно многоосновным кислотам, характерна ступенчатая диссоциация.
Тем не менее, будет происходить не только взаимодействие щелочей с кислотами, но и нерастворимых оснований. Объяснением этому служит, то, что кислоты практически все растворимы, за исключением силикатной H2SiO3, которая реагирует только со щелочами. Продуктом будет соль (в зависимости от соотношения реагентов средняя, основная или кислая) и вода.
Кислотные оксиды со щелочами образуют соль и воду.
Для нерастворимых оснований эта реакция не характерна, поскольку именно гидроксильная группа реагирует с оксидами.
Амфотерные основания реагируют также с щелочами. Результатом данного взаимодействия будет соль, зачастую комплексная, и вода.
Взаимодействие солей с щелочами приводит к образованию соли либо основания. Также не забываем об условии, что в продукте должен быть либо газ, либо осадок.
Отличительной способностью обладают нерастворимые, а также амфотерные основания. Они при нагревании распадаются на оксиды.
Соли и их свойства
Этот класс веществ состоит из частичек кислоты – кислотного остатка и основания – катионов металла (либо иона аммония NH4 + ). Диссоциация солей всегда идёт в одну стадию.
Если посмотреть на состав соли, то смело можно предположить, что их растворы будут нейтральными. Поскольку нет ионов, которые отвечают за реакцию среды. Однако на деле совсем не так. Лакмус в водном растворе солей может иметь как красную, так и синюю окраску, а также не изменять её. Объяснением этого явления служит их взаимодействие с водой, которое имеет название гидролиз солей. Возьмём, к примеру, три пробирки, в которых содержатся растворы NaCl, ZnCl2 и Na2CO3. И в каждую добавим лакмус. Результаты эксперимента отображены на рисунке.
Запишем суть реакции соли с водой (молекулу Н2О распишем как НОН), с помощью ионно-молекулярных уравнений.
Сокращённое уравнение хорошо иллюстрирует, почему происходит изменение окраски индикатора. Теперь давайте разберёмся, какие соли подвергаются гидролизу.
Именно наличием ионов Н + в растворе соли ZnCl2, а также группы ОН - в солевом растворе карбоната натрия, объясняется изменение окраски индикатора.
Рассмотрим взаимодействие металлов с солями. Чтобы понять принцип их взаимодействия, вспомним ряд активностей металлов.
Данный вид взаимодействия Вы можете наблюдать, выполнив дома опыт (не забываем о разрешении родителей). Вам понадобится раствор медного купороса и скрепка, либо гвоздь.
На поверхности гвоздя выделилась медь в чистом виде. Это окислительно-восстановительная реакция.
Более сильный металл, вытесняет слабый с раствора его соли. Если промоделировать обратную реакцию, а именно положить медную проволоку в раствор соли железа, то не будет никакого взаимодействия. «Силы» у меди не хватит, потеснить железо.
Взаимодействие солей между собой возможно только, если реагенты растворимы, а в продукте будет осадок.
Свойства солей, кислот и оснований, рассмотренных выше, можно объединить в схематическом виде.
Цвета ионов металлов в растворах

ЕГЭ-2023 с Химическим Котом | Степенин и Дацук запись закреплена
Хотите красиво оформить свой конспект по качественным реакциям? Для этого у нас есть классные стикеры:

Ещё основания кобальта имеют интересную окраску от розового до фиолетового в зависимости от способа получения. Судя по ЕГЭ этого года, ожидать можно всего.
Анастасия, да, кобальт красивые окраски дает. По поводу него в ЕГЭ я бы все же поспорила — в спецификации и кодификаторе не упоминается


Можно бледно-розовый цвет у марганца +2 в гидроксиде и солях добавить. Ну, и цвет фосфора. Да, и в моду вошла одновалентная медь, хоть и в таблице растворимости ее нет. Cul, CuCl - белые осадки.
Людмила, подождите, подождите, но ведь в ЕГЭ говорят, что желтый?! или я что-то путаю? в 32 задании я точно видела такие формулировки! желтый осадок В чистом виде — белое кристаллическое вещество, со временем приобретает бурый цвет из-за разложения на медь и иод.Видите - белое. В любом учебнике это написано. А те, кто составил задание, видимо, не знали. Жёлтым осадком всегда называют CuOH.
Людмила, на органике мы брали древний CuCl как катализатор, он был цвета куркумы, весь окислился Екатерина, видать, от древности он потемнел.Екатерина, в Вашем замечательном паблике в этом году вообще все участники проявляют невиданную активность, и вправду воюют. Значит, людям интересны эти вопросы!

Светлана, сдавала учительское ЕГЭ в июне. Попалось ОВР с описанием "признак реакции - белый осадок". CuCl2+KI.
как обнаружить ионы металлов?
Т. к. все соединения щелочных металлов хорошо растворимы в воде, то их определяют по цвету пламени:
Таблица качественных реакций
Осадки белого цвета
Качественная реакция
Белый творожистый
нерастворимый в воде;
нерастворимый в HNO3
Ag+ + Cl- → AgCl↓
качественная реакция на соли серебра;
качественная реакция на хлорид-ионы;
Белый осадок
нерастворимый в кислотах
Ba2+ + SO4 -2 → BaSO4↓
качественная реакция на соли бария;
качественная реакция на сульфат-ионы;
Белый осадок
образуется при пропускании газа без цвета с резким запахом через известковую воду;
растворяется при пропускании избытка газа;
растворяется в кислотах
Сa(OH)2 + SO2 = CaSO3↓ + H2O
избыток SO2: CaSO3↓ + H2O + SO2 = Ca(HSO3)2;
растворение в кислотах:
CaSO3 + 2H+ → SO2↑ + H2O + Ca2+
Белый осадок
образуется при добавлении щелочи;
растворяется в избытке щелочи
Al3+ + 3OH- = Al(OH)3↓
Zn2+ + 2OH- = Zn(OH)2↓
избыток щелочи: Al(OH)3 + NaOH =Na[Al(OH)]4;
избыток щелочи: Zn(OH)2 +2NaOH =Na2[Zn(OH)]4;
Белый осадок
образуется при пропускании газа без цвета и запаха через известковую воду;
растворяется при пропускании избытка газа;
растворяется в кислотах
Сa(OH)2 + CO2 = CaCO3↓ + H2O
избыток CO2: CaCO3↓ + H2O + CO2 = Ca(HSO3)2;
растворение в кислотах:
CaCO3 + 2H+ → CO2↑ + H2O + Ca2+
Осадок светло-желтого цвета
(осадок кремового цвета)
образуется при приливании AgNO3;
нерастворим в HNO3;
Ag+ + Br- → AgBr↓
качественная реакция на бромид-ионы;
(качественная реакция на соли серебра);
Осадок желтого цвета
образуется при приливании AgNO3;
нерастворим в HNO3;
Ag+ + I- → AgJ↓
качественная реакция на иодид-ионы;
(качественная реакция на соли серебра);
Осадок желтого цвета
образуется при приливании AgNO3;
растворим в кислотах;
3Ag+ + PO43- → Ag3PO4↓
Осадки коричневых цветов
Качественная реакция
Осадок бурого цвета
образуется при взаимодействии с растворами щелочей;
Fe3+ +3OH- → Fe(OH)3↓
качественная реакция на соли железа
Осадки синих цветов
Качественная реакция
Осадок голубого цвета
(осадок синего цвета)
образуется при взаимодействии с растворами щелочей
Cu2+ +2OH- → Cu(OH)2↓
качественная реакция на соли меди (II)
Осадок синего цвета
образуется при взаимодействии с раствором красной кровяной и желтой кровяной соли
3Fe2+ + 2[Fe(CN)6]3- → Fe3[Fe(CN)6]2↓
качественная реакция на соли железа (II) — с красной кровяной солью;
4Fe3+ + 3[Fe(CN)6]4-4 → Fe4[Fe(CN)6]3↓
качественная реакция на соли железа (III) — с желтой кровяной солью;
Осадки черного цвета
Качественная реакция
Осадок черного цвета
Образуется при взаимодействии с сульфидами или с H2S
Fe2+ + S2- → FeS↓
Ni2+ + S2- → NiS↓
Cu2+ + S2- → CuS↓
Pb2+ + S2- → PbS↓
Hg2+ + S2- → HgS↓
Ag+ + S2- → Ag2S↓
качественная реакция на сульфид-ионы
Читайте также: