Цвета металлов в химии таблица
Обновлено: 14.05.2024
Вопросы части С объединяют знание всех тем химии. В случае Задания С2 ЕГЭ по химии — знание всех классов неорганических веществ и их качественных реакции.
Дается конкретный химический эксперимент, ход которого нужно описать химическими реакциями.
Для таких реакции обычно предлагаются какие-то внешние проявления — выделения газа, выпадение осадка или изменение окраски раствора.
Таблица качественных реакций для газов
2) взаимодействие металлов с азотной кислотой (концентрированной)
3) разложение нитратов
Взаимодействие активных металлов с концентрированной серной кислотой:
4Mg + 5H2SO4 = 4MgSO4 + H2S + 4H2O
Газ с резким запахом. Растворимый в воде
1) взаимодействие серасодежащих веществ с кислородом
2) взаимодействие некоторых металлов с концентрированной серной кислотой
1) горение азотсодержащих веществ;
2) разложение нитрита аммония:
Газы, поддерживающие горение:
(иногда, для озона — запах свежести);
Таблица качественных реакций для щелочных металлов:
Т.к. все соединения щелочных металлов хорошо растворимы в воде, то их определяют по цвету пламени:
(указан так же цвет пламени некоторых щелочно-земельных металлов)
Таблица качественных реакций
— цвета осадков
Осадки белого цвета
Качественная реакция
Белый творожистый
нерастворимый в воде;
нерастворимый в HNO3
качественная реакция на соли серебра;
качественная реакция на хлорид-ионы;
Белый осадок
нерастворимый в кислотах
качественная реакция на соли бария;
качественная реакция на сульфат-ионы;
образуется при пропускании газа без цвета с резким запахом через известковую воду;
растворяется при пропускании избытка газа;
растворяется в кислотах
растворение в кислотах:
CaSO3 + 2H + → SO2↑ + H2O + Ca 2+
образуется при добавлении щелочи;
растворяется в избытке щелочи
избыток щелочи : Al(OH)3 + NaOH =Na[Al(OH) 4 ];
образуется при пропускании газа без цвета и запаха через известковую воду;
растворение в кислотах:
Осадок светло-желтого цвета
(осадок кремового цвета)
образуется при приливании AgNO3;
нерастворим в HNO3;
качественная реакция на бромид-ионы;
(качественная реакция на соли серебра);
Осадок желтого цвета
качественная реакция на иодид-ионы;
растворим в кислотах;
Осадки коричневых цветов
Качественная реакция
Осадок бурого цвета
образуется при взаимодействии с растворами щелочей;
качественная реакция на соли железа
Осадки синих и зеленых цветов
Осадки зеленого цвета
Осадок голубого цвета
(осадок синего цвета)
образуется при взаимодействии с растворами щелочей
качественная реакция на соли меди ( II)
Осадок синего цвета
образуется при взаимодействии с раствором красной кровяной и желтой кровяной соли
качественная реакция на соли железа ( II) — с красной кровяной солью;
качественная реакция на соли железа ( III) — с желтой кровяной солью;
Осадки черного цвета
Осадок черного цвета
Образуется при взаимодействии с сульфидами или с H2S
качественная реакция на сульфид-ионы
Еще на эту тему:
а какого цвета осадок тетрагидроксоалюмината натрия?
а это не осадок, это растворимое вещество
Любой осадок возможно растворим другим веществом. В данной среде вещество ведет себя пассивно от того и осаждается.
порода, до этого промытая кислотами, была залита мною аптечным йодом и прокипела в нём целую ночь. После остывания была добавлена вода, раствор отстоялся и был декантирован. Раствор представляет собой очень тёмный, чёрно-коричневый золь. В луче фонаря видна мельчайшая, не оседающая, не фильтрующаяся пыль. При добавлении в золь соляной к-ты выпадает красно-коричневый осадок, а раствор светлеет до тёмно красного. В растворе появляется свободный йод обнаруживаемый крахмалом, до прибавления солянки йод не обнаруживался. Так вот, выпавший осадок не растворяется ни в кислотах, ни в щелочах, не реагирует с хлором, растворить его больше ни в чём не получается, на частицы породы уже не похож. Напоминает по цвету осадок смеси гидроксидов железа II и III, однако нерастворим в кислотах. Что это может быть, хотя бы класс соединения узнать? Подскажите пожалуйста.
напишите хотя бы примерно что за порода…
Это глинистая порода светло коричневого цвета. После травления указанной породы смесью соляной к-ты с гипохлоритом натрия был получен жёлтый раствор. Раствор был нейтрализован и осаждён гидрокарбонатом натрия, осадок отправлен на спектральный анализ, вот результат в массовых долях:
13Al 5.420±0.061
14Si 1.136±0.023
15P 0.597±0.019
16S 0.279±0.010
17Cl 77.974±0.066
20Ca 5.778±0.014
22Ti 0.157±0.017
26Fe 8.506±0.026
29Cu 0.152±0.002
Да, результат более чем странный, но ведь лаборатория анализ делала! В общем, эта же порода (поскольку растворилась лишь незначительная, незаметная на глаз её часть) была промыта водой и обработана указанным выше способом. Больше ничего не знаю))) Подскажите хотя бы возможные варианты полученного осадка.
После обработки смесью гипохлорита и соляной все указанные элементы должны были перейти в раствор. После реакции с гидрокарбонатом могло получиться:
Al(OH)3, CaCO3, Ca(OH)2, Ti(OH)2, возможно, Ti(OH)CO3, Fe(OH)2, Fe(OH)3, Cu(OH)2, возможно очень небольшие кол-ва карбонатов, хотя, после промывания водой они должны были раствориться
Дело в том, что полученный раствор после травления солянкой с гипохлоритом был декантирован с породы и только тогда обработан гидрокарбонатом, там действительно могли образоваться указанные вами осадки хоть это и противоречит результатам лаб. анализа. Но не в этом дело. Состав этого раствора я привёл лишь для понимания какие элементы могут там содержаться. Сама порода была промыта водой и затем обработана аптечным йодом, как я писал ранее в первом посте, вот осадок полученный после йода меня интересует.
Указанные осадки как раз по составу соответствуют анализу, ну да ладно. Смотрите по таблице растворимости, что дает с йодом осадок
Как читаются элементы в таблице Менделеева?
Например водород(H)-читается как Аш, Азот(N)-читается как Эн,а остальные как?

Есть русское и латинское обозначение каждого химического элемента из таблицы Менделеева. Обычно прооще использовать русское название элемента. Но при названии формулы употребляются латинские названеия. При этом латинские названия соответствуют русским, если в обозначении элемента более одной буквы. Если в обозначении только один символ, то латинскому названию элемента соответствует название этой буквы.

Существует несколько вариантов произношения химических элементов в периодической таблице Д. И. Менделеева.
Большинство из них читаются (произносятся) в соответствие с русским названием.
Литий (Li) читается как Литий.
Неон (Ne) читается как Неон.
Хлор (Cl) читается как Хлор.
Произношение нескольких элементов совпадает с символом, который используется для записи химического элемента в периодической таблице.
К ним относятся:
Кроме того, есть элементы, которые читаются в соответствие с латинским названием.
Кремний (Si) - Силициум (Silicium).
Медь (Cu) - Купрум (Cuprum).
Серебро (Ag) - Аргентум (Argentum).
Олово (Sn) - Станнум (Stannum).
В таблицах, которые я привёл ниже, представлена подробная информация о 118 химических элементах, которые известны на данный момент.




Помню из химии элементы в таблице Менделеева читались в соответствии со словами латинского языка. Произносятся они, в основном, так как и называются. Например, бериллий, так и будет произносится в формулах. Обращайте внимание на сокращенные буквы латинницы - если одна буква, то и читайте, как одну букву, например, аш - водород. Если две буквы в сокращении, то произносить полностью элемент, как называется, например Al - алюминий и т. д. Вот некоторые названия элементов:
Запомните простое правило: если видите в таблице одну букву, то читайте ее так, как читается сама буква в английском алфавите. Это касается всех одиночных букв, кроме F (фтор), B (бор), I (йод), K (калий). Остальные названия, которые состоят из двух букв нужно читать так, как называется элемент.
Вот полный список названий с переводом на английский и латиниский:

Элементы, обозначаемые одной буквой латинского алфавита, читаются по названию этих букв в латинском алфавите. Элементы, обозначаемые двумя буквами, читаются по латыни, например медный купорос CuSO4 читается: "Купрум Эс О Четыре".
Таблица Менделеева включает в себя в упорядоченном положении сочетание всех имеющихся химических элементов. Такая таблица имеет вот такой вид:

А вот информация относительно прочтения всех химических элементов:

Многие элементы в таблице Менделеева, как пишуться так и читаются, как правило русского языка, как слышится так и пишется. Нам с вами важно знать как польностью пишеться каждый элемент, ведь в таблиице, лишшь сокращённые названия, такие как предлагает нам автор вопроса - это водород (H), он так же и читается как (Аш). Но есть и такие элементы в таблице Менделеева как например свинец

всего две буквы "Pb" но произноситься он уже как (плюмбум). Давайте же изначально с вами вспомним знаменитую таблицу Менделеева, выпишем из неё все элементы, найдём полное их название, для этого нам придётся обратиться к информационным источникам и сведениям, поискать в учебниках, образовательной литературе, в учебниках по химии; и просто прочитаем полные названия элементов, и добавим наше произношение в отдельную графу к таблицу, которую мы разлинуем и поделим на графы.

Наша знаменитая таблица химических элементов, сейчас все вспомнили, у многих она была на обороте тетрадки по химии как памятка и шпаргалка. Теперь нарисуем отдельную таблицу элементов из таблицы.

Итак в первой графе у нас будет сам химический элемент, его название на русском языке; во второй, латинское его название; в третьей, символ, то что мы привыкли видеть на таблице Менделеева, в четвёртой графе, как раз и будет самое нужное для нас произношение данного элемента в формуле и с правильным ударением на слоге, чтобы вы видели как правильно его произносить или читать; и в заключительной пятой графе мы укажем относительную атомную массу каждого из этих элементов.
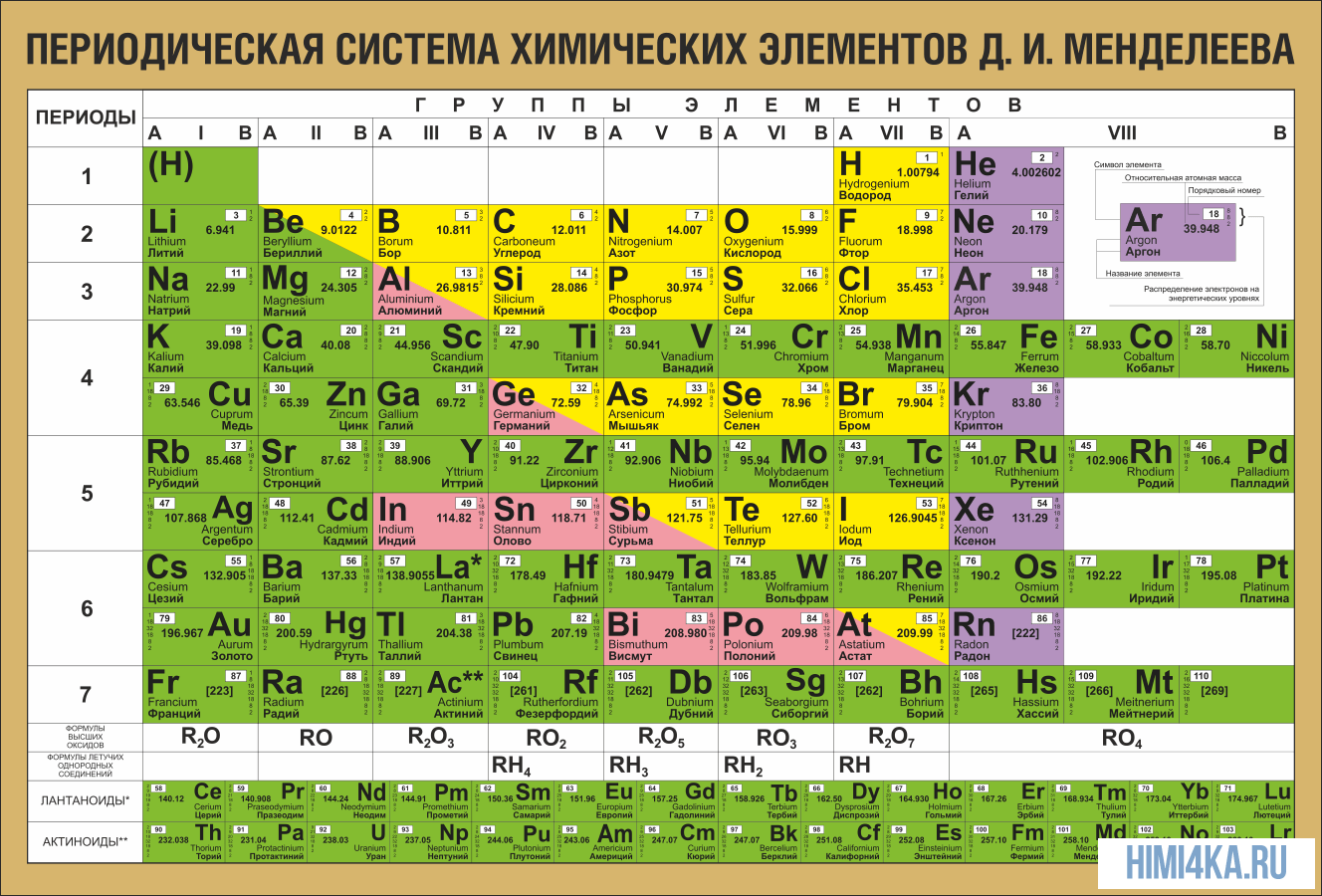
ТАБЛИЦА МЕНДЕЛЕЕВА - периодическая система химических элементов
Таблица Менделеева (периодическая система химических элементов) - это такая таблица, в которой классифицируются химические элементы по различным свойствам в зависимости от заряда их атомного ядра. Таблица является графическим изображением периодического закона, который открыл Дмитрий Иванович Менделеев в 1869 году. Изначальный вариант этой таблицы 1869 - 1871 гг. и устанавливал зависимость свойств элементов от их атомной массы. На данный момент элементы сводятся в двумерную таблицу, в которой каждый столбец - это группа, определяющая основные физико-химические свойства, а строки - это периоды, схожие друг с другом. Наиболее распространены 2 формы таблицы: короткая и длинная.
ТАБЛИЦА МЕНДЕЛЕЕВА

Периодическая таблица Менделеева в классическом варианте (или короткая форма), основана на параллелизме степеней окисления химических элементов главных и побочных подгрупп. В каждой ячейке таблицы указан символ элемента, порядковый номер, относительная атомная масса, и название элемента.
Порядковый номер элемента - это число равное числу протонов в ядре атома и числу электронов, которые вращаются вокруг него.
Чтобы посмотреть все свойства конкретного химического элемента нужно перейти по ссылке нажав на символ элемента в таблице.
Периодическая система химических элементов Д.И. Менделеева
Расшифровка периодической системы химических элементов Д.И. Менделеева:
Номер группы (для большинства элементов) – общее число валентных электронов (электронов внешнего энергетического уровня, а также предпоследнего d-подуровня, если он застроен не полностью).
Число элементов в периоде – максимальная емкость соответствующего энергетического уровня:
2 элемента (1s 2 )
18 элементов (5s 2 4d 10 5p 6 )
8 элементов (2s 2 2p 6 )
32 элемента (6s 2 4f 14 5d 10 6p 6 )
8 элементов (3s 2 3p 6 )
18 элементов (4s 2 3d 10 4p 6 )
Построение периодов – в начале: два s-элемента, в конце: шесть р- элементов. В четвертом и пятом периодах между ними помещается по десять d-элементов, а в шестом и седьмом к ним добавляются четырнадцать f-элементов (формы электронных орбиталей).
В периоде – свойства химических элементов различаются между собой, т.к. электронные конфигурации валентных электронов их атомов различны.
В подгруппе – свойства элементов сходны между собой, т.к. электронные конфигурации валентных электронов их атомов сходны.
Причина периодичности свойств химических элементов заключается в периодической повторяемости сходных электронных конфигураций внешних энергетических уровней.
Формы электронных орбиталей (электронные семейства)
Классификация химических элементов по электронным конфигурациям их атомов (электронные орбитали)
внешний (n) s-подуровень
внешний (n) р-подуровень
предвнешний (n–1 ) d-подуровень
(n-2)f 1–14 (n-1)d 1–10 ns 1–2
третий снаружи (n–2) f-подуровень
Графическое изображение орбиталей
Свойства элементов таблицы Менделеева
Металлы – элементы главных подгрупп с числом валентных электронов от 1 до 3 (подгруппы IA, IIA, IIIА, кроме элемента бора), а также германий, олово, свинец, сурьма, висмут и полоний.
Неметаллы – бор и элементы главных подгрупп с числом валентных электронов от 4 до 7 (подгруппы IVA, VA, VIA, VIIA) кроме германия, олова, свинца, сурьмы, висмута и полония.
Переходные элементы – элементы побочных подгрупп (IB-VIIB); в виде простых веществ ведут себя как металлы.
Благородные газы – элементы подгруппы VIIIA, полностью застроенные энергетические подуровни s 2 p 6 , для гелия s 2 .
Галогены – элементы подгруппы VII(a) таблицы Менделеева, реагируют со всеми простыми веществами, кроме некот. неметаллов, являются энергичными окислителями, к ним относят F, Cl, Br, I, At, Ts.
Лантанойды – 15 элементов III группы 6-го периода, металлы с атомными номерами 57–71. Все они имеют стабильные изотопы, кроме прометия.
Актинойды – 15 радиоактивных элементов III группы 7-го периода с атомными номерами 89–103.
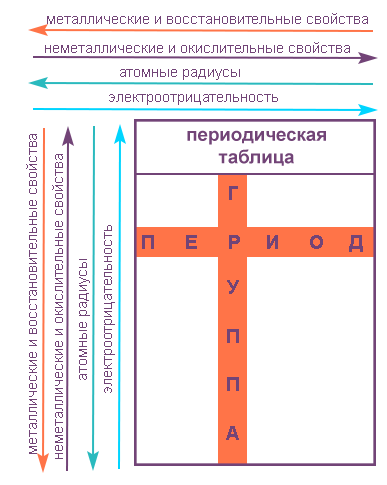
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
В периодах с увеличением порядкового номера элемента прослеживается следующая закономерность:
Все элементы таблицы Менделеева, исключая гелий, неон и аргон, образуют кислородные соединения, которые изображены общими формулами под каждой группой в порядке возрастания степени окисления элементов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где R - обозначает элемент группы.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения: RH4, RH3, RH2, RH. Соединения RH4 имеют нейтральный характер; RH3 – слабоосновной; RH2 – слабокислый; RH – сильнокислый характер.
История открытия периодического закона Менделеевым Д.И.
Самый важный вклад в систематизацию химических элементов внёс русский выдающийся химик Дмитрий Иванович Менделеев, автор труда "Основы химии", который в марте 1869 года представил Русскому химическому обществу (РХО) периодический закон химических элементов, изложенный в нескольких основных положениях.
В 1871 году Менделеев в итоговой статье «Периодическая законность химических элементов» дал формулировку Периодического закона: "Свойства элементов, а потому и свойства образуемых ими простых и сложных тел стоят в периодической зависимости от атомного веса". Тогда же Менделеев придал своей периодической таблице классический вид (короткая таблица, смотрите ниже).

В современном изложении периодический закон химических элементов звучит так: "Свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера)."
Периодическая таблица элементов Менделеева длинная форма
Длинная форма таблицы Менделеева (или длиннопериодная форма) состоит из 18 групп с лева на право от щелочных металов до благородных газов. считается официальной версией с 1989 года.

Таблица Менделеева для печати в хорошем качестве скачать
Вы можете скачать таблицу Менделеева на выбор короткую или длинную форму в цветном и черно-белом цвете, для этого откройте по ссылке ниже изображение и сохраните его себе на компьютер.
____________
Источник информации:
1. Большой химический справочник / А.И.Волков, — М.: 2005.
2. Большая энциклопедия химических элементов. Периодическая таблица Менделеева / И.А.Леенсон. — Москва : 2014.
ПЕРИОДИЧЕСКАЯ ТАБЛИЦА МЕНДЕЛЕЕВА
Еще в школе, сидя на уроках химии, все мы помним таблицу на стене класса или химической лаборатории. Эта таблица содержала классификацию всех известных человечеству химических элементов, тех фундаментальных компонентов, из которых состоит Земля и вся Вселенная. Тогда мы и подумать не могли, что таблица Менделеева бесспорно является одним из величайших научных открытий, который является фундаментом нашего современного знания о химии.
На первый взгляд, ее идея выглядит обманчиво просто: организовать химические элементы в порядке возрастания веса их атомов. Причем в большинстве случаев оказывается, что химические и физические свойства каждого элемента сходны с предыдущим ему в таблице элементом. Эта закономерность проявляется для всех элементов, кроме нескольких самых первых, просто потому что они не имеют перед собой элементов, сходных с ними по атомному весу. Именно благодаря открытию такого свойства мы можем поместить линейную последовательность элементов в таблицу, очень напоминающую настенный календарь, и таким образом объединить огромное количество видов химических элементов в четкой и связной форме. Разумеется, сегодня мы пользуемся понятием атомного числа (количества протонов) для того, чтобы упорядочить систему элементов. Это помогло решить так называемую техническую проблему «пары перестановок», однако не привело к кардинальному изменению вида периодической таблицы.
В периодической таблице Менделеева все элементы упорядочены с учетом их атомного числа, электронной конфигурации и повторяющихся химических свойств. Ряды в таблице называются периодами, а столбцы группами. В первой таблице, датируемой 1869 годом, содержалось всего 60 элементов, теперь же таблицу пришлось увеличить, чтобы поместить 118 элементов, известных нам сегодня.
Периодическая система Менделеева систематизирует не только элементы, но и самые разнообразные их свойства. Химику часто бывает достаточно иметь перед глазами Периодическую таблицу для того, чтобы правильно ответить на множество вопросов (не только экзаменационных, но и научных).
The YouTube ID of 1M7iKKVnPJE is invalid.
Периодический закон
Существуют две формулировки периодического закона химических элементов: классическая и современная.
Классическая, в изложении его первооткрывателя Д.И. Менделеева: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов.
Современная: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).
Графическим изображением периодического закона является периодическая система элементов, которая представляет собой естественную классификацию химических элементов, основанную на закономерных изменениях свойств элементов от зарядов их атомов. Наиболее распространёнными изображениями периодической системы элементов Д.И. Менделеева являются короткая и длинная формы.

Группы и периоды Периодической системы
Группами называют вертикальные ряды в периодической системе. В группах элементы объединены по признаку высшей степени окисления в оксидах. Каждая группа состоит из главной и побочной подгрупп. Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов. Побочные подгруппы состоят только из элементов больших периодов. Химические свойства элементов главных и побочных подгрупп значительно различаются.
Периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров. В периодической системе имеются семь периодов: первый, второй и третий периоды называют малыми, в них содержится соответственно 2, 8 и 8 элементов; остальные периоды называют большими: в четвёртом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 31 элемент. Каждый период, кроме первого, начинается щелочным металлом, а заканчивается благородным газом.
Физический смысл порядкового номера химического элемента: число протонов в атомном ядре и число электронов, вращающихся вокруг атомного ядра, равны порядковому номеру элемента.

Свойства таблицы Менделеева
Напомним, что группами называют вертикальные ряды в периодической системе и химические свойства элементов главных и побочных подгрупп значительно различаются.
- усиливаются металлические свойства и ослабевают неметаллические;
- возрастает атомный радиус;
- возрастает сила образованных элементом оснований и бескислородных кислот;
- электроотрицательность падает.
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения, существует всего восемь форм кислородных соединений. В периодической системе их часто изображают общими формулами, расположенными под каждой группой в порядке возрастания степени окисления элементов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где символом R обозначают элемент данной группы. Формулы высших оксидов относятся ко всем элементам группы, кроме исключительных случаев, когда элементы не проявляют степени окисления, равной номеру группы (например, фтор).
Оксиды состава R2O проявляют сильные основные свойства, причём их основность возрастает с увеличением порядкового номера, оксиды состава RO (за исключением BeO) проявляют основные свойства. Оксиды состава RO2, R2O5, RO3, R2O7 проявляют кислотные свойства, причём их кислотность возрастает с увеличением порядкового номера.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют четыре формы таких соединений. Их располагают под элементами главных подгрупп и изображают общими формулами в последовательности RH4, RH3, RH2, RH.
Соединения RH4 имеют нейтральный характер; RH3 — слабоосновный; RH2 — слабокислый; RH — сильнокислый характер.
Напомним, что периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров.
В пределах периода с увеличением порядкового номера элемента:
- электроотрицательность возрастает;
- металлические свойства убывают, неметаллические возрастают;
- атомный радиус падает.
Элементы таблицы Менделеева
Щелочные и щелочноземельные элементы
К ним относятся элементы из первой и второй группы периодической таблицы. Щелочные металлы из первой группы — мягкие металлы, серебристого цвета, хорошо режутся ножом. Все они обладают одним-единственным электроном на внешней оболочке и прекрасно вступают в реакцию. Щелочноземельные металлы из второй группы также имеют серебристый оттенок. На внешнем уровне помещено по два электрона, и, соответственно, эти металлы менее охотно взаимодействуют с другими элементами. По сравнению со щелочными металлами, щелочноземельные металлы плавятся и кипят при более высоких температурах.
| Щелочные металлы | Щелочноземельные металлы |
| Литий Li 3 | Бериллий Be 4 |
| Натрий Na 11 | Магний Mg 12 |
| Калий K 19 | Кальций Ca 20 |
| Рубидий Rb 37 | Стронций Sr 38 |
| Цезий Cs 55 | Барий Ba 56 |
| Франций Fr 87 | Радий Ra 88 |
Лантаниды (редкоземельные элементы) и актиниды
Лантаниды — это группа элементов, изначально обнаруженных в редко встречающихся минералах; отсюда их название «редкоземельные» элементы. Впоследствии выяснилось, что данные элементы не столь редки, как думали вначале, и поэтому редкоземельным элементам было присвоено название лантаниды. Лантаниды и актиниды занимают два блока, которые расположены под основной таблицей элементов. Обе группы включают в себя металлы; все лантаниды (за исключением прометия) нерадиоактивны; актиниды, напротив, радиоактивны.
| Лантаниды | Актиниды |
| Лантан La 57 | Актиний Ac 89 |
| Церий Ce 58 | Торий Th 90 |
| Празеодимий Pr 59 | Протактиний Pa 91 |
| Неодимий Nd 60 | Уран U 92 |
| Прометий Pm 61 | Нептуний Np 93 |
| Самарий Sm 62 | Плутоний Pu 94 |
| Европий Eu 63 | Америций Am 95 |
| Гадолиний Gd 64 | Кюрий Cm 96 |
| Тербий Tb 65 | Берклий Bk 97 |
| Диспрозий Dy 66 | Калифорний Cf 98 |
| Гольмий Ho 67 | Эйнштейний Es 99 |
| Эрбий Er 68 | Фермий Fm 100 |
| Тулий Tm 69 | Менделевий Md 101 |
| Иттербий Yb 70 | Нобелий No 102 |
Галогены и благородные газы
Галогены и благородные газы объединены в группы 17 и 18 периодической таблицы. Галогены представляют собой неметаллические элементы, все они имеют семь электронов во внешней оболочке. В благородных газахвсе электроны находятся во внешней оболочке, таким образом с трудом участвуют в образовании соединений. Эти газы называют «благородными, потому что они редко вступают в реакцию с прочими элементами; т. е. ссылаются на представителей благородной касты, которые традиционно сторонились других людей в обществе.
| Галогены | Благородные газы |
| Фтор F 9 | Гелий He 2 |
| Хлор Cl 17 | Неон Ne 10 |
| Бром Br 35 | Аргон Ar 18 |
| Йод I 53 | Криптон Kr 36 |
| Астат At 85 | Ксенон Xe 54 |
| — | Радон Rn 86 |
Переходные металлы
Переходные металлы занимают группы 3—12 в периодической таблице. Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (при помощи которых они соединяются с другими элементами) находятся в нескольких электронных оболочках.
| Переходные металлы |
| Скандий Sc 21 |
| Титан Ti 22 |
| Ванадий V 23 |
| Хром Cr 24 |
| Марганец Mn 25 |
| Железо Fe 26 |
| Кобальт Co 27 |
| Никель Ni 28 |
| Медь Cu 29 |
| Цинк Zn 30 |
| Иттрий Y 39 |
| Цирконий Zr 40 |
| Ниобий Nb 41 |
| Молибден Mo 42 |
| Технеций Tc 43 |
| Рутений Ru 44 |
| Родий Rh 45 |
| Палладий Pd 46 |
| Серебро Ag 47 |
| Кадмий Cd 48 |
| Лютеций Lu 71 |
| Гафний Hf 72 |
| Тантал Ta 73 |
| Вольфрам W 74 |
| Рений Re 75 |
| Осмий Os 76 |
| Иридий Ir 77 |
| Платина Pt 78 |
| Золото Au 79 |
| Ртуть Hg 80 |
| Лоуренсий Lr 103 |
| Резерфордий Rf 104 |
| Дубний Db 105 |
| Сиборгий Sg 106 |
| Борий Bh 107 |
| Хассий Hs 108 |
| Мейтнерий Mt 109 |
| Дармштадтий Ds 110 |
| Рентгений Rg 111 |
| Коперниций Cn 112 |
Металлоиды
Металлоиды занимают группы 13—16 периодической таблицы. Такие металлоиды, как бор, германий и кремний, являются полупроводниками и используются для изготовления компьютерных чипов и плат.
| Металлоиды |
| Бор B 5 |
| Кремний Si 14 |
| Германий Ge 32 |
| Мышьяк As 33 |
| Сурьма Sb 51 |
| Теллур Te 52 |
| Полоний Po 84 |
Постпереходными металлами
Элементы, называемые постпереходными металлами, относятся к группам 13—15 периодической таблицы. В отличие от металлов, они не имеют блеска, а имеют матовую окраску. В сравнении с переходными металлами постпереходные металлы более мягкие, имеют более низкую температуру плавления и кипения, более высокую электроотрицательность. Их валентные электроны, с помощью которых они присоединяют другие элементы, располагаются только на внешней электронной оболочке. Элементы группы постпереходных металлов имеют гораздо более высокую температуру кипения, чем металлоиды.
| Постпереходные металлы |
| Алюминий Al 13 |
| Галлий Ga 31 |
| Индий In 49 |
| Олово Sn 50 |
| Таллий Tl 81 |
| Свинец Pb 82 |
| Висмут Bi 83 |
Неметаллы
Из всех элементов, классифицируемых как неметаллы, водород относится к 1-й группе периодической таблицы, а остальные — к группам 13—18. Неметаллы не являются хорошими проводниками тепла и электричества. Обычно при комнатной температуре они пребывают в газообразном (водород или кислород) или твердом состоянии (углерод).
| Неметаллы |
| Водород H 1 |
| Углерод C 6 |
| Азот N 7 |
| Кислород O 8 |
| Фосфор P 15 |
| Сера S 16 |
| Селен Se 34 |
| Флеровий Fl 114 |
| Унунсептий Uus 117 |
А теперь закрепите полученные знания, посмотрев видео про таблицу Менделеева и не только.
Отлично, первый шаг на пути к знаниям сделан. Теперь вы более-менее ориентируетесь в таблице Менделеева и это вам очень даже пригодится, ведь Периодическая система Менделеева является фундаментом, на котором стоит эта удивительная наука.
Как пользоваться таблицей Менделеева
Соавтор(ы): Bess Ruff, MA. Бесс Руфф — аспирантка Университета штата Флорида, работает над получением степени PhD по географии. Получила степень магистра экологии и менеджмента в Калифорнийском университете в Санта-Барбаре в 2016 году. Проводила исследования для проектов по морскому пространственному планированию в Карибском море и обеспечивала научную поддержку в качестве дипломированного участника Группы устойчивого рыболовства.
Если таблица Менделеева кажется вам сложной для понимания, вы не одиноки! Хотя бывает непросто понять ее принципы, умение работать с ней поможет при изучении естественных наук. Для начала изучите структуру таблицы и то, какую информацию можно узнать из нее о каждом химическом элементе. Затем можно приступить к изучению свойств каждого элемента. Наконец, с помощью таблицы Менделеева можно определить число нейтронов в атоме того или иного химического элемента.

- Атомная масса увеличивается слева направо и сверху вниз, поскольку в атомах элементов с бо́льшим номером содержится больше протонов и нейтронов. Каждый последующий элемент содержит больше протонов, чем предыдущий, поэтому возрастает и его атомная масса.
- В атомной массе не учитываются электроны, поскольку они весят намного меньше, чем протоны и нейтроны. [1] X Источник информации
- Например, первая строка таблицы содержит водород, который имеет атомный номер 1, и гелий с атомным номером 2. Однако они расположены на противоположных краях, так как принадлежат к разным группам.

- Водород можно отнести как к группе щелочных металлов, так и к группе галогенов. В некоторых таблицах его указывают в обеих группах.
- В большинстве случаев группы пронумерованы от 1 до 18, и номера ставятся вверху или внизу таблицы. Номера могут быть указаны римскими (например, IA) или арабскими (например,1A или 1) цифрами.
- При движении вдоль колонки сверху вниз говорят, что вы «просматриваете группу».
- Например, первые 3 строки имеют пустые ячейки, поскольку переходные металлы встречаются лишь с атомного номера 21.
- Элементы с атомными номерами с 57 по 71 относятся к редкоземельным элементам, и обычно их выносят в отдельную подгруппу в нижнем правом углу таблицы.

- Например, атомы элементов первого периода имеют одну орбиталь, а атомы элементов седьмого периода — 7 орбиталей.
- Как правило, периоды обозначаются цифрами от 1 до 7 слева таблицы.
- При движении вдоль строки слева направо говорят, что вы «просматриваете период».

- Помните, что по свойствам водород можно отнести как к щелочным металлам, так и к галогенам, поэтому он может иметь разный цвет и располагаться в двух ячейках.
- Металлические элементы блестят, являются твердыми при комнатной температуре (за исключением ртути), хорошо проводят тепло и электрический заряд и достаточно пластичны.
- Неметаллы не имеют выраженного блеска, плохо проводят тепло и электрический заряд, обладают низкой пластичностью. Как правило, при комнатной температуре неметаллические элементы представляют собой газ, но при определенных температурах и давлениях они могут принимать жидкое или твердое состояние.
- Металлоиды совмещают в себе свойства металлов и неметаллов. [8] X Источник информации

- Обычно символы элементов являются сокращением их латинского названия, хотя для некоторых, особенно недавно открытых элементов, они получены из общепринятого названия. К примеру, гелий обозначается символом He, что близко к общепринятому названию в большинстве языков. В то же время железо обозначается как Fe, что является сокращением его латинского названия.

- Иногда в таблице не указываются названия элементов и приводятся лишь их химические символы.

- По атомному номеру элемента можно также определить количество электронов и нейтронов в атоме.

- Ионы имеют электрический заряд. Если в ионе больше протонов, то он обладает положительным зарядом, и в этом случае после символа элемента ставится знак «плюс». Если ион содержит больше электронов, он имеет отрицательный заряд, что обозначается знаком «минус».
- Знаки «плюс» и «минус» не ставятся, если атом не является ионом.

- Поскольку атомная масса представляет собой среднюю величину, для большинства элементов она записывается в виде десятичной дроби.
- Хотя может показаться, что атомная масса всегда возрастает при движении слева направо и сверху вниз, это справедливо не во всех случаях.
- Например, атомная масса углерода составляет 12,011, после округления получаем 12. Для железа, атомная масса которого равна 55,847, получаем 56.

- Используйте следующую формулу: Число нейтронов = Массовое число – Число протонов.
- Например, массовое число углерода равно 12, и атом углерода имеет 6 протонов. Поскольку 12 – 6 = 6, атом углерода содержит 6 нейтронов.
- Массовое число железа составляет 56, и его атом содержит 26 протонов. Так как 56 – 26 = 30, в атоме железа содержится 30 нейтронов.
- Изотопы элементов имеют разное количество нейтронов, благодаря чему меняется их атомная масса.
- Многим сложно освоить таблицу Менделеева. Не расстраивайтесь, если столкнетесь с определенными трудностями!
- Хотя цвета могут меняться, они передают одну и ту же информацию.
- Встречаются упрощенные таблицы. Например, в таблице могут содержаться лишь символы элементов и их атомные номера. Выберите такую таблицу, которая подходит для ваших целей.
Дополнительные статьи














Об этой статье
Читайте также:

