Дайте характеристику окислительно восстановительных свойств металлов
Обновлено: 16.05.2024
К окислительно-восстановительным реакциям относятся такие, которые сопровождающиеся перемещением электронов от одних частиц к другим. При рассмотрении закономерностей протекания окислительно-восстановительных реакций используется понятие степени окисления.
Степень окисления
Понятие степени окисления введено для характеристики состояния элементов в соединениях. Под степенью окисления понимается условный заряд атома в соединении, вычисленный исходя из предположения, что соединение состоит из ионов. Степень окисления обозначается арабской цифрой со знаком плюс при смещении электронов от данного атома к другому атому и цифрой со знаком минус при смещении электронов в обратном направлении. Цифру со знаком “+” или “-“ ставят над символом элемента. Степень окисления указывает состояние окисления атома и представляет собой всего лишь удобную форму для учета переноса электронов: ее не следует рассматривать ни как эффективный заряд атома в молекуле (например, в молекуле LiF эффективные заряды Li и F равны соответственно + 0,89 и -0,89, тогда как степени окисления +1 и -1), ни как валентность элемента (например, в соединениях CH4, CH3OH, HCOOH, CO2 валентность углерода равна 4, а степени окисления соответственно равны -4, -2, +2, +4). Численные значения валентности и степени окисления могут совпадать по абсолютной величине лишь при образовании соединений с ионной структурой.
При определении степени окисления используют следующие правила:
Атомы элементов, находящихся в свободном состоянии или в виде молекул простых веществ, имеют степень окисления, равную нулю, например Fe, Cu, H2, N2 и т.п.
Степень окисления элемента в виде одноатомного иона в соединении, имеющем ионное строение, равна заряду данного иона,
например, NaCl , Cu S, AlF3.
Водород в большинстве соединений имеет степень окисления +1, за исключением гидридов металлов (NaH, LiH), в которых степень окисления водорода равна -1.
Наиболее распространенная степень окисления кислорода в соединениях -2 , за исключением пероксидов (Na2O2, Н2О2), в которых степень окисления кислорода равна –1 и F2O, в котором степень окисления кислорода равна +2.
Окислительно-восстановительные свойства веществ
Любая окислительно-восстановительная реакция состоит из процессов окисления и восстановления. Окисление - это процесс отдачи электронов атомом, ионом или молекулой реагента. Вещества, которые отдают свои электроны в процессе реакции и при этом окисляются, называют восстановителями.
Восстановление – это процесс принятия электронов атомом, ионом или молекулой реагента.
Вещества, которые принимают электроны и при этом восстанавливаются, называют окислителями.
Реакции окисления-восстановления всегда протекают как единый процесс, называемый окислительно-восстановительной реакцией. Например, при взаимодействии металлического цинка с ионами меди восстановитель (Zn) отдает свои электроны окислителю – ионам меди (Cu 2+ ):
Zn + Cu 2+ Zn 2+ + Cu
Медь выделяется на поверхности цинка, а ионы цинка переходят в раствор.
Окислительно-восстановительные свойства элементов связаны со строением их атомов и определяются положением в периодической системе Д.И. Менделеева. Восстановительная способность элемента обусловлена слабой связью валентных электронов с ядром. Атомы металлов, содержащие на внешнем энергетическом уровне небольшое число электронов склонны к их отдаче, т.е. легко окисляются, играя роль восстановителей. Самые сильные восстановители – наиболее активные металлы.
Критерием окислительно-восстановительной активности элементов может служить величина их относительной электроотрицательности: чем она выше, тем сильнее выражена окислительная способность элемента, и чем ниже, тем ярче проявляется его восстановительная активность. Атомы неметаллов (например, F, O) обладают высоким значением сродства к электрону и относительной электроотрицательности, они легко принимают электроны, т.е. являются окислителями.
Окислительно-восстановительные свойства элемента зависят от степени его окисления. У одного и того же элемента различают низшую, высшую и промежуточные степени окисления.
В качестве примера рассмотрим серу S и ее соединения H2S, SO2 и SO3. Связь между электронной структурой атома серы и его окислительно-восстановительными свойствами в этих соединениях наглядно представлена в таблице 1.
В молекуле H2S атом серы имеет устойчивую октетную конфигурацию внешнего энергетического уровня 3s 2 3p 6 и поэтому не может больше присоединять электроны, но может их отдавать.
Состояние атома, в котором он не может больше принимать электроны, называется низшей степенью окисления.
В низшей степени окисления атом теряет окислительную способность и может быть только восстановителем.
В зависимости от строения их атомов
Способность химических элементов присоединять или отдавать электроны связана со строением атомов и положением их в периодической системе элементов Д.И. Менделеева.
Атомы металлов в химических реакциях способны лишь отдавать электроны и быть восстановителями. Наиболее активными восстановителями являются щелочные и щелочноземельные металлы.
Атомы неметаллов (за исключением фтора) в зависимости от
свойств партнеров, с которыми они взаимодействуют, могут
проявлять как окислительные, так и восстановительные свойства.
Fe 0 + S 0 = Fe +2 S -2 и S 0 + O2 = S +4 O2 -2 .
Однако, у химически активных неметаллов проявляются преимущественно окислительные свойства. Их часто используют на практике в качестве окислителей (кислород, Cl2).
Атомы водорода в зависимости от свойств партнера могут проявлять как окислительные, так восстановительные свойства. Например, в реакции
водород восстановитель, так как в молекуле HCl электронная пара сильно смещена в сторону ядра атома хлора. При нагревании натрия в струе водорода образуется гидрид натрия (2Na 0 + H2 0 = 2Na +1 H -1 ). Электронная пара, обусловливающая химическую связь, сильно смещена в сторону водорода. СО водорода в этом соединении равна -1. Таким образом, водород в этой реакции является окислителем. Однако для водорода более характерна тенденция к отдаче электронов. Чаще всего водород используют как восстановитель.
Одноатомные молекулы благородных газов (Не, Nе, Ar…) практически не проявляют ни окислительных, ни восстановительных свойств, что находится в согласии со строением их атомов (внешний энергетический уровень полностью заполнен электронами).
У ионов металлов и неметаллов в высших степенях окисления восстановительные свойства отсутствуют. Такие частицы в окислительно–восстановительных реакциях могут проявлять только окислительные свойства (присоединять электроны). В связи с этим соединения, в состав которых входят частицы (ионы) в высшей СО, используются в качестве окислителей (KMnO4, HNO3, K2CrO4, K2Cr2O7 и т.д.).
Положительные ионы промежуточных СО в зависимости от свойств партнеров могут выступать как в роли восстановителей, так и в роли окислителей:
2Fe +2 Сl2 + Cl2 0 = 2Fe +3 Cl3 -1 (Fe +2 - восстановитель);
Fe +2 O + C +2 O = Fe 0 + CO2 +4 (Fe +2 - окислитель).
Ион железа в высшей СО обладает только окислительными свойствами. Так, феррат калия К2FeO4 – один из наиболее сильных окислителей.
Вещества, в состав которых входят ионы неметаллов (например, Cl -1 ,
Br -1 , S -2 , I -1 ), за счет последних могут выступать только в роли восстановителей.
В пределах каждого периода с возрастанием порядкового номера элемента восстановительная способность его атомов понижается, а окислительная способность - повышается.
Так, во II периоде литий – только восстановитель, а фтор – только окислитель. Это результат постепенного заполнения электронами внешнего электронного уровня (у атома лития - 1 электрон, у атома фтора - 7 электронов из 8 возможных на данном уровне).
В пределах каждой главной подгруппы с возрастанием порядкового номера элемента восстановительная способность их атомов возрастает, а а окислительная способность постепенно убывает. Так, в главной подгруппе IV группы кислород – сильный окислитель, а теллур – очень слабый окислитель, в некоторых реакциях он выступает даже как восстановитель. Аналогичное явление наблюдается также и в отношении их химических соединений. Эти закономерности обусловлены повышением величины радиусов атомов элементов.
Химические свойства металлов

Свойства металлов начинают изучать на уроках химии в 8–9 классе. В этом материале мы подробно разберем химические свойства этой группы элементов, а в конце статьи вы найдете удобную таблицу-шпаргалку для запоминания.
20 декабря 2021
· Обновлено 20 декабря 2021
Ждём вас 8 октября в 13:00. Вместе с педагогами, психологами и другими экспертами в образовании и воспитании ответим на главные вопросы мам и пап.
Металлы — это химические элементы, атомы которых способны отдавать электроны с внешнего энергетического уровня, превращаясь в положительные ионы (катионы) и проявляя восстановительные свойства.
В окислительно-восстановительных реакциях металлы способны только отдавать электроны, являясь сильными восстановителями. В роли окислителей выступают простые вещества — неметаллы (кислород, фосфор) и сложные вещества (кислоты, соли и т. д.).
Металлы в природе встречаются в виде простых веществ и соединений. Активность металла в химических реакциях определяют, используя электрохимический ряд, который предложил русский ученый Н. Н. Бекетов. По химической активности выделяют три группы металлов.
Ряд активности металлов
Металлы средней активности
Общие химические свойства металлов
Взаимодействие с неметаллами
Щелочные металлы сравнительно легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность:
оксид образует только литий
натрий образует пероксид
калий, рубидий и цезий — надпероксид
Остальные металлы с кислородом образуют оксиды:
2Zn + O2 = 2ZnO (при нагревании)
Металлы, которые в ряду активности расположены левее водорода, при контакте с кислородом воздуха образуют ржавчину. Например, так делает железо:
С галогенами металлы образуют галогениды:
Медный порошок реагирует с хлором и бромом (в эфире):
При взаимодействии с водородом образуются гидриды:
Взаимодействие с серой приводит к образованию сульфидов (реакции протекают при нагревании):
Реакции с фосфором протекают до образования фосфидов (при нагревании):
Основной продукт взаимодействия металла с углеродом — карбид (реакции протекают при нагревании).
Из щелочноземельных металлов с углеродом карбиды образуют литий и натрий:
Калий, рубидий и цезий карбиды не образуют, могут образовывать соединения включения с графитом:
С азотом из металлов IA группы легко реагирует только литий. Реакция протекает при комнатной температуре с образованием нитрида лития:
Взаимодействие с водой
Все металлы I A и IIA группы реагируют с водой, в результате образуются растворимые основания и выделяется H2. Литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом:
Металлы средней активности реагируют с водой только при условии, что металл нагрет до высоких температур. Результат данной реакции — образование оксида.
Неактивные металлы с водой не взаимодействуют.
Взаимодействие с кислотами
Если металл расположен в ряду активности левее водорода, то происходит вытеснение водорода из разбавленных кислот. Данное правило работает в том случае, если в реакции с кислотой образуется растворимая соль.
2Na + 2HCl = 2NaCl + H2
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.


Металлы IА группы:
Металлы IIА группы
Такие металлы, как железо, хром, никель, кобальт на холоде не взаимодействуют с серной кислотой, но при нагревании реакция возможна.
Взаимодействие с солями
Металлы способны вытеснять из растворов солей другие металлы, стоящие в ряду напряжений правее, и могут быть вытеснены металлами, расположенными левее:
Zn + CuSO4 = ZnSO4 + Cu
На металлы IА и IIА группы это правило не распространяется, так как они реагируют с водой.
Реакция между металлом и солью менее активного металла возможна в том случае, если соли — как вступающие в реакцию, так и образующиеся в результате — растворимы в воде.
Взаимодействие с аммиаком
Щелочные металлы реагируют с аммиаком с образованием амида натрия:
Взаимодействие с органическими веществами
Металлы IА группы реагируют со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
Также они могут вступать в реакции с галогеналканами, галогенпроизводными аренов и другими органическими веществами.
Взаимодействие металлов с оксидами
Для металлов при высокой температуре характерно восстановление неметаллов или менее активных металлов из их оксидов.
3Са + Cr2O3 = 3СаО + 2Cr (кальциетермия)
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков

Вопросы для самоконтроля
С чем реагируют неактивные металлы?
С чем связаны восстановительные свойства металлов?
Верно ли утверждение, что щелочные и щелочноземельные металлы легко реагируют с водой, образуя щелочи?
Методом электронного баланса расставьте коэффициенты в уравнении реакции по схеме:
Mg + HNO3 → Mg(NO3)2 + NH4NO3 + Н2O
Как металлы реагируют с кислотами?
Подведем итоги
От активности металлов зависит их химические свойства. Простые вещества — металлы в окислительно-восстановительных реакциях являются восстановителями. По положению металла в электрохимическом ряду можно судить о том, насколько активно он способен вступать в химические реакции (т. е. насколько сильно у металла проявляются восстановительные свойства).
Напоследок поделимся таблицей, которая поможет запомнить, с чем реагируют металлы, и подготовиться к контрольной работе по химии.
Сравнение окислительно-восстановительной активности различных веществ
Из определений понятий " атом-окислитель" и " атом-восстановитель" следует, что только окислительными свойствами обладают атомы в высшей степени окисления. Наоборот, только восстановительными свойствами обладают атомы в низшей степени окисления. Атомы, находящиеся в промежуточных степенях окисления, могут быть как окислителями, так и восстановителями.
Вместе с тем, основываясь только на степени окисления, невозможно однозначно оценить окислительно-восстановительные свойства веществ. В качестве примера рассмотрим соединения элементов VA группы. Соединения азота(V) и сурьмы(V) являются более или менее сильными окислителями, соединения висмута(V) – очень сильные окислители, а соединения фосфора(V) окислительными свойствами практически не обладают. В этом и других подобных случаях имеет значение, насколько данная степень окисления характерна для данного элемента, то есть, насколько устойчивы соединения, содержащие атомы данного элемента в этой степени окисления.
Любая ОВР протекает в направлении образования более слабого окислителя и более слабого восстановителя. В общем случае возможность протекания какой-либо ОВР, как и любой другой реакции, может быть определена по знаку изменения энергии Гиббса. Кроме того, для количественной оценки окислительно-восстановительной активности веществ используют электрохимические характеристики окислителей и восстановителей (стандартные потенциалы окислительно-восстановительных пар). Основываясь на этих количественных характеристиках, можно построить ряды окислительно-восстановительной активности различных веществ. Известный вам ряд напряжений металлов построен именно таким образом. Этот ряд дает возможность сравнивать восстановительные свойства металлов в водных растворах, находящихся в стандартных условиях (с = 1 моль/л, Т = 298,15 К), а также окислительные свойства простых аквакатионов. Если в верхней строке этого ряда поместить ионы (окислители), а в нижней – атомы металлов (восстановители), то левая часть этого ряда (до водорода) будет выглядеть так:
| Li | K | Cs | Ba 2 | Rb | Sr 2 | Ca 2 | Na | Mg 2 | Be 2 | Al 3 | Mn 2 | Zn 2 | Cr 3 | Fe 2 | Co 2 | Ni 2 | Sn 2 | Pb 2 | H3O |
| Li | K | Cs | Ba | Rb | Sr | Ca | Na | Mg | Be | Al | Mn | Zn | Cr | Fe | Co | Ni | Sn | Pb | H2 |
В этом ряду окислительные свойства ионов (верхняя строка) усиливаются слева направо, а восстановительные свойства металлов (нижняя строка), наоборот, справа налево.
Учитывая различия в окислительно-восстановительной активности в разных средах, можно построить аналогичные ряды и для окислителей. Так, для реакций в кислотной среде (pH = 0) получается " продолжение" ряда активности металлов в направлении усиления окислительных свойств
| H3O | Cu 2 | I2 | O2 | Fe 3 | Ag | HNO2 | Br2 | O2 | MnO2 | Cr2O7 2 | Cl2 | PbO2 | MnO4 | H2O2 | O3 | CaO2 | Na2O2 | F2 |
| H2 | Cu | I | H2O2 | Fe 2 | Ag | NO | Br | H2O | Mn 2 | Cr 3 | Cl | Pb 2 | Mn 2 | H2O | H2O | H2O | H2O | HF |
Как и в ряду активности металлов, в этом ряду окислительные свойства окислителей (верхняя строка) усиливаются слева направо. Но, используя этот ряд, сравнивать восстановительную активность восстановителей (нижняя строка) можно только в том случае, когда их окисленная форма совпадает с приведенной в верхней строке; в этом случае она усиливается справа налево.
Рассмотрим несколько примеров. Чтобы узнать, возможна ли данная ОВР будем использовать общее правило, определяющее направление протекания окислительно-восстановительных реакций (реакции протекают в направлении образования более слабого окислителя и более слабого восстановителя).
1. Можно ли магнием восстановить кобальт из раствора CoSO4?
Магний более сильный восстановитель, чем кобальт, и ионы Co 2 более сильные окислители, чем ионы Mg 2 , следовательно, можно.
2. Можно ли раствором FeCl3 окислить медь до CuCl2 в кислотной среде?
Так как ионы Fe 3B более сильные окислители, чем ионы Cu 2 , а медь более сильный восстановитель, чем ионы Fe 2 , то можно.
3. Можно ли, продувая кислород через подкисленный соляной кислотой раствор FeCl2, получить раствор FeCl3?
Казалось бы нет, так как в нашем ряду кислород стоит левее ионов Fe 3 и является более слабым окислителем, чем эти ионы. Но в водном растворе кислород практически никогда не восстанавливается до H2O2, в этом случае он восстанавливается до H2O и занимает место между Br2 и MnO2. Следовательно такая реакция возможна, правда, протекает она довольно медленно (почему?).
4. Можно ли в кислотной среде перманганатом калия окислить H2O2?
В этом случае H2O2 восстановитель и восстановитель более сильный, чем ионы Mn 2B , а ионы MnO4 окислители более сильные, чем образующийся из пероксида кислород. Следовательно, можно.
Аналогичный ряд, построенный для ОВР в щелочной среде, выглядит следующим образом:
| SO4 2 | H2O | SO3 2 | CrO4 2 | NO3 | NO2 | Ag2O | O2 | I2 | MnO4 | HO2 | Br2 | Na2O2 | O3 | Cl2 | F2 |
| SO3 2 | H2 | S | [Cr(OH)6] 2 | NO2 | N2O | Ag | OH | I | MnO4 2 | OH | Br | OH | OH + O2 | Cl | F |
В отличие от " кислотного" ряда, этот ряд нельзя использовать совместно с рядом активности металлов.
Метод электронно-ионного баланса (метод полуреакций), межмолекулярные ОВР, внутримолекулярные ОВР, ОВР дисмутации (диспропорционирования, самоокисления-самовосстановления), ОВР конмутации, пассивация.
- Используя метод электронно-ионого баланса, составьте уравнения реакций, протекающих при добавлении к подкисленному серной кислотой раствору перманганата калия раствора а) H2S 8>; б) KHS; в) K2S; г) H2SO3; д) KHSO3; е) K2SO3; ё) HNO2; ж) KNO2; и) KI 2>; к) FeSO4; л) C2H5OH 3COOH>; м) CH3CHO; н) (COOH)22>; п) K2C2O4. Здесь и далее в необходимых случаях в фигурных скобках указаны продукты окисления.
- Составьте уравнения реакций, протекающих при пропускании следующих газов через подкисленный серной кислотой раствор перманганата калия: а) C2H22>; б) C2H42>; в) C3H4(пропин) 2 и CH3COOH>; г) C3H6; д) CH4; е) HCHO.
- То же, но раствор восстановителя добавлен к нейтральному раствору перманганата калия: а) KHS; б) K2S; в) KHSO3; г) K2SO3; д) KNO2; е) KI.
- То же, но в раствор перманганата калия предварительно добавлен раствор гидроксида калия: а) K2S 2SO4>; б) K2SO3; в) KNO2; г) KI 3>.
- Составьте уравнения следующих реакций , протекающих в растворе: а) KMnO4 + H2S . ;
б) KMnO4 + HCl . ;
в) KMnO4 + HBr . ;
г) KMnO4 + HI . - Составьте следующие уравнения ОВР диоксида марганца:
- К подкисленному серной кислотой раствору дихромата калия добавлены растворы следующих веществ: а) KHS; б) K2S; в) HNO2; г) KNO2; д) KI; е) FeSO4; ж) CH3CH2CHO; и) H2SO3; к) KHSO3; л) K2SO3. Составьте уравнения протекающих реакций.
- То же, но через раствор пропущены следующие газы: а) H2S; б) SO2.
- К раствору хромата калия, содержащему гидроксид калия, добавлены растворы а) K2S 2SO4>; б) K2SO3; в) KNO2; г) KI 3>. Составьте уравнения протекающих реакций.
- К раствору хлорида хрома(III) прибавили раствор гидроксида калия до растворения первоначально образовавшегося осадка, а затем – бромную воду. Составьте уравнения протекающих реакций.
- То же, но на последнем этапе был добавлен раствор пероксодисульфата калия K2S2O8, восстановивегося в процессе реакции до сульфата.
- Составьте уравнения реакций, протекающих в растворе:
- Составьте уравнения реакций, протекающих между твердым триоксидом хрома и следующими веществами: а) C; б) CO; в) S 2>; г) H2S; д) NH3; е) C2H5OH 2 и H2O>; ж) CH3COCH3.
- Составьте уравнения реакций, протекающих при добавлении в концентрированную азотную кислоту следующих веществ: а) S 2SO4>; б) P4<(HPO3)4>; в) графит; г) Se; д) I23>; е) Ag; ж) Cu; и) Pb; к) KF; л) FeO; м) FeS; н) MgO; п) MgS; р) Fe(OH)2; с) P2O3; т) As2O33AsO4>; у) As2S3; ф) Fe(NO3)2; х) P4O10; ц) Cu2S.
- То же, но при пропускании следующих газов: а) CO; б) H2S; в) N2O; г) NH3; д) NO; е) H2Se; ж) HI.
- Одинаково, или по-разному будут протекать реакции в следующих случаях: а) в высокую пробирку на две трети заполненную концентрированной азотной кислотой, поместили кусочек магния; б) на поверхность магниевой пластины поместили каплю концентрированной азотной кислоты? Составьте уравнения реакций.
- В чем отличие реакции концентрированной азотной кислоты с сероводородной кислотой и с газообразным сероводородом? Составьте уравнения реакций.
- Одинаково ли будут протекать ОВР при добавлении к концентрированному раствору азотной кислоты безводного кристаллического сульфида натрия и его 0,1 M раствора?
- Концентрированной азотной кислотой обработали смесь следующих веществ: Cu, Fe, Zn, Si и Cr. Составьте уравнения протекающих реакций.
- Составьте уравнения реакций, протекающих при добавлении в разбавленную азотную кислоту следующих веществ: а) I2; б) Mg; в) Al; г) Fe; д) FeO; е) FeS; ж) Fe(OH)2; и) Fe(OH)3; к) MnS; л) Cu2S; м) CuS; н) CuO; п) Na2Sкр; р) Na2Sр; с) P4O10.
- Какие процессы будут протекать при пропускании через разбавленный раствор азотной кислоты а) аммиака, б) сероводорода, в) диоксида углерода?
- Составьте уравнения реакций, протекающих при добавлении в концентрированную серную кислоту следующих веществ: а) Ag; б) Cu; в) графит; г) HCOOH; д) С6H12O6; е) NaClкр; ж) C2H5OH.
- При пропускании через холодную концентрированную серную кислоту сероводорода образуется S и SO2, горячая концентрированная H2SO4 окисляет серу до SO2. Составьте уравнения реакций. Как будет протекать реакция между горячей концентрированной H2SO4 и сероводородом?
- Почему хлороводород получают, обрабатывая кристаллический хлорид натрия концентрированной серной кислотой, а бромоводород и йодоводород этим способом не получают?
- Составьте уравнения реакций, протекающих при взаимодействии разбавленной серной кислоты с а) Zn, б) Al, в) Fe, г) хромом в отсутствии кислорода, д) хромом на воздухе.
- Составьте уравнения реакций, характеризующих окислительно-восстановительные свойства пероксида водорода:
В каких из этих реакций пероксид водорода является окислителем, а в каких – восстановителем?
Окислительно-восстановительные реакции

Разбираться в ОВР важно, чтобы хорошо сдать ЕГЭ по химии. Какие реакции называются окислительно-восстановительными, их типы, а также примеры окислителей и восстановителей — в нашей подробной статье.
28 декабря 2021
· Обновлено 3 июня 2022
Что такое ОВР
Окислительно-восстановительная реакция (ОВР) — это реакция, которая протекает с изменением степеней окисления.
В такой реакции всегда участвуют вещество-окислитель и вещество-восстановитель. Другие вещества могут выступать в качестве среды, в которой протекает данная реакция.
Конечно, в каждом правиле есть исключения. Например, реакция диспропорционирования галогенов в горячем растворе щелочи выглядит так: Br2 + KOH = KBrO3 + KBr + H2O. Здесь и окислителем, и восстановителем является простое вещество бром (Br2).
Теперь посмотрим внимательнее на вещества — участники окислительно-восстановительных реакций.
Окислитель — вещество, в состав которого входит ион или атом, который в процессе реакции будет принимать электроны, тем самым понижая свою степень окисления.
Восстановитель — вещество, в состав которого входит ион или атом, который в процессе реакции будет отдавать электроны, тем самым повышая свою степень окисления.
Из определений понятно, что реакция включает два противоположных по действиям явления: процесс окисления и процесс восстановления. Процесс восстановления — это процесс принятия электронов, а процесс окисления — процесс отдачи электронов. Оба процесса протекают одновременно: окислитель восстанавливается, а восстановитель окисляется.
Вот мы и узнали общие закономерности протекания окислительно-восстановительных реакций. Теперь давайте разберемся, какие вещества могут быть окислителями, а какие — восстановителями, и может ли одно вещество проявлять те и другие свойства.
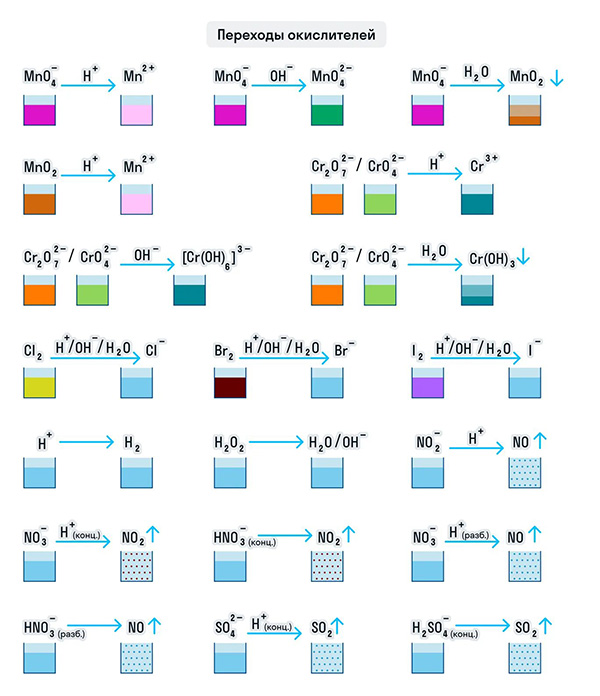
Примеры веществ-окислителей
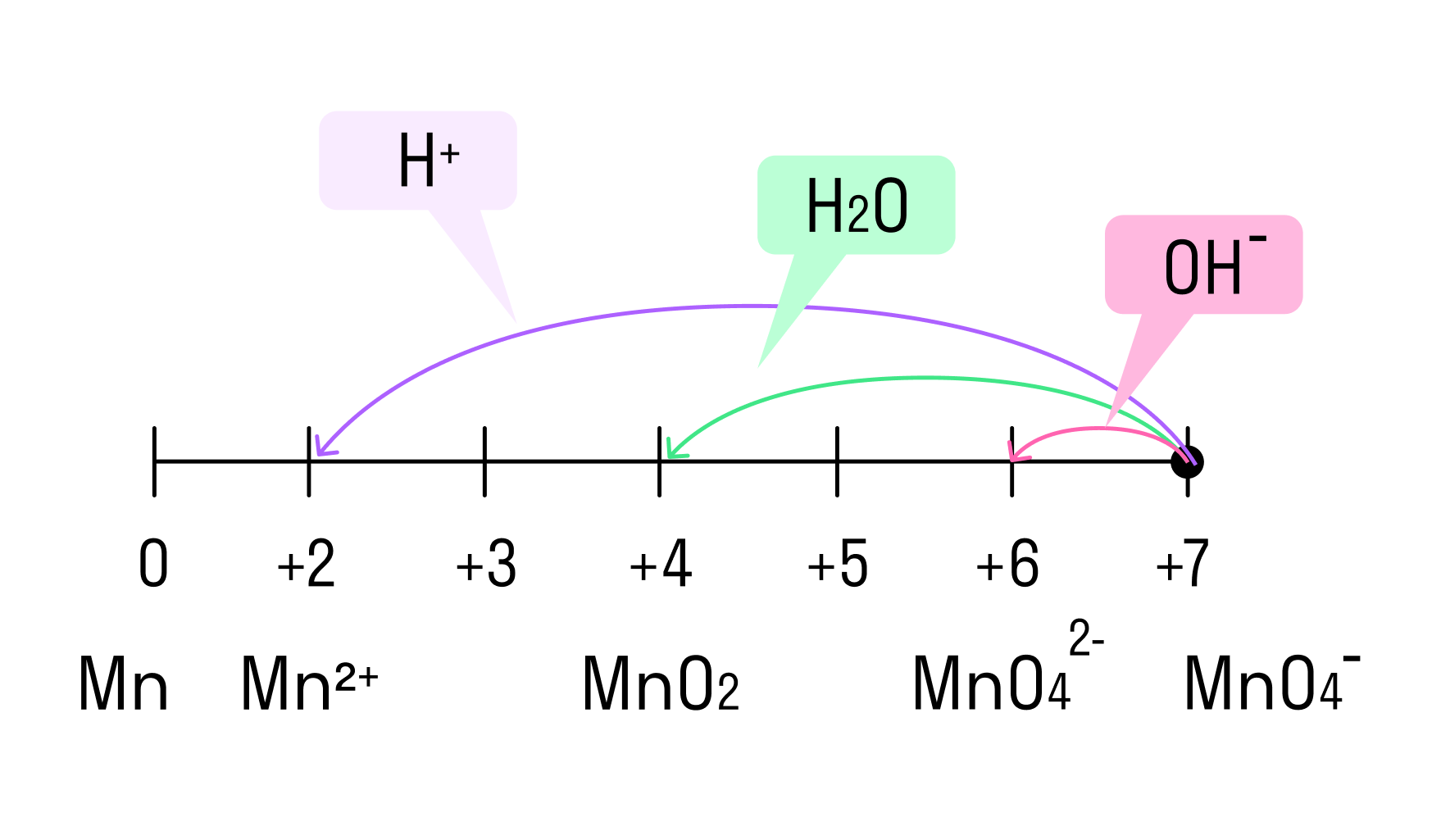
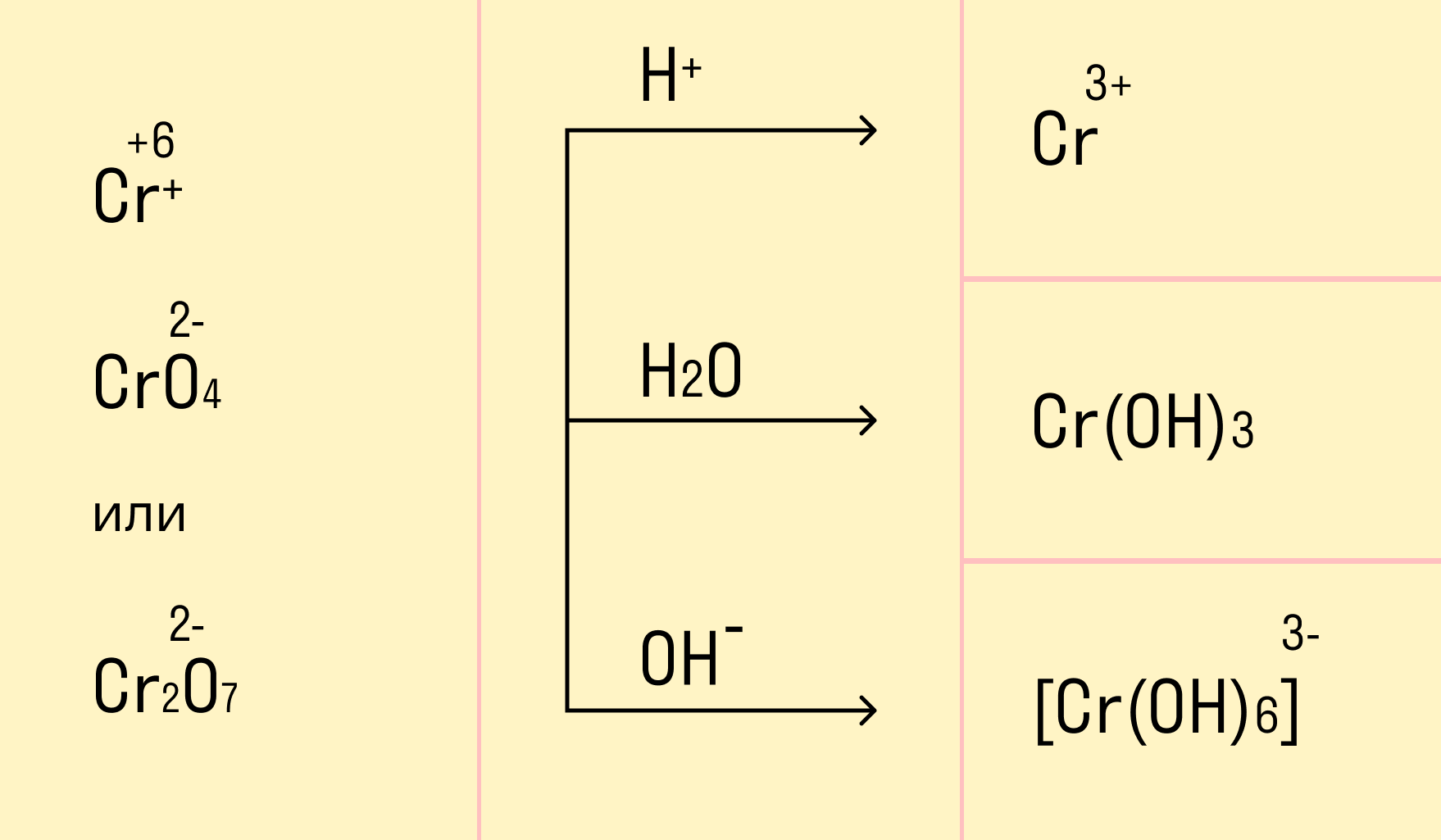
И марганец, и хром в кислой среде (H + ) образуют соли той кислоты, которая образовывала среду. В нейтральной среде (H2O) марганец превращается в оксид бурого цвета, а хром — в серо-зеленый нерастворимый в воде гидроксид. В щелочной среде (OH − ) марганец превращается в манганат (MnO4 2− ), а хром — в комплексное соединение светло-зеленого цвета.
Только окислителями могут быть простые вещества-неметаллы. Например, представители VIIA группы — галогены. Проявляя окислительные свойства в кислой среде, галогены восстанавливаются до соответствующих им галогеноводородных кислот: HF, HCl, HBr, HI. В щелочной среде образуются соли галогеноводородных кислот.
Кислород превращается в анион с устойчивой степенью окисления −2. А сера ведет себя как окислитель по отношению к водороду и металлам, образуя при этом сероводород и сульфиды.
Только окислителями могут быть и протон водорода (H + ) и катионы металлов в их высших степенях окисления при нескольких возможных. Ион Н + при взаимодействии с восстановителями переходит в газообразный водород (H2), а катионы металлов — в ионы с более низкой степенью окисления: 2CuCl2 + 2KI = CuCl + 2KCl + I2.
Рассмотрим как ведут себя сильные кислоты-окислители — азотная и серная. В зависимости от их концентрации меняются и продукты реакции.
Разбавленная азотная кислота никогда не реагирует с металлами с выделением водорода в отличие от разбавленной серной кислоты. Обе эти кислоты реагируют с металлами, стоящими в ряду активности после водорода.
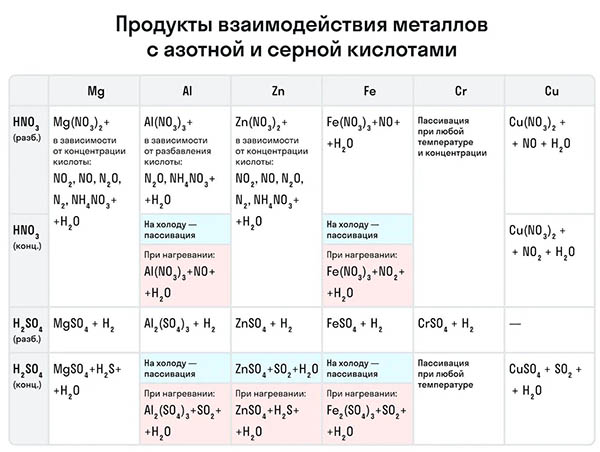
Эти кислоты проявляют окислительные способности и с некоторыми неметаллами, окисляя их до соответствующих кислот в высшей степени окисления неметалла-восстановителя.
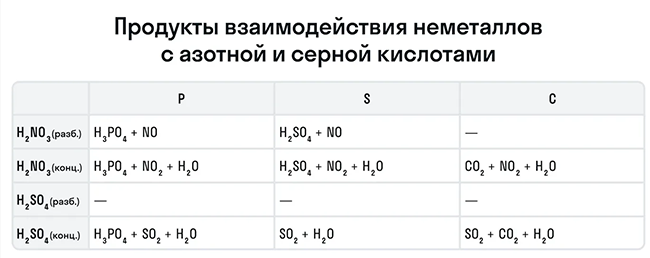
Для удобства мы собрали цвета переходов важнейших веществ-окислителей в одном месте.
Примеры веществ-восстановителей
Типичными восстановителями могут быть щелочные (IA) и щелочноземельные (IIA) металлы, цинк и алюминий, а также катионы металлов в своих низших степенях окисления при нескольких возможных. Например:
Типичными восстановителями также могут быть бескислородные кислоты и их соли. Например, H2S + 4Cl2 + 4H2O = 8HCl + H2SO4.
Гидриды активных металлов (щелочных и щелочноземельных) тоже являются типичными восстановителями. Например, NaH + H2O = NaOH + H2.
Для удобства мы собрали цвета переходов важнейших веществ-восстановителей в одном месте.

Пошаговый гайд от Екатерины Мурашовой о том, как перестать делать уроки за ребёнка и выстроить здоровые отношения с учёбой.

Окислительно-восстановительная двойственность
Окислительно-восстановительная двойственность — это способность атома проявлять как свойства окислителя, так и свойства восстановителя в зависимости от условия протекания химической реакции.
Разберем вещества, атомы которых обладают окислительно-восстановительной двойственностью.
По отношению к водороду и металлам сера играет роль окислителя: S + H2 = H2S.
При взаимодействии с сильными окислителями повышает свою степень окисления до +4 или +6: S + KMnO4 = K2SO4 + MnO2.
Кислородсодержащие соединения серы в степени окисления +4
Сера в сульфитах и сернистой кислоте при взаимодействии с сильными окислителями повышает степень окисления до +6: SO2 + 2HNO3 (конц) = H2SO4 + 2NO2.
С восстановителями соединения серы проявляют окислительные свойства, восстанавливаясь до степени окисления 0 или −2: SO2 + C = CO2 + S.
Пероксид водорода
Атом кислорода в пероксиде водорода находится в промежуточной степени окисления –1, и в присутствии восстановителей может понижать степень окисления до –2: 4H2O2 + PbS = PbSO4 + 4H2O.
Атом кислорода в пероксиде водорода находится в промежуточной степени окисления –1, и в присутствии окислителей может повышать степень окисления до 0: 3H2O2 + 2KMnO4 = 3O2 + 2MnO2 + 2KOH + 2H2O.
Простое вещество йод
Окислительная способность проявляется у йода в реакции с такими восстановителями, как сероводород, фосфор и металлы: I2 + H2S = S + 2HI.
Йод при взаимодействии с более сильными окислителями играет роль восстановителя: I2 + 5Cl2 + 6H2O = 2HIO3 + 10HCl.
Азотистая кислота и нитриты
При взаимодействии с более сильными окислителями азот повышает степень окисления до +5 и превращается либо в азотную кислоту из азотистой, либо в нитрат-анион из нитрит-аниона: 5NaNO2 + 2KMnO4 + 3H2SO4 = 5NaNO3 + 2MnSO4 + K2SO4 + 3H2O.
При взаимодействии с сильными восстановителями обычно происходит восстановление до NO (иногда до других соединений азота в более низких степенях окисления): 2HNO2 + 2HI = 2NO + I2 + 2H2O.
Для удобства мы собрали представителей типичных окислителей и восстановителей в одну схему.

Классификация окислительно-восстановительных реакций
Окислительно-восстановительные реакции можно поделить на четыре типа:
Рассмотрим каждую по отдельности.
Межмолекулярная ОВР — это реакция, окислитель и восстановитель которой являются различными веществами.
2KI + Br2 = 2KBr + I2, где Br2 — окислитель, а KI — восстановитель (за счёт I −1 ).
Внутримолекулярная ОВР — это реакция, в которой один атом является окислителем, а другой восстановителем в рамках одного соединения.
Пример такой окислительно-восстановительной реакции:
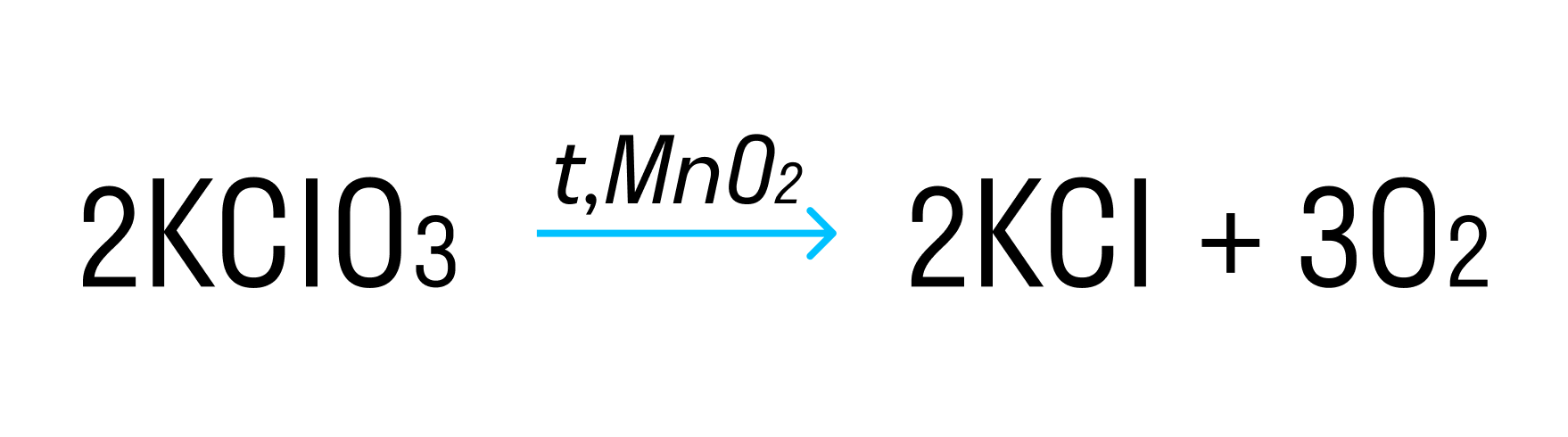
где Cl +5 — окислитель, а O −2 — восстановитель.
Термическое разложение нитратов — это внутримолекулярная ОВР. Вот схема разложения нитратов в зависимости от металла, входящего в состав соли.
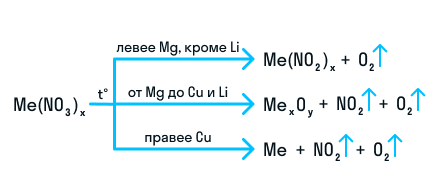
Исключение — разложение нитрата железа (II): 4Fe(NO3)2 = 2Fe2O3 + 8NO2 + O2. Здесь железо окисляется до +3 вопреки правилам. Иначе разлагается при нагревании и нитрат аммония: NH4NO3 = N2O + 2H2O.
Окислительно-восстановительная реакция диспропорционирования — это реакция, в ходе которой один и тот же атом является и окислителем, и восстановителем. Например, 3HNO2 = HNO3 + 2NO + H2O, где N +3 переходит в N +5 , являясь восстановителем, и N +3 переходит в N +2 , являясь окислителем.
Окислительно-восстановительная реакция контрпропорционирования — это реакция, в которой атомы одного и того же химического элемента в разных степенях окисления входят в состав разных веществ, при этом образуя новые молекулы одного и того же продукта.
Основные правила составления ОВР
Подобрать среди исходных веществ окислитель и восстановитель, а также вещество, которое отвечает за среду — при необходимости. Для этого нужно расставить степени окисления элементов и сравнить их окислительно-восстановительные свойства.
Составить уравнение реакции и записать продукты реакции. Следует помнить, что в кислой среде образуются соли одно-, двух- и трехзарядных катионов, а для создания среды чаще всего используют серную кислоту. В кислой среде невозможно образование оснóвных оксидов и гидроксидов, так как они вступят в реакцию с кислотой. В щелочной среде не могут образовываться кислоты и кислотные оксиды, а образуются соли.
Уравнять методом электронного баланса или методом полуреакций.
Составим алгоритм для уравнивания окислительно-восстановительных реакций методом электронного баланса.
Главное условие протекания ОВР — общее число электронов, отданных восстановителем, должно быть равно общему числу электронов, принятых окислителем.
Определите атомы, которые меняют свои степени окисления в ходе реакции.
Выпишите, сколько электронов принял окислитель и отдал восстановитель. Если восстановителей несколько, выписываем все.
Найдите НОК для суммарно отданных/принятых электронов.
Расставьте первые полученные коэффициенты перед окислителем и одним или несколькими восстановителями.
Уравняйте все присутствующие металлы в уравнении реакции.
Уравняйте кислотные остатки.
Уравняйте водород — в обеих частях его должно быть одинаковое количество.
Проверьте себя по кислороду — если все посчитано верно, то он сойдется.
Читайте также:
