Дайте определение металлам расскажите об особенностях их строения
Обновлено: 30.06.2024
Более 80% известных элементов образуют простые вещества — металлы. К ним относятся s -элементы I и II групп (исключение — водород), все d - и f - элементы, а также р-элементы III группы (кроме бора), IV группы (олово, свинец), V группы cурьма, висмут) и VI группы (полоний).
Особенности строения атомов металлов:
♦ небольшое число электронов на внешнем энергетическом уровне (как правило, один-три электрона). Исключение — атомы р-элементов IV-VI групп;
♦ малые заряды ядер и большие радиусы атомов по сравнению с атомами неметаллов данного периода;
♦ сравнительно слабая связь валентных электронов с ядром;
♦ низкие значения электроотрицательности.
В связи с этим атомы металлов легко отдают валентные электроны и превращаются в положительно заряженные ионы, т. е. м еталлы - восстановители.
Однако способность отдавать электроны проявляется у металлов неодинаково. В периодах с увеличением зарядов ядер атомов уменьшаются их радиусы, увеличивается число электронов на внешнем уровне и усиливается связь валентных электронов с ядром. Поэтому в периодах слева направо восстановительная способностъ атомов металлов уменьшается.
В главных подгруппах с возрастанием атомных номеров элементов увеличиваются радиусы их атомов и уменьшается притяжение (валентных электронов к ядру. Поэтому в главных подгруппах сверху вниз восстановительная активность атомов металлов возрастает. Следовательно, наиболее активными восстановителями являются щелочные и щелочно-земельные металлы.
Только некоторые металлы (золото, платина) находятся в природе в виде простых веществ (в самородном состоянии). Металлы, расположенные в электрохимическом ряду напряжений между оловом и золотом, встречаются как в виде простых веществ, так и в составе соединений. Большинство же металлов находятся в природе в виде соединений — оксидов, сульфидов, карбонатов и т. д. Распространенность металлов в природе уменьшается в ряду:
Содержание в земной коре (массовая доля, %) уменьшается
Получение металлов из их соединений — задача металлургии. Металлургия — наука о промышленном получении металлов из природного сырья. Различают черную (производство железа и его сплавов) и цветную (производство всех остальных металлов сплавов) металлургию. Любой металлургический процесс является процессом восстановления ионов металла различными восстановителями:
Me n + + пе - = Me
В зависимости от условий проведения процесса восстановления различают несколько способов получения металлов.
2. Способы получения металлов
Пирометаллургия — восстановление безводных соединений при высокой температуре
С или СО (карботермия)
Сульфиды предварительно обжигают:
2 = 2 ZnO + 2 S 02
ZnO + С = Zn + 2СО
Fe, Cu, Pb, Sn, Cd, Zn
Mn, Cr, W, Mo, Ti, V
H 2 (водородотермия)
Оксиды активных металлов (МgО, СаО, А1203 и др.) водородом не восстанавливаются
Cu, Ni, W, Fe, Mo, Cd, Pb
Электрометаллургия – восстановление электрическим током
2 1
электролиз 2 Na + Cl 2
Щелочные металлы, Be , Mg , Ca (из расплавленных хлоридов), Al – из расплавленного оксида
К Ni 2+ + 2е - = Ni 2
А 2Н2О - 4е - = O 2 + 4Н + 1
4 + 2Н2О электролиз 2 Ni + О2 + Н2 SO 4
Гидрометаллургия – восстановление из растворов солей
Металл, входящий в состав руды, переводят в раствор, затем восстанавливают более активным металлом:
Задания для самостоятельной работы
1. Атому магния в степени окисления +2 соответствует электронная конфигурация:
а ) 1s 2 2s 2 2 р 6 3s 2 3 р 6 ; в ) 1s 2 2s 2 2 р 4 ;
б) 1 s 2 2 s 2 2р 6 ; г ) 1 s 2 2 s 2 2р 6 3 s 2 ;
2. При частичном восстановлении водородом 30 г оксида кобальта. В получили смесь оксида и металла массой 26,8 г. Определите количество вещества водорода, вступившего в реакцию, и массовую долю кобальта в полученной смеси.
3. При электролизе раствора сульфата меди ( II ) в растворе образовалась кислота (около анода), на нейтрализацию которой затрачен раствор объемом 16 см (р = 1,05 г/см 3 ) с массовой долей гидроксида калия 6%. Вычислите массу меди, которая выделилась на катоде.
4. Для восстановления марганца из оксида марганца(1\/) путем алюмотермии было смешано 10,8 г алюминия и 26,2 г оксида. Определите, какое из исходных веществ осталось и какова его масса.
3. Физические свойства металлов
Все металлы обладают металлической кристаллической решеткой, особенности которой определяют их общие физические и механические свойства.
Общие свойства металлов:
1). Все металлы являются твердыми веществами, за исключением ртути.
2). Металлический блеск и непрозрачность металлов — результат отражения световых лучей.
3). Электро- и теплопроводность обусловлены наличием в металлических решетках свободных электронов.
С повышением температуры электропроводность металлов уменьшается, а с понижением температуры — увеличивается. Около абсолютного нуля для многих металлов характерно явление сверхпроводимости.
4). Металлы обладают ковкостью и пластичностью. По определению М. В. Ломоносова, «металлом называется светлое тело, которое ковать можно». Металлы легко прокатываются в листы, вытягиваются в проволоку, поддаются ковке, штамповке, прессованию.
Специфические физические свойства металлов:
1). по значению плотности металлы делят на легкие (плотность меньше 5 г/см 3 ): Na , Са , Mg , Al , Ti — и тяжелые (плотность больше 5 г/см 3 ): Zn , Cr , Sn , Mn , Ni , С u , Ag , Pb , Hg , Аи, W , Os - самый тяжелый ;
2). по значению температуры плавления — на легкоплавкие ( t пл < 1000 °С): Hg , Na , Sn , Pb , Zn , Mg , Al , Ca , Ag — и тугоплавкие ( t пл > 1000 ° C ): Au , Cu , Mn , Ni , Fe , Ti , Cr , Os , W - самый тугоплавкий;
3). из металлов самые мягкие — щелочные (их можно резать ножом), самый твердый — хром (царапает стекло).
4). по отношению к магнитным полям металлы подразделяют на три группы:
а) ферромагнитные — способны намагничиваться под действием даже слабых магнитных полей ( Fe , Со, Ni );
б) парамагнитные — проявляют слабую способность к намагничиванию даже в сильных магнитных полях ( Al , Cr , Ti );
в) диамагнитные — не притягиваются к магниту ( Sn , С u , Bi ).
4. Химические свойства металлов
Если атомы большинства неметаллов могут как отдавать, так и присоединять электроны, проявляя окислительно-восстановительную двойственность, то атомы металлов способны только отдавать валентные электроны, проявляя восстановительные свойства: Me - пе - = Me п+ (окисление)
Как восстановители металлы взаимодействуют с неметаллами, водой, растворами щелочей, кислот и солей.
1). Взаимодействие металлов с простыми веществами — неметаллами
Металлы при определенных условиях взаимодействуют с неметаллами, например с кислородом образуют оксиды:
Из щелочных металлов только литий сгорает на воздухе с образованием оксида:
Основной продукт окисления натрия — пероксид:
При горении других щелочных металлов образуются супероксиды, например:
Оксиды натрия и калия могут быть получены при нагревании смеси пероксида с избытком металла в отсутствие кислорода:
На реакции пероксида натрия с оксидом углерода (1 V ) основана регенерация воздуха в изолированных помещениях (например, на подводных лодках):
Что такое металлы и их строение
Определение металлов можно дать с позиций химии, физики и техники.
В химии металлы — это химические элементы, находящиеся в левой части периодической системы элементов Д. И. Менделеева, которые обладают особым механизмом взаимодействия валентных электронов (ионов) с ядром как в самих металлах, так и при вступлении в химические реакции с другими элементами, в том числе с металлами.
Физика характеризует металлы как твердые тела, обладающие цветом, блеском, способностью к плавкости (расплавлению) и затвердеванию (кристаллизации), тепло- и электропроводностью, магнитными и другими свойствами.
В технике металлы — это конструкционные материалы, обладающие высокой обрабатываемостью (ковкостью, штампуемостью, обрабатываемостью резанием, паяемостью, свариваемостью и др.), прочностью, твердостью, ударной вязкостью и рядом других ценных свойств, благодаря которым они находят широкое применение.
Русский ученый М. В. Ломоносов (1711 — 1765), исследуя металлы и неметаллы в своем труде «Первые основания металлургии или рудных дел», дал металлам определение: «Металлом называется светлое тело, которое ковать можно. Таких тел находим только шесть: золото, серебро, медь, олово, железо и свинец». Это определение М. В. Ломоносов дал в 1773 г., когда известны были только шесть металлов.
Из металлов, добываемых из недр земли, получают большую группу конструкционных материалов, применяемых в различных отраслях промышленности. В природе одни металлы встречаются в чистом, самородном виде, другие — в виде оксидов (соединений металла с кислородом), нитридов и сульфидов, из которых состоят различные руды этих металлов.
Самыми распространенными металлами, применяемыми в качестве конструкционных материалов, являются железо, алюминий, медь и сплавы на основе этих металлов.
К металлам относятся более 80 элементов периодической системы Менделеева. Все эти металлы подразделяются на две большие группы: черные металлы и цветные металлы.
Характерными признаками черных металлов являются темно-серый цвет, блеск, высокие плотность и температура плавления, твердость, прочность, вязкость и полиморфизм (аллотропия). По физикохимическим свойствам черные металлы подразделяют на пять групп:
- железистые (железо, кобальт, никель, марганец);
- тугоплавкие (вольфрам, рений, тантал, молибден, ниобий, ванадий, хром, титан и др.);
- урановые — актиниды (уран, торий, плутоний и др.);
- редкоземельные — лантаниды (лантан, церий, иттрий, скандий и др.);
- щелочно-земельные (литий, натрий, калий, кальций и др.).
Из этих пяти групп черных металлов особенно широкое применение в промышленном производстве находят железистые и тугоплавкие металлы.
Железистые металлы, кроме марганца, называют еще ферромагнетиками. Ферромагнетики способны намагничиваться и притягивать металлы своей группы.
К тугоплавким относятся металлы, которые имеют температуру плавления выше температуры плавления железа (1 539 °С): титан — 1 667 °С, ванадий — 1 902 °С, хром — 1 903 °С, молибден — 2 615 °С, ниобий — 2 460 °С, тантал — 2 980 °С, вольфрам — 3 410 °С. Тугоплавкие металлы в основном применяются как легирующие элементы в производстве жаропрочных, жаростойких, теплостойких и специальных сплавов, в том числе твердых сплавов и высоколегированных сталей.
2. Строение металлов
Атомно-кристаллическая структура металлов. Как известно, все вещества состоят из атомов, в том числе и металлы. Каждый металл (химический элемент) может находиться в газообразном, жидком или твердом агрегатных состояниях. Каждое агрегатное состояние будет иметь свои особенности, отличные друг от друга. В газообразном металле расстояние между атомами велико, силы взаимодействия малы и атомы хаотично перемещаются в пространстве; газ стремится к расширению в сторону большего объема. При понижении температуры и давления вещество переходит в жидкое состояние. Свойства жидкого вещества резко отличаются от свойств газообразного. В жидком металле атомы сохраняют лишь так называемый ближний порядок атомов, т. е. в объеме расположено небольшое количество атомов, а не атомы всего объема. При понижении температуры жидкий металл переходит в твердое состояние, которое имеет строгую закономерность расположения атомов.
Если условно провести вертикальные и горизонтальные линии связи через центры атомов, можно увидеть, что у металлов в твердом состоянии атомы расположены в строго определенном порядке и представляют собой множество раз повторяющиеся элементарные геометрические фигуры — параллелепипеды (рис. 1). Наименьшую геометрическую фигуру называют элементарной ячейкой. Элементарные ячейки, расположенные на горизонтальных и вертикальных кристаллографических плоскостях (рис. 2), образуют пространственную кристаллическую решетку.
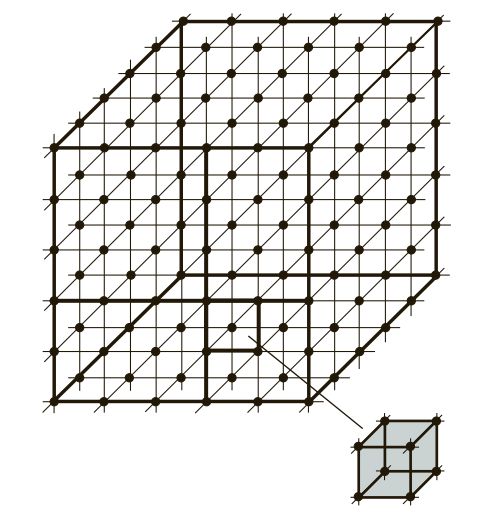
Рис. 1. Схема расположения элементарных геометрических ячеек в атомных решетках металлов и сплавов
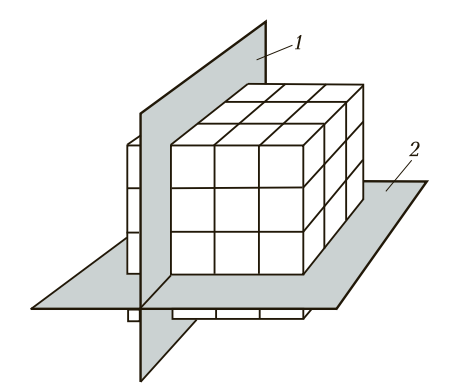
Рис. 2. Расположение кристаллографических плоскостей: 1 и 2 — соответственно горизонтальная и вертикальная кристаллографические плоскости
Элементарные кристаллические решетки характеризуют следующие основные параметры: расстояние между атомами по осям координат (по линиям связи), углы между линиями связи, координационное число — число атомов, находящихся на наиболее близком и равном расстоянии от любого атома в решетке. Форму элементарной ячейки рассматривают по кристаллографическим плоскостям в трех измерениях.
Таким образом, любой металл можно представить не как однородную цельную массу, а как массу, сложенную из множества элементарных ячеек. Блок элементарных атомных кристаллических ячеек образует атомно-кристаллическую ячейку (решетку). Если выделить эту элементарную ячейку, то в зависимости от металла получим следующие типы кристаллических ячеек (рис. 3): куб (К), объемно-центрированный куб (ОЦК), гранецентрированный куб (ГЦК), гексагональная плотноупакованная ячейка (ГПУ), гексагональная простая ячейка (Г) и др.
Простая кубическая ячейка (рис. 3, а) характерна для неметаллов, которые обладают наибольшими плотностью и удельным весом, и имеет восемь атомов, которые расположены в каждой вершине куба.
Объемно-центрированная кубическая ячейка (рис. 3, б ) состоит из восьми атомов, которые расположены по одному атому в каждой вершине куба, и одного, находящегося в центре куба на равных расстояниях от его граней. Эту форму атомной кристаллической ячейки имеют железо модификации Fe-α, ванадий, вольфрам, молибден, тантал и хром, т. е. в основном черные металлы.
Гранецентрированная кубическая ячейка (рис. 3, в) имеет 14 атомов — по одному атому в каждой вершине куба (восемь атомов) и по одному атому в центре каждой грани (шесть атомов). Гранецентрированную кубическую ячейку имеют алюминий, железо модификации Fe-γ, золото, кобальт, медь, никель, платина и серебро, в основном это цветные металлы и часть черных металлов.
Гексагональная плотноупакованная ячейка (рис. 3, г) состоит из 17 атомов. Форма геометрического тела, которую образуют эти атомы, является шестигранной призмой. При этом по шесть атомов расположены в каждой вершине верхнего и нижнего оснований, по одному атому в центре этих оснований и три атома в центре одной их трех граней (через грань). Гексагональную плотноупакованную ячейку имеют бериллий, кадмий, магний, ванадий, тантал.
Простая гексагональная ячейка (рис. 3, д) состоит из 12 атомов, которые расположены в вершинах верхнего и нижнего оснований шестигранной призмы. Такую кристаллическую ячейку имеют ртуть и цинк.
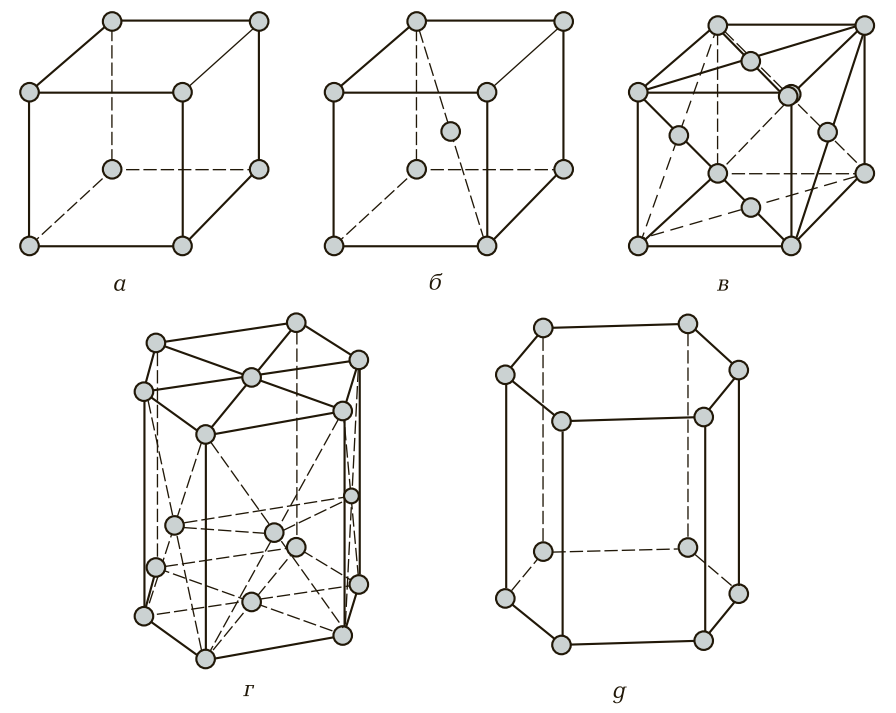
Рис. 3. Геометрические формы элементарных кристаллических ячеек: а — куб; б — объемно-центрированный куб; в — гранецентрированный куб; г — гексагональная плотноупакованная ячейка; д — гексагональная простая ячейка
Связь между атомами в кристаллической решетке и между решетками осуществляется за счет так называемой металлической связи. От прочности этой связи зависят прочность и твердость металлов. Чем выше эта связь, тем бо´льшую прочность и твердость имеют металлы. Механизм связи между атомами в решетке и между решетками имеет сложную физико-химическую природу.
В практике идеальное расположение кристаллических решеток обычно не наблюдается. Кристаллы, образуемые кристаллическими решетками, имеют искаженную геометрическую форму и различную величину.
Анизотропия металлов. Анизотропия (от гр. anisos — неравный и tropos — направление) — неодинаковость физических свойств среды (тела) в различных направлениях. Анизотропия предполагает зависимость свойств металлов от направления по плоскостям атомно-кристаллических решеток. Чем больше в плоскости атомов, тем выше свойства металлов. В горизонтальных плоскостях в любой форме атомно-кристаллических решеток больше, чем в вертикальных плоскостях. Следовательно, прочность металлов, испытанная в горизонтальном направлении, выше, чем в вертикальном. Анизотропия проявляется в процессе обработки конструкционных материалов давлением (проката, волочения, штамповки и других технологических способов получения заготовок и изделий).
На рис. 2 кристаллографические плоскости совпадают с линиями связи, проходящими через атомы металла. Форма элементарной кристаллической ячейки, расстояние между атомами и прочность металлической связи определяют физические, механические и технологические свойства металлов. Если исследуемый металл рассматривать по трем кристаллографическими плоскостям, по линиям связи между атомами, то можно заметить, что свойства по этим трем измерениям будут различны. Число атомов в этих плоскостях неодинаково. Металлическая связь между горизонтально и вертикально расположенными атомами также неодинакова. Это, в свою очередь, приводит к различной прочности металлов в продольном и поперечном направлениях. Например, предел прочности меди в продольном направлении будет в 2 раза больше, чем в поперечном.
Все металлы анизотропны, так как они состоят из кристаллов. Кристаллическое строение металлов обусловливает пластическую деформацию, т. е. изменение внешней формы и размеров под действием нагрузок без разрушения. Способность металлов и сплавов пластически деформироваться положена в основу их обработки давлением (прокатка, волочение, ковка, штамповка и прессование). При обработке давлением, например прокатке (рис. 4, а), происходит перемещение одного слоя атомных решеток по другому по кристаллографическим плоскостям (рис. 4, б).
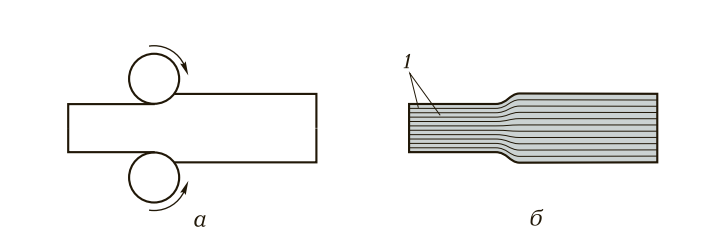
Рис. 4. Схема деформации металлов и сплавов (прокатка): а — деформация; б — скольжение металлов по кристаллографическим плоскостям в процессе деформации; 1 — кристаллографические плоскости
В процессе деформации металла при прокатке происходит не только изменение поперечных и продольных размеров заготовок, но и изменение микроструктуры металла.
Зерна под действием давления прокатных валков искажаются, приобретая продолговатую или пластинчатую форму, а затем преобразуются в волокна. Изменение микроструктуры металла в процессе деформации условно показано на рис. 5.
Процесс кристаллизации. Рассмотрим, как происходит образование кристаллов у чистых металлов. Установлено, что процесс кристаллизации металлов из жидкого состояния в твердое идет в две стадии:
- образование центров кристаллизации;
- рост кристаллов вокруг этих центров (рис. 6).
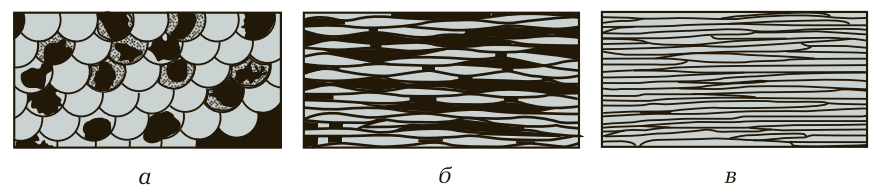
Рис. 5. Изменение микроструктуры металла в процессе деформации: а — микроструктура металла до деформации; б — микроструктура металла после первой операции деформации; в — микроструктура металла после окончательной деформации
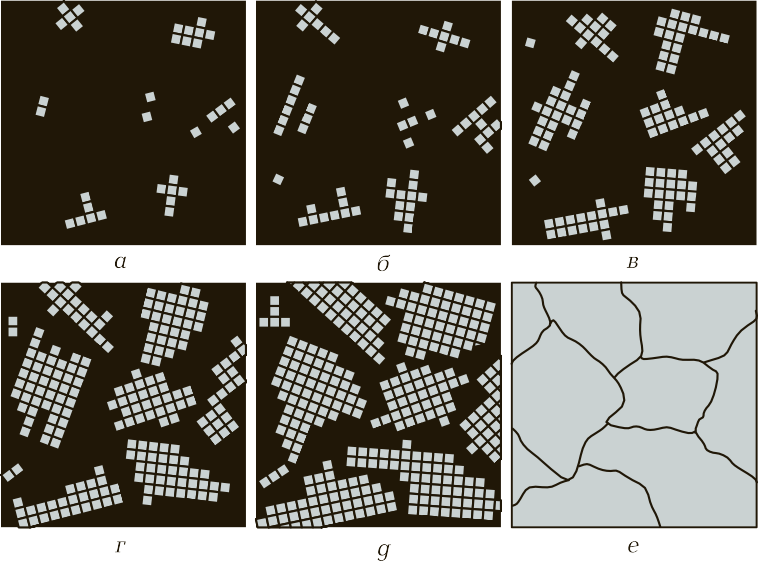
Рис. 6. Процесс кристаллизации металлов и сплавов: а — е — последовательные этапы процесса
Далее вновь появляются новые центры, и происходит рост твердой фазы вокруг первичных и вторичных центров. Процесс происходит до того момента, пока образованные таким образом кристаллы не будут соприкасаться друг с другом и не будет наличия жидкой фазы металла (см. рис. 6, г — е). Когда образование кристалла идет в жидкой фазе (в расплавленном металле), он будет иметь правильную форму, т. е. состоять из определенных геометрических фигур правильной формы. Когда кристаллы начинают соприкасаться друг с другом, а процесс затвердевания еще не закончен, тогда происходят искажения формы зерен. В практике замечено, что когда идет быстрое охлаждение, образуются мелкие зерна — мелкозернистая структура. При медленном охлаждении появление новых центров кристаллизации замедляется, но происходит рост зерна вокруг первичных центров кристаллизации. В этом случае металл будет иметь крупнозернистую структуру.
Процесс образования кристаллов в жидком состоянии и перехода металла в твердое состояние называется первичной кристаллизацией. Величина и форма зерна влияет на механические свойства металлов. Чем зерна мельче и чем правильнее их форма, тем большую твердость и прочность будет иметь металл. Чем зерна больше и чем искаженнее их форма, тем ниже твердость и прочность металла.
Аллотропия металлов. Такие металлы, как железо, кобальт, никель и др., обладают способностью изменять кристаллическую решетку при нагревании в твердом состоянии. Процесс изменения кристаллических решеток в твердом состоянии называется вторичной кристаллизацией, или аллотропией, а состояние вещества (металла) при наличии нескольких кристаллических решеток при изменении параметров (давления, температуры) — аллотропическими модификациями, или полиморфизмом. Такие металлы, как железо, молибден, вольфрам, литий в твердом состоянии при нормальной температуре имеют объемно-центрированную кубическую ячейку; алюминий, медь, серебро в твердом состоянии при нормальной температуре имеют форму гранецентрированной кубической ячейки.
На рис. 7 представлены кривые нагрева и охлаждения металла (на примере марганца). Аллотропные состояния (модификации), имеющие те или иные кубические ячейки, обозначаются греческими буквами. Первоначальное аллотропное состояние при нормальной температуре обозначается буквой α, при дальнейших повышении температуры и перекристаллизации металла — буквами β, γ, δ и т. д. При охлаждении металлов и сплавов процесс аллотропного превращения происходит в обратном порядке, как правило при тех же температурах.
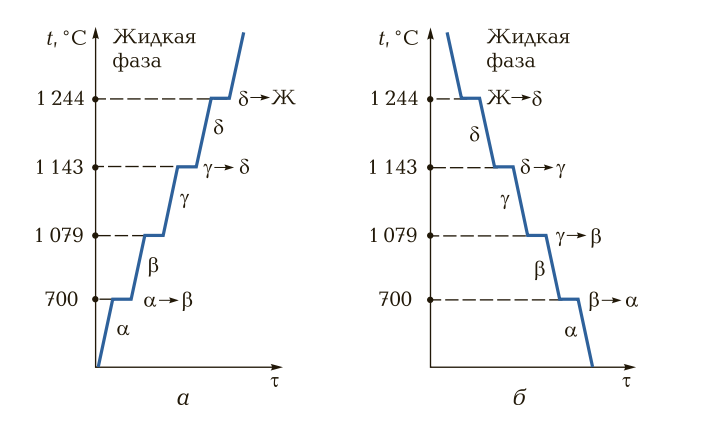
Рис. 7. Кривые нагрева (а) и охлаждения (б) марганца: t — температура; τ — время
Общие сведения о металлах и сплавах
Металлы — кристаллические вещества, характеризующиеся высокими электро- и теплопроводностью, ковкостью, способностью хорошо отражать электромагнитные волны и другими специфическими свойствами. Свойства металлов обусловлены их строением: в их кристаллической решетке есть не связанные с атомами электроны, которые могут свободно перемещаться.
В технике обычно применяют не чистые металлы, а сплавы, что связано с трудностью получения чистых веществ, а также с необходимостью придания металлам требуемых свойств.
Сплавы — это системы, состоящие из нескольких металлов или металлов и неметаллов. Сплавы обладают всеми характерными свойствами металлов. В строительстве применяют сплавы железа с углеродом (сталь, чугун), меди и олова (бронза) и меди и цинка (латунь) и др. На практике термин «металлы» распространяют и на сплавы, поэтому далее он относится и к металлическим сплавам.
Применяемые в строительстве металлы делят на две группы: черные и цветные.
К черным металлам относятся железо и сплавы на его основе (чугун и сталь).
Сталь — сплав железа с углеродом (до 2,14%) и другими элементами. По химическому составу различают стали углеродистые и легированные, а по назначению — конструкционные, инструментальные и специальные.
Чугун — сплав железа с углеродом (более 2,14%), некоторым количеством марганца (до 2%), кремния (до 5%), а иногда и других элементов. В зависимости от строения и состава чугун бывает белый, серый и ковкий.
К цветным металлам относятся все металлы и сплавы на основе алюминия, меди, цинка, титана и др.
Широкое использование металлов в строительстве и других отраслях экономики объясняется сочетанием у них высоких физико-механических свойств с технологичностью.
Металлы обладают высокой прочностью, причем прочность на изгиб и растяжение у них практически такая же, как и на сжатие (у каменных материалов прочность на изгиб и растяжение в 10… 15 раз ниже прочности на сжатие). Так, прочность стали более чем в 10 раз превышает прочность бетона на сжатие и в 100…200 раз прочность на изгиб и растяжение; поэтому, несмотря на то что плотность стали (7850 кг/м ) в 3 раза выше плотности конструкционного бетона (2400 + 50 кг/м ), металлические конструкции при той же несущей способности значительно легче и компактнее бетонных. Этому способствует также высокий модуль упругости стали (в 10 раз выше, чем у бетона и других каменных материалов). Еще более эффективны конструкции из легких сплавов.
Металлы очень технологичны: во-первых, изделия из них можно получать различными индустриальными методами (прокатом, волочением, штамповкой и т. п.), во-вторых, металлические изделия и конструкции легко соединяются друг с другом с помощью болтов, заклепок и сварки.
Однако с точки зрения строителя металлы имеют и недостатки. Высокая теплопроводность металлов требует устройства тепловой изоляции металлоконструкций зданий. Хотя металлы негорючи, но металлические конструкции зданий необходимо специально защищать от действия огня. Это объясняется тем, что при нагревании прочность металлов резко снижается и металлоконструкции теряют устойчивость и деформируются. Большой ущерб экономике наносит коррозия металлов. Металлы широко применяют в других отраслях промышленности, поэтому их использование в строительстве должно быть обосновано экономически.
Наука, изучающая состав, строение и свойства металлов и сплавов, а также зависимость между внутренним строением (структурой) и свойствами металлических сплавов называется металловедением.
Отличительными особенностями металлов являются: блеск, ковкость, непрозрачность, теплопроводность и электропроводность.
Таким образом, под термином «металлы» понимают всю группу металлических материалов — чистые металлы и сплавы. Чистые металлы используют только в тех случаях, когда от материала требуются высокие показатели теплопроводности, электропроводности и высокая температура плавления. Эти свойства у них всегда выше, чем у сплавов.
Основными материалами при монтаже металлоконструкций, трубопроводов и оборудования являются сплавы, имеющие по сравнению с чистыми металлами следующие преимущества: – более высокую прочность; – способность изменять свойства при изменении химического состава; » – способность улучшать свойства под влиянием термической обработки; – более низкую температуру плавлеиия; – большую текучесть в расплавленном состоянии; – меньшую усадку.
Указанные свойства сплавов имеют большое практическое значение, так как позволяют получать всевозможные металлоконструкции с показателями, отвечающими требуемым эксплуатационным условиям.
Применяемые в строительстве сплавы делят на две группы:
I группа — сплавы на основе железа (сталь, чугун);
II группа—сплавы на основе металлов (сплавы на медной, алюминиевой, магниевой и другой основе — бронза, латунь, силумины и др.).
К физическим свойствам металлов относятся: удельный вес, теплопроводность, электропроводность и температура плавления.
Удельный вес — это вес 1 см3 металла, сплава или любого другого вещества, выраженный в граммах. Например, удельный вес железа равен 7,88 г/см3. Удельные веса наиболее распространенных металлов приведены в табл. 1.
Теплопроводность — способность металлов и сплавов проводить тепло. Теплопроводность измеряется количеством тепла, которое проходит по металлическому стержню сечением 1 см2 за 1 мин.
Электропроводность — способность металлов и, сплавов проводить электричество. Это свойство наиболее характерно для чистых металлов. Для сплавов более характерным является свойство, обратное электропроводности — электросопротивление.
Удельным электрическим сопротивлением называется сопротивление проводника сечением 1 мм2 и длиной 1 м, выраженное в омах.
Температура плавления — степень нагрева, при которой металл переходит из твердого состояния в жидкое (табл. 1).
К механическим свойствам металлов и сплавов относят: твердость, прочность, упругость, пластичность.
Эти свойства обычно являются решающими показателями, определяющими способность металлов сопротивляться прилагаемым к детали, узлам и металлоконструкциям внешним нагрузкам, характеризующим пригодность сплава” или изделия к различным условиям эксплуатации.
Твердость — способность металла сопротивляться внедрению в его поверхность другого, более твердого тела. ,
Прочность — способность металла сопротивляться разрушению при действии на него нагрузки.
Упругость—способность металла принимать первоначальную форму и размеры после прекращения действия нагрузки.
Пластичность (вязкость) — способность металла изменять первоначальные формы и размеры под действием нагрузки и сохранять приданные формы и размеры после прекращения ее действия.
К технологическим свойствам относят обрабатываемость резанием, ковкость, жидкотекучесть, усадку, свариваемость и другие свойства, определяющие пригодность материала к обработке тем или иным способом.
Обрабатываемость резанием — способность металла более или менее легко обрабатываться острым режущим инструментом.
Ковкость — способность металла поддаваться обработке давлением, принимать новую форму и размеры под влиянием прилагаемой нагрузки без нарушения целостности.
Жидкотекучесть — способность расплавленного металла или сплава заполнять литейную форму.
Усадка—уменьшение объема отливки при охлаждении сплава.
Свариваемость — способность металлов образовывать прочные соединения отдельных металлических заготовок путем их местного нагрева до расплавленного или пластического состояния.
Химические свойства металлов — это способность металлов вступать в соединения с различными веществами, и в первую очередь с кислородом. Чем легче металл вступает в соединение с другими элементами, тем легче он разрушается. Разрушение металлов и сплавов под действием окружающей среды называется коррозией.
Лекция 1. Общая характеристика металлов
1. Особенности строения атомов металлов. Положение металлов в ПС.
2. Строение простых веществ-металлов. Металлическая связь и металлическая кристаллическая решетка.
3. Физические свойства металлов.
4. Химические свойства металлов.
5. Нахождение в природе и общие способы получения металлов.
6. Понятие про коррозию.
1. Внешний электронный уровень элементов, которые относят к металлам заполнен электронами менее чем наполовину (обычно 1-2). Обычно это s-электроны. К типичным металлам (т.е. проявляющим металлические свойства в максимальной степени) относят s-элементы (элементы 1 и 2 группы, главных подгрупп), т.е. те у которых только начинается заполнение нового слоя. Причем металлические свойства усиливаются с увеличением радиуса атомов (числа электронных слоев). К металлам относят также все d элементы (т.е. те у которых идет заполнение d-подуровня предпоследнего слоя), они расположены в побочных подгруппах во всех группах. d элементы называют переходными металлами, нетипичными. К металлам относятся и f- элементы (лантаноиды и актиноиды, которые располагают обычно отдельными строками внизу таблицы
2. Металлы имеют кристаллическое, т.е. упорядоченное строение. Часть атомов в кристаллической решетке ионизирована, т.е. потеряла электроны внешнего электронного слоя и свободные электроны равномерно распределены по всему кристаллу. Они присоединяются к ионам металла и те превращаются в атомы, а другие атомы металла в это время теряют свои электроны и превращаются в ионы. Т.е. происходит своеобразный обмен электронами. Валентные электроны находятся одновременно во владении всех атомов и ионов металла (т.е. притягиваются к ним) и называются «электронным газом. Такая связь между атомами в кристалле металла называется металлической. И кристаллическая решетка металлов тоже называется металлической. Металлы имеют немолекулярное строение. Металлическая связь нелокализована между определенными атомами.
3. Общие физические свойства металлов обусловлены сходством в строении кристаллической решетки и одинаковом типе химической связи.
Эта связь достаточно прочная, поэтому металлы при н.у. находятся в твердом агрегатном состоянии. Исключение – ртуть Hg с температурой плавления (-39металлы легкоплавкие (менее 100 ) и другие щелочные металлы, магний, алюминий… Есть и тугоплавкие(более 100 ), а также хром, молибден, медь, титан, железо…
Металлическая кристаллическая решетка плотная и поэтому все металлы непрозрачные и отражают падающий свет (белый цвет, металлический блеск). Исключением являются золото и медь, которые поглощают часть спектра и имеют желтый цвет.
Все металлы могут проводить электрический ток. Это свойство обусловлено наличием подвижных электронов в кристаллической решетке. При обычных условиях самой высокой электропроводностью обладают металлы подгруппы меди: Ag, Cu, Au и алюминий. Эти металлы используются как проводники в электротехнике и радиоэлектронике. Высокое сопротивление имеют вольфрам, никель, хром. Из них изготавливают нагревательные элементы электроприборов.
Металлы проводят не только электрический ток, но и тепло. Металлы, хорошо проводящие электрический ток, имеют высокую теплопроводность. Это тоже связано с возможностью электронов перемещаться и переносить тепловую энергию.
Все металлы в той или другой степени пластичны (т.е. они необратимо деформируются при механических нагрузках), их можно ковать. Самым пластичным является золото, из него можно получить нить в 500 раз тоньше человеческого волоса, т.е. практически невидимую. Мягкими являются также и щелочные металлы. Очень твердыми металлами считаются хром и вольфрам. А сурьма при комнатной температуре настолько хрупкая, что ее можно растереть в порошок. Пластическая деформация объясняется тем, что у металлов не происходит разрыва химических связей в металлической кристаллической решетке, ионы и атомы просто смещаются относительно друг друга.
Все металлы не растворимы в воде, но растворяются друг в друге. Такие растворы называют сплавами.
По плотности металлы делят на легкие (меньше 5 г/см 3 ) и тяжелые. К легким металлам относятся щелочные и щелочноземельные металлы, титан, алюминий. К тяжелым относятся цинк, железо, медь, ртуть, свинец, золото. Самым тяжелым является осмий (22,6 г/см 3 ).
4. Общие химические свойства металлов тоже определяются общими чертами в их строении. Все они завершают внешний электронный слой отдавая валентные электроны. Следовательно, в химических реакциях простые вещества - металлы всегда являются восстановителями.
Чем легче атомы отдают электроны, тем более сильным восстановителем является металл. Но надо помнить, что ионы металлов способны принимать электроны, т.е. проявлять окислительную способность. Причем чем легче атом теряет электроны, тем хуже принимает их соответствующий ион. Т.е. например, натрий активный восстановитель, но ион натрия окислительной активности не проявляет. Малоактивный атом меди неохотно теряет свои электроны, а ион меди является достаточно сильным окислителем.
Окислителями металлов могут выступать разные вещества, но в природе и технике важнейшими считают газообразный кислород и ион водорода, который присутствует в воде и растворах кислот. Рассмотрите внимательно таблицу.
| Li | K | Ca | Na | Mg | Al | Mn | Zn | Cr | Fe | Ni | Sn | Pb | H2 | Cu | Hg | Ag | Pt | Au | |
| Восстановительная способность металлов в свободном состоянии | |||||||||||||||||||
| Взаимодействие с кислородом воздуха | Быстро окисляется при обычной температуре | Медленно окисляется при обычной температуре или при нагревании | Не окисляются | ||||||||||||||||
| Взаимодействие с водой | При обычной температуре выделяется H2 и образуется гидроксид | При нагревании выделяется водород, и образуются оксиды | Не вытесняют водород из воды | ||||||||||||||||
| Взаимодействие с кислотами | Вытесняют водород из разбавленных кислот ( кроме HNO3) | Не вытесняют водород из разбавленных кислот | |||||||||||||||||
| Реагируют с HNO3 и конц. H2SO4 | Растворяются только в «царской водке» | ||||||||||||||||||
| Нахождение в природе | Только в соединениях | В соединениях и в свободном виде | Главным образом в свободном виде | ||||||||||||||||
| Способы получения | Электролиз расплавов | Восстановление углём, СО, активными металлами, электролиз водных растворов | |||||||||||||||||
| Окислительная способность ионов металлов | Li | K | Ca | Na | Mg | Al 3 | Mn | Zn | Cr | Fe | Ni | Sn | Pb | H | Cu | H Hg | Ag | Pt | Au |
Окисление металлов: Zn + O2 → ZnO
Взаимодействие активных металлов с водой: K + H2O → KOH + H2
Взаимодействие металлов с кислотами: Mn + HCl → MnCl2+ H2
Взаимодействие металлов с другими окислителями: Fe + CuSO4 → FeSO4 + Cu
5. Те металлы, которые могут окисляться ионами водорода из природной воды (обычно подкисленной взаимодействием с различными кислотными оксидами) или кислородом воздуха в свободном виде, т.е. в виде простого вещества в природе не могут существовать. Значит, в свободном состоянии обычно встречаются «благородные металлы» золото, серебро и платина. Некоторые малоактивные металлы тоже могут встречаться, но такие месторождения – редкие, и к настоящему времени хозяйственного значения не имеют. Но именно это было причиной, по которой первыми металлами известными человечеству были медь, ртуть, свинец, олово… Неблагородные металлы в природе встречаются в виде соединений. Для активных металлов это соли: хлориды, сульфаты, фосфаты, карбонаты. Причем, чем ниже растворимость этих соединений, тем больше вероятность их встретить. Менее активные металлы встречаются в виде оксидов или в виде сульфидов. Причем до железа – преимущественно оксиды, а после – преимущественно сульфиды.
Естественно, что и способы получения металлов тоже зависят от их активности. Получение благородных металлов обычно заключается в отделении их от пустой породы. Существует много методов для этого, они описаны в художественной и специальной литературе. Получение металлов из их соединений можно назвать одним словом: «восстановление». Т.е. химическая суть этих процессов – заставить ионы металла принять электроны. Что можно использовать как восстановитель? Какие вещества легко расстаются со своими электронами? Правильно, металлы! Значит активные металлы можно использовать для получения менее активных из их оксидов. Например:
Mg + SnO2 → MgO + Sn
Такие способы получения металлов в зависимости от восстановителя называются магнийтермия, кальцийтермия, натрийтермия…
Хорошим восстановителем является и водород:
Но у этих восстановителей (и водорода и активных металлов) есть существенный недостаток – высокая стоимость. Ведь в природе они в свободном виде не встречаются, а их получение требует больших затрат. Поэтому такие восстановители используют только если это экономически обосновано, т.е. для получения редких и дорогих металлов. А металлы, которые надо получать в очень большом количестве (железо), восстанавливают более дешевыми восстановителем – углеродом. Его применяют в виде кокса, а ранее использовали древесный уголь.
А если металл находится в природе не в виде оксида, а в виде сульфида, то руду предварительно подвергают обжигу, а уже потом восстанавливают образовавшийся оксид. Например:
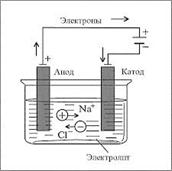
А как восстанавливают самые активные металлы? Где найти такой сильный восстановитель? Таким активным восстановителем будет электрический ток. Процесс называют электролизом. Оксид металла или его хлорид расплавляют и через расплав пропускают электрический ток. Например:
Лекция по Химии на тему "Металлы"
1. Где расположены металлы в периодической системе химических элементов Д.И.Менделеева?
2. Каковы особенности строения атомов металлов?
3. В чём различие в строении внешнего энергетического уровня у металлов и неметаллов?
4. Сколько наружных электронов имеют атомы металлов главных и побочных подгрупп?
5. В каких формах могут находиться металлы в природе?
6. Как устроена кристаллическая решетка металлов?
7. Каковы физические свойства металлов?
8. Как можно получить металлы из их соединений?
9. Как ведут себя атомы металлов в химических реакциях и почему?
10. Какие свойства – окислителей или восстановителей – проявляют металлы в химических реакциях?
11. Расскажите об электрохимическом ряде напряжений металлов.
12. Перечислите реакции, в которые могут вступать металлы.
13. Каково значение металлов в жизни человека?
1. Особенности электронного строения металлов.
Металлы - это химические элементы, атомы которых отдают электроны внешнего (а иногда предвнешнего) электронного слоя, превращаясь в положительные ионы. Металлы – восстановители Ме 0 – nе = Ме n+ . Это обусловлено небольшим числом электронов внешнего слоя (в основном 1 - 3), большим радиусом атомов, вследствие чего эти электроны слабо удерживаются с ядром.
2. Положение металлов в ПСХЭ.
Легко увидеть, что большинство элементов ПСХЭ – металлы (92 из 114).
Металлы размещены в левом нижнем углу ПСХЭ. Это все элементы, расположенные ниже диагонали В – А t , даже те у которых на внешнем слое 4 электрона ( Je , Sn , Pb ), 5 электронов ( Sb , Di ), 6 электронов ( Po ), так как они отличаются большим радиусом. Среди них есть s и p -элементы – металлы главных подгрупп, а также d и f металлы, образующие побочные подгруппы.
В соответствии с местом, занимаемым в периодической системе, различают переходные (элементы побочных подгрупп) и непереходные металлы (элементы главных подгрупп). Металлы главных подгрупп характеризуются тем, что в их атомах происходит последовательное заполнение электронных s- и р-подуровней. В атомах металлов побочных подгрупп происходит достраивание d- и f-подуровней.
Закономерности в изменении свойств элементов – металлов.
Признаки сравнения
В главной подгруппе
Число электронов на внешнем слое
У элементов – металлов побочных подгрупп свойства чуть-чуть другие.
В побочных подгруппах ( Cu , Ag , Au ) – активност ь элементов – металлов падает. Эта закономерность наблюдается и у элементов второй побочной подгруппы Zn , Cd , Hg . У элементов побочных подгрупп – это элементы 4-7 периодов – с увеличением порядкового элемента радиус атомов изменятся мало, а величина заряда ядра увеличивается значительно, поэтому прочность связи валентных электронов с ядром усиливается, восстановительные свойства ослабевают.
3. Металлическая химическая связь. Кристаллические решетки.
Связь в металлах между («атом-ионами» ) посредством (большого количества не связанных с ядрами подвижных электронов) называется (металлической связью) .
Все металлы являются кристаллическими телами, имеющими определенный тип кристаллической решетки, состоящей из малоподвижных положительно заряженных ионов, между которыми движутся свободные электроны (так называемый электронный газ). Такой тип структуры называется металлической связью.
Тип решетки определяется формой элементарного геометрического тела, многократное повторение которого по трем пространственным осям образует решетку данного кристаллического тела.
Обобщим сведения о типе химической связи, образуемой атомами металлов и строение кристаллической решетки:
- сравнительно небольшое количество электронов одновременно связывают множество ядер, связь делаколизована;
- валентные электроны свободно перемещаются по всему куску металла, который в целом электронейтрален;
- металлическая связь не обладает направляемостью и насыщенностью.
4. Физические свойства металлов
В соответствие именно с таким строением металлы характеризуются общими физическими свойствами.
а) твердость – все металлы кроме ртути, при обычных условиях твердые вещества. Самые мягкие – натрий, калий. Их можно резать ножом; самый твердый хром – царапает стекло.
б) плотность. Металлы делятся на мягкие (5г/см³) и тяжелые (меньше 5г/см³).
в) плавкость. Металлы делятся на легкоплавкие и тугоплавкие.
г) электропроводность, теплопроводность металлов обусловлена их строением. Хаотически движущиеся электроны под действием электрического напряжения приобретают направленное движение, в результате чего возникает электрический ток.
При повышении температуры амплитуда движения атомов и ионов, находящихся в узлах кристаллической решетки резко возрастает, и это мешает движению электронов, и электропроводность металлов падает.
д) металлический блеск – электроны, заполняющие межатомное пространство отражают световые лучи, а не пропускают как стекло. Поэтому все металлы в кристаллическом состоянии имеют металлический блеск. Для большинства металлов в ровной степени рассеиваются все лучи видимой части спектра, поэтому они имеют серебристо-белый цвет. Только золото и медь в большой степени поглощают короткие волны и отражают длинные волны светового спектра, поэтому имеют желтый цвет. Самые блестящие металлы – ртуть, серебро, палладий. В порошке все металлы, кроме Al и Mg , теряют блеск и имеют черный или темно-серый цвет.
е) пластичность. Механическое воздействие на кристалл с металлической решеткой вызывает только смещение слоев атомов и не сопровождается разрывом связи, и поэтому металл характеризуется высокой пластичностью.
Некоторые металлы, например, железо, титан, олово и др. способны по достижении определенных температур изменять кристаллическое строение. Это явление получило название аллотропии или полиморфизма, а сами переходы от одного кристаллического строения к другому называются аллотропическими или полиморфными.
5. Химические свойства металлов
Ряд напряжений характеризует химические свойства металлов: чем меньше электродный потенциал металла, тем больше его восстановительная способность.
А) Взаимодействие с неметаллами ( в названиях полученных веществ окончание
2Mg 0 +O2 0 —>2Mg 2+ O 2- (оксид магния)
Fe 0 +S 0 —>Fe 2+ S 2- ( сульфид железа II)
Б) Взаимодействие с водой. Самые активные металлы реагируют с водой при обычных условиях, и в результате этих реакций образуются растворимые в воде основания и выделяется водород
2Na + 2HOH = 2NaOH + H2
2Li 0 +2H2 + O 2– —> 2Li + O 2- H + + H2 0
Менее активные металлы реагируют с водой при повышенной температуре с выделением водорода и образованием оксида соответствующего металла Zn + H2O = ZnO +H2
В) Взаимодействие с растворами кислот. Происходит при соблюдении ряда условий
· Металл должен находиться левее в ряду напряжений металлов;
· В результате реакции должна образовываться растворимая соль, иначе металл покроется осадком и доступ кислоты к металлу прекратиться;
· Для этих реакций не рекомендуется использовать щелочные металлы, так как они взаимодействуют с водой в растворе кислоты;
· По особому взаимодействуют с металлами концентрированные азотная и серная кислоты;
2H + Cl – +Zn0 → Zn 2+ Cl2 - +H20
Г) Взаимодействие с растворами солей. При этом соблюдаются следующие условия
· Металл должен находиться в ряду напряжений левее металла, образующего соль;
· Для этих реакций не рекомендуется использовать щелочные металлы, так как они взаимодействуют с водой в растворе соли;
Fe 0 +Cu 2+ Cl2 – →Fe 2+ Cl2 – +Cu 0
Д) Взаимодействие со щелочами (только амфотерные)
Магний и щелочноземельные металлы с щелочами не реагируют.
Е) Взаимодействие с оксидами металлов (металлотермия).
Некоторые активные металлы способны вытеснять другие металлы из их оксидов при поджигании смеси.
2Al 0 + Fe 2 O 3 = Al 2 O 3 +2 Fe 0
Ж) Коррозия (будет рассмотрена на другом занятии).
6. Способы получения металлов
Существуют несколько основных способов получения — металлов.
а) Пирометаллургия – это получение металлов из их соединений при высоких температурах с помощью различных восстановителей (C, CO, H2, Al, Mg и др.).
— из их оксидов углем или оксидом углерода (II)
ZnО + С = Zn + СО
Fе2О3 + ЗСО = 2Fе + ЗСО2
— водородом
WO3 + 3H2 =W + 3H2O
СоО + Н2 = Со + Н2О
— алюминотермия
4Аl + ЗМnО2 = 2А12О3 + ЗМn
б) Гидрометаллургия – это получение металлов, которое состоит из двух процессов: сначала природное соединение металла (оксид) растворяют в кислоте, в результате чего получают соль металла. Затем из полученного раствора необходимый металл вытесняют более активным металлом. Например:
Обжигом сульфидов металлов и последующим восстановлением образовавшихся оксидов (например, углем):
2ZnS + ЗО2 = 2ZnО + 2SО2
ZnО + С = СО + Zn
в) Электрометаллургия – это получение металлов при электролизе растворов или расплавов их соединений. Роль восстановителя при этом играет электрический ток.
СuСl2 → Сu 2 + 2Сl -
Катод (восстановление): Сu 2+ - 2е - = Сu 0
Читайте также:
