Действие азота на металл
Обновлено: 04.10.2024
Исследования взаимодействия азота со сталью проводились в течении всего 20 века. Они были начаты Н.П.Чижевским и И.И.Жуковым [7]. Однако только после 40-х годов стали рассматривать возможность использования азота как легирующего элемента. Вопросам влияния азота на свойства сталей, его растворимости и поведения в металле уделялось много внимания, как в нашей стране, так и за рубежом [2…4, 8, 9]. В настоящее время в промышленности используется более 200марок сталей, легированных азотом.
Стали, легированные азотом, принято подразделять на две категории:
-стали с содержанием азота ниже равновесного;
-стали с содержанием азота выше равновесного («сверхравновесные»).
Первые получают в условиях выплавки и кристаллизации при атмосферном давлении азота. Вторые — при повышенном давлении азота, позволяющем сохранить большее его содержание в металле, чем при открытой выплавке.
В последние годы в качестве перспективных сталей с различным уровнем легирования азота для разнообразных сфер применения были отмечены [10]:
— дисперсионно-твердеющие стали, легированные ванадием, ниобием и титаном;
— высокопрочные коррозионно-стойкие, аустенитные стали;
— стали со структурой азотистого феррита и мартенсита.
Легирование азотом дисперсионно-твердеющих сталей приводит к образованию мелкодисперсных нитридов по границам зерен, препятствующих их росту, позволяет повысить предел текучести и ударную вязкость металла [8].
Легирование азотом нержавеющих сталей, позволяет уменьшить в них содержание никеля и марганца в полтора – два раза, а в некоторых случаях вообще исключить эти элементы. Нержавеющие стали, легированные азотом, превосходят по прочности, вязкости и коррозионной стойкости традиционные нержавеющие стали.
Легированные азотом безникелевые стали, применяемые в медицине для изготовления хирургического инструмента и имплантатов 11 обладают повышенной прочностью, износостойкостью и не вызывают негативных явлений и аллергических реакций в человеческом организме.
Нержавеющие мартенситные и ферритные стали, легированные азотом, при соответствующей термической и термопластической обработке обладают повышенной прочностью, коррозионной стойкостью и улучшенной технологической пластичностью при высоких и низких температурах.
Подробное аналитическое обобщение данных о структуре и свойствах нержавеющих сталей, легированных азотом; растворимости азота в них; термодинамике этих растворов, в том числе, в зависимости от концентрации примесей и легирующих элементов; от температур и давлений реакций, протекающих в жидком металле; параметров диффузии и других факторов, связанных с особенностями выплавки, по состоянию на 60-е годы было сделано М.В. Приданцевым, Н.П. Таловым и Ф.Л. Левиным [13].
На основе анализа многочисленных публикаций 14 было показано, что азот:
— образует твердые растворы внедрения в аустените и феррите;
— увеличивает количество аустенита и стабилизирует аустенит по отношению к γ → α и γ→ε превращениям при охлаждении и пластической деформации;
— изменяет предельную растворимость легирующих элементов в γ и α — твердых растворах и влияет на распределение хрома, никеля и других легирующих элементов между аустенитом и ферритом;
— изменяет кинетику образования карбидных и других избыточных фаз при термической обработке;
— снижает энергию дефектов упаковки и, в связи с этим увеличивает деформационную способность аустенита.
Введение азота в сплавы позволяет:
— уменьшить в сплавах содержание никеля, марганца и других аустенитообразующих элементов при сохранении заданной аустенитной или иной структуры и, соответственно, уровня ферромагнитности сплава;
— увеличить содержание в сплавах элементов ферритообразователей, положительно влияющих на механические и коррозионные характеристики сплавов;
— улучшить характеристики технологической пластичности в результате расширения интервала существования аустенита в высокотемпературной области;
— повысить термическую стабильность аустенита и снизить вероятность его распада при нагреве с образованием нитридов и других фаз;
— увеличить коррозионную стойкость (сопротивление питтинговой и ножевой коррозии, коррозионному растрескиванию под напряжением, интеркристаллитной коррозии);
— повысить прочность сплавов путем использования деформационного упрочнения при наклепе [1].
1.2. Растворимость азота в железе
Растворимость азота в железе подчиняется закону Сивертса (закону квадратного корня):
1/2N2 = [N]; [N] = KN (1.1)
где [N] – растворимость азота в железе при данном парциальном давлении PN2 ;
KN константа реакции, численное значение которой зависит от температуры и способов выражения концентрации.
Выполняемость закона Сивертса указывает на идеальность образующегося раствора [18].
Авторам работы [19] для определения растворимости азота в жидком железе до температуры 2650°С предлагается уравнение:
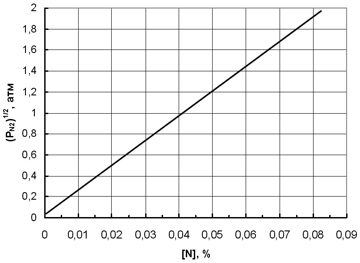
lg[N] = (-850/T) – 0,905 +0,5 lg PN2 (1.2)
Из которого следует, что при Т = 1873 °К и PN2 = 1 атм [N] = 0,044%.
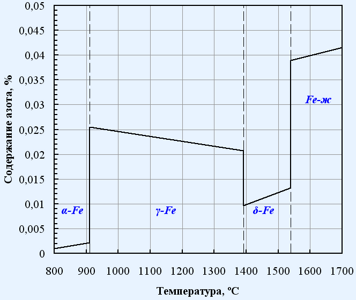
На рис.1.1 представлена температурная зависимость растворимости азота в жидком железе. Диаграмма состояния системы железо-азот приведена на рис. 1.2

.
Рис. 1. 1. Температурная зависимость растворимости азота в жидком железе
Рис.1.2. Диаграмма состояния Fe-N [26]
Концентрация азота, находящегося в равновесии с газообразным азотом растет с увеличением температуры. В точке перехода α→γ (906 °С) скачкообразно изменяется, при дальнейшем росте температуры до перехода γ→ δ (1402 °С) она уменьшается.
Азот может образовывать с железом два соединения Fe4N (9,9% N) и Fe2N (11,5% N). Fe2N начинает разлагается при температуре ~550 °С. При дальнейшем повышении температуры начинает диссоциировать и Fe4N.
Энтальпия растворения азота в жидком железе ΔHN представляет собой разность двух противоположных по знаку величин: энтальпии диссоциации молекулярного азота на атомы (ΔHдис) и энтальпии растворения атомарного азота в жидком железе (ΔHP). Первый процесс является эндотермическим, а второй – экзотермическим. Так как ΔHдис > ΔHP, то процесс, описанный уравнением (1), протекает с поглощением тепла. Если данные по растворимости азота показывают хорошую согласованность у различных исследователей, то данные по энтальпии имеют значительный разброс.
Результаты статистической обработки большого массива экспериментальных данных позволили авторам работы [27] описать растворимость азота в жидком железе двумя уравнениями:
при Т > 1973K: lg [N] = -1100/T – 0,79 (1.4)
Таким образом, энтальпия растворения азота в жидком железе до 1973 °K – 10700 Дж/моль, а выше 1973 °K – 21000 Дж/моль.
А.М. Самарин, первым обративший на это внимание, связывал изменение ΔH при изменении температуры со структурными превращениями. Известно, что при растворении кислорода оксидная фаза проявляется при очень низком парциальном давлении кислорода в газовой фазе ( PO2= 10-8 атм). В отличие от этого, при растворении азота даже при PN2 > 1атм самостоятельная нитридная фаза не образуется. Образование нитридов типа Fe2N и Fe4N наблюдали лишь в твердом металле в температурном интервале существования аустенита.
Влияние парциального давления над расплавом железа на его растворимость в зависимости от времени выдержки при T = 1560 °C представлено на рис. 1.3.
Данные по кинетике азотирования свидетельствуют о том, что для выхода на стационарную концентрацию в чистом железе требуется около 40 мин., причем время практически не зависит от давления азота над расплавом.

Рис. 1.3. Изменение растворимости азота в железе в зависимости от его давления и времени выдержки при температуре 1560 °С [28].

Рис.1.4. Зависимость растворимости азота в жидком железе при температуре 1560 °С от парциального давления азота над расплавом
Присутствие примесей влияет на скорость растворения азота в металле. Так, при увеличении концентрации кислорода в металле от 0,067 до 0,144% время достижения равновесной концентрации увеличивается с 1,5 до 3,0 часов. Отмечено и аналогичное влияние серы: при ее концентрациях 0,49 и 0,87% и давлении азота 0,1МПа время достижения равновесной концентрации возрастает до 3,0 и 6,0 часов соответственно.
В работе [14] представлены данные, характеризующие изменение растворимости азота в жидком железе при температуре 1560 °С в зависимости от давления (до 4 атм.).
Список использованой литературы
Сущность технологии и процесс азотирования стали
Азотирование стали является одним из многочисленных методов укрепления поверхности металлических изделий.
Не следует путать азотирование с цементацией: первое проходит в более щадящих температурных режимах и никаким образом не влияет на линейные размеры заготовки, не допускает деформации поверхности после обработки.
При азотировании слой насыщают только азотной составляющей, а структура кристаллической решетки основного металла остается неизменной. До азотации деталь из стали можно закалить, сделать отпуск, отшлифовать до нужных размеров.
После азотирования достаточно провести полирование до финишного состояния изделия. Процесс азотирования не требует серьезных материально-технических затрат, поэтому широко используется в промышленных масштабах на различных производственных линиях.

Суть и назначение технологии
Азотирование металла по сути – это термическая обработка изделий в среде, которую постоянно насыщают аммиаком. Для этого предусмотрена специальная герметичная камера-печь. На поверхности стального изделия после проведения обработки наблюдаются такие изменения:
- показатель износостойкости увеличивается за счет повышения прочности верхнего слоя;
- металл становится менее подверженным усталости;
- возрастает устойчивость к деструктивным коррозионным воздействиям, что эффективно проявляется даже при соприкосновении с агрессивной коррозионной средой.
Самое ценное, что происходит при азотировании стали, – приобретенные качества твердости имеют высокие показатели стабильности. Так, можно сказать о сохранении поверхностной твердости изделием, которое после азотирования подвергли нагреву до 600 градусов по Цельсию.
Такого результата невозможно достичь при обыкновенной цементации, где наблюдается постепенное снижение твердости при нагреве более 225 градусов по Цельсию.
Если взять начальные характеристики прочности, полученные путем цементации или закалки, и сравнить их с характеристиками прочности после азотации, то последний вариант будет превосходить их в 1.5–2 раза.
Виды азотирования
Существует несколько видов азотирования стали. Они отличаются друг от друга способом выделения азота, температурными режимами, рабочей средой. Но есть у них один общий признак – это то, что азот проникает внутрь стального изделия по закону диффузии.
Возникновение разных видов азотирования было вызвано стремлением ускорить процесс либо улучшить результаты применения метода, то есть качество полученного слоя.
Сегодня известны такие виды процесса:
- газовая азотация;
- плазменное азотирование;
- азотирование в цианистых солях.
Газовая азотизация
Следует рассмотреть еще один способ азотации, который получил название газового каталитического азотирования. Суть его состоит в том, что внутри печи создается определенная атмосфера, где аммиак диссоциированный подвергают специальной обработке на элементе каталитическом.
Особенности этого метода:
- Процесс требует применения сложного оборудования по созданию особых химических условий.
- Благодаря получению большего количества радикалов ионизированных при подготовке аммиака доля диффузии твердорастворной увеличивается, доля процессов химических реакционных снижается – азот быстрее проникает внутрь структуры металла.
Такой способ азотирования стали более дорогостоящий, но позволяет добиться очень высоких показателей износостойкости у ответственных изделий.
Термохимический процесс
В отличие от газового азотирования стали, где рабочей средой является смесь эндогаза или пропана с аммиаком в пропорции один к одному, при термохимическом процессе участвует только газообразный аммиак. Его подают из баллона внутрь специального герметично закрытого бокса (муфели), куда предварительно укладывают детали, требующие обработки азотированием.
Этот бокс помещают в печь, где поддерживается определенная температура. Горячий воздух воздействует на аммиак таким образом, что он начинает распадаться на азот и другие элементы. Азот постепенно диффундирует внутрь стали: чем дольше процесс, тем глубже проникновение. Термохимический процесс позволяет получить укрепленный слой глубиной 0.6 миллиметров.
Как происходит процесс азотирования
Для того чтобы проводить процессы азотирования стали, необходима специальная муфельная печь с герметически закрывающейся дверцей и возможностью создавать внутри температуру 600–500 градусов по Цельсию. Когда поверхность помещенной в печь заготовки достигнет этой температуры, некоторое время ее поддерживают при таком нагреве.
Затем в камеру начинают подавать аммиак (2NH₃), закачивая его под давлением. При повышенной температуре происходит распад аммиака на такие компоненты, как 2N и 6H. Высвободившиеся атомы азота начинают диффундировать в сталь и образовывать в поверхностном слое так называемые нитриды. Именно эти вещества, обладая высокой степенью твердости, усиливают металл, покрывая последний слой азотом.
Важно закрепить полученный результат, то есть предотвратить возможность окисления полученного слоя стали. Для этого избегают быстрого охлаждения нагретой детали, позволяя остывать ей постепенно вместе с охлаждением камеры муфельной печи.
Слой нитридный (светлая полоса на рисунке), сформировавшийся на металлической поверхности, по толщине может быть в пределах 0.6–0.3 миллиметра. Такие характеристики являются нормой при азотировании и соответствуют всем необходимым прочностным показателям – дальнейшая обработка стали не требуется.
Типы сред при азотировании
Процесс азотирования стали в реальности проводят не по одной, а по нескольким технологиям, отсюда разнообразие видов азотирования. Это связано с тем, что для одних типов металлов более эффективно усваивается азот в одной среде, для других – в другой. Но это не главное.
Среда позволяет получить определенное качество поверхности либо изменить скоростной режим выполнения операции по азотированию стали. Наиболее распространенные технологии, которые используются на предприятиях:
- диффузия азота в среде газовой на основе пропана с аммиаком;
- диффузия азота при использовании разряда тлеющего;
- диффузия азотная в среде жидкого характера.
Аммиачно-пропановая среда
Азотирование в газе из смеси пропана с аммиаком сейчас наиболее применимый способ укрепления поверхности стали. Соотношение компонентов смеси берется равнозначным, температуру по шкале Цельсия догоняют до 570 градусов выше нуля, обработку проводят на протяжении трех часов.
Влияние азота на свойства стали
При отсутствии в стали элементов, образующих нитриды при большой температуре (Ti, Al, Zr, V), после образования ?-Fe возникает выделение азота из раствора в виде включений нитридов железа (Fe2N, Fe4N, Fe8N). Это выделение может длиться продолжительное время после остывания и, так как оно проистекает в основном при низкой температуре, выделившиеся включения дисперсны (размером порядка 10-3 мкм). Дисперсные включения нитридов железа размещаются по кристаллографическим плоскостям и, мешая перемещению дислокаций, вызывают чрезмерную хрупкость металла. Следствием этого является понижение ударной вязкости и относительного сужения, при одновременном росте твердости и прочности.
Как и выделение нитридов железа, понижение ударной вязкости повышается при продолжительном хранении или эксплуатации стальных изделий, достигая минимума спустя 20–40 суток, потому описываемое явление получило название старения. Старение может быть ускорено искусственно, если закаленное железо или сталь подвергать холодной пластической деформации, повышающей скорость распада твердого раствора и выделения нитридов железа. В следствии старения ударная вязкость может понизиться в четыре–шесть раз, поэтому склонность к старению является недостатком стали. Она свойственна для малоуглеродистой стали, не раскисленной алюминием или ванадием.
Воздействие азота на механические свойства стали изображено на рисунке 3.

Рисунок 3 – Воздействие азота на механические свойства стали
Присадка в сталь элементов, связывающих азот в нитриды при больших температурах, ликвидирует склонность стали к старению. Подобными элементами являются следующие:
- 1) алюминий, образующий нитриды в основном во время затвердевания и в твердом металле до температуры превращения ?-Fe в ?-Fe;
- 2) ванадий и цирконий, образующие нитриды во время кристаллизации;
- 3) титан, образующий нитриды в жидкой стали и во время кристаллизации.
Наибольшее использование приобрел алюминий, обширно используемый и в качестве раскислителя. При обыкновенных концентрациях азота и алюминия в твердом металле образуются нитриды. Однако включения этих нитридов, выделяясь при более высокой температуре, имеют на два-три порядка крупные размеры, чем включения нитридов железа, потому они не оказывают такого воздействия на движение дислокаций и не вызывают старение.
Таким образом, спокойная сталь, раскисленная алюминием, не склонна к старению. Тем не менее и в стали, раскисленной алюминием, может наблюдаться снижение ударной вязкости. Это выражается при высоком содержании азота и алюминия (например, 0,01% N и 0,2% А1), когда в металле образуется межзеренный излом, проходящий по границам зерен первичного аустенита. Формирование такого излома вызвано ослаблением связи между зернами в результате выделения по их границам включений нитрида алюминия, и оно указывает об ухудшении свойств металла.
Азот является одним из наиболее распространенных элементов: его содержание в нижних слоях атмосферы составляет 78,11% а в земной коре – 0,04%. В нормальных условиях (Т=20 °С и P =1атм) азот представляет собой 2-х атомный газ. Атомный номер – 7, атомный вес – 14,008, плотность молекулярного азота – 1,649 × 10 -3 г/см 3 . Температура плавления – 209,9 °С, а температура кипения – 195,7 °С.
-стали с содержанием азота выше равновесного ("сверхравновесные").
Первые получают в условиях выплавки и кристаллизации при атмосферном давлении азота. Вторые - при повышенном давлении азота, позволяющем сохранить большее его содержание в металле, чем при открытой выплавке.
В последние годы в качестве перспективных сталей с различным уровнем легирования азота для разнообразных сфер применения были отмечены [ 10 ] :
- дисперсионно-твердеющие стали, легированные ванадием, ниобием и титаном;
- высокопрочные коррозионно-стойкие, аустенитные стали;
- стали со структурой азотистого феррита и мартенсита.
Легирование азотом дисперсионно-твердеющих сталей приводит к образованию мелкодисперсных нитридов по границам зерен, препятствующих их росту, позволяет повысить предел текучести и ударную вязкость металла [ 8 ] .
- образует твердые растворы внедрения в аустените и феррите;
- увеличивает количество аустенита и стабилизирует аустенит по отношению к γ → α и γ→ε превращениям при охлаждении и пластической деформации;
- изменяет предельную растворимость легирующих элементов в γ и α - твердых растворах и влияет на распределение хрома, никеля и других легирующих элементов между аустенитом и ферритом;
- изменяет кинетику образования карбидных и других избыточных фаз при термической обработке;
- снижает энергию дефектов упаковки и, в связи с этим увеличивает деформационную способность аустенита.
- уменьшить в сплавах содержание никеля, марганца и других аустенитообразующих элементов при сохранении заданной аустенитной или иной структуры и, соответственно, уровня ферромагнитности сплава;
- увеличить содержание в сплавах элементов ферритообразователей, положительно влияющих на механические и коррозионные характеристики сплавов;
- улучшить характеристики технологической пластичности в результате расширения интервала существования аустенита в высокотемпературной области;
- повысить термическую стабильность аустенита и снизить вероятность его распада при нагреве с образованием нитридов и других фаз;
- увеличить коррозионную стойкость (сопротивление питтинговой и ножевой коррозии, коррозионному растрескиванию под напряжением, интеркристаллитной коррозии);
- повысить прочность сплавов путем использования деформационного упрочнения при наклепе [ 1 ] .
где [ N ] – растворимость азота в железе при данном парциальном давлении PN 2 ;
KN константа реакции, численное значение которой зависит от температуры и способов выражения концентрации.
lg [ N ] = (-850/ T ) – 0,905 +0,5 lg PN 2 (1.2)
Из которого следует, что при Т = 1873 °К и PN 2 = 1 атм [ N ] = 0,044%.
На рис.1.1 представлена температурная зависимость растворимости азота в жидком железе. Диаграмма состояния системы железо-азот приведена на рис. 1.2 .

Рис.1.2. Диаграмма состояния Fe - N [26]
Азот может образовывать с железом два соединения Fe 4 N (9,9% N ) и Fe 2 N (11,5% N ). Fe 2 N начинает разлагается при температуре ~ 550 °С. При дальнейшем повышении температуры начинает диссоциировать и Fe 4 N .
Энтальпия растворения азота в жидком железе Δ HN представляет собой разность двух противоположных по знаку величин: энтальпии диссоциации молекулярного азота на атомы (Δ H дис) и энтальпии растворения атомарного азота в жидком железе (Δ HP ). Первый процесс является эндотермическим, а второй – экзотермическим. Так как Δ H дис > Δ HP , то процесс, описанный уравнением (1), протекает с поглощением тепла. Если данные по растворимости азота показывают хорошую согласованность у различных исследователей, то данные по энтальпии имеют значительный разброс.
при Т > 1973 K : lg [ N ] = -1100/ T – 0,79 (1.4)
Таким образом, энтальпия растворения азота в жидком железе до 1973 ° K – 10700 Дж/моль, а выше 1973 ° K – 21000 Дж/моль.
А.М. Самарин, первым обративший на это внимание, связывал изменение Δ H при изменении температуры со структурными превращениями. Известно, что при растворении кислорода оксидная фаза проявляется при очень низком парциальном давлении кислорода в газовой фазе ( PO 2= 10 -8 атм). В отличие от этого, при растворении азота даже при PN 2 > 1атм самостоятельная нитридная фаза не образуется. Образование нитридов типа Fe 2 N и Fe 4 N наблюдали лишь в твердом металле в температурном интервале существования аустенита.
Влияние парциального давления над расплавом железа на его растворимость в зависимости от времени выдержки при T = 1560 ° C представлено на рис. 1.3.

Атомарный азот растворяется преимущественно в тех металлах, с которыми он может образовывать химические соединения - нитриды. При растворении в стали азот образует нитриды как с железом, так и с большинством примесей. С железом азот взаимодействует по эндотермическим реакциям и образует два типа нитридов:
Нитрид БедЫ содержит 5,88 % N2, а нитрид Fe2N - 11,1 % N2. Для сварки большее значение имеет нитрид Fe4N, а для процессов, характеризующихся избытком азота, например для азотизации стали, - Fe2N.
В соответствии с равновесной диаграммой состояния «железо - азот» (рис. 9.10) при охлаждении сплава вначале из нитроаустенита
(твердого раствора азота в Fey) выпадает a-фаза, или нитроферрит
(твердый раствор азота в Fea). После достижения температуры
865 К, отвечающей точке А нитроферрит-эвтектоид распадается на механическую смесь феррита и нитрида железа. При дальнейшем уменьшении температуры в равновесных условиях предельная растворимость азота в нитроферрите снижается от 0,135 % при 865 К до 0,001 % при комнатной температуре. Это приводит к тому, что избыточный азот в виде Fe4N выделяется из твердого раствора Fea по диффузионному механизму.
В неравновесных условиях сварки этот процесс практически не развивается, и получают сталь, пересыщенную азотом. При последующем нагреве или при вылеживании происходит медленное выделение нитридов железа. Это явление называют старением. Оно снижает пластичность стали. При нагревании выше 900 К сталей, содержащих нитриды железа, они диссоциируют.
Нитроферрит [а] + + эвтектоид (Fea + Fe4N)
Рис. 9.10. Диаграмма состояния Fe-N2
Таким образом, в железе азот может находиться в твердом растворе Fea и в виде отдельных включений нитридов - главным образом Fe4N. В результате сварки и здесь имеют место существенные отклонения от равновесной диаграммы состояния Fe - N2. Поэтому общее количество растворенного в металле азота вследствие перегрева металла может быть увеличенным. Кроме того, при повышенной скорости охлаждения металла может не закончиться процесс выпадения нитридов железа из твердого раствора Fea, который останется пересыщенным азотом.
С легирующими элементами стали азот также образует нитриды, часто значительно более стойкие, чем нитриды железа. Особенно стойкими в области высоких температур являются нитриды кремния и титана.
' Равновесная растворимость азота в железе сильно зависит от температуры (см. рис. 9.6, б). По мере ее роста в интервале существования феррита растворимость азота увеличивается, а в интервале существования аустенита снижается вследствие снижения парциального давления азота в связи с образованием твердых нитридов по аналогии со снижением растворимости водорода в титане (см. рис. 9.7). В этом интервале кривые зависимости равновесной растворимости от температуры претерпевают скачкообразные изменения в моменты полиморфных превращений железа и при переходе его из твердого состояния в жидкое. При снижении температуры растворимость азота изменяется по тем же законам. В период кристаллизации азот, выделяющийся из металла, может вызвать порообразование. Несмотря на малую степень диссоциации азота в зоне столба дуги (см. рис. 8.9, а), а также ионизации (см. рис. 8.9, б), азот в металле шва присутствует в значительном
количестве, что объясняется большим содержанием его в атмосфере и спецификой его поведения в зоне сварки.
Исследования процесса насыщения металла азотом показали, что возможны следующие пути его протекания.
1. Диссоциированный азот непосредственно растворяется в жидком металле капель. При последующем охлаждении металла образуются нитриды железа. Роль этого процесса мала, так как степень диссоциации при сварке незначительна.
2. Диссоциированный азот образует в высокотемпературной области дугового разряда (см. рис. 9.1) окись азота N0, которая растворяется в каплях. При температурах металла ниже 3300 К окись азота диссоциирует на поверхности сварочной ванны, при этом атомарный азот, вступая во взаимодействие с железом, образует нитриды железа, а кислород - оксиды железа. Термодинамическим расчетом и экспериментом (см. рис. 9.5) подтверждено, что последний вариант (с участием кислорода) наиболее вероятен.
3. Диссоциированный азот непосредственно образует с диссоциированным кислородом в области высоких температур стойкие нитриды, которые, растворяясь согласно закону Сивертса в жидком металле капли, насыщают его азотом. В этом случае по мере охлаждения металла сварочной ванны из раствора может выделиться атомарный азот, который, вступая во взаимодействие с железом, образует нитриды железа.
Содержащиеся в стали нитриды азота весьма сильно влияют на ее свойства. Из рис. 9.11 следует, что с увеличением содержания
сто,2І ств, МПа 55, %
азота N в металле повышаются пределы прочности (ав) и текучести (ат). Этим влияние азота на свойства стали принципиально отличается от влияния кислорода. Вместе с тем по аналогии с кислородом снижаются пластические свойства и особенно резко - ударная вязкость стали. Наряду с этим происходят и другие нежелательные изменения: появляется склонность металла к старению и к хладноломкости (сине-
пи о ломкости); увеличивается склонность
Рис. 9.11. Влияние концен - п J
трации азота в углероди - к закалке; понижается магнитная простой стали на ее механичес - ницаемость; увеличивается электриче - кие свойства ское сопротивление металла.
Итак, для углеродистых и низколегированных сталей азот - нежелательная примесь в металле шва, особенно при действии на него динамической нагрузки. При сварке легированных сталей осуществляют микролегирование азотом с целью частичной замены углерода и увеличения пластичности и прочности сталей. Азот, как и углерод, образует твердый раствор внедрения, т. е. является сильным упрочнителем, но в отличие от углерода не образует карбидов, которые при нагреве растворяются в стали. Нитриды железа более термостойки, чем РезС.
При сварке деталей из высоколегированных сталей аустенитного класса азот вводится специально, так как он повышает устойчивость аустенита и выступает как легирующая добавка, способная заменить некоторое количество углерода и никеля. В таких сталях азот устраняет явление транскристаллизации и улучшает механические свойства, а также может вызвать и эффект упрочнения чугуна.
В условиях сварки деталей из меди азот применяют в качестве инертного защитного газа, не взаимодействующего с медью.
Взаимодействие металла с азотом при сварке
Процессы взаимодействия металла с азотом имеют большое значение при сварке электродами, порошковой проволокой, в защитных газах. Благодаря высоким температурам, большим удельным поверхностям и диссоциации молекулярного азота в дуге абсорбция азота на стадии капли происходит весьма интенсивно и зависит от степени диссоциации азота, температуры металла и растворимости в нем азота.
Повышение температуры капель в сплавах с отрицательным температурным коэффициентом растворимости азота (например, стали типа 0Х18Н9) приводит к снижению абсорбции азота, а в сплавах с положительным коэффициентом (например, низкоуглеродистая сталь) — к повышению абсорбции азота. Интенсивное испарение капель малоуглеродистой стали при нагреве выше 2600. 2700 К вызывает снижение абсорбции азота.
Содержание азота в каплях на прямой полярности в сравнимых условиях, как правило, выше, чем на обратной. Это связано с их температурой, различным характером плавления электродной проволоки и поведением активных пятен на обеих поверхностях. Время и поверхность взаимодействия металла, незащищенного шлаком, играют второстепенную роль в абсорбции азота. Значение этих факторов возрастает при наличии слоя шлака на поверхности капли и сварочной ванны.
Повышение окислительного потенциала атмосферы дуги способствует более интенсивной абсорбции азота жидким железом при сварке в защитных газах.
Кислород в дуге вступает в цепную реакцию с азотом с образованием при сравнительно низких температурах (3500. 4000 К) оксида азота (NO). Попадая на «холодный» жидкий металл капель или ванны, NO диссоциирует. Образующиеся при этом атомарные азот и кислород активно растворяются в железе.
При плавлении кремнемарганцевых и хромоникелевых проволок в кислородсодержащей атмосфере на каплях образуется пленка шлака, препятствующая проникновению азота в металл.
В сварных швах на низкоуглеродистых сталях азот находится в твердом растворе внедрения и нитридах. При легировании сварочной ванны титаном и алюминием азот в сварных швах находится в основном в виде нитридов и карбонитридов этих элементов. В зависимости от способов сварки и эффективности зашиты расплавленного металла от воздуха массовая доля азота в металле швов находится в пределах 0,01. 0,04 %.
Основным источником азота является атмосфера при сварке на воздухе и в защитных газах, а также покрытие электродов, сердечник порошковой проволоки, флюс. Содержание азота в металле низкоуглеродистых швов нужно ограничивать либо связывать его в нитриды.
Азот снижает ударную вязкость, повышает прочность и температуру перехода металла швов в хрупкое состояние, вызывает старение швов. Микролегирование сварочной ванны титаном и бором при определенном содержании бора и кислорода позволяет добиться оптимальных структур и высоких механических свойств металла швов.
При сварке покрытыми электродами зашита металла газошлаковая. Эффективность защиты от азота воздуха повышается за счет увеличения массы покрытия, окислительного потенциала покрытий рутилового вида, предупреждения деструкции органических составляющих покрытий и диссоциации карбонатов путем регулирования температуры прокалки электродов при изготовлении, ограничения силы тока и напряжения дуги. При сварке электродами с основным покрытием предпочтительно применение тока обратной полярности и ограничение длины дуги.
При сварке в защитных газах проволоками сплошного сечения и порошковыми проволоками необходимо всеми мерами предупреждать попадание воздуха в атмосферу дуги. При сварке самозащитной порошковой проволокой необходимо применять такие составы сердечников проволок, которые обеспечивали бы равномерное выделение газов в широком интервале температур от 400 до 1400 °С при нагреве проволок на «вылете». Эффективно использование проволок двухслойной конструкции. Сварку самозащитной проволокой с принудительным формированием швов рекомендуется выполнять с использованием техники «заглубленной» ванны.
При отсутствии в стали элементов, образующих нитриды при высокой температуре (Ti, Al, Zr, V), после образования α-Fe начинается выделение азота из раствора в виде включений нитридов железа (Fe2N, Fe4N, Fe8N). Это выделение может продолжаться длительное время после охлаждения и, так как оно происходит в основном при низкой температуре, выделившиеся включения дисперсны (размером порядка 10-3 мкм). Дисперсные включения нитридов железа располагаются по кристаллографическим плоскостям и, препятствуя перемещению дислокаций, вызывают охрупчивание металла. Результатом этого является снижение ударной вязкости и относительного сужения, при одновременном повышении твердости и прочности.
Как и выделение нитридов железа, снижение ударной вязкости усиливается при длительном хранении или эксплуатации стальных изделий, достигая минимума через 20—40 суток, поэтому описываемое явление получило название старения. Старение может быть ускорено искусственно, если закаленное железо или сталь подвергнуть холодной пластической деформации, увеличивающей скорость распада твердого раствора и выделения нитридов железа. В результате старения ударная вязкость может уменьшиться в четыре—шесть раз, поэтому склонность к старению является пороком стали. Она характерна для малоуглеродистой стали, не раскисленной алюминием или ванадием [1].
Влияние азота на механические свойства стали показано на рисунке 3.
Рисунок 3 – Влияние азота на механические свойства стали
Присадка в сталь элементов, связывающих азот в нитриды при высоких температурах, устраняет склонность стали к старению. Такими элементами являются следующие:
1) алюминий, образующий нитриды в основном во время затвердевания и в твердом металле до температуры превращения γ-Fe в α-Fe;
2) ванадий и цирконий, образующие нитриды во время кристаллизации;
3) титан, образующий нитриды в жидкой стали и во время кристаллизации.
Наибольшее применение получил алюминий, широко применяемый и в качестве раскислителя. При обычных концентрациях азота и алюминия в твердом металле образуются нитриды. Но включения этих нитридов, выделяясь при более высокой температуре, имеют на два-три порядка большие размеры, чем включения нитридов железа, поэтому они не оказывают такого влияния на движение дислокаций и не вызывают старение.
Следовательно, спокойная сталь, раскисленная алюминием, не склонна к старению. Однако и в стали, раскисленной алюминием, может наблюдаться понижение ударной вязкости. Это проявляется при высоком содержании азота и алюминия (например, 0,01% N и 0,2% А1), когда в металле образуется межзеренный излом, проходящий по границам зерен первичного аустенита. Образование такого излома вызвано ослаблением связи между зернами вследствие выделения по их границам включений нитрида алюминия, и оно свидетельствует об ухудшении свойств металла.
Источники газов
К основным источникам газов относятся :
1) шихтовые материалы ;
2) атмосфера плавильного агрегата, а также подаваемое на поверхность или в глубь ванны дутье (технический кислород или воздух );
3) ферросплавы и различные добавки, вводимые в металл или шлак по ходу плавки и разливки ;
4) атмосфера, окружающая жидкий металл при выпуске и разливке.
Большое количество газов вносит в металл шихта и, несмотря на то, что эти газы в значительной мере удаляются из металла по ходу плавки, на насыщенность шихтовых материалов газами обращают особое внимание. Лом содержит обычно 0,003-0,005% N. Чугун содержит обычно 0,0055 N [5].
Читайте также:
