Действие кислот и щелочей на металлы
Обновлено: 04.10.2024
Ржавчина покрывает металл рыхлым слоем, поэтому не предохраняет его от дальнейшей коррозии вплоть до полного разрушения. Растворы солей, как правило, вызывают более сильную коррозию, чем чистая вода. Небольшие количества NH 4 C l, присутствующие в воздухе лабораторий, в значительной степени ускоряют коррозию. Неустойчивы к действию большинства разбавленных кислот. В разбавленных растворах НС l растворение железа идет интенсивно. Азотная кислота с концентрацией выше 50% пассивирует металл, однако защитный слой оксида хрупок, и пассивное состояние легко нарушается. Железо вполне устойчиво к действию дымящей HNO 3 . Серная кислота пассивирует Железо при концентрации выше 70%, при нагревании стали марки СтЗ в 90%-й H 2 SO 4 при 40 °С скорость коррозии составляет 0,14 мм/год; при 90 °С скорость коррозии увеличивается в 10 раз; 50%-я H 2 SO 4 очень активно растворяет железо. Фосфорная кислота в отношении железа не агрессивна. В безводных органических растворителях Железо практически не корродирует, устойчиво к действию растворов щелочей, водного аммиака, сухих С l 2 и В r 2 . Хорошими ингибиторами коррозии являются хромовокислый натрий (в виде добавки к воде в количестве 0,1%), гексаметафосфат натрия. Ион Сl - , напротив, способствует снятию с металла защитной пленки и усилению коррозии. Технически чистое Железо с массовым содержанием примесей около 0,16% обладает высокой коррозионной стойкостью.
Низколегированные и среднелегирова н ные стали. Подобны простым углеродистым сталям, но небольшие легирующие добавки меди, никеля или хрома могут повышать устойчивость к атмосферной и водной коррозии. С повышением количества хрома повышается стойкость к окислению. Однако стали с содержанием хрома менее 12% в основном не рекомендуется использовать при контакте с химически активными средами.
Стали с содержанием хрома 12—18% устойчивы при контакте с пищевыми продуктами, большинством органических кислот, азотной кислотой, сильными щелочами, большинством растворов солей. скорость коррозии в 25%-й муравьиной кислоте составляет около 2 мм/год. Эта группа сталей неустойчива к действию сильных восстановителей, соляной кислоты, хлоридов и галогенов.
Нержавеющие стали с содержанием 17—19% хрома и 8—11% никеля более устойчивы по сравнению с обычными высокохромистыми сталями. Они исключительно стойки в окислительных средах, в том числе кислых (азотнокислой, хромовокислой и т. д.) и сильно щелочных. Добавка никеля повышает устойчивость к некоторым неокислительным средам. Они превосходно устойчивы к действию атмосферных факторов. Однако в кислых восстановительных средах, и особенно в кислых, содержащих ионы галогенов, пассивирующий слой оксидов разрушается и нержавеющие стали теряют свою кислотоустойчивость.
Нержавеющие стали с добавкой 1—4% молибдена. Их общая коррозионная стойкость выше, чем у хромоникелевых сталей. Введение молибдена повышает устойчивость к серной, сернистой, органическим кислотам, галогенидам и морской воде.
Железокремнистое литье (сплавы железа с 13—17% Si , ферросилиций). Коррозионная стойкость определяется образованием пленки Si 02, поэтому окислительные среды (азотная, серная, хромовая кислоты) лишь усиливают защитные свойства пленки. Соляная кислота вызывает коррозию ферросилиция.
Устойчив к атмосферным факторам, в том числе к атмосфере химических лабораторий, воде, даже соленой, нейтральным и щелочным солям — хлоридам, карбонатам, сульфатам, нитратам, ацетатам. Достаточно устойчив к органическим кислотам, если только они не горячие и не насыщены кислородом. Устойчив к кипящим концентрированным щелочам (КОН до 60%). Подвержен воздействию окислительных или восстановительных сред, окислительных солей (кислых или щелочных), окислительных кислот, например азотной, влажных газообразных галогенов, оксидов азота, диоксида серы.
Монельметалл (70% Ni , 30% Си) по сравнению с никелем более устойчив к кислотам, хотя и не выдерживает действия кислот с сильными окислительными свойствами. Обладает сравнительно хорошей устойчивостью к органическим кислотам, к большинству растворов солей. Не подвержен атмосферной и водной коррозии, устойчив к действию фтора. Монельметалл подобно платине выдерживает HF в концентрации 40% при кипении.
Благодаря защитной окисной пленке стойки к окислительным средам, в том числе к фтору, уксусной кислоте и большинству органических жидкостей, к атмосферной коррозии. Алюминий с содержанием примесей не более 0,5% обладает высокой стойкостью к действию Н2О2. Сильные восстановительные среды и едкие щелочи разрушают алюминий. Алюминий устойчив к действию разбавленной серной кислоты и олеума, но не стоек к серной кислоте средней концентрации. Такая же картина и в отношении горячей азотной кислоты. Соляная кислота разрушает защитную.пленку. При соприкосновении с ртутью или ее солями Алюминий быстро разрушается. Чем чище алюминий, тем меньше он подвержен коррозии. Дюралюминий (сплав с 3,5—5,5% Си, 0,5% Mg и 0,5—1% Мп) менее коррозионностоек. Силумин (11 — 14% Si ) имеет высокие антикоррозионные свойства.
Отличаются стойкостью к атмосферной и водной коррозии, включая морскую воду. Устойчивы к растворам едких щелочей при комнатной температуре, горячим разбавленным щелочам, сухому NH 3 , нейтральным солям, сухим газам и к большинству органических растворителей. Сплавы с высоким содержанием меди (бронзы) устойчивы ко многим кислотам, включая горячую разбавленную и холодную концентрированную H 2 SO 4 . как разбавленную, так и концентрированную НСl без нагревания. Контакт с органическими кислотами в отсутствие кислорода не вызывает разрушения меди. Медь не поддается воздействию F 2 и сухого HF . Медь и ее Сплавы подвержены действию окисляющих кислот и неокисляющих кислот в присутствии кислорода, влажного NH 3, некоторых кислых солей, таких влажных газов, как ацетилен, Cl 2 . SO 2 , СО2 . Медь легко амальгамируется. Цинк-медные Сплавы (латуни) в основном не отличаются высокой коррозийной стойкостью.
Устойчив в сухом и влажном воздухе, в чистой воде. В воде с содержанием СО2, NH 3 или солей подвержен коррозии. Сильно корродирует в атмосфере лаборатории. щелочи растворяют цинк, в HNO 3 он растворяется быстро, в НС l и H 2 SO 4 — тем медленнее, чем чище цинк. Не взаимодействует с органическими растворителями, нефтепродуктами, однако при длительном контакте, например с крекинг-бензином, происходит коррозия за счет постепенного повышения кислотности бензина при его окислении воздухом.
Отличается устойчивостью к атмосферной и водной коррозии, устойчив при контакте с почвой, хотя заметно растворяется в воде, содержащей высокие концентрации СО2 , за счет образования растворимого гидрокарбоната свинца. В основном обладает хорошей стойкостью по отношению к нейтральным растворам, удовлетворительной к щелочным, практически стоек к хромовой, серной, сернистой и фосфорной кислотам. В H 2 SO 4 концентрации 98% и выше при комнатной температуре свинец растворяется очень медленно; 48%-я HF вызывает коррозию при нагревании; заметно действуют на свинец НС l , HNO 3 , а также уксусная и муравьиная кислоты. При взаимодействии с НС l свинец покрывается слоем труднорастворимого Р b С l 2 , который препятствует дальнейшему растворению металла. Азотнокислый свинец, образующийся при действии азотной кислоты, нерастворим в концентрированной HNO 3 , но растворим в разбавленной, поэтому разбавленная HNO 3 более агрессивна по отношению к свинцу, чем концентрированная. Растворы нитратов агрессивны по отношению к свинцу, а хлориды, сульфаты и карбонаты — нет.
Обладает превосходной коррозионной стойкостью. Устойчив к действию FeCl 3 , растворов солей, в том числе сильных окислителей. Легко подвергается действию более концентрированных минеральных кислот, но выдерживает кипящую HNO 3 до концентрации 65% и H 2 SO 4 и НС l ниже 5%. Проявляет хорошую устойчивость к органическим кислотам, щелочам и щелочным солям.
Используется при необходимости высокой химической стойкости к большинству кислот и щелочей. Устойчив при контакте с Н2О2. Подвержен действию некоторых хлоридов, кипящей концентрированной НСl, царской водки, дымящей азотной и горячей концентрированной серной кислот. По отношению к соляной и серной кислоте цирконий устойчивее титана, а по отношению к влажному хлору и царской водке — наоборот. Практически важное свойство металлического циркония — гидрофобность его поверхности, он не смачивается водой и водными растворами.
Отличается превосходной химической стойкостью, подобно стеклу, что обусловлено наличием плотной оксидной пленки. При температуре ниже 150 °С на него практически не действуют Cl 2 , В r 2 , I 2 . Устойчив к большинству кислот при комнатной температуре, в том числе к азотной кислоте, царской водке. На него почти не оказывают действия Растворы щелочей. На тантал действует HF и горя чие концентрированные Растворы щелочей, он растворяется в расплавах щелочей.
Действие кислот и щелочей на металлы и сплавы
Действие кислот и щелочей на разные металлы различно в зависимости от реакционной способности металла и концентрации кислоты или щелочи.
В разбавленных кислотах и щелочах металлы с более отрицательным потенциалом окисляются ионом водорода, вытесняя его из растворов. При этом протекают следующие реакции окисления - восстановления:
2 nH + + ne = n/2 Н2
Эти реакции протекают с одинаковой скоростью, взаимно обуславливая друг друга, и могут быть реализованы как на одной и той же поверхности металла (и даже в одной материальной точке поверхности), так и на разных металлах, если они находятся в контакте. В последнем случае анодный процесс (реакция 1) будет протекать на металле с более отрицательным потенциалом, а катодный процесс (реакция 2) будет протекать преимущественно на металле с более положительным потенциалом.
В технических металлах и сплавах видимого разделения участков с анодными и катодными процессами не наблюдается, если поверхность однородна с точки зрения чистоты обработки, наклепа, наличия загрязнений и т.д. При погружении таких металлов в кислоту происходит выделение водорода со всей поверхности, объем которого эквивалентен количеству растворенного металла. Концентрированные кислоты (особенно горячие) являются более сильными окислителями, поэтому в них не устойчивы благородные металлы. Так, например, окисление в концентрированной серной кислоте может протекать до различной степени восстановления ее, в зависимости от реакционной способности металла, с выделением SO2 и даже H2S.
Азотная кислота в зависимости от концентрации и реакционной способности металла проходит следующие стадии восстановления:
Судить о количестве растворенного металла в таких кислотах по объему выделившихся газообразных продуктов трудно, так как состав газовой фазы является сложным и не остается постоянным в процессе окисления металла, поскольку некоторые газы хорошо растворяются в воде (SO2, NO2), а другие образуют комплексные соединения.
Для некоторых металлов концентрированные кислоты менее опасны, чем разбавленные. Например, серная кислота для железа, свинца и алюминия. Потому, что на их поверхности образуются нерастворимые соли, играющие роль защитных покрытий. В сильно разбавленных щелочах ввиду малой концентрации ионов водорода окисление происходит, главным образом, за счет кислорода по реакции (для двухвалентного металла):
Эта реакция идет с поглощением кислорода из воздуха.
Стойкость металлов в щелочах зависит от характера образующейся гидроокиси. Если гидроокись амфотерна, и может образовывать с гидроксид-ионом растворимый комплексный продукт, то металл будет неустойчив в щелочи. Такие гидроокиси образуют алюминий, цинк, олово, свинец и др.
Если гидроокиси металлов не амфотерны (гидроокиси никеля, магния), то они не растворяются в щелочных растворах, и поверхность металла пассивируется гидроокисной пленкой, предохраняющей его от окисления. В этом случае водород перестает выделяться, и коррозия не протекает.
Явление самопроизвольной пассивности наблюдается и при действии разбавленных кислот на некоторые сплавы, например, при действии серной кислоты концентрацией до 20 % на высокохромистые чугуны с добавками титана или соляной кислоты на высокохромистые чугуны с добавкой молибдена и т.п. Для этих сплавов характерным является интенсивное растворение ( и, соответственно, обильное выделение водорода). В начальные периоды испытания наблюдается замедление, и даже прекращение процесса через некоторое время. Время до наступления пассивного состояния зависит от состава сплава и концентрации раствора. Это время легко установить по прекращению выделения водорода, а также по изменению знака потенциала.
Объемный метод широко используют в лабораторной практике, когда нужно установить кинетику коррозионного разрушения металла или сплава в кислотах или щелочах, окисляющих ионом водорода. Измеряя объем водорода через равные промежутки времени, можно выяснить характер изменения скорости коррозии и установить способность металла к самопроизвольному пассивированию в данных условиях.
Количество выделившегося водорода, являющегося мерой скорости коррозии, зависит от суммарноготока, возникшего в коррозионной системе.
Предполагая, что токи, протекающее через микроэлементы, равны между собой, объём выделившегося водорода будет пропорциональным количеству микропор, имеющихся на поверхности металла, т. е. его неоднородности.
Величина тока, протекающего через каждый микроэлемент, пропорционально разности потенциалов, установившихся в процессе растворения между анодным и катодным участками.
Введение в сплав легирующих элементов, вызывающих пассивацию сплава должно вызвать увеличение перенапряжения выделение водорода на микрокатодах и уменьшение скорости коррозии.
Увеличение структурной неоднородности и образование ликокатодов с малым перенапряжение выделяющего водорода должно вызвать увеличение количества выделившегося водорода, т. е. скорость коррозии.
Этот метод позволяет непрерывно следить за изменением скорости коррозии.
Выполнение работы
Пред проведением работ необходимо ознакомится:
1. с влиянием примесей и присадок на коррозионную устойчивость металлов в кислотах;
2. с объёмны методом определения скорости коррозии;
3. с оценкой коррозионной стойкости металлов.
1-й вариант. Наблюдения за объемом выделяющегося водорода можно производить с помощью бюретки, опущенной в стакан. В первом случае нижняя часть бюретки соединяется с воронкой, под которую помещаем испытуемый образец. Раствор наливаем в стакан с помощью водоструйного насоса, засасываем его в бюретку до метки. Затем бюретку отключаем от насоса и производим запись показаний уровня жидкости в ней через 10 минут.
Опыт производят на двух образцах. Желательно иметь сплавы с различной способностью к самопроизвольному пассивированию. Взвешенные на аналитических весах образцы помещают в стакан, куда наливают раствор.
Можно начинать опыт, отсчитывая объем выделяющегося водорода. Длительность испытания - 1,5 часа. По окончании испытания образцы необходимо взвесить на тех же аналитических весах и с той же точностью. Потерю в весе выразить в г/(м 2 ч), произвести оценку стойкости металла по 10-бальной шкале. В том случае если сплав перешел в пассивное состояние в процессе испытания, необходимо определить время коррозии, а весовые потери разделить не на все время испытания, а на то, в течение которого происходило растворение.
По данным наблюдений построить графики:
1. Объем водорода, отнесенный к единице поверхности S - время в мин.
2. Изменения относительного объема водорода во времени V - время в мин. Для построения первого графика необходимо объем водорода, полученный за каждый отсчет, разделить на поверхность образца.
Для построения второго графика необходимо найти разницу показаний относительно объема водорода между ближайшими отсчетами и разделить на время между отсчетами (10 мин).
По общему объему водорода, выделившегося за время опыта, можно вычислить весовые потери в граммах, пользуясь уравнением:
где М – атомная масса металла
n- валентность металла
V –объем выделившегося водорода, мл
VH2 – измеренный объем водорода, мл
t – температура раствора, о С.
Задание:
1. Опишите процессы, которые вы наблюдали.
2 Оцените стойкость металла в данной агрессивной среде
3 Сделайте заключение о целесообразности использования сплава в данной среде.
2-й вариант. Для определения скорости коррозии по выделению водорода широко применяется метод, при котором водород вытесняет раствор, объём которого измеряется.
Выделяющийся водород вытесняет из герметически закрытой бутылки кислоту, которая капает в бюретку; объём вытесненной жидкости соответствует объёму выделившегося водорода.
Образцами для испытаний служат:
- серый чугун – феррит + перлит + зеерлит ;
- сталь 0,4% - феррит + перлит
- хромистая сталь с 12% Cr – твёрдый раствор + карбиды;
- хромоникелевая сталь с 8% Ni + 18% Cr – аустенит;
Образцы с измеренной поверхностью должны быть зачищены наждачной бумагой, тщательно обезжирены содой, промыты в проточной воде и вытерты фильтровальной бумагой. Опыт проводят в установке, изображенной на рисунке
Подготовленные образцы М помещают в стеклянные держатели, которые подвешивают на стеклянные крючки, укреплённые в пробке Б.
. В склянки с тубусом наливают 5% - ную Н2SO4, пробку Б и кран А плотно закрывают, после чего открывают зажим Е, из которого при этом вытекает в бюретку небольшое количество раствора. Зажим Е в дальнейшем при работе оставляют открытым.
Загрузив образец, записывают уровень жидкости в бюретке – этот момент и является началом опыта.
В дальнейшем в течение 100 мин такую запись повторяют каждые 20 мин.
После окончания опыта закрывают зажимы Е и вынимают образцы с пробками.
. Образцы хорошо ополаскивают водой и вытирают
Результаты опытов записывают по форме.
Результаты опытов т. е. объём выделившегося водорода в см 3 относят к единице поверхности образцов и выражают в см 3 /см 2 .
Кроме того, результаты опытов оформляются в виде диаграмм, показывающие зависимость количества выделившегося водорода с единицы поверхности образца ΔV ( см 3 /см 2 ) от продолжительности испытания для каждого образца τ.мин.
Зная объём водорода, выделившегося за время опыта, можно вычислить весовые потери корродировавших образцов.
При вычислении исходят из того, что при растворении одного грамм-эквивалента металла выделившегося при нормальных условиях 11,2л. водорода.
Условно принимаем, что во всех взятых для испытания образцах происходит растворение железа.
Характеризую коррозионную устойчивость испытанных образцов по шкале коррозионной стойкости ( таблица 3).
Химические свойства металлов
Металлы занимают в Периодической таблице левый нижний угол. Металлы относятся к семействам s-элементов, d-элементов, f-элементов и частично – р-элементов.
Самым типичным свойством металлов является их способность отдавать электроны и переходить в положительно заряженные ионы. Причём металлы могут проявлять только положительную степень окисления.
1. Взаимодействие металлов с неметаллами.
а) Взаимодействие металлов с водородом.
С водородом непосредственно реагируют щелочные и щелочноземельные металлы, образуя гидриды.
Например:
Образуются нестехиометрические соединения с ионной кристаллической структурой.
б) Взаимодействие металлов с кислородом.
Все металлы за исключением Au, Ag, Pt окисляются кислородом воздуха.
Пример:
в) Взаимодействие металлов с галогенами.
Все металлы реагируют с галогенами с образованием галогенидов.
Пример:
В основном это ионные соединения: MeHaln
г) Взаимодействие металлов с азотом.
С азотом взаимодействуют щелочные и щелочноземельные металлы.
д) Взаимодействие металлов с углеродом.
Соединения металлов и углерода – карбиды. Они образуются при взаимодействии расплавов с углеродом. Активные металлы образуют с углеродом стехиометрические соединения:
Металлы – d-элементы образуют соединения нестехиометрического состава типа твердых растворов: WC, ZnC, TiC – используются для получения сверхтвёрдых сталей.
2. Взаимодействие металлов с водой.
С водой реагируют металлы, имеющие более отрицательный потенциал, чем окислительно-восстановительный потенциал воды.
Активные металлы более активно реагируют с водой, разлагая воду с выделением водорода.
Менее активные металлы медленно разлагают воду и процесс тормозится из-за образования нерастворимых веществ.
3. Взаимодействие металлов с растворами солей.
Такая реакция возможна, если реагирующий металл активнее, чем находящийся в соли:
Металл, обладающий более отрицательным или менее положительным стандартным электродным потенциалом, вытесняет другой металл из раствора его соли.
4. Взаимодействие металлов с растворами щелочей.
Со щелочами могут взаимодействовать металлы, дающие амфотерные гидрооксиды или обладающие высокими степенями окисления в присутствии сильных окислителей. При взаимодействии металлов с растворами щелочей, окислителем является вода.
1 Zn 0 + 4OH – – 2e = [Zn(OH)4] 2– окисление
Zn 0 – восстановитель
1 2H2O + 2e = H2 + 2OH – восстановление
Металлы, обладающие высокими степенями окисления, могут взаимодействовать со щелочами при сплавлении:
5. Взаимодействие металлов с кислотами.
Это сложные реакции, продукты взаимодействия зависят от активности металла, от вида и концентрации кислоты и от температуры.
По активности металлы условно делятся на активные, средней активности и малоактивные.
Кислоты условно делятся на 2 группы:
I группа – кислоты, обладающие невысокой окислительной способностью: HCl, HI, HBr, H2SO4(разб.), H3PO4, H2S, окислитель здесь H + . При взаимодействии с металлами выделяется кислород (H2↑). С кислотами первой группы реагируют металлы, обладающие отрицательным электродным потенциалом.
II группа – кислоты, обладающие высокой окислительной способностью: H2SO4(конц.), HNO3(разб.), HNO3(конц.). В этих кислотах окислителями являются анионы кислоты: . Продукты восстановления аниона могут быть самыми разнообразными и зависят от активности металла.
H2S↑ – c активными металлами
H2SO4 +6е S 0 ↓ – с металлами средней активности
SO2↑ – c малоактивными металлами
HNO3 +4,5e N2O, N2 – с металлами средней активности
NO – c малоактивными металлами
HNO3(конц.) – NO2↑ – c металлами любой активности.
Если металлы обладают переменной валентностью, то с кислотами I группы металлы приобретают низшую положительную степень окисления: Fe → Fe 2+ , Cr → Cr 2+ . При взаимодействии с кислотами II группы – степень окисления +3: Fe → Fe 3+ , Cr → Cr 3+ , при этом никогда не выделяется водород.
Некоторые металлы (Fe, Cr, Al, Ti, Ni и др.) в растворах сильных кислот, окисляясь, покрываются плотной оксидной плёнкой, которая защищает металл от дальнейшего растворения (пассивация), но при нагревании оксидная плёнка растворяется, и реакция идёт.
Малорастворимые металлы, обладающие положительным электродным потенциалом, могут растворяться в кислотах I группы, в присутствии сильных окислителей.
Действие кислот и щелочей на металлы
Цель работы: изучение влияния природы металлов на процесс их взаимодействия с различными кислотами и щелочами.
Металлическими свойствами обладает большинство элементов, входящих в периодическую систему Д. И. Менделеева. Металлы характеризуются рядом физических свойств: металлическим блеском, обусловленным способностью их отражать лучи света; высокой тепло- и электропроводностью; пластичностью; легко подвергаются механической деформации; некоторые из них имеют большую прочность при растяжении или при сжатии. Все физические свойства обусловливаются особенностями их внутренней структуры. Атомы и ионы располагаются в узлах кристаллической решетки, а электроны – электронный газ– в пространстве между ними. Устойчивость кристалла обеспечивается силами притяжения между положительными ионами и электронным газом. При обыкновенной температуре все металлы (за исключением ртути) – твердые вещества. Металлы способны взаимодействовать между собой, образуя сплавы. [1 – 4].
В соответствии с особенностями электронной структуры и положением в периодической системе различают s-, p-, d-иf-семейства металлов. Кs-семейству относятся металлы, у которых происходит заполнение электронами внешнегоs-подуровня. Это элементы главных подгруппIиIIгрупп – щелочные и щелочноземельные металлы. Дляp-металлов главных подгрупп характерно последовательное заполнение внешнегоp- подуровня. Металлические свойства у них выражены слабее. Наиболее многочисленны металлыd-семейства, у которых происходит заполнениеd- подуровней (переходные металлы). Металлы, у которых заполняютсяf-подуровни, образуют две группы, очень похожие между собой, - лантаноиды и актиноиды.
Внешние электроны в атомах металлов находятся на значительном расстоянии от ядра и связаны с ним сравнительно слабо. Металлы отличаются небольшими значениями энергии ионизации, т. е. энергия, которую надо затратить для отрыва электронов от нейтрального атома и перевода его в положительный ион.
Н. Н. Бекетов установил химический ряд активности металлов (электрохимический ряд напряжений металлов), в котором металлы расположены в порядке убывания их активности:
Li, K, Mg, Al… Fe… Sn, Pb, H, Cu, Ag, Au
Чем левее расположен в ряду напряжений металл, тем он активнее, тем больше его восстановительная способность, тем легче он окисляется. Характеристикой восстановительной способности металлов является также величина стандартных электродных потенциалов: чем меньше значение стандартного электродного потенциала, тем активнее металл и тем выше его восстановительная способность. Каждый металл этого ряда вытесняет все следующие за ним металлы из растворов их солей.
Химические свойства металлов весьма разнообразны. Общим свойством для всех металлов является их способность отдавать свои электроны, проявляя восстановительные свойства [1 -4].
Восстановительная способность металлов проявляется при взаимодействии с различными веществами (кислотами, щелочами, водой и др.).
Концентрированная соляная кислота, разбавленные растворы серной и соляной кислот взаимодействуют только с металлами, стоящими в ряду напряжений до водорода, вытесняя его из разбавленных растворов этих кислот. Металлы d-семейства, имеющие две степени окисления, при действии разбавленных сернойH2SO4и соляной НСlкислот образуют соли с низшей степенью окисления металла:

Zn+HCIразб =ZnCI2+H2

Fe + H2SO4 разб = FeSO4 + H2
Медь взаимодействует с соляной кислотой в присутствии кислорода воздуха:
Концентрированная серная кислота окисляет почти все металлы, за исключением благородных. Металлы средней и малой активности, включая серебро, окисляются ею лишь при нагревании, образуя соли с высшей степенью окисления металла. В концентрированной серной кислоте окислителем является сульфат-ион SO4 2- . В зависимости от активности металла и условий проведения реакции (температуры, концентрации кислоты) могут образовываться следующие продукты:H2S(с активными металлами),S(с металлами средней активности),SО2(с малоактивными металлами). Например:

Мg+ Н2SO4 конц.MgSO4+H2S+ Н2О

Сu+ 2Н2SO4 конц.СuSO4+SO2+ 2H2O
Цинк может восстанавливать концентрированную кислоту до SO2,S,H2S.

Zn+ 2Н2SO4 конц. ZnSO4 +SO2 + 2H2O

3Zn+ 4Н2SO4 конц. 3ZnSO4 +S + 4H2O

4Zn+ 5Н2SO4 конц. 4ZnSO4+H2S+ 4H2O
Азотная кислота является более сильным окислителем. Особенностью ее взаимодействия с металлами является то, что металлы не вытесняют водород даже из ее разбавленных кислот, в этом случае происходит восстановление азотной кислоты. Состав продуктов зависит от активности металла и концентрации, причем доля продуктов с низкими степенями окисления азота возрастает по мере разбавления кислоты. Продуктами восстановления могут быть NO2,NO,N2O,N2иNH4NО3. Чем активнее металл и чем меньше концентрация кислоты, тем полнее восстанавливается азот. При взаимодействии неактивных металлов (расположенных правее железа) с концентрированной азотной кислотой выделяетсяNO2, с разбавленной –NO, например:
При взаимодействии активных металлов (щелочных, щелочноземельных, цинка) с концентрированной азотной кислотой выделяется N2O, с очень разбавленной –NH4NО3, например:
Если металлы p-иd-семейства имеют две степени окисления, то при действии разбавленной азотной кислоты они образуют, главным образом, соли с высшей степенью окисления металла.
Реакционная способность некоторых металлов невелика, т. к. их поверхность покрыта оксидной пленкой устойчивой к действию растворов кислот и щелочей. Например, оксидная пленка на поверхности свинца разрушается при действии разбавленной азотной кислоты и нагревании.
При действии концентрированной азотной или серной кислот на поверхности некоторых металлах образуется плотная оксидная пленка, устойчивая к действию окислителей и предохраняющая металлы от дальнейшего разрушения. Это явление называется пассивацией. Например, концентрированная серная кислота пассивирует Fe,Be,Co,Bi,Nb, а концентрированная азотная –Al,Cr,Fe,Nb,Be,Coи другие [1 – 3].
При нагревании концентрированные кислоты окисляют эти металлы:

2Fe + 6H2SO4 концFe2(SO4)3 + 3SO2 + 2H2O
Смесь концентрированных азотной и соляной кислот (“царская водка”) окисляет самые благородные металлы – золото и платину.
Некоторые металлы (Be,Al,Zn,Sn,Pbи др.) способны растворяться в растворах щелочей. При взаимодействии указанных металлов или их гидроксидов с растворами щелочей образуются комплексные соединения (гидрооксосоли), в которых лигандами являются ионы гидроксила.
При сплавлении таких металлов и их гидроксидов со щелочами образуются соли слабых кислот.
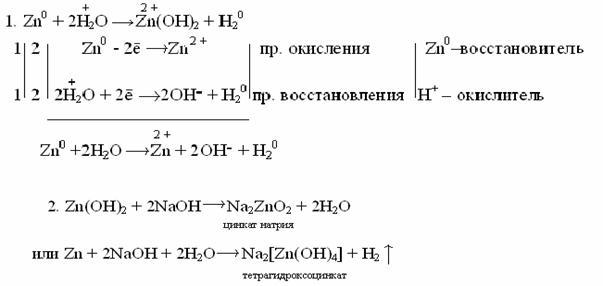
Ве+2NaOHNa2BeO2+H2

Zn(OH)2+ 2NaOHNa2ZnO2+H2О
Действие щелочей на металлы
Щелочи действуют только на металлы, образующие амфотерные оксиды и гидроксиды. При этом выделяется водород и образуется соль очень слабой кислоты данного металла. Следует отметить, что образование водорода является результатом взаимодействия атомов металла с ионами водорода воды, а не водорода, входящего в состав щелочи.
Таким образом, реакция идет в две стадии:
Тема 14: ХИМИЯ МЕТАЛЛОВ И ЭЛЕКТРОТЕХНИЧЕСКИЕ МАТЕРИАЛЫ
ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
Характерным химическим свойством металлов является их восстановительная способность. Они вступают в реакцию как с простыми веществами – неметаллами, так и со сложными веществами – водой, кислотой, щелочами и другими веществами.
Взаимодействие металлов с кислотами
ДЕЙСТВИЕ ХЛОРОВОДОРОДНОЙ КИСЛОТЫ НА МЕТАЛЛЫ
ДЕЙСТВИЕ СЕРНОЙ КИСЛОТЫ НА МЕТАЛЛЫ
ДЕЙСТВИЕ АЗОТНОЙ КИСЛОТЫ НА МЕТАЛЛЫ
ДЕЙСТВИЕ ЩЕЛОЧЕЙ НА МЕТАЛЛЫ
ДЕЙСТВИЕ ХЛОРОВОДОРОДНОЙ КИСЛОТЫ НА МЕТАЛЛЫ
Металл взаимодействует с хлороводородной кислотой, если энергия его ионизации меньше энергии ионизации водорода, а таковыми являются активные металлы, стоящие в ряду напряжений до водорода. При растворении в хлороводородной кислоте активных металлов образуется соль этого металла (хлорид) и выделяется водород. В этом случае в качестве окислителя выступает ион водорода (Н + ) кислоты, который оттягивает электрон от атома восстановителя (металла).

Можно рассчитать ЭДС этой реакции.
ЭДС = Еокис-ля – Евос-ля = 0 – (-0,76) = 0,76 В.
Потенциалы находятся в ряду напряжений металлов.
Действие серной кислоты на металлы
Разбавленная серная кислота растворяет только активные металлы, т.е. реакции идут аналогично реакциям с хлороводородной кислотой. В результате реакции образуется соль металла (сульфат) и выделяется водород.
1 2 2H + + 2ē → H2 0 процесс восстановления Н + - окислитель
Fe + 2H + → Fe 2+ + H2
ЭДС = 0 – (-0,44) = 0,44 В
Концентрированная серная кислота растворяет металлы, стоящие в ряду напряжений металлов до серебра (включительно). Не растворяется золото и платиновые элементы (Рt, Os, Ru, Ir, Rh, Pd).
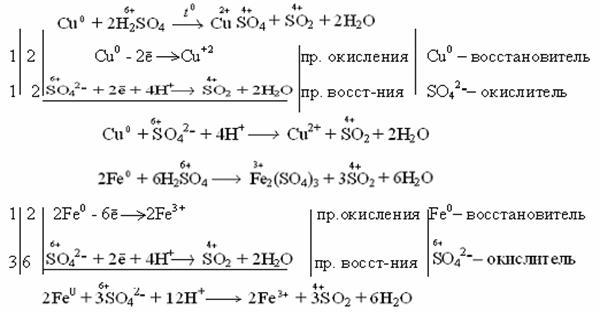
Например: неактивные и малоактивные металлы (Cu, Ag, Fe, Ni) восстанавливают серу +6 до серы +4 (SO2). Реакция идет при нагревании.
Как видно из реакций, разбавленная серная кислота окисляет железо до +2, а концентрированная до +3.
Более активные металлы восстанавливают серу +6 до свободной серы (S 0 ) и сероводородной кислоты (H2S), где сера имеет степень окисления -2.
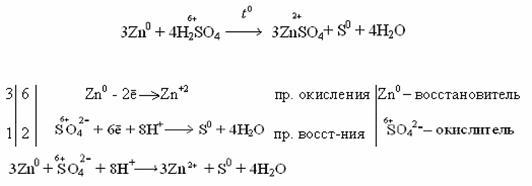
Действие азотной кислоты на металлы
Азотная кислота, являясь сильным окислителем, действует почти на все металлы (кроме Au, Pt, Ru, Rh, Ir, Os, Ta), превращая их в нитраты, а некоторые – в оксиды (пассивирование металлов).
Особенность действия азотной кислоты на металлы заключается в том, что она окисляет металлы без выделения водорода даже из разбавленного раствора кислоты, в отличие от серной. Глубина восстановления азота из азотной кислоты зависит от концентрации последней и от активности взаимодействующего с ней металла. Чем больше разбавлена кислота и чем активнее металл, тем глубже идет восстановление. Азот кислоты восстанавливается
ÜРазберем некоторые примеры взаимодействия азотной кислоты с металлами.
При взаимодействии концентрированной азотной кислоты с неактивными металлами выделяется NO2:

Разбавленная азотная кислота с малоактивными и неактивными металлами (Pb, Cu, Ni, Ag, Fe) образует NO:
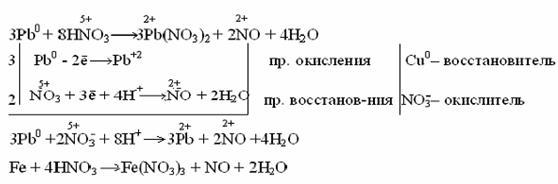
Очень разбавленная азотная кислота восстанавливается до аммиака (NH3) при взаимодействии с очень активным металлом, образующим в кислой среде ион аммония NH4 + :
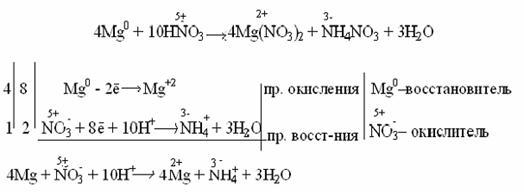
Концентрированная кислота пассивирует некоторые металлы (Al, Cr, Fe), что выражается в покрытии металлов тонкой оксидной пленкой:
Поэтому концентрированную азотную кислоту перевозят в алюминиевых цистернах, а разбавленную – в цистернах из кислотоупорной стали.
Металлы способны вытеснять друг друга из растворов солей. Возможность прохождения таких реакций определяется положением металлов в ряду напряжений: более активные металлы вытесняют из растворов их солей менее активные.
Читайте также:
