Действие тяжелых металлов на микроорганизмы
Обновлено: 04.10.2024
Методами рентгенофлуоресцентного анализа и атомно-силовой микроскопии изучена способность бактерий рода Bacillus аккумулировать металлы Co, Pb, Cd, Zn. Установлены минимально подавляющие концентрации поглощаемых металлов Co, Pb, Cd, Zn, Mn, Fe для каждого штамма микроорганизмов. Определены фазы роста бактерий рода Bacillus без металлов и в присутствии их солей. При культивировании с металлами в некоторых случаях происходило увеличение времени выхода бактерий на стационарную фазу роста. Динамика накопления металлов клетками микроорганизмов изучена методом рентгенофлуоресцентного анализа. Для изучения изменения морфологии бактерий при накоплении тяжелых металлов использовался метод атомно-силовой микроскопии. Измерены основные морфометрические показатели клеток в присутствии солей металлов и их отсутствии. Показано, что действие солей металлов на микроорганизмы приводит к уменьшению размеров клеток, замедлению их роста и образованию спор.

1 Безруков, М. Г., Белоусова М. А., Сергеев А. В. Взаимодействие металлов с белками // Успехи химии. – 2000. – Т. 51. – № 4. – С. 696–711.
2 Букреева В.Ю., Грабович М.Ю., Епринцев А.Т. Сорбция коллоидных соединений оксидов железа и марганца с помощью железобактерий на песчаных загрузках очистных сооружений водоподъемных станций // Сорбционные и хроматографические процессы. – 2009. – Т. 9. – № 4. – C. 506–514
3 Сизенцов А.Н., Исайкина Е.Ю., Кван О.В., Сизова Е.А. Эффективность применения пробиотических препаратов на основе бактерий рода Bacillus при лечении экспериментальной интоксикации медью // Известия Оренбургского государственного аграрного университета. – 2015. – Т. 51 – №. 1. – C. 149–152.
4 Сизенцов А. Н., Пешков С.А., Нугаманова Э.М. Влияние тяжелых металлов на рост пробиотических штаммов E.coli M-17, E.faecium, L.acidophilus, L.bulgaricus и бактерий рода Bacillus в условиях in vitro // Вестник ОГУ. – 2011. – Т. 131. – № 12. – С. 358–360.
5 Costa, A. C., Duta F. P. Bioaccumulation of copper, zinc, cadmium and lead by Bacillus sp., B.cereus, B.sphaericus and B.subtilis // Braz. J. Microbiol. – 2001. – V. 32. – №.1. – P. 159–175.
6 Lodeiro P. et al. Biosorption of cadmium by biomass of brown marine macroalgae // Bioresource Technology. – 2005. – V. 96. – №. 16. – P. 1796–1803.
7 Montes, D. Removal of mercury (II) from aqueous solutions of non-viable cells of Bacillus sp. // Biotechnology. – 2006. – V. 97. – №. 7. – P. 1907–1911.
В настоящее время достаточно остро стоит проблема загрязнения почв металлами. Растения и микроорганизмы обладают способностью накапливать и удалять металлы [5, 7, 2]. Наибольший интерес представляют микроорганизмы, в частности бактерии, входящие в состав пробиотиков, поскольку они являются рекордсменами по аккумуляции металлов [6] и обладают рядом полезных свойств, что делает возможным их применение для коррекции функциональных состояний у животных и человека после интоксикации металлами [3]. Влияние металлов на морфологию клетки изучено недостаточно полно [1]. Одним из методов, используемых при исследовании воздействий металлов на клетку, является метод атомно-силовой микроскопии (АСМ). С помощью этого метода и электронной микроскопии можно определить, накапливаются ли металлы на поверхности клетки или поглощаются ею. Использование метода рентгенофлуоресцентного анализа (РФА) позволяет изучить динамику изменения концентрации металлов в среде и клетке.
Цель работы
Установить способность микроорганизмов рода Bacillus накапливать тяжелые металлы и проанализировать их влияние на клетки бактерий.
Материалы и методы
В работе использовались три пробиотических штамма бактерий рода Bacillus: B.пlicheniformis ВКПМ В 7038; B. clausii; B. subtilis УКМ В - 5020. В качестве регулирующих факторов использовались водорастворимые соли металлов ZnSO4*7Н20 - сульфат цинка, Pb(NO3)2 - нитрат свинца, CoSO4*7Н2О - сульфат кобальта, CdSO4*8Н2О - сульфат кадмия, MnSO4*H2O - сульфат марганца и FeSO4*H2O - сульфат железа. Выбор таких элементов, как свинец и кадмий, определялся их большой токсичностью для клетки. Металлы цинк и кобальт выбраны как наиболее распространенные биогенные элементы.
Для определения минимально-подавляющей концентрации (МПК) использовался метод последовательных разведений. Влияние солей тяжелых металлов на рост микроорганизмов определялось по оптической плотности суспензии с помощью фотоэлектроколориметра (ФЭК-КФК-2). Методики выполнения подробно описаны в статье [4].
Динамику накопления металлов клетками исследовали методом рентгенофлуоресцентного анализа (РФА). Микроорганизмы культивировали в жидкой питательной среде в течение 36 ч при 37оC. Каждые 3 ч, начиная с нулевого часа, отбирали суспензию микроорганизмов объемом 3 мл и центрифугировали. Определение проводили в супернатанте. Для анализа выбраны два наиболее токсичных металла (Co, Pb) и один биогенный (Zn). Динамику накопления кадмия измерить не удалось, так как низкие концентрации кадмия в растворе находятся вне диапазона точности измерений прибора. Марганец и железо исключены из исследования, так как слабо накапливаются микроорганизмами рода Bacillus и их влияние на рост незначительно. Анализ динамики накопления металлов произведен на приборе «Spectroscan-LF».
Влияние металлов на морфологию клеток микроорганизмов исследовали с помощью атомно-силовой микроскопии (АСМ). Бактерии культивировались в жидкой питательной среде с металлами в течение 36 ч при 37оC, после чего микроорганизмы отмывали. Суспензию микроорганизмов объемом 1 мл центрифугировали в течение 5 мин при 10 000 оборотов. После отбора супернатанта в него добавляли дистиллированную воду до первоначального объема, полученную суспензию тщательно перемешивали. Данную процедуру повторяли 3–4 раза. Это позволило отделить бактерии от среды и металлов, оставшихся в растворе.
С целью определения точной концентрации бактерий, необходимой для нанесения на подложку, предварительно проводили разведения микроорганизмов. Бактерии выращивались без металлов в жидкой питательной среде, затем отмывались. Процедуру проводили 3–4 раза вышеописанным способом. После последнего центрифугирования к осадку в пробирке добавляли 100 мкл дистиллированной воды, увеличивая ее количество на 100 мкл в следующих пробирках, добиваясь разведения 1:1, 1:2, 1:3 и т.д. Наилучшей концентрацией после анализа на АСМ оказалась 1:3. В дальнейшем эта концентрация использовалась для приготовления всех препаратов для проведения экспериментов методом АСМ. Каплю полученной суспензии (30 мкл) наносили на свежий скол слюды и давали высохнуть. В качестве регулирующих факторов выбраны соли свинца как наиболее токсичного и сравнительно сильно аккумулируемого металла.
Полученные образцы сканировались в контактном режиме на атомно-силовом микроскопе СММ-2000 (ОАО «Завод ПРОТОН-МИЭТ», Россия). В работе использовались кантилеверы MSCT-AUNM («Veeco Instruments Inc.», США) микроскопа с жесткостью балки 0,03 Н/м и радиусом кривизны иглы порядка 10 нм. Количественный морфометрический анализ полученных изображений проводили с использованием штатного программного обеспечения микроскопа.
Ранее установлены МПК и влияние металлов на рост микроорганизмов для двух штаммов Bacillus: B. licheniformis 7048 и B. subtilis 7092 [4].
Из результатов, представленных в таблице 1, видно, что металлом, оказывающим наименьшее влияние на рост микроорганизмов, является свинец. Так, B. subtillis УКМ В-5020 растут при концентрации от 0,02 М/л, а B. licheniformis 7038 и B. clausii начинают рост при 0,005 М/л. Наиболее токсичным металлом оказался кадмий. Так, микроорганизмы B. licheniformis 7038 растут при концентрации 3,9∙10-5 М/л, микроорганизмы B. subtillis УКМ В-5020 растут при концентрации 1,5∙10-4 М/л, а Bacillus clausii – при 7,8∙10-5 М/л.
Анализ полученных данных позволяет сделать вывод, что из всех исследуемых микроорганизмов рода Bacillus самым чувствительным штаммом к используемым металлам является B. clausii.
Действие тяжелых металлов на микроорганизмы
Представлены результаты изучения влияния тяжёлых металлов (Co2+, Pb2+, Cu2+, Zn2+, Cd2+) на размножение патогенных бактерий: Listeria monocytogenes (1/2а, 1/2b, 4b), Yersinia pseudotuberculosis (2781, 3515, 907), Esherihia coli (1147), Staphylococcus aureus (6538р/206р). Подобраны минимальные ингибирующие концентрации (МИК) солей тяжелых металлов, при которых рост патогенных бактерий угнетался на 50 % по сравнению с контролем. Показано, что патогенные бактерии обладают механизмами металл-резистентности, при этом установлены разные значения МИК используемых ионов, как на уровне видов бактерий, так и на уровне штаммов, что предполагает реализацию разных механизмов устойчивости бактерий к тяжелым металлам. Штаммы, растущие на подобранных МИК тяжелых металлов, являются моделью для изучения факторов патогенности и изменения биологических свойств исследуемых бактерий.

1. Зайцева О.В. Биотехнологические приемы оценки устойчивости сталей к коррозии, вызываемой бактериальной сульфатредукцией, и пути повышения коррозионной устойчивости нефтегазового оборудования: автореф. дис. . канд. биол. наук. – Уфа, 2009. – 23 с.
2. Алексеева А.Н., Анисимов Д.А., Хоменко В.А. Изменение состава белков оболочки и липополисахарида у кадмийустойчивых псевдомонад // Биол. Мембраны. – 1991. – Т.8. – № 8. – С. 800–804.
3. Иванова Е.П. Горшкова Н.М., Куриленко В.В. Толерантность к солям тяжёлых металлов морских протеобактерий родов Pseudoalteromonas и Alteromonas // Микробиология. – 2001. – Т. 70. – № 2. – С. 283–285.
4. Каравайко Г.И., Дубинина Г.А., Кондратьева Т.Ф. Литотрофные микроорганизмы окислительных циклов серы и железа // Микробиология. – 2006. – Т. 75. – № 5. – С. 593–629.
6. Сомов Г.П., Бузолёва Л.С. Адаптация патогенных бактерий к абиотическим факторам окружающей среды. – Владивосток: ОАО «Примполиграфкомбинат», 2004. –167 с.
7. McEntee J.D., Woodrow J.R., Quirk A.V. Investigation of cadmium resistanse in Alcaligenes sp. // Appl. Environ. Microbiol. – 1986. – Vol. 51. – P. 515–520.
8. Nies D.H. Microbial heavy-metal resistance // Appl.Microbiol. Biotechnol. – 1999. – Vol. 51. – P. 730–750.
9. Rouch D.A., Lee B.T.D., Morby A.P. Understanding cellular responses to toxic agenst: A model for mechanism choise in bacterial metal resistanse // J. of Indust. Microbiol. 1995. – Vol. 14. – P. 132–141.
10. Silver S., Phung L.T. Bacterial heavy metal resistance: new surprises // Annu. Rev. Microbiol. – 1996. – Vol 50. – P. 753–789.
Патогенные микроорганизмы, способные обитать в объектах окружающей среды, относятся к возбудителям сапрозоонозов или факультативным паразитам. К настоящему времени число микроорганизмов, характерной особенностью которых является способность вести как сапрофитный, так и паразитический образ жизни, неуклонно растет. Известно, что изменение природных абиотических факторов среды (температура, солёность, рН, влажность, кислородный режим, питательный субстрат) приводит к изменению биологических свойств патогенных бактерий, включая вирулентность [6]. Современная окружающая среда испытывает мощное влияние факторов антропогенного характера, к числу которых можно отнести тяжелые металлы, определенным образом воздействующие и на микроорганизмы.
Тяжёлые металлы играют двойственную роль в процессах жизнедеятельности микроорганизмов. Некоторые из них – Mo, Cu, Mn, Zn, Ni являются жизненно необходимыми в небольших количествах. Так, общеизвестно, что ионы металлов входят в состав многих биологически важных макромолекул (ферментов, гормонов, витаминов, дыхательных пигментов, липидов и т.д.) и являются их необходимой частью, без которой не реализуется их физиологическая функция. Другие – Cd, Pb, Sn, Hg, Ag, Co – не выполняют биологических функций, однако, при высоких концентрациях все эти элементы, за счёт хорошей способности к комплексообразованию, являются чрезвычайно токсичными для микробов. Они могут взаимодействовать с гидроксильными, карбоксильными, фосфатными, сульфгидрильными и аминогруппами, вызывая изменения свойств белков, нуклеотидов, коферментов, фосфолипидов, в состав которых входят перечисленные группировки, а также токсичность проявляется в нарушении процессов окислительного фосфорилирования и поддержания осмотического баланса клеток. Металлы могут влиять на процессы, протекающие в клетке, только проникая внутрь её и фиксируясь на субклеточных мембранах [8].
К настоящему времени установлено, что клетки разных микроорганизмов способны аккумулировать тяжёлые металлы в количествах, намного превышающих потребность в них как в компонентах питания. Накопление металла приводит к его значительному концентрированию в клетках по отношению к среде. Из литературных данных известно, что микроорганизмы проявляют устойчивость фактически ко всем тяжёлым металлам [10].
Общим механизмом действия разных тяжёлых металлов является ингибирование ими дыхания у микроорганизмов. Этот эффект в ряде случаев, но не во всех, наблюдается при сравнительно более высоких концентрациях металлов, чем те, которые ингибируют рост [4]. Известно, что при действии тяжёлых металлов в клетках микроорганизмов происходит целый ряд деградативных изменений, которые могут вести к ингибированию их размножения. Так, под действием тяжёлых металлов наблюдаются изменения в содержании и синтезе основных полимеров в клетках. Тяжёлые металлы могут оказывать мутагенное действие на микроорганизмы, вызывая увеличение частоты мутаций, хромосомные аберрации или другие разрушения ДНК [3].
Цель исследования. Приведенные данные получены при изучении сапрофитных микроорганизмов, в отношении патогенных бактерий, способных существовать в объектах окружающей среды, такие исследования не проводились. Поэтому целью настоящей работы было определение минимальной ингибирующей концентрации катионов тяжёлых металлов, оказывающей влияние на размножение патогенных бактерий.
Материал и методы исследования
Объектами исследования были: Listeria monocytogenes (1/2а и 1/2b) – из коллекции НИИЭМ им. Н.Ф. Гамалея; 4b – из коллекции ВГНКИ ветеринарных препаратов; Yersinia pseudotuberculosis (2781, 3515, 907), Esherihia coli (1147) – коллекция НИИЭМ, Владивосток; Staphylococcus aureus (6538р/206р) – ФТУЗ Хабаровская противочумная станция. Для приготовления жидких сред использовали основы следующего состава: для культивирования L. monocytogenes – бульон для листерий (рыбный бульон с аминным азотом 110 мг %, дрожжевой экстракт сухой 1 %, глюкоза 0,2 %, рН 7,3); для Y. pseudotuberculosis и E. coli – бульон Хоттингера (рН 8); для S. aureus (6538р/206р) – сахарный бульон (бульон Хоттингера с 1 % глюкозы). Подбирали минимальную ингибирующую концентрацию солей тяжёлых металлов.
Для изучения динамики роста исследуемых бактерий в средах, содержащих соли тяжёлых металлов, использовали одни и те же концентрации солей для Y. pseudotuber-culosis, L. monocytogenes, E. coli и S. аureus. Предварительно штаммы подращивали в течение одних суток на плотных питательных средах, содержащих те же концентрации тяжёлых металлов, что и в жидкой среде. Динамику роста патогенных бактерий наблюдали в течение 7 дней при температуре 20–22 °С. В качестве контрольных – использовали те же среды для культивирования бактерий, но без катионов металлов. Патогенные бактерии добавляли в питательные среды с солями тяжелых металлов в дозе – 103 КОЕ/мл. Численность бактерий определяли спектрофотометрически по оптической плотности (ОП) культуральной среды при λ 600 нм на спектрофотометре Т70 UV/VIS Spectrometer PG Instruments Ltd (Англия).
Ингибирующее действие катионов тяжёлых металлов на размножение патогенных бактерий определяли по изменению концентрации микроорганизмов в точке их максимального роста по отношению к контролю, выраженному в процентах: ОПО600/ОПК600∙100–100 % (100 % – контроль) [1] (рисунок).
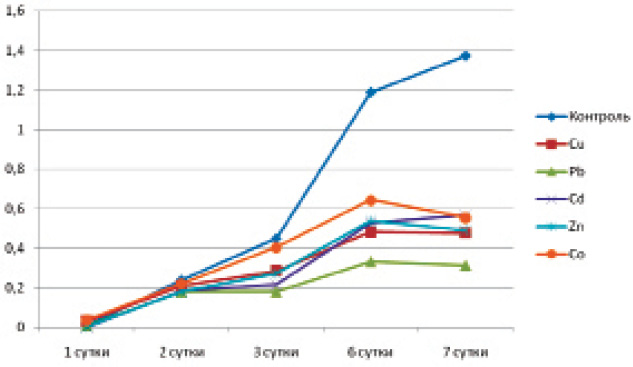
Динамика роста Y. pseudotuberculosis (шт. 3515) в питательном бульоне с солями тяжёлых металлов при температуре 20 °С (6 сутки – точка сравнения результатов)
Результаты исследования и их обсуждение
Данные, полученные в результате исследования, представлены в таблице, из которой видно, что листерии, по сравнению с другими тест-микроорганизмами, быстро откликаются на воздействие тяжелых металлов. Так, свинец, кобальт, цинк , медь и кадмий ингибировали рост L. monocytogenes уже на 2–3 сутки.
Минимальные ингибирующие концентрации (МИК) солей тяжелых металлов, определенные для патогенных бактерий (мг/л)
Возбудители сапрозоонозов способны адаптироваться к широкому спектру тяжелых металлов. Возможность выживания в присутствии поллютантов зависит от биологических свойств бактерий, вида и концентрации металла, в соответствии с чем, в ходе настоящих исследований подобраны максимальные концентрации тяжелых металлов, к которым устойчивы изучаемые бактерии. Установлено, что тяжелые металлы оказывают как стимулирующее, так и угнетающее воздействие на факторы патогенности. Показано, что тяжелые металлы усиливают адгезивные свойства иерсиний и сальмонелл. Высокой адгезивностью обладают штаммы, устойчивые к свинцу и никелю. Тяжелые металлы усиливают вирулентные свойства патогенных иерсиний и сальмонелл. Сокращение сроков гибели лабораторных животных и усиление вирулентности иерсиний и сальмонелл под воздействием свинца является результатом повышения адгезии – первого этапа в развитии инфекционного процесса, способствующего дальнейшей реализации патогенных свойств возбудителя.

1. Безвербная И.П., Бузолева Л.С., Христофорова Н.К. Металлоустойчивые гетеротрофные бактерии в прибрежных акваториях Приморья // Биология моря. – 2005. – Т. 31. – № 2. – С. 89–93.
2. Брилис В.И., Брилене Т.А., Ленцнер X.П., Ленцнер А.А. Методика изучения адгезивного процесса микроорганизмов // Лабораторное дело. – 1986. – № 4. – С. 210–212.
3. Лабинская, А.С., Блинкова Л.П. Общая и санитарная микробиология с техникой микробиологических исследований. – М.: Медицина, 2005. – 600 с.
4. Львов Н. П. Молибден и ассимиляция азота у растений и микроорганизмов // 43 Баховские чтения. – М.: Наука, 1989. – 86 с.
5. Поздеев О.К., Покровский В.И. Медицинская микробиология: учебное пособие для ВУЗов. – М.: ГЭОТАР-Медиа, 2001. – 765 с.
6. Супотницкий М.В. Микроорганизмы, токсины и эпидемии. – М.: Изд-во «Вузовская книга», 2000. – 376 с.
7. Самойленко И.И., Белодед А.В., Цепилов Р.Н. Синтез и деградация гиалуроновой кислоты бактериями рода Streptococcus // Журнал микробиологии, эпидемиологии и иммунобиологии. – 2010. – № 5. – С. 83–90.
Известно, что у патогенных бактерий биологические свойства проявляются как факторы патогенности. Наибольшее значение имеют бактериальные ферменты, обладающие токсическим действием. Вырабатываемые бактериями, они могут влиять на течение, исход болезни и на иммунитет макроорганизма. Многие энзимы патогенных и условно-патогенных микробов, катализирующие чуждые животному организму реакции, могут являться типичными токсинами, обладающими антигенными свойствами. Ферменты паразитирующих в организме микробов способны образовывать ядовитые продукты, как за счет распада своих составных частей, так и за счет разложения веществ животного организма [6].
Изучение влияния тяжелых металлов на ферментативную активность патогенных микробов является важным, так как многие наступающие при этом изменения в свойствах бактерий могут влиять на их вирулентность, а, следовательно, на скорость и качество течения инфекционного процесса.
Цель работы – изучить влияние ионов тяжелых металлов на ферментативную активность и вирулентные свойства патогенных бактерий – возбудителей сапрозоонозов.
В качестве объектов исследований были использованы следующие микроорганизмы: Salmonella typhimurium, Salmonella enteritidis; Yersinia pseudotuberculosis: штамм Н-2781, 282. Эксперименты проводили в условиях острого опыта.
Уровень индивидуальной устойчивости бактериальных штаммов к ионам тяжелых металлов: Ni2+, Zn2+, Co2+, Pb2+, Cu2+, Cd2+ оценивали на основе определения максимальной концентрации соли каждого металла, при которой не был отмечен эффект подавления роста культуры [1]. Посев производили в трех повторностях методом отпечатков чистых культур на среду МПА (для Yersinia и Salmonella) с добавками солей металлов в возрастающих концентрациях. Подобраны максимальные концентрации тяжелых металлов, к которым были устойчивы выбранные патогенные бактерии.
Для оценки адгезивной активности в качестве клеточного объекта нами были использованы эритроциты, а показателем адгезии служил СПА – средний показатель адгезии, то есть среднее количество адгезированных клеток штамма на одном эритроците. Адгезивность считали нулевой при СПА от 0 до 1,0; низкой при СПА от 1,01 до 2,0; средней при СПА от 2,01 до 4,0; высокой при СПА больше 4 [2].
Анализ определения максимальных концентраций солей тяжелых металлов, к которым были резистентны исследуемые тест-микроорганизмы показали, что все взятые в эксперимент штаммы обладали наибольшей устойчивостью к свинцу и никелю, а бактерии рода Salmonella – еще и к меди. При сравнении максимальных концентраций солей тяжелых металлов, к которым устойчивы исследуемые бактерии, были выявлены существенные отличия (табл. 1). Так, штаммы Y. pseudotuberculosis были наименее устойчивы ко всем тяжелым металлам, по сравнению со штаммами бактерий рода Salmonella. По степени уменьшения резистентности штаммов Y. pseudotuberculosis к тяжелым металлам их можно расположить в следующей последовательности: Pb > Ni > Zn > Сu > Со > Cd. Для сальмонелл выявлена другая последовательность: Pb > Ni = Сu > Zn = Со > Cd.
Максимальные концентрации солей тяжелых металлов (мг/л в пересчете на безводную соль), к которым устойчивы исследуемые штаммы бактерий
XIII Международная студенческая научная конференция Студенческий научный форум - 2021

ВЛИЯНИЕ ТЯЖЕЛЫХ МЕТАЛЛОВ НА ПОЧВЕННЫЕ МИКРООРГАНИЗМЫ
Текст работы размещён без изображений и формул.
Полная версия работы доступна во вкладке "Файлы работы" в формате PDF
Из различных химических веществ, попадающих в окружающую среду из антропогенных источников, особое место занимают тяжелые металлы. Попадая в почву, они влияют на видовой состав и численность, а также на функциональное состояние микробиоценоза [4, c . 119].
Почва для микроорганизмов является средой обитания и субстратом. Она представляет интерес как природный резервуар для медицинской санитарии и гигиены, содержащий микроорганизмы.
В почве содержится большая часть различных продуктов минерализации органических веществ, обеспечивающих сопряжение биологического и геологического круговоротов, и этим определяется важность проблемы влияния тяжелых металлов на почвенные микроорганизмы.
Из-за загрязнения тяжелыми металлами существенно меняются определенные микробиологические и химические свойства почвы. Также тяжёлые металлы в почве оказывают влияние на деление клеток микроорганизмов и изменяют разновидность почвенной микрофлоры, которая представлена в основном трофическими группами [5].
Микроорганизмы занимают определенную роль в миграции тяжелых металлов в почве. Они могут выступать в качестве продуцентов, потребителей и транспортирующих агентов в почвенной экосистеме. Многие почвенные грибы могут проявлять способность к иммобилизации тяжелых металлов, накапливая их в мицелии, временно исключая из круговорота веществ [6].
Из-за повышения концентрации тяжелых металлов можно наблюдать стремительное уменьшение активности ферментов и снижение численности определенных групп микроорганизмов. Тяжелые металлы в почве ингибируют процессы минерализации, могут подавлять дыхание почвенных микроорганизмов, вызывать микробостатический эффект, а также выступать как мутагенный фактор.
Разные группы микроорганизмов различным образом реагируют на тяжелые металлы. Это зависит от их вида, концентрации тяжелых металлов в среде и типа почвы.
У тяжелых металлов двойственная роль в процессах жизнедеятельности микроорганизмов. Все микроорганизмы нуждаются в тех или иных металлах в качестве компонентов питания. Например, некоторые из них – Fe , Zn , Cu , Cr , Mn , являются необходимыми в малых количествах для поддержания жизнедеятельности. А также определенные микроорганизмы нуждаются в тяжелых металлах, таких, как Mo , V , Ni . Все перечисленные металлы в основном принимают участие в ферментативном катализе в качестве кофакторов, и должны присутствовать в низких концентрациях в питательной среде. Другие металлы, например, такие, как Cd , Pb , Sn , Hg Ag, Co не выполняют биологических функций, но при высоком содержании в почве могут быть токсичными для микробов. Они могут изменять свойства белков, коферментов, нуклеотидов, фосфолипидов, взаимодействуя с гидроксильными, карбоксильными, фосфатными, сульфгидрильными и аминогруппами. Также тяжелые металлы, проникая внутрь клетки и фиксируясь на субклеточных мембранах, могут влиять на процессы, протекающие в клетке [1].
При высокой концентрации тяжелых металлов снижается количество микроорганизмов в почве. Из-за техногенных загрязнений уменьшается как общая численность микроорганизмов, так и резко снижается количество аммонификаторов и нитрификаторов, а группы денитрификаторов и олигонитрификаторов возрастает. Увеличивается также численность фосфатрастворяющих и железоредуцирующих бактерий, а целлюлозоразрушающих, напротив, идет на спад [3].
Также степень угнетения жизнедеятельности микробиоценоза может зависеть от физиолого-биохимических свойств конкретных тяжелых металлов, которые загрязняют почву. Свинец отрицательно воздействует на биотическую деятельность в почве, ингибируя активность ферментов, нарушает метаболизм микроорганизмов, особенно, процессов дыхания и клеточного деления. При наличии в почве высокого количества свинца (более 8000 мг/кг) изменяется морфологическое строение Bacillus mycoides: их скрученные, извилистые гифообразные выросты распрямляются и становятся вытянутыми [2, c . 384].
Ионы С d в концентрации 12 мг/кг имеют свойства нарушать фиксацию атмосферного азота, а также влиять на процессы аммонификации, нитрификации и денитрификации. Наиболее подвержены воздействию Cd грибы, причем определенные виды при попадании тяжевого металла в почву полностью исчезают. При избытке концентрации ионы Zn затрудняют дыхание микроорганизмов, ферментацию разложения целлюлозы и т.д., из-за которых в почве могут нарушаться процессы преобразования органических веществ. Кроме того, токсичное действие тяжелых металлов зависит от набора конкретных металлов и их взаимодействия с микробиотой.
Также известно, что при загрязнении почвы тяжелыми металлами, микроскопические грибы могут реагировать на них положительно или отрицательно, угнетая сообщество в почве, или, стимулируя их развитие. Например, Sr в некоторых видах почв резко увеличивает токсинообразование и стимулирует рост грибов рода Fusarium.
При постоянном загрязнении почвы микромицеты способны накапливать Сu и Ni. Эта способность грибов позволяет использовать те или иные микромицеты в качестве биоиндикаторов загрязнения почв тяжелыми металлами [1].
При загрязнении почвы тяжелыми металлами изменяется структура грибных сообществ, которая выражается обычно в снижении видового разнообразия и приводит к доминированию тех грибов, которые имеют толерантность к тяжелым металлам.
Тяжелые металлы влияют на микроскопические грибы по-разному. Одни ионы металлов, такие, как Сu, С o , Мо могут нарушать морфогенез у определенных грибов, например, микроскопического гриба рода Fusarium., а ионы Cu и Zn при определенных токсических концентрациях влияют на грибы рода Penicillium. Также было доказано, что Cd имеет свойство подавлять транспорт Zn и частично Cu в мицелии гриба Penicillium notatum.
Показано, что ионы меди и ионы некоторых других тяжелых металлов влияют на генетический аппарат, синтез белка и организацию клеточной мембраны у микроскопических грибов. Предполагается, что в присутствии Zn и Сu увеличивается образование микотоксинов [1].
Таким образом, изменения в сообществе почвенных микроорганизмов происходят из-за загрязнения почвы тяжелыми металлами. Это проявляется в уменьшении видового разнообразия и увеличении доли микроорганизмов толерантных к загрязнению. От активности почвенных процессов и жизнедеятельности населяющих ее микроорганизмов зависит интенсивность самоочищения почвы от загрязнителей.
Багаева Т.В., Ионова Н.Э., Надеева Г.В. Микробиологическая ремедиация природных систем от тяжелых металлов: учеб.-метод. пособие // Казань: Казанский университет. 2013. 56 с.
Мосина Л. В., Довлетярова Э. А., Ефремова С. Ю., Норвосурэн Ж. – Экологическая опасность загрязнения почвы тяжелыми металлами (на примере свинца) // Известия ПГПУ им. В.Г. Белинского. 2012. № 29. С. 383–386.
Семенова И.Н., Ильбулова Г.Р., Суюндуков Я.Т. Изучение эколого-трофических групп почвенных микроорганизмов в зоне влияния горнорудного производства. //Фундаментальные исследования 2011. №11(2). С. 410-414.
Чичерина В.Р., Сапрыкина У.Ю. Влияние тяжелых металлов на рост бактерий рода Bacillus // Шаг в науку. 2016. №1. С.119-125.
Читайте также:
