Электрохимический ряд активности металлов это
Обновлено: 02.07.2024
Первоначально Бекетов предполагал, что способность одних металлов вытеснять из растворов солей другие металлы связана с их плотностью: более лёгкие металлы способны вытеснять металлы более тяжелые. Но опыты говорили о ином. Непонятно было и то, как связан “вытеснительный ряд” с рядом напряжений Алессандро Вольта. Со временем накапливалось всё больше экспериментальных данных того, что некоторые правила вытеснения нарушаются при определенных условиях. Бекетов обнаружил, что водород под давлением 10 атмосфер вытесняет серебро из раствора нитрата серебра. Английский химик Уильям Одлинг (1829-1921) описал множество случаев подобных аномалий. Например, медь вытесняет олово из концентрированного подкисленного раствора хлорида олова (II) и свинец – из кислого раствора хлорида свинца (II). Медь, олово и свинец находятся в ряду правее кадмия, однако могут вытеснять его из кипящего слабо подкисленного раствора хлорид кадмия.
Теоретическую основу ряда активности (и ряда напряжений) заложил немецкий физикохимик Вальтер Нернст (1864-1941). Вместо качественной характеристики – “склонности” металла и его иона к тем или иным реакциям – появилась точная количественная величина. Такой величиной стал стандартный электродный потенциал металла, а соответствующий ряд, выстроенный в порядке изменения потенциалов, называется рядом стандартных электродных потенциалов.
Электрохимический ряд напряжений металлов (ряд Бекетова) это последовательность расположения металлов и их ионов в порядке возрастания стандартных электродных потенциалов в растворах электролитов. Электродом сравнения обычно служит стандартный водородный электрод, электродный потенциал которого условно принимается равным нулю.
| Восстановленная форма | Число отданных електронов | Окисленная форма | Стандартный электродный потенциал, В |
| Li | 1e | Li + | -3,05 |
| K | 1e | K + | -2,925 |
| Rb | 1e | Rb + | -2,925 |
| Cs | 1e | Cs + | -2,923 |
| Ba | 2e | Ba 2+ | -2,91 |
| Sr | 2e | Sr 2+ | -2,89 |
| Ca | 2e | Ca 2+ | -2,87 |
| Na | 1e | Na + | -2,71 |
| Mg | 2e | Mg 2+ | -2,36 |
| Al | 3e | Al 3+ | -1,66 |
| Mn | 2e | Mn 2+ | -1,18 |
| Zn | 2e | Zn 2+ | -0,76 |
| Cr | 3e | Cr 3+ | -0,74 |
| Fe | 2e | Fe 2+ | -0,44 |
| Cd | 2e | Cd 2+ | -0,40 |
| Co | 2e | Co 2+ | -0,28 |
| Ni | 2e | Ni 2+ | -0,25 |
| Sn | 2e | Sn 2+ | -0,14 |
| Pb | 2e | Pb 2+ | -0,13 |
| Fe | 3e | Fe 3+ | -0,04 |
| H2 | 2e | 2H + | 0,00 |
| Cu | 2e | Cu 2+ | 0,34 |
| Cu | 1e | Cu + | 0,52 |
| 2Hg | 2e | Hg2 2+ | 0,79 |
| Ag | 1e | Ag + | 0,80 |
| Hg | 2e | Hg 2+ | 0,85 |
| Pt | 2e | Pt 2+ | 1,20 |
| Au | 3e | Au 3+ | 1,50 |
Место каждого элемента в ряду напряжений условно, т.к. величина электродного потенциала зависит от температуры и состава раствора, в который погружены электроды, в частности от концентрации ионов. Большое значение также имеет состояние поверхности электрода (гладкая, шероховатая). Стандартный электродный потенциал относится к водным растворам при температуре 25 °С, давлении газов 1 атмосфера и концентрации ионов 1 моль/л.
Из электрохимического ряда напряжений металлов вытекает ряд важных следствий:
- Каждый металл способен вытеснять (замещать) из растворов солей все другие металлы, стоящие правее данного металла;
- Все металлы, расположенные левее водорода, способны вытеснять его из кислот;
- Чем дальше расположены друг от друга два металла в ряду напряжений, тем большее напряжение может давать созданный из них гальванический элемент.
Восстановление водородом из оксидов
Металлы, которые водород не восстанавливает из их оксидов
Электрохимический ряд активности металлов
Электрохимический ряд активности (ряд напряжений, ряд стандартных электродных потенциалов) металлов — последовательность, в которой металлы расположены в порядке увеличения их стандартных электрохимических потенциалов φ 0 , отвечающих полуреакции восстановления катиона металла Me n+ : Me n+ + nē → Me
Ряд напряжений характеризует сравнительную активность металлов в окислительно-восстановительные реакциях в водных растворах.
Содержание
История
Последовательность расположения металлов в порядке изменения их химической активности в общих чертах была известна уже алхимикам [1] . Процессы взаимного вытеснения металлов из растворов и их поверхностное осаждение (например, вытеснение серебра и меди из растворов их солей железом) рассматривались как проявление трансмутации элементов.
Поздние алхимики вплотную подошли к пониманию химической стороны взаимного осаждения металлов из их растворов. Так, Ангелус Сала в работе «Anatomia Vitrioli» (1613) пришёл к выводу, что продукты химических реакций состоят из тех же «компонентов», которые содержались в исходных веществах. Впоследствии Роберт Бойль предложил гипотезу о причинах, по которым один металл вытесняет другой из раствора на основе корпускулярных представлений [2] .
В 1793 году Алессандро Вольта, конструируя гальванический элемент («Вольтов столб»), установил относительную активность известных тогда металлов: Zn, Pb, Sn, Fe, Cu, Ag, Au. «Сила» гальванического элемента оказывалась тем больше, чем дальше стояли друг от друга металлы в этом ряду («ряд напряжений»). Однако Вольта не связал этот ряд с химическими свойствами металлов.
В 1798 году Иоганн Вильгельм Риттер указал, что ряд Вольта эквивалентен ряду окисления металлов (т. е. последовательности уменьшения их сродства с кислородом). Таким образом, Риттер высказал гипотезу о возникновении электрического тока вследствие протекания химической реакции [3] .
В эпоху становления классической химии способность элементов вытеснять друг друга из соединений стала важным аспектом понимания реакционной способности. Й. Берцелиус на основе электрохимической теории сродства построил классификацию элементов, разделив их на «металлоиды» (сейчас применяется термин «неметаллы») и «металлы» и поставив между ними водород.
Не отрицая значительных заслуг Бекетова в становлении современных представлений об ряде активности металлов, следует считать ошибочным бытующее в отечественной популярной и учебной литературе представление о нём как единственном создателе этого ряда. [5] [6] .
Многочисленные экспериментальные данные, полученные в конце XIX века, опровергали гипотезу Бекетова. Так, Уильям Одлинг описал множество случаев «обращения активности». Например, медь вытесняет олово из концентрированного подкисленного раствора SnCl2 и свинец — из кислого раствора PbCl2; она же способна к растворению в концентрированной соляной кислоте с выделением водорода. Медь, олово и свинец находятся в ряду правее кадмия, однако могут вытеснять его из кипящего слабо подкисленного раствора CdCl2.
Бурное развитие теоретической и экспериментальной физической химии указывало на иную причину различий химической активности металлов. С развитием современных представлений электрохимии (главным образом в работах Вальтера Нернста) стало ясно, что эта последовательность соответствует «ряду напряжений» – расположению металлов по значению стандартных электродных потенциалов. Таким образом, вместо качественной характеристики — «склонности» металла и его иона к тем или иным реакциям — Нерст ввёл точную количественную величину, характеризующую способность каждого металла переходить в раствор в виде ионов, а также восстанавливаться из ионов до металла на электроде, а соответствующий ряд получил название ряда стандартных электродных потенциалов.
Теоретические основы
Значения электрохимических потенциалов являются функцией многих переменных и поэтому обнаруживают сложную зависимость от положения металлов в периодической системе. Так, окислительный потенциал катионов растёт с увеличением энергии атомизации металла, с увеличением суммарного потенциала ионизации его атомов и с уменьшением энергии гидратации его катионов.
В самом общем виде ясно, что металлы, находящиеся в начале периодов характеризуются низкими значениями электрохимических потенциалов и занимают места в левой части ряда напряжений. При этом чередование (щелочных и щёлочноземельных металлов отражает явление диагонального сходства. Металлы, расположенные ближе к серединам периодов, характеризуются большими значениями потенциалов и занимают места в правой половине ряда. Последовательное увеличение электрохимического потенциала (от −3,395 В у пары Eu 2+ /Eu [источник не указан 228 дней] до +1,691 В у пары Au + /Au) отражает уменьшение восстановительной активности металлов (свойство отдавать электроны) и усиление окислительной способности их катионов (свойство присоединять электроны). Таким образом, самым сильным восстановителем является металлический европий, а самым сильным окислителем — катионы золота Au + .
В ряд напряжений традиционно включается водород, поскольку практическое измерение электрохимических потенциалов металлов производится с использованием стандартного водородного электрода.
Практическое использование ряда напряжений
Ряд напряжений используется на практике для сравнительной оценки химической активности металлов в реакциях с водными растворами солей и кислот и для оценки катодных и анодных процессов при электролизе:
Ряд активности металлов

Химия
Что же из себя представляет ряд активности металлов давайте разбираться. Металлы — группа химических элементов, обладающих сходными свойствами. Среди них — электропроводность, пластичность, температурная зависимость сопротивления. По виду металлы можно отличить по характерному блеску, который так и назвали — металлический. Но химические свойства элементов отличаются в зависимости от строения их молекул и кристаллической решетки. Особенно ярко отличия проявляются по отношению взаимодействия с кислотами и щелочами. Всего на данный момент насчитывается 96 металлов. Общие свойства металлов показаны в таблице:
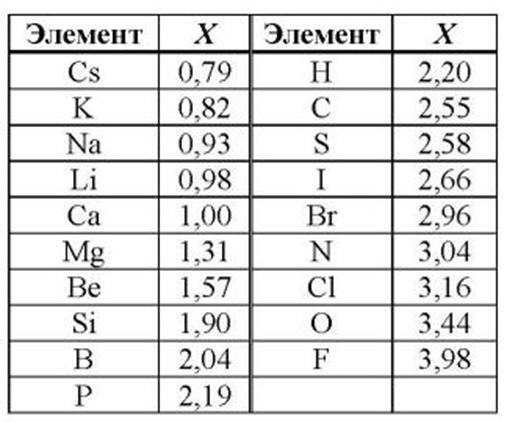
Все металлы в той или иной степени являются восстановителями, то есть, отдают электроны при течении окислительно-восстановительных реакций. Таблица электроотрицательности металлов показывает, какой металл является наиболее активным восстановителем. Если цифра напротив элемента больше 2, то это окислитель с характерными свойствами и выходит из ряда металлов, проявляя типичные свойства неметалла.
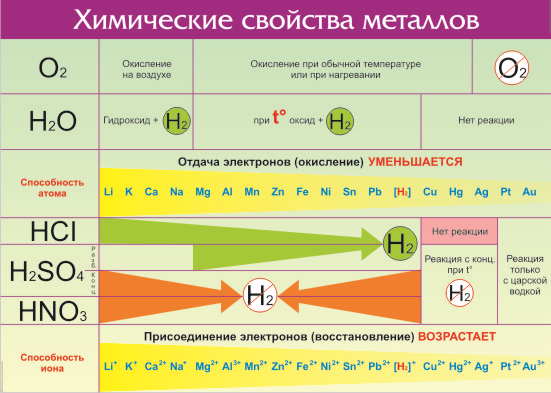
Электрохимический ряд активности металлов показывает, какие из металлов более активные, какие менее. Расположение элементов в горизонтальном ряду слева направо показывает направление снижения восстановительной способности и возрастание окислительной.
Восстановительная способность — свойство отдавать электроны в химических реакциях с водными растворами солей и щелочей.
Окислительная способность — свойство присоединять электроны в реакциях с теми же веществами.

Металлы в правой стороне более слабые восстановители, они вытесняются при реакциях с солевыми растворами металлами, расположенными левее. Пример реакции — Zn + Cu 2+ → Zn 2+ + Cu, которая протекает только в одном направлении. Цинк вытесняет медь, реагируя с водным раствором любой соли меди. Цинковая пластинка, при этом, растворяется, а медная восстанавливается.
Такую последовательность элементов еще называют ряд напряженности металлов, или ряд Бекетова. На всех вариантах записи ряда можно заметить, что последовательность металлов разделена знаком водорода (гидрогена), который металлом никак не является. Это своеобразный маркер, показывающий, что стоящие левее металлы вытесняют водород из водных растворов кислот, не обладающих окислительными свойствами. Некоторые металлы, например, литий, кальций, барий и остальные, стоящи до алюминия, вытесняют водород и при реакции с водой.
2Al +3H2SO4 = Al2(SO4)3 + 3H2↑
Fe + 2HCl = FeCl2 + H2↑
Стоящие правее знака водорода металлы с кислотами-неокислителями не взаимодействуют при нормальных условиях.
Шкала активности металлов широко используется для практических целей, например, в гальванике. Если электроды сделаны из разных металлов, то разрушаться будет тот, который стоит левее. Чем больше промежуток между металлами в ряду, тем активнее проходит процесс коррозии.
Например, метод оцинковки позволяет защитить железо именно потому, что цинк находится левее железа в ряду активности. Пока он не разрушится, то ржавчина на железе не появится. При электролизе, расположенные за водородом металлы осаживаются на катоде, а самые активные, занимающее места до алюминия, выделить из солевых растворов в не получится при нормальных температуре и давлении.
Малоактивные металлы, так называемые переходные элементы с электроотрицательностью в пределах 1,5 – 2. Это:
- Ртуть;
- Олово;
- Серебро;
- Никель;
- Рений;
- Медь;
- Марганец и еще несколько элементов.
К металлам средней активности относятся элементы с числом электроотрицательности от 1 до 1,5. В эту группу входят такие известные элементы, как магний, плутоний, неодим, кальций. Остальные элементы обладают высокой химической активностью. Лидирует в этом списке Франций, который практически не встречается в чистом виде. Из более известных можно назвать калий и натрий, которые приходится хранить в керосине, чтобы они не взаимодействовали с водой и воздухом. Если извлечь их из керосина, то металлы практически мгновенно сгорают.
Реакции кальция и натрия с водой при комнатной температуре выглядят так:
2Na + 2H2O = 2NaOH + H2↑
Сa + 2H2O = Сa(OH)2 + H2↑Стоящие в ряду электронапряжения металлов правее элементы тоже взаимодействуют с водой, но реакция протекает при более высокой температуре с образованием оксида и водорода.
3Fe + 4H2O = Fe3O4 + 4H2↑
Если вступает в реакцию металл и неметалл, то электрический ряд напряжений металлов тоже дает возможность заранее узнать, в каком направлении будет протекать реакция. Скорость реакции зависит как от восстановительной активности металла, так и от окислительных свойств неметалла. Стоящие до водорода металлы реагируют с кислородом уже при комнатной температуре, некоторые — достаточно бурно, например, литий и кальций.
4Li + O2 = 2Li2O
2Ca + O2 = 2CaO.
При таком взаимодействии образуются оксиды. Менее активные металлы, например железо, реагируют с кислородом спокойнее, а некоторые, например, золото и серебро, платина не окисляются вовсе, благодаря чему получили определение благородных.
С хлором реагируют практически все активные металлы с выделением теплоты.
2Fe + 3Cl2 = 2FeCl3
Также выделяется теплота при реакции активных металлов с серой, но начинается она при нагревании. После начала реакции нагрев не нужен — образовавшегося тепла достаточно для поддержания реакции.
2Al + 3S = Al2S3
Внимательно изучив ряд металлов, несложно определить тип реакции при контакте с другими элементами в зависимости от места в последовательности. Также легко назвать основные характеристики металла, как химического элемента, и возможность его использования на практике.
Урок №48. Химические свойства металлов. Ряд активности (электрохимический ряд) металлов
Химические свойства металлов определяются их активностью. Простые вещества – металлы в химических реакциях всегда являются восстановителями . Положение металла в ряду активности характеризует то, насколько активно данный металл способен вступать в химические реакции (т. е. то, насколько сильно у него проявляются восстановительные свойства).
Среди металлов традиционно выделяют несколько групп.
благородные металлы (серебро, золото, платина, иридий);
щелочные металлы – I(A) группа ;
щелочноземельные металлы – II(A) группа , кроме Be, Mg.
Металлы встпают в реакции с простыми веществами – неметаллами (кислород, галогены, сера, азот, фосфор и др.) и сложными веществами (вода, кислоты, растворы солей)
Взаимодействие с простыми веществами-неметаллами
1. Металлы взаимодействуют с кислородом, образуя оксиды:
4Li + O 2 = обыч. усл . = 2Li 2 O
2Mg + O 2 = t, °C = 2MgO
Серебро, золото и платина с кислородом не реагируют
2. Металлы взаимодействуют с галогенами (фтором, хлором, бромом и йодом), образуя галогениды – Ме +n Г -1 n
2Na + Cl 2 = 2NaCl
3. Металлы взаимодействуют с серой, образуя сульфиды.
4. Активные металлы при нагревании реагируют с азотом, фосфором и некоторыми другими неметаллами.
3Na + P = t, °C = Na 3 P
Взаимодействие со сложными веществами
I. Взаимодействие воды с металлами
1). Взаимодействие с самыми активными металлами, находящимися в периодической системе в I(А) и II(А) группах (щелочные и щелочноземельные металлы) и алюминий . В результате образуются основание и газ водород .
Me + H 2 O = Me(OH) n + H 2 (р. замещения)
Внимание! Алюминий и магний ведут себя также:
Магний (в горячей воде):
2) Взаимодействие воды с менее активными металлами, которые расположены в ряду активности от алюминия до водорода.
Металлы средней активности, стоящие в ряду активности до (Н 2 ) – Be, Fe, Pb, Cr, Ni, Mn, Zn – реагируют с образованием оксида металла и водорода
Me + Н 2 О = Ме х О у + Н 2 (р. замещения)
Бериллий с водой образует амфотерный оксид:
Be + H 2 O = t°C = BeO + H 2
Раскалённое железо реагирует с водяным паром, образуя смешанный оксид — железную окалину Fe 3 O 4 и водород:
3) Металлы, стоящие в ряду активности после водорода, не реагируют с водой.
Cu + H 2 O ≠ нет реакции
II. Взаимодействие растворов кислот с металлами
Металлы, стоящие в ряду активности металлов левее водорода, взаимодействуют с растворами кислот ( раствор азотной кислоты – исключение ), образуя соль и водород.
Кислота (раствор) + Me до (Н2) = Соль + H 2 ↑
III. Взаимодействие кислот-окислителей с металлами
Металлы особо реагируют с серной концентрированной и азотной кислотами:
H 2 SO 4 (конц.) + Me = Сульфат + H 2 O + Х
HNO 3 + Me = Нитрат + H 2 O + Х
4Zn + 10HNO 3 (раствор горячий) = t˚C = 4Zn(NO 3 ) 2 + N 2 O + 5H 2 O
4Zn + 10HNO 3 (оч. разб. горячий) = t˚C = 4Zn(NO 3 ) 2 + NH 4 NO 3 + 3H 2 O
IV. С растворами солей менее активных металлов
Ме + Соль = Новый металл + Новая соль
Активность металла в реакциях с кислотами, водными растворами солей и др. можно определить, используя электрохимический ряд, предложенный в 1865 г русским учёным Н. Н. Бекетовым: от калия к золоту восстановительная способность (способность отдавать электроны) уменьшается, все металлы, стоящие в ряду левее водорода, могут вытеснять его из растворов кислот; медь, серебро, ртуть, платина, золото, расположенные правее, не вытесняют водород.
Руководство по материалам электротехники для всех. Часть 12. Финальная

Последняя часть руководства. Внутри бонусные главы, немного новых фотографий, и главное — pdf с руководством которое можно скачать и поделиться с другом.
Доработки (доступны в pdf версии):
— Добавлены фото деструкции оптического поликарбоната, добавлены фото кварцевого стекла, фото проводящих углеродных композиций в конструкции ПДУ.
— Доработан раздел с изолентами, пришлось подождать посылок, но оно того стоило — теперь это самое полное описание изоляционных лент (добавлена полиэфирная, мастичная, тканевая и другие виды лент).
— Добавлена глава про электрические соединения — с ответом на вопрос почему нельзя.
— Ну и много мелких правок согласно комментариям.
Название я сменил, просто из соображений «легко запомнить-легко гуглить».
Электрические соединения
Популярная шутка говорит о том, что электротехника — это наука о контактах. И две основные неисправности — нет контакта там где он должен быть, и есть контакт там где его быть не должно.
На обложке этого руководства изображена скрутка двух проводов — медного и алюминиевого. Некоторых читателей такое зрелище возмутило, и не без оснований — так делать нельзя. Если попытаться разобраться в причинах этого «нельзя», то можно найти множество дискуссий на эту тему, практически в каждой из которых можно найти довод «всегда так делал, на даче такая скрутка работает уже 100500 лет». К сожалению, понимания причин запрета такой подход не привносит.
В чем же проблема соединить в контакт два произвольных металла? Дело в том, что в силу некоторых причин (о которых ниже) некоторые металлы образуют надежный контакт и работают практически безотказно, а некоторые образуют контакт, который тоже работает, но менее надежен и чаще приносит проблемы. Нужно понимать, что «чаще» не означает, что если вы сделали такое соединение, то оно откажет завтра с вероятностью 100%. Нет, вероятность отказа станет не 0,0001%, а к примеру 0,01%. Все такая же малая, но вас бы не устроила в 100 раз большая вероятность пожара?
Опыт эксплуатации различной техники привел инженеров к выводу, что определенные комбинации металлов обеспечивают приемлемую надежность контакта, а некоторые слишком низкую. Еще раз стоит отметить, что на надежность контакта сильно влияют условия эксплуатации, если соединение находится при постоянной температуре в сухом месте, то оно может быть вполне надежным, даже если пара металлов нежелательная.
Ряд электрохимической активности металлов
Первая причина нарушения контакта которую мы рассмотрим — электрохимическая коррозия. Некоторые из вас помнят со школы ряд активности металлов (неполный):
Li K Ba Sr Ca Na Mg Al Mn Cr Zn Fe Cd Co Ni Sn Pb H Sb Bi Cu Hg Ag Pd Pt Au
| Металл | Электрохимический потенциал, Вольт |
|---|---|
| Литий (Li) | -3,0401 |
| Калий (K) | -2,931 |
| Барий (Ba) | -2,905 |
| Стронций (Sr) | -2,899 |
| Кальций (Ca) | -2,868 |
| Натрий (Na) | -2,71 |
| Магний (Mg) | -2,372 |
| Алюминий (Al) | -1,700 |
| Марганец (Mn) | -1,185 |
| Хром (Cr) | -0,852 |
| Цинк (Zn) | -0,763 |
| Железо (Fe) | -0,441 |
| Кадмий (Cd) | -0,404 |
| Кобальт (Co) | -0,28 |
| Никель (Ni) | -0,234 |
| Олово (Sn) | -0,141 |
| Свинец (Pb) | -0,126 |
| Водород (H) | 0 |
| Сурьма (Sb) | +0,240 |
| Висмут (Bi) | +0,317 |
| Медь (Cu) | +0,338 |
| Ртуть (Hg) | +0,7973 |
| Серебро (Ag) | +0,799 |
| Палладий (Pd) | +0,98 |
| Платина (Pt) | +0,963 |
| Золото (Au) | +1,691 |
Для инженера этот ряд говорит следующее: В присутствии электролита (вода, влажность воздуха) в паре металлов будет разрушаться тот металл, что в ряду напряженности левее. Чем дальше друг от друга металлы в ряду, тем интенсивнее будет протекать коррозия. На базе
этого явления построена электрохимическая защита металлов, например оцинковка стали. При наличии воды, первым делом разрушается цинковое покрытие, и только после того как оно разрушилось начинается коррозия стали.
В случае электрических контактов, нам важнее не то, какой металл разрушится в паре, они нужны оба, а то, насколько интенсивно будет протекать процесс коррозии. И в этом плане потенциал создаваемый парой алюминий-медь 2,038 В очень большой, его достаточно чтобы разорвать молекулу воды в процессе электролиза! Но если разделить эти два металла стальной оцинкованной пластинкой, то образуется две пары: цинк-алюминий с потенциалом 0,937 В, и цинк-медь, с потенциалом 1,101 В. Это уже не такие большие потенциалы, поэтому процесс коррозии будет протекать медленнее.
Принимая во внимание, что основными металлами для изготовления проводников являются медь и алюминий, то заучивать таблицу и считать потенциалы не требуется, важно только помнить, что непосредственно соединять медь и алюминий в электрический контакт работающий на воздухе нельзя.
Тепловое расширение
Все тела при нагревании расширяются, и металлы не исключение. Для любого материала есть характеристика, такая как «коэффициент теплового расширения тел», который показывает, во сколько раз увеличится размер тела, при нагреве на 1 градус Цельсия. (В различных диапазонах температур значение теплового коэффициента расширения может различаться, кроме того для некоторых анизотропных материалов коэффициент может различаться в разных плоскостях. Для упрощения не будем учитывать эту разницу, воспользовавшись усредненными значениями) Вот небольшая табличка:
| Материал | Тепловой коэффициент расширения α, (1/К) |
|---|---|
| Алюминий | |
| Медь | |
| Сталь | |
| Стекло | |
| Стекло термостойкое (боросиликатное) | |
| Стекло кварцевое | |
| Инвар (сплав) | |
| Платина |
Из этой таблички видно, что соединение из двух материалов при нагревании будет расширяться по разному, провоцируя внутренние напряжения и деформации. Иногда это полезное свойство — оно используется в биметаллических пластинках в терморегуляторах, такие пластинки при нагреве изгибаются и разрывают контакт. Но в деле создания надежного электрического соединения такая разница в величине теплового расширения может ослабить контакт. Если соединение не обладает упругими свойствами, то спустя нескольких циклов нагрева и охлаждения, можно обнаружить что вместо плотного тугого контакта проводник болтается.
Если соединения разных материалов не избежать, то нужно помнить, что такое соединение потенциально может ослабнуть при изменениях температуры, и должно быть обслуживаемым и контролируемым. Замуровать соединение медного и алюминиевого проводника в стенке под слоем штукатурки — плохая идея.
Ползучесть
Некоторые материалы склонны проявлять явление «ползучести», когда к примеру проводник под небольшой механической нагрузкой, не достаточной для пластической деформации, тем не менее деформируется со временем. Величина этого явления зависит от нагрузки и от температуры, характеризуясь очень малой величиной. Пройдут тысячи часов, прежде чем размер тела изменится на доли процента. Тем не менее это явление достаточно важно в обеспечении надежного контакта. Ползучесть, наряду с тепловым расширением вносит вклад в то, что затянутая клемма спустя годы ослабевает и провод в ней болтается.
К сожалению алюминий (чистый) обладает значительно более интенсивной ползучестью, чем медь, что делает электрические контакты с его участием менее надежными и требующими регулярного обслуживания. Это стоит помнить при ремонте и обслуживании проводки из алюминиевого кабеля времен СССР. Производители современных алюминиевых кабелей легируют алюминий в токопроводящей жиле, добиваясь уменьшения ползучести до значений, сопоставимых с медью, пускай и ценой небольшого снижения электропроводности.
Так как же все-таки соединять провода?
Вопрос сложный тем, что ответ зависит от условий работы соединения и однозначно универсального способа нет.
Но про пару алюминий-медь было сказано столько плохого, что я просто обязан дать ответ на вопрос «как их соединять?».
Первый вариант — классический, при помощи стальной пластинки исключая непосредственный контакт меди и алюминия. Стальная пластинка предотвратит интенсивную электрохимическую коррозию (но не избавит от нее совсем), обеспечит приемлемое усилие на площади контакта проводников. Но такое соединение требует регламентных работ по обслуживанию: 1–2 раза в год необходимо проверять усилие затяжки проводников.
Второй вариант. Специализированные пружинные клеммы для алюминиевого проводника. (например клеммники WAGO серии 2273 с пастой). В такой клемме зачищенный проводник всё время прижимается пружинным контактом, предотвращая его ослабление вследствие ползучести.
Паста внутри клеммника предотвращает доступ влаги и воздуха к поверхности алюминия, препятствуя окислению проводника. (Важно отметить, клеммы должны быть качественные, а сечение проводника номинальным. Самолично наблюдал сгоревшие соединения выполненные клеммами, купленными в ближайшем киоске (вероятно поддельными).)
Третий вариант — Медно-алюминиевые гильзы. Этот вид соединения актуален для силовых линий на большие токи с сечением от 10 кв. мм. Медно-алюминиевые гильзы предназначены под опрессовку специальным инструментом. Соединенные в толще металлы обеспечивают надежный контакт большой площади, влага и электрохимическая коррозия могут лишь повредить нежную поверхность гильзы, не нарушив контакт в толще.
И помните, любое силовое электрическое соединение (тем более из разных металлов) должно быть доступно для обслуживания! Замурованная в стену скрутка — залог того, что вас будет вспоминать ремонтная бригада в различных матерных выражениях.
Заключение
Так как установка при написании данного пособия была на минимум брехни, я писал о том, что сам пощупал, использовал, с чем работал. Некоторые темы я не раскрыл, в силу малого опыта (или малого количества собранного материала) в этих областях, но их стоило бы раскрыть. Переписывать бездумно то, что описано в специализированной литературе я не стал, зачем искажать источник? Поэтому, если вы можете что-то рассказать по теме — я буду рад включить ваш текст в руководство.
Данное руководство распространяется свободно, вы можете скачать самую последнюю вер-
сию у меня в блоге совершенно бесплатно. Если вам понравилась моя работа, я буду рад услышать от вас пожелания и предложения, а также замечания и указания на допущенные ошибки.
Где скачать?
→ Руководство на GitHub вместе с исходником текста и фотографиями. Там же pdf с книгой.
→ Домашняя страничка руководства на моем сайте.
Если вы захотите бумажный экземпляр к себе на полку, то его можно приобрести (технология печати по требованию). Это не реклама — я выставил руководство по себестоимости — не заработаю ни копейки. К сожалению в бумажном виде иллюстрации будут черно-белые.
Благодарности
Выражаю признательность Алексею Gall Галахову за ценные дополнения руководства и помощь в верстке руководства.
Talion_amur за предоставленный образец ртутного счетчика времени наработки.
Спасибо всем кто написал комментарии, они дали ценную обратную связь.
Пользуясь случаем хочу передать привет Meklon DIHALT Milfgard lozga superhimik tnenergy BarsMonster — я с удовольствием читаю ваши посты и старался держать планку не ниже.
Ссылки на части руководства:
1: Проводники: Серебро, Медь, Алюминий.
2: Проводники: Железо, Золото, Никель, Вольфрам, Ртуть.
3: Проводники: Углерод, нихромы, термостабильные сплавы, припои, прозрачные проводники.
4: Неорганические диэлектрики: Фарфор, стекло, слюда, керамики, асбест, элегаз и вода.
5: Органические полусинтетические диэлектрики: Бумага, щелк, парафин, масло и дерево.
6: Синтетические диэлектрики на базе фенолформальдегидных смол: карболит (бакелит), гетинакс, текстолит.
7: Диэлектрики: Стеклотекстолит (FR-4), лакоткань, резина и эбонит.
8: Пластики: полиэтилен, полипропилен и полистирол.
9: Пластики: политетрафторэтилен, поливинилхлорид, полиэтилентерефталат и силиконы.
10: Пластики: полиамиды, полиимиды, полиметилметакрилат и поликарбонат. История использования пластиков.
11: Изоляционные ленты и трубки.
Так получилось, что у меня параллельно собирается материалы по нескольким темам, какая тема интереснее?
Читайте также:
