Электролитическое получение металлических порошков
Обновлено: 18.04.2024
В зависимости от условий электролиза на катоде получают твердые хрупкие осадки (в виде плотных слоев, чешуек, кристаллов), губчатые мягкие осадки и рыхлые (черные) осадки.
Плотные осадки представляют собой слоистые сростки крупных, хорошо сцепленных кристаллов. Для получения подобных осадков электролиз ведут при незначительных концентрациях водородных ионов, повышенных содержаниях ионов выделяемого металла и низких плотностях тока. Для придания такому осадку хрупкости используют смазку катода различными веществами или введение в раствор специальных добавок. Технология получения чешуйчатых осадков состоит в том, что на катоде послойно (попеременно) осаждаются разнородные металлы, один из которых является подслоем, подлежащим дальнейшему растворению. После растворения подслоя, извлеченного из ванны катодного осадка, второй металл (основной, не растворившийся) образует частицы в виде отдельных чешуек.
Губчатые мягкие осадки представляют собой скопления отдельных мелких кристалликов, легко поддающихся разрушению при растирании. Получению подобных осадков способствуют сравнительно низкие плотности тока, повышение кислотности раствора, уменьшение концентрации в электролите катионов выделяемого металла, наличие примесей ионов более электроположительных металлов и присутствие некоторых окислителей.
Плотные и губчатые осадки подвергают дополнительному измельчению для разделения частиц или уменьшения их размеров.
Рыхлые осадки являются высокодисперсными порошками, получающимися в готовом виде непосредственно в процессе электролиза. Их образованию способствуют высокие плотности тока, низкие концентрации в электролите катионов выделяемого металла, повышенная кислотность электролита и наличие некоторых примесей в нем или осаждаемого металла в составе комплексного аниона.
Производство металлических порошков методом электролиза водных растворов с успехом конкурирует с другими известными методами. В настоящее время в промышленных масштабах получают порошки меди, серебра, железа, хрома, цинка, никеля, кадмия, свинца, олова, сурьмы, а также их сплавов.
Характер образующихся катодных осадков зависит как от индивидуальных особенностей металлов, так и от состава электролита и условий электролиза. Некоторые металлы (Ni, Zn или Co) образуют равномерные плотные мелкозернистые осадки независимо от природы электролита. Другие (серебро или кадмий) – растут в виде отдельных сильно разветвляющихся кристаллов при электролизе растворов простых солей или выделяются в виде совершенно ровного гладкого слоя из растворов комплексных цианистых солей этих металлов.
Размер частиц и гранулометрический состав порошков определяются (при прочих равных условиях) плотностью тока. Однако наряду с этим на характер образующихся осадков влияет состав электролита.
Электролитический способ получения медного порошка известен с 1865 г. В настоящее время в России этот метод обеспечивает производство медного порошка высокой чистоты, требуемой зернистости, с хорошими технологическими свойствами. Существенными недостатками метода являются сравнительно высокая стоимость получаемых порошков, а также большой расход электроэнергии (при невысокой производительности).
Производства медного порошка (рис. 10) электролизом проводят с использованием кислого раствора сернокислой меди. Анодами (плиты размером 880x980x10 мм) служит чистая катодная медь. Плавленую черновую медь не применяют, так как она загрязнена примесями мышьяка, сурьмы и свинца, которые переходят в получаемый медный порошок. При производстве порошков применяют литые аноды, изготовленные из катодной меди (катоды, получаемые при электрорафинировании черновой меди), либо аноды, изготовленные из медного проката. Электролит представляет собой сернокислый раствор сульфата меди CuSО4. Вещества, составляющие электролит, диссоциируют с образованием катионов меди и водорода, а также анионов. Выделение порошка проводят на медных катодах пластинчатого или стержневого типа. В некоторых случаях применяют катоды, изготовленные не из меди, а из алюминия, титана или свинцово-сурьмянистого сплава. Катодная плотность тока лежит в пределах от 1800 до 3250 А/м 2 при напряжении на ванне от 1,3 до 1,7 В. Анодов в ванне всегда на один больше, чем катодов (для того чтобы любая из поверхностей катодов являлась рабочей).
Для устранения пассивации анодов в электролите поддерживают концентрацию хлор-иона на уровне 0,5–4,0 мг/л. Большее количество хлорионов вредно, так как возможно образование полухлористой меди, образующей коллоидный осадок, который нарушает нормальный ход электролиза. Хлор-ионы в электролит поступают с водой, к которой добавляют поваренную соль NaCl или соляную кислоту НСl.

Рис. 10. Типовая аппаратурно-технологическая схема получения медного порошка: 1 – плавильная печь; 2 – узел корректировки состава электролита; 3 – электролизная ванна; 4 – узел промывки, стабилизации и обезвоживания порошка; 5 – установка подготовки стабилизирующего раствора; 6, 9, 12 – бункеры-накопители порошка; 7 – сушка порошка; 8 – элеватор; 10 – измельчение порошка; 11 – классификатор порошка; 13 – смеситель (усреднитель) порошка; 14 – упаковка порошка; 15, 16 – ловушки (фильтры); 17 – узел регенерации электролита
На практике применяют электролизные ванны ящичного или бункерного типа (рис. 11) с каркасом их дерева, металла или железобетона. Рабочая поверхность ванны футеруется кислотостойким материалом (винипластом, пластмассой, сурьмянистым свинцом и пр.). Но даже при нормальном (без побочных эффектов) течении процесса прикатодное пространство обедняется по катионам меди и обогащается ионами, а прианодное пространство и электролит – ионами меди.
Ванны включаются в электрическую цепь сериями (15–25 ванн), последовательно, а электроды в них – параллельно. Это позволяет поддерживать на каждой из ванн серии одинаковую силу тока и одинаковое напряжение между электродами. Максимальное время наращивания порошка на стержневых катодах составляет около 7–8 ч. Время наращивания порошка на пластинчатых катодах – 1–2 ч. Порошок снимают с катода специальными скребками из нержавеющих сталей, пластмасс, полимеризированных смол.
В процессе электролиза происходит существенное изменение состава электролита. Он обогащается медью за счет некоторого (до 2,0–2,5 %) растворения катодного осадка и неполного (выход по току составляет 80–90 %) выделения меди из электролита. Неполное выделение меди из раствора связано с разрядкой на катоде ионов водорода. Эти явления приводят к повышению содержание меди в электролите на 20–30 %/сут (против исходного состава раствора). Кроме того, электролит обедняется по серной кислоте, затрачиваемой на растворение катодной меди и выделение водорода на катоде.
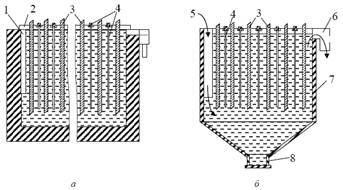
Рис. 11. Разрез ванны электролизера ящичного (а) и бункерного (б) типов: 1 – карман для приема электролита; 2 – промежуточная шина; 3 – анод; 4 – катод; 5 – карман для подачи электролита; 6 – лоток для выпуска электролита; 7 – корпус электролизера; 8 – устройство для выгрузки порошка
Выравнивание концентрации ионов по объему электролизной ванны и удаление «избытка» ионов меди осуществляют с помощью системы непрерывной замкнутой циркуляции и регенерации раствора.
Часть электролита из ванны через лоток выпуска непрерывно сливается в сборник, из которого он поступает в теплообменник и систему регенерационных ванн. В теплообменнике электролит проходит по трубкам из кислотостойкой нержавеющей стали, омываемым холодной водой, и охлаждается до необходимой температуры (48–55 °С). Одновременно с циркуляцией осуществляют регенерацию электролита, так как в электролите происходит постепенное накапливание примесей (As, Sb, Fe и др.), попадающих в него по мере растворения анода. Для обеспечения постоянства заданного состава проводят корректировку электролита, включая в систему сблокированных ванн специальные регенеративные ванны с нерастворимыми анодами свинцовыми или из платинированного титана. В регенерационных ваннах выделение меди на катоде уменьшает концентрацию ее катионов в электролите, а на аноде образуется кислород и происходит регенерация серной кислоты. По мере накапливания примесей часть электролита выводят из системы циркуляции, а вместо него вводят свежеприготовленные порции электролита.
Медный порошок, снятый с катодов, выгружают из ванны периодически без ее отключения при помощи гидровакуумной системы. Для удаления механически захваченного электролита порошок промывают горячей водой на фильтрах или в аналогичных им по конструкции специальных промывателях, в которых вода фильтруется через слой порошка, находящийся на перфорированной (сетчатой) решетке из нержавеющей стали. Для качественной промывки порция порошка должна иметь одинаковую фильтрующую способность по всей высоте и поверхности слоя. Полнота отмывки определяется реакцией на наличие катионов меди в воде после промывки (отсутствие окрашивания раствора желтой кровяной соли или 5 %-го аммиака). Пленка воды на частицах порошка приводит к их коррозии (окислению). Поэтому после отмывки порошка водой применяют его стабилизацию – промывку раствором хозяйственного мыла или мылонафта. После стабилизации на поверхности частиц остается гидрофобная пленка, защищающая медь от коррозии (коррозионная стойкость порошка повышается в несколько десятков раз). Избыток стабилизатора удаляют промывкой порошка холодной водой. После промывки порошок обезвоживают и сушат. Если это требуется, то высушенный порошок измельчают в мельницах непрерывного действия, работающих в замкнутом цикле с устройством для рассева порошка на фракции.
Технология производства электролитических порошков из водных растворов
Мы ограничимся изложением технологии изготовления методом электролиза нескольких металлов (железа, меди, никеля, серебра, хрома и марганца), поскольку получение других видов порошков осуществляется пока в основном в лабораторных масштабах и подробно изложено в работе О. Кудры и Е. Гитмана.
Железо. Порошок железа может быть получен электролизом сульфатных и хлористых солей. Железо — электроотрицательный металл, поэтому из кислых растворов на катоде совместно с ним выделяется водород. Осаждение железа в виде порошка или рыхлого осадка в таких условиях нерационально, так как процесс сопровождается низким выходом по току.
Обычно принятым методом является получение не рыхлого, а хрупкого осадка, который подвергается в дальнейшем размолу.
В России промышленное получение электролитического железного порошка было разработано Б.А. Бороком.
Состав сернокислых ванн следующий: 120—140 г/л FeSCV, 40—50 г/л NaCl; 0,20—0,28 г/л H2SO4.
Плотность тока 400—500 а/м2, напряжение на ванне 1,5—1,7 в, температура электролита 48—54°.
Электролиз проводится в бетонных ваннах, футерованных винипластом и соединенных последовательно в серии. Число ванн в серии определяется напряжением в сети постоянного тока. Циркуляция электролита в ваннах принудительная, параллельная во всех ваннах. Электролит поступает из общего напорного бака, в котором поддерживается его постоянный состав и температура.
Аноды изготавливаются из листовой обрези (малоуглеродистая сталь), катоды — из листовой нержавеющей стали 1Х18Н9Т. Цикл осаждения продолжается двое суток с периодическими (через 6 час.) перерывами в подаче тока на 15—20 мин. Осадок получается слоистый, характерной столбачтой структуры; он легко измельчается в порошок. Для снятия осадка катоды извлекаются из ванны и промываются в холодной проточной воде. Затем осадок, представляющий пластины толщиной 1,5—2 мм, снимается с катодов и поступает на предварительный размол в молотковой дробилке непрерывного действия. Более тонкое измельчение происходит в шаровых мельницах. Для тщательной отмывки катодного осадка размол обычно проводится в воде, что способствует также и более качественному измельчению.
Сушка порошка, содержащего после мокрого размола 15— 20% влаги, проводится в камерных или барабанных сушилках. Получаемый, так называемый черный, порошок содержит значительное количество окислов (92—95% Fe), углерода (до 0,15% С) и водорода.
Такой порошок, частицы которого обладают твердостью 180—200 Нв, плохо прессуется и не может быть использован без дополнительного отжига.
Последний проводится при температуре около 700° в течение 1—3 час. в восстановительной атмосфере (водород, генераторный газ и др.). Во время отжига восстанавливаются окислы, снимаются остаточные напряжения, удаляется водород.
После отжига следует рассев на фракции. Готовый порошок содержит не менее 98% общего железа (обычно 98,5—99% Fe) и не более: 0,06% Si; 0,05% С; 0,05% Mn; 0,1% S; 0,005% Р. Гранулометрический состав порошка: + 0,16 мм 10%, — 0,1 + 0,08 мм 30% и -0,08 мм — остальное.
Насыпной вес электролитического порошка железа составляет 2—3 г/см3.
В качестве электролита для сернокислых ванн используется также 10%-ный раствор солей FeSO4 и (NH4)2SO4 и другие составы.
Однако хлористые ванны для осаждения железных порошков в последнее время получают все большее распространение. По сравнению с сернокислыми хлористые электролиты обладают большей проводимостью, что исключает пассивацию анодов, и меньшей склонностью к образованию гидроокисей. Загрязнения, попадаемые в порошок из хлористых ванн, удаляются гораздо легче и не содержат серы — нежелательной примеси в порошке железа. Детальные исследования осаждения железного порошка при электролизе хлористых ванн были выполнены М.Ю. Бальшиным.
Был установлен оптимальный состав электролита (30г/л FeCl2, 100 г/л NH4Cl), выяснены закономерности влияния кислотности и температуры электролита и другие вопросы.
Получение электролитического порошка путем электролиза хлористых ванн осуществлено в полупромышленном и в промышленном масштабах.
По данным Лунгберга, на одном из заводов Швеции получение железного порошка осуществляется электролизом солей FeCl2+NH4Cl при плотности тока 3000—6000 a/м2, длительность процесса составляет 2—3 дня.
Разработанная технология позволяет получать порошки с широким диапазоном значений насыпного веса: от 2 г/см3 до — 4 г/см3. Этот порошок обладает хорошей прессуемостью и спекаемостью. Помимо изложенных методов получения электролитического железа из сернокислых и хлористых растворов, в литературе сообщается и о других возможных методах электроосаждения железа: электролиз щелочных растворов, электролиз расплавленных сред и осаждение железа из отработанных травителей на ртутном катоде.
В последнем случае железо, выделяясь на катоде, растворяется в небольшом количестве в ртути, основная же его масса образует суспензию частиц железа в ртути. Последующий отжиг при температуре 400° в вакууме или в слабом потоке водорода приводит к отгонке ртути. Таким методом можно получать очень тонкие порошки высокой чистоты.
Медь. Первые патенты, относящиеся к получению электролитического медного порошка, появились, по данным, около ста лет назад. Среди промышленных методов получения порошка меди электролиз занимает одно из ведущих мест. Вопросам разработки технологии изготовления порошка меди посвящено много работ, обзор которых дан в монографии.
Медный порошок получают из сернокислых ванн. Опишем технологию производства электролитического порошка меди, разработанную Б.А. Бороком, М.Ю. Бальшиным и И.А. Гавриловым. Электролиз ведется в сернокислой ванне, содержащей 100 г/л CuSO4 и 114 г/л H2SO4; плотность тока составляет 1200—1500 а/м2, напряжение на ванне — 1,5—1,8 в.
Температура электролита 60—65°. Аноды изготовляются из литой рафинированной меди. Расход электроэнергии равен 6800—7500 квт*ч на 1 т готового порошка.
Медь осаждается на катоде в виде порошка, который периодически удаляется щетками через каждые 15—20 мин. После электролиза порошок отфильтровывается от электролита, промывается последовательно разбавленной серной кислотой и водой и сушится в вакуумных сушилках при температуре 50°. Цвет сухого порошка светло-розовый, при окислении порошок заметно темнеет.
Электролитический порошок меди содержит не менее 99,5% Cu (обычно 99,7%) и не более: 0,02% Fe; 0,05% Pb; 0,005% Ag; 0,0011% Sb, 0,01% сернокислых соединений в пересчете на SO4; 0,05% влаги (ГОСТ 4960-49).
Гранулометрический состав, форма порошков и соответственно насыпной вес могут в зависимости от режимов электролиза колебаться в широких пределах. Так, насыпной вес может быть получен в пределах 0,4—4 г/см3, но обычно эта величина составляет 1,5 г/см3. Большинство частиц электролитического медного порошка проходит через сито с размерами ячеек 0,04 мм (для МП-1 фракция — 0,04 мм составляет 65—70%, для МП-2—85— 90%).
По данным, производительность одного из заводов, получающих медный электролитический порошок, составляет 450 т в месяц. В качестве катодов используются пластины из сплава Pb+6% Sb. В каждой ванне находится 18 катодов и 19 медных анодов; напряжение на ванне 1,5—1,8 в. После электролиза порошок отжигается при температуре 480—780° в атмосфере частично сожженного природного газа. Спекшаяся губка измельчается в молотковой мельнице. Готовый порошок имеет насыпной вес примерно 3,5 г/см3.
Для повышения коррозионной стойкости медного электролитического порошка А.И. Левин и А.В. Помосов предложили обрабатывать его раствором жидкого калиевого мыла. Такая обработка (гидрофобизация), приводя к созданию на поверхности частиц полимолекулярных стабилизирующих пленок, способствует, кроме увеличения коррозионной стойкости, сохранению постоянного гранулометрического состава и насыпного веса при транспортировке порошка. Вместо сравнительно дорогого продукта — мыла — можно также использовать отходы очистки нефтепродуктов — смесь натриевых солей нафтеновых кислот (мылонафт).
Порошок меди применяется в производстве меднографитовых электрощеток, антифрикционных, конструкционных, фрикционных, контактных и других металлокерамических материалов.
Никель. Порошок никеля обычно получают электролизом раствора сернокислой никелевой соли. Примерный состав ванны (в г/л): Ni от 15 до 25 (в виде NiSО4*7H2О), NH4Cl-40, NaCl от 50 до 80; условия электролиза: pH от 6,5 до 7,2; температура 20—30°; плотность тока 1000—5000 а/м2: напряжение на ванне — 7—12 в. Выделение порошкообразного никеля происходит только при применении повышенных плотностей тока. Рекомендуется применять нерастворимые аноды (графит) и охлаждаемые катоды. Для получения мелкодисперсного порошка (средний размер частиц 10—30 мк) необходимо через 1—2 час. удалять порошок с катодов. Промывка вынутого из ванны порошка не требует особых мер предосторожности от окисления. Порошок промывается и сушится в закрытом сосуде (выделение сорбированного водорода обеспечивает восстановительную атмосферу при сушке).
Электролизом сернокислых солей получают также порошок кобальта.
Никелевые и кобальтовые порошки используются в производстве магнитных изделий, твердых и жаропрочных сплавов.
Серебро. Порошок серебра широко используется при получении контактных материалов типа Ag—W, Ag—Cu, Ag—Ni, Ag—WC.
Наиболее простым методом получения порошка серебра является электролиз растворов азотнокислого серебра. В качестве анодов и катодов служат слитки серебра. Электролит содержит 40 г/л AgNO3 и 12,5 г/л HNO3. Плотность тока не ниже 1400 а/м2, температура электролита не выше 35°, расстояние между электродами около 40 мм. В этих условиях серебро осаждается на катоде в виде дисперсного рыхлого осадка, который затем промывается водой и сушится при температуре 100—120° в течение 18—20 час. Получаемый порошок почти полностью проходит через сито с размером ячейки 0,05 мм.
Хром и марганец. Порошки хрома и марганца используются в производстве различных сплавов: конструкционных, магнитных, жаропрочных. Электролитический метод получения этих металлов обеспечивает высокую степень чистоты, что, учитывая повышенную хрупкость хрома и марганца, очень существенно. В случае марганца электролитический метод экономичнее металлотермического.
Электролитическое осаждение хрома в виде чешуек или твердых осадков проводится из раствора, содержащего сернокислый хром и сернокислый аммоний в пропорции, соответствующей квасцам (NH4)2SO4*Cr2(SO4)3*24Н2О. Плотность тока 860 а/м2, напряжение на ванне 4,8 в, pH 2,45—2,65, расход энергии 12500 квт-ч/т, продолжительность осаждения 72—80 час.
Электролит для получения хрома готовят растворением обогащенных хромитовых руд, при этом принимаются меры для отделения примесей (Fe, Al, Mg, Mn и др.), содержащихся в рудах. Для дальнейшей очистки от примесей, в большой степени влияющих на пластичность, электролитический хром подвергают рафинирующей обработке. Порошок хрома получают измельчением электролитического хрома в шаровых мельницах.
Технологический процесс получения электролитического марганца состоит в восстановительном обжиге руды для перевода марганца в MnO, затем следует выщелачивание обожженой руды и очистка щелочного раствора путем обработки сероводородным газом. В результате для электролиза используется раствор сульфата аммония, в котором содержится ион марганца; остальные примеси составляют тысячные доли процента. Необходимость малого содержания примесей в электролите обусловлена сравнительно высоким электроотрицательным потенциалом марганца. Почти все металлы могут осаждаться из водных растворов раньше его.
В качестве анодов при электролизе используются специальные сплавы свинца, катоды изготавливаются из хромоникельмолибденовой стали.
Электролиз проводится при pH раствора 8,1—8,4, температуре 34—37°, плотности тока 450 а/м2. Чистота электролитического марганца порядка 99,3%. Порошок марганца получают размолом электролитических осадков в шаровой мельнице в защитной атмосфере. Необходимость в последней обусловлена пирофорностью порошка марганца.
Общая характеристика электролиза как метода получения металлических порошков
Среди физико-химических методов получения металлических порошков электролитический способ по промышленному распространению занимает второе место после восстановления.
Методом электролиза можно получать порошки почти всех металлов. Иногда, например в случае получения порошка тантала, этот метод является наиболее приемлемым.
Электролиз позволяет также получать легированные порошки, например порошки сплавов Fe—Ni, Fe—Mo, Ni—Mo, Fe—Cr, Fe—Mn, Fe—Ni—Mo.
Важнейшим преимуществом электролитического метода получения порошков является высокая чистота продукта в результате очистки от примесей во время электролиза. Это обстоятельство в ряде случаев играет решающую роль в выборе метода изготовления порошка.
Основным недостатком электролитического метода является высокая стоимость порошков из-за низкой производительности и больших затрат энергии.
Высокая стоимость электролитических порошков обусловливает применение их в промышленности только для изготовления особо ответственных изделий и в случае отсутствия других эффективных методов получения порошков. Поэтому относительная доля порошков, получаемых электролизом, сравнительно невелика в общей массе производимых порошков. Так, количество железных порошков, изготовляемых электролизом, составляет только примерно 10%.
Однако, имея в виду расширение выработки электроэнергии в связи с широким строительством тепло- и гидроэлектростанций, простоту технологических процессов, возможность использования в качестве сырья полупродуктов и отходов, высокую чистоту электролитических порошков, легкость варьирования технологией получения и некоторые другие преимущества, можно надеяться на дальнейшее расширение производства металлических порошков методом электролиза.
В основе процесса получения электролитических порошков лежит разложение водных растворов металлических соединений, а также расплавленных солей при пропускании постоянного электрического тока. Сущность электроосаждения металлов состоит в разряде металлических ионов на катоде Меn+ + ne (рис. 12).

Источниками металлических ионов в общем случае являются анод, состоящий из металла, подвергаемого электролизу, и электролит, содержащий соль этого металла. Однако в некоторых случаях используются нерастворимые аноды, и тогда металлические ионы поставляются только электролитом.
Перемещение металлических ионов к катоду осуществляется за счет диффузии, конвекции и миграции. Протекание этих трех процессов и зависит от многих факторов: температуры, электролита, вязкости раствора, размера ионов (диффузия); перемешивания электролита и его температуры (конвекция); величины электрического поля (миграция). Перечисленные факторы и такие, как концентрация электролита, расстояние между электродами, наличие в растворе коллоидных добавок, протекание вторичных реакций, природа осаждаемого металла, форма катода и некоторые другие обстоятельства, определяют структуру и свойства катодных осадков. Подробно характер влияния этих многочисленных факторов на протекание электроосаждения металлов описан в монографии О. Кудры и Е. Гитман.
Различают три вида катодных осадков, пригодных для производства металлических порошков:
1) твердые хрупкие осадки в виде плотных слоев, чешуек или кристаллов, которые затем подвергаются размолу;
2) губчатые мягкие осадки — скопления отдельных мелких кристалликов, легко поддающиеся растиранию;
3) рыхлые (черные) осадки, представляющие собой высокодисперсные порошки, получающиеся в таком виде непосредственно при самом электролизе.
Получение первого вида осадков — хрупких образований — возможно при следующих условиях электролиза: увеличенной концентрации водородных ионов и низкой концентрации ионов металла в электролите, высокой плотности тока, смазке электрода, введении в раствор специальных добавок типа аммиака, глицерина и др. Получение твердых осадков сопровождается, как правило, насыщением металла водородом, что, повышая хрупкость, способствует лучшему дроблению и размолу осадков.
Губчатые мягкие осадки получаются при электроосаждении металлов при низких плотностях тока, а также в условиях повышенной кислотности раствора, пониженной концентрации электролита, наличия примесей более электроположительного металла, чем осаждаемый, и присутствия некоторых окислителен и коллоидов. К выделению губчатых мягких осадков на катоде особенно склонны такие металлы, как цинк, кадмий, олово, свинец и сурьма.
Рыхлые осадки, не нуждающиеся ни в какой дополнительной обработке для перевода в порошкообразное состояние, наиболее пригодны для изготовления металлических порошков. Такого рода осадки получаются при больших плотностях тока.
В зависимости от степени дисперсности рыхлые осадки могут быть черного, бурого, темно-серого, серого или светло-серого цветов.
Рыхлые осадки могут быть получены практически для всех электроосаждаемых на катоде металлов, причем не только осаждением в водных растворах, но и в расплавах.
На формирование дисперсных осадков, помимо высокой плотности тока, оказывают влияние и такие факторы, как добавки глюкозы, сахара, наличие комплексного аниона и др.
В результате исследований установлены следующие условия для получения осадков того или иного вида.
Предельная величина плотности тока, при которой происходит выделение только плотных осадков, определяется в большинстве случаев выражением

где i — плотность тока, а/см2; с — концентрация электролита, мол/л; k — константа, колеблющаяся для различных солей от 0,5 до 0,9.
Образование рыхлых осадков происходит при условии i больше кс; при i = (0,2/1)кс выделяется рыхлый или плотный осадок в зависимости от времени электролиза, это так называемая переходная зона. На рис. 13 показана диаграмма i—с, графически иллюстрирующая условия образования рыхлых и твердых осадков.

Для получения мелких электролитических порошков обычно прибегают к большим плотностям тока, так как при этом растет скорость выделения металла на единицу поверхности электрода и образуется большое количество центров кристаллизации. Влияние плотности тока на размер частиц порошка показано, по данным, на рис. 14. Из графика видно, что с ростом плотности тока увеличивается содержание мелких фракций. На снижение размера частиц оказывает влияние также уменьшение расстояния между электродами и периодическое или полное удаление порошка с катода.

При неполном и нечастом удалении порошка поверхность катода увеличивается, а плотность тока уменьшается. Порошок с катода снимают скребками или щетками автоматически или вручную.
Условия электролиза, помимо размера частиц, определяют и остальные характеристики порошка: форму частиц, содержание примесей и газов, наличие несовершенств в кристаллической решетке, — а последние сказываются на таких показателях, как насыпной вес, химическая активность, прессуемость и спекаемость.
Для электролитических порошков типичной формой частиц является дендритообразная. Большое влияние на форму и величину частиц, а следовательно, и на технологические характеристики порошка оказывает степень перемешивания электролита. С увеличением интенсивности перемешивания при электролитическом осаждении меди происходит рост содержания крупных фракций и переход формы частиц от дендритообразной к более сглаженной, все это способствует увеличению насыпного веса. Регулируя таким образом интенсивность перемешивания, можно обеспечить получение стандартных по свойствам порошков.
Электролитические порошки содержат некоторое количество окислов, главной причиной образования которых являются вторичные окислительные реакции. Количество окислов зависит от способности электроосаждаемого металла к окислению, поэтому, например, порошок серебра в связи с низкой способностью последнего к окислению не содержит окислов.
В последнее время большое внимание уделяется получению методом электролиза легированных порошков совместным осаждением компонентов сплава на катоде. В качестве анода используется литой сплав или применяются составные аноды из компонентов сплава; иногда осаждение идет за счет катионов электролита, а анод является нерастворимым.
Электролизом можно получать порошки таких сплавов, как

и др. Изготовление легированных электролитических порошков пока не вышло за рамки исследовательских работ.
Метод электролиза оказался эффективным и в получении субмикроскопических порошков размером 0,01—0,1 мк, которые находят применение в производстве магнитных и других материалов. Электролитическое получение коллоидных металлов, так называемых органозолей, было разработано Э.М. Натансоном с сотрудниками.
Получение порошков электролизом расплавленных сред
Несмотря на кажущуюся простоту, электролитическое выделение многокомпонентных металлических порошков в промышленных масштабах не осуществляют прежде всего из-за быстрого изменения состава электролита в процессе электролиза, что приводит к получению на катоде порошка меняющегося химического состава и дисперсности.
Перспективным является проведение электролиза с несколькими растворимыми анодами из индивидуальных компонентов, входящих в состав сплава.
Примером подобного процесса является технология получения двухкомпонентного железокобальтового порошка с использованием трех анодов: двух растворимых (железный и кобальтовый) и одного нерастворимого (свинцовый). Нерастворимый анод используется в сочетании с дополнительным электродом из железной сетки. Катод никелевый или из нержавеющей стали. Электролизер питается током от трех выпрямителей с регулируемым напряжением, что позволяет независимо регулировать токи, проходящие через аноды. Температура электролита 20–25 ° С, катодная плотность тока 1000–3000 А/м 2 . На катоде совместно разряжаются ионы железа, кобальта и водорода. Ток на свинцовом аноде должен соответствовать сумме токов на катоде и сетке. Меняя соотношение Co 2+ /Fe 2+ в растворе и соотношение анодных токов, можно получать железокобальтовые порошки любого заданного состава от чистого железа до чистого кобальта с размером частиц от нескольких до сотен микрометров.
Аналогично рассмотренному могут быть получены железоникелевые порошки любого заданного состава. В электролизере располагают два растворимых анода из малоуглеродистого железа и никеля и один нерастворимый анод из угля или графита, применяемый в сочетании с дополнительным электродом из железной или никелевой сетки.
Электролитом служит подкисленный соляной кислотой до рН 2,5 смешанный раствор сульфатов железа FeSО4 и никеля NiSО4. Температура электролита 20–30 °С. Катодная плотность тока находится в пределах от 2000 до 20000 А/м 2 . Размер частиц порошка зависит от катодной плотности тока и при ее величине в 3 000 А/м 2 не превышает 200–300 мкм.
Бронзовый порошок (92 % Сu и 8 % Sn) получают из лимонно-кислого электролита, содержащего CuCl2, SnCl2 и цитрат натрия (комплексообразователь); плотность тока 1600 А/м 2 , температура электролита 30 °С, рН 2. Можно использовать триполифосфатный электролит, содержащий сульфат меди и хлорид олова.
Большинство металлических порошков из расплавов получают с использованием хлоридов, фторидов или смеси этих соединений. В герметичных электролизерах создают инертную газовую атмосферу (чаще всего аргон) или вакуум.
Структура катодных осадков зависит от условий их осаждения. При этом большое влияние на характер выделяемого осадка оказывают состав электролита, степень его чистоты, а также материал и состояние поверхности катода. Известно, что при наличии ничтожных следов влаги осадки выделяются в виде губки, а при содержании в электролите небольших количеств примесей железа или марганца образуются осадки в виде черного порошка.
Одним из способов освобождения порошков от находящегося вместе с ними электролита является удаление последнего отгонкой нагреванием или центрифугированием, а также отмыванием.
На выход по току влияют состав и температура электролита, плотность тока, расстояние между электродами и другие факторы.
Состав электролита. Этот фактор на выход по току оказывает наиболее сильное влияние. Одной из основных причин отклонения выхода по току от 100 % является растворимость металла в электролите с последующим окислением анодными продуктами, в связи с чем желательно ее понизить. Так, добавки солей с более электроотрицательными катионами по сравнению с выделяющимся на катоде металлом значительно понижают растворимость металла в расплавленном электролите и этим повышают выход по току.
Температура электролита. Электролиз стараются вести при температурах, превышающей температуру плавления компонентов электролита, но ниже температуры плавления выделяемого на катоде металла. Образующиеся продукты реакции (соединения металлов пониженной валентности) обладают высокой упругостью паров, следовательно, с увеличением температуры электролита потери металлов возрастают и по этой причине. Кроме того, с повышением температуры возрастает циркуляция электролита в ванне, способствующая уносу металлов, растворенных в нем после их выделения на катоде, в анодное пространство. Часто для снижения температуры плавления электролита в него вводят добавки солей (обычно хлористые и фтористые соединения щелочных и щелочно-земельных металлов), у которых катионы электроотрицательнее выделяемого металла.
Плотность тока. Выход по току растет с увеличением плотности тока. Поэтому оптимальное значение плотности тока будет соответствовать наибольшему выходу по току, при котором уменьшение потерь выделяемого металла вследствие его вторичного растворения в электролите не будет сопровождаться сильным повышением разряда катионов металла с более электроотрицательным потенциалом. Однако слишком высокая плотность тока увеличивает падение напряжения в слое электролита и повышает расход электроэнергии. Кроме того, при высоких плотностях тока возможно также протекание побочных процессов – выделение на катоде наряду с основным металлом другого, более электроотрицательного металла, присутствующего в электролите.
Межэлектродное расстояние. В связи с наличием факторов, вызывающих потери металла при электролизе расплавленных солей (растворением выделенного металла, переносом его от катода к аноду и взаимодействием растворенного металла с газами, образующимися на аноде), расстояние между электродами тоже влияет на выход по току. С увеличением межэлектродного расстояния перенос растворенного металла от катода к аноду диффузией, конвекцией и циркуляцией затрудняется вследствие удлинения пути перемещения металла, уменьшения градиента концентрации растворенного металла в межэлектродном пространстве, а также из-за уменьшения скорости циркуляции электролита при большем объеме расплава, приводимого в движение одним и тем же количеством анодных газов. В результате абсолютные потери металла уменьшаются, а выход по току возрастает.
Анодный эффект. Анодным эффектом называют явление резкого возрастания напряжения на ванне с одновременным падением силы тока и появлением характерных искровых разрядов на аноде. При возникновении анодного эффекта электролит оказывается отделенным от поверхности анода прослойкой выделяющегося на нем газа, т.е. наблюдается ухудшение смачиваемости анода электролитом. Увеличение в электролите концентрации поверхностно-активных веществ, хорошо смачивающих анод и имеющих небольшое поверхностное натяжение на границе раздела электролит – анод (хлоридов щелочных металлов или растворимых оксидов), приводит к повышению критической силы тока, вызывающей анодный эффект. Это особенно важно для электролизеров, в которых анод, имеющий сравнительно небольшую рабочую поверхность, выполнен из углеграфитовых материалов.
Общие закономерности процессов производства порошков электролизом
Электролитический металлический порошок – это металлический порошок, полученный электролизом растворов или расплавов соединений металлов. Электролиз представляет собой своеобразный процесс восстановления, осуществляемый не с помощью восстановителей, а за счет использования энергии электрического тока. К преимуществам этого процесса относят универсальность, высокую чистоту получаемых металлических порошков и их хорошие технологические свойства. Недостатки электролиза – большая энергоемкость, низкая производительность, необходимость утилизации большого количества жидких отходов производства.
Электролитическое получение порошков заключается в разложении водных растворов соединений выделяемого металла или его бескислородных расплавленных солей при пропускании через них постоянного электрического тока и последующей разрядке соответствующих ионов металла на катоде. Используемые при электролизе растворы или расплавы солей называют электролитами и относят к проводникам второго рода. Сам процесс электрохимического превращения происходит на границе электрод (анод или катод) – электролит (раствор или расплав). Источник электрического тока играет роль своеобразного «насоса», перекачивающего ионы с одного полюса электроцепи на другой.
Источником ионов выделяемого металла служат, как правило, анод и/или электролит, в составе которого находится растворимое (расплавленное) соединение соответствующего металла. В случае, когда используют нерастворимые аноды, источником выделяемого металла является только электролит.
Ионы в электролите в отсутствие электрического поля движутся хаотично. При наложении электрического поля движение ионов становится более упорядоченным: положительно заряженные ионы (катионы) приближаются к катоду, а отрицательно заряженные ионы (анионы) – к аноду.
Электролиз является одновременно и рафинированием, так как при некотором напряжении на катоде будут (преимущественно) выделяться только катионы определенного металла. В соответствии с величиной напряжения, требуемого для выделения на катоде, металлы образуют «ряд напряжений». Например: цинк, железо, олово, медь, серебро, золото. Чем левее находится металл в этом ряду, тем он более электроотрицателен или менее благороден, более активен (по отношению к кислороду кислотам, щелочам и пр.) и тем большее напряжение требуется для его выделения на катоде.
В равновесных условиях (при фиксированном напряжении), пока на катоде выделяется какой-либо металл ионы более электроотрицательных по отношению к нему элементов разряжаться не будут. Однако в реальных условиях в переносе зарядов наряду с ионами выделяемого металла участвуют и ионы более электроотрицательных элементов. А это приводит к их выделению на катоде. Как правило, этот процесс сопровождается повышением напряжения на катоде («перенапряжением»).
Чем больше сродство металла к кислороду, тем труднее его выделить из водного раствора. Поэтому такие металлы, как алюминий, магний, цирконий, титан и прочие, получают путем электролиза расплавленных солей соответствующего металла.
В соответствии с законом Фарадея, количество катодного осадка, выделившегося при электролизе, пропорционально силе тока, времени его прохождения через электролит и электрохимическому эквиваленту, т.е. количеству металла, выделяемого за один ампер-час. Однако реально получаемые при электролизе количества осадка всегда меньше, чем рассчитанные. Это объясняется тем, что в процессе электролиза происходит совместный разряд на катоде ионов нескольких элементов (как правило, двух-трех), частичное растворение выделенного металла и пр.
Кроме того, возможна и утечка тока через дефекты электроизоляции. Для оценки степени несовпадения расчетных и реально полученных количеств осадка используют такой показатель, как выход по току, %: n – масса вещества (осадка), реально выделившаяся при прохождении определенного количества электричества через электролит; qm – масса вещества (осадка), которая должна была бы выделиться.
На свойства получаемых порошков оказывают влияние следующие факторы технологического процесса.
Плотность тока. Плотность тока связывает силу тока с суммарной рабочей поверхностью катодов (катодная плотность тока) или анодов (анодная плотность тока), находящихся в ванне электролизера: i = I/S, где i – плотность тока, А/м 2 ; I – сила тока на ванне, A; S – суммарная рабочая поверхность катодов или анодов соответственно, м 2 .
Как правило, катодная и анодная плотности тока в электролизере не совпадают, так как практически всегда не совпадают суммарные рабочие поверхности катодов и анодов. Выделение металла на катоде начинается в центрах первичной кристаллизации. При большей плотности тока в ванне на единице площади катода разряжается больше ионов, т.е. на катоде создается больше первичных центров кристаллизации. В связи с этим при низкой концентрации катионов в электролите скорость роста каждого из подобных центров уменьшается. Это приводит к получению более мелких (дисперсных) осадков. Однако при большой плотности тока высоко и напряжение на ванне, что обуславливает выделение на катоде побочных элементов (а не только атомов получаемого металла) и снижению выхода по току. С повышением катодной плотности тока растет и анодная плотность тока, в результате чего на аноде начинается более интенсивная разрядка анионов кислорода (при электролизе водных растворов), хлора или фтора (при электролизе расплавов). Это может привести к проявлению анодного эффекта: электролит как бы отделяется от электрода прослойкой газа и в ней возникает искрение. Выделение металла на катоде практически прекращается. Поэтому необходимо подбирать такие плотности тока, которые позволят избежать появления анодного эффекта.
Плотность тока можно корректировать либо за счет изменения токовых нагрузок на ванне, либо путем изменения суммарной рабочей поверхности катодов (количества катодов).
Концентрация ионов выделяемого металла. Повышение концентрации выделяемых ионов (при низкой плотности тока) создает благоприятные условия для активного питания сравнительно небольшого количества центров, в результате чего формируется плотный осадок. Для образования порошкообразного (рыхлого) осадка нужна пониженная концентрация ионов металла в электролите. Однако при слишком малой концентрации ионы металла перенесут лишь небольшую долю электроэнергии, в связи с чем в процесс электропереноса будут вовлекаться и другие катионы, например водорода, что приведет к снижению выхода по току.
Температура электролита. Повышение температуры увеличивает скорость перемещения ионов и ускоряет их диффузионную подвижность. Это компенсирует обеднение приэлектродной области электролита катионами. Стабильное «питание» центров кристаллизации способствует укрупнению порошков, но одновременно с этим возрастает и интенсивность химического взаимодействия выделяемого металла с электролитом. Это приводит к растворению катодного осадка и снижению выхода по току. Кроме того, увеличивается испарение электролита, что обуславливает ухудшение условий труда. Поэтому электролиз водных растворов ведут при температуре электролита не выше 60 °С, а электролиз расплавов – при температуре, которая должна быть выше температуры плавления электролита (при сохранении электролитом требуемой относительно достаточной жидкотекучести), но ниже температуры плавления выделяемого металла.
Кислотность электролита. Повышение содержания в электролите ионов водорода может привести к их бурному выделению на катоде. Это, с одной стороны, способствует разрыхлению (измельчению) порошка, но, с другой стороны, обуславливает существенное уменьшение выхода по току и возрастание расхода энергии. Кроме того, повышенная кислотность электролита приводит к растворению части металла, выделившегося на катоде.
Межэлектродное расстояние. Увеличение расстояния между электродами (при постоянном напряжении на ванне) способствует повышению электросопротивления электролита. При этом падает сила тока на ванне, уменьшается его катодная плотность, что обуславливает получение более крупных порошков. Одновременно снижается относительное количество растворяющегося в электролите катодного осадка и увеличивается выход по току. Однако при чрезмерном увеличении межэлектродного расстояния возрастает количество выделяемого тепла, что может привести к перегреву электролита и уменьшению выхода по току за счет растворения части катодного осадка.
При слишком малом расстоянии между электродами может произойти короткое замыкание, напряжение на ванне упадет до нуля, и выделение порошка на катоде прекратится, хотя сила тока в ней будет такой же, как и в нормально работающих ваннах.
Длительность наращивания слоя порошка на катоде. В процессе роста частиц порошка значительно увеличивается их суммарная поверхность (особенно у рыхлых осадков), а следовательно, возрастает и суммарная поверхность самих катодов. Это, в свою очередь, приводит к снижению плотности тока и образованию на катоде более крупных частиц (на катоде может сформироваться губка или даже плотная корка). Несвоевременное удаление порошка может стать причиной короткого замыкания электродов через разросшийся катодный осадок.
Циркуляция электролита. В процессе электролиза может произойти частичное расслаивание электролита вследствие различной плотности его составляющих (при электролизе расплавов), обеднение (обогащение) прикатодного (прианодного) пространство катионами (анионами), а также изменение заданной температуры раствора (расплава). Для предотвращения этих нежелательных явлений проводят выравнивание концентрации электролита с помощью системы непрерывной замкнутой циркуляции.
Наличие газообразных и органических примесей. В процессе электролиза в электролите присутствует растворенный кислород, пероксид водорода, а также другие окислители, вызывающие окисление поверхности катода. В результате окисления поверхность катода становится более развитой, что способствует образованию рыхлых осадков. Присутствующие в электролите органические примеси и поверхностно-активные вещества адсорбируются на поверхности растущих граней кристаллов и препятствуют их дальнейшему росту, что также приводит к получению более рыхлых осадков.
Читайте также:
