Электронное строение внешней оболочки металла
Обновлено: 13.05.2024
Неверие в квантово-механические представления о строении электронных оболочек атомов и молекул принято считать ересью, не заслуживающей серьёзного внимания. Тем не менее, регулярно появляются еретики, пытающиеся при построении своих теорий обойтись без принципа неопределённости, орбиталей, волновых функций и прочих постулатов квантовой механики. В основе большинства таких теорий лежит представление о кольцевом (или тороидальном) строении электрона («магнетона»), предложенное ещё в 1915 году Альфредом Парсоном. У авторов более современной теории струн электроны считаются кольцевыми струнами, но Вселенной приписывается не менее десяти измерений, из которых только четыре доступны человеческому восприятию. К последователям А.Парсона с менее буйной фантазией относятся A.Канарёв, А.Кушелев, З.Огжевальский, S.Allen, D.Bergman, P.Ošmera, K.Snelson, P.Vesly и многие другие авторы и сторонники теорий кольцевого (тороидального, вихревого, фрактального и т.п.) электрона.
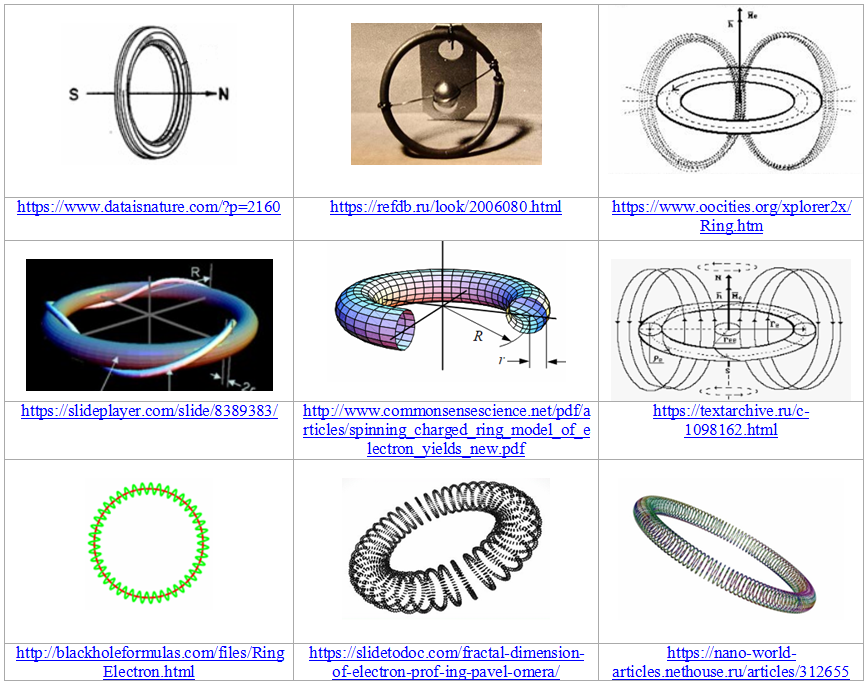
Рис. 1. Некоторые варианты кольцевых электронов
Один из возможных вариантов такой трансформации – дробление одного кольца, соответствующего верхнему (нулевому) энергетическому уровню электрона в атоме водорода, на пары мелких колечек. При этом количество таких пар (от 1 до 6) соответствует дискретным энергетическим состояниям электрона.
Такая схема формирования дискретных энергетических уровней электрона позволяет объяснить существование спектральных серий и линий излучения атомарного водорода.
Если электроны действительно являются не просто кольцевыми, а многокольцевыми, то этим определяется строение внешних электронных оболочек всех элементов таблицы Менделеева. И их электроны должны состоять из шести пар колец – как у атомарного водорода в невозбуждённом состоянии. Для подтверждения данной гипотезы необходимо построить модели различных оболочек из замкнутых 12-звенных электронов, и при помощи таких моделей попытаться объяснить физические и химические свойства соответствующих им атомов и молекул.
При построении моделей электронных оболочек элементов, относящихся к различным группам и периодам таблицы Менделеева, эту таблицу желательно иметь перед глазами. И ориентироваться не только на общее количество внешних электронов, но и на их чётность, а также на возможное влияние нижележащих оболочек на характер сборки внешних оболочек и, соответственно, на свойства атомов.
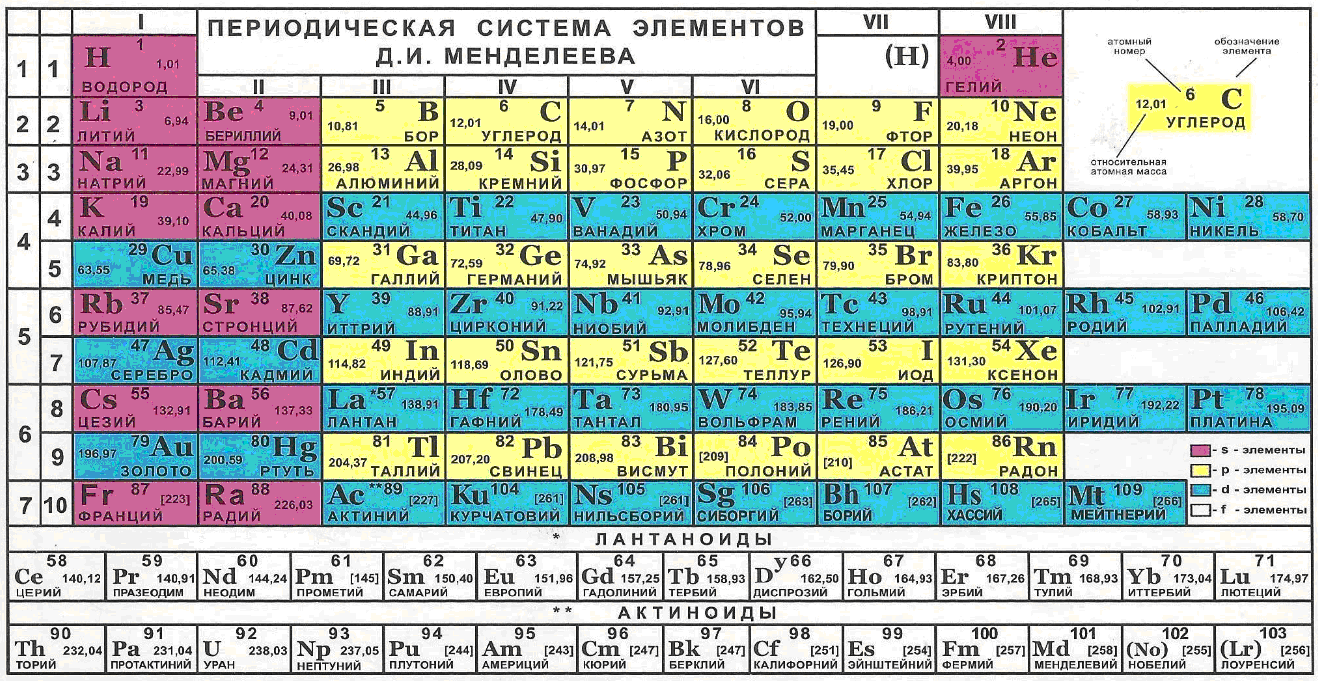
Рис. 4. Периодическая система химических элементов (таблица Менделеева)
Многокольцевые электроны могут иметь несколько вариантов укладки составляющих их звеньев, отличающихся количеством контактных точек и плотностью распределения заряда. Можно предположить, что наиболее стабильные оболочки атомов и молекул состоят из электронов с симметричным расположением составляющих их одинаковых звеньев (колечек).
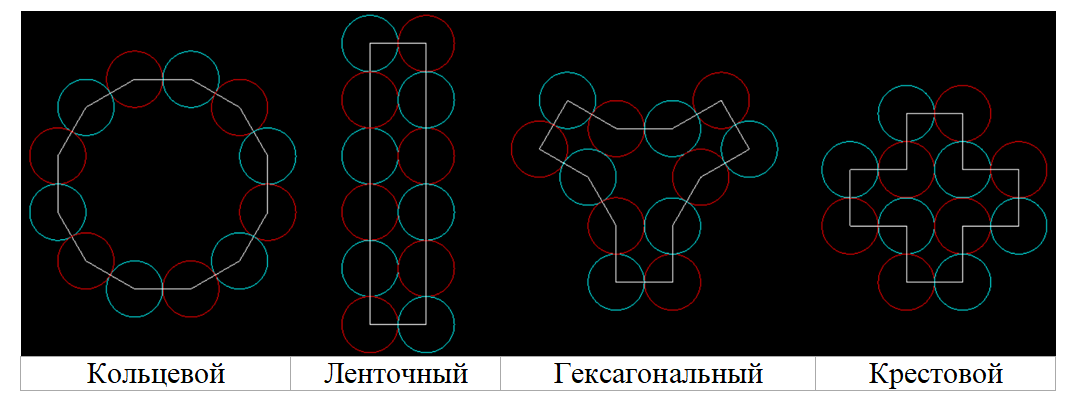
Рис. 5. Основные варианты симметричной укладки электронных звеньев
В трёхмерной модели атома водорода с электроном в основном (невозбуждённом) состоянии составляющие его звенья (с ленточной укладкой) могут располагаться на поверхности сферы с центральным атомным ядром (протоном). Такая электронная сфера обладает минимальным объёмом (и диаметром) и максимальным количеством точек соприкосновения звеньев с противоположной ориентацией магнитного поля.
Для двух электронов атома гелия возможны по крайней мере два варианта укладки составляющих их 24 (12х2) звеньев. Сферический может соответствовать гелию-I – химически инертному, с экстремально низкой температурой кипения (4,2°K). Трубчатый вариант должен легко полимеризоваться и подходит для гелия-II, образующегося при температуре
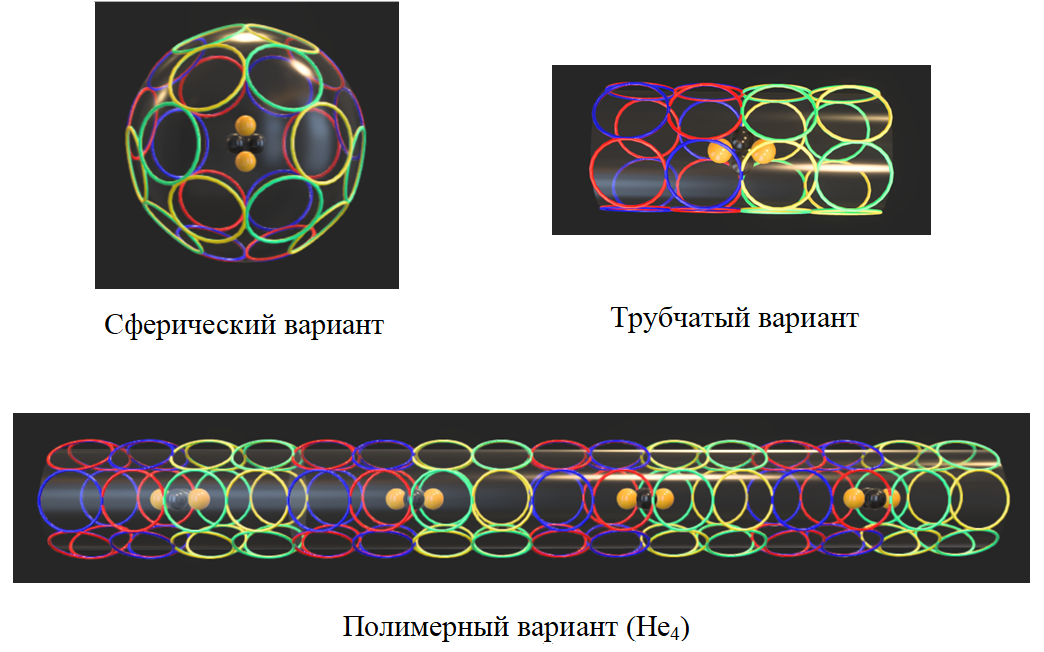
Рис. 7. Варианты построения двухэлектронных оболочек гелия
Немаловажным преимуществом двухслойной оболочки является простота построения её производных, у которых нехватка электронов во внешнем слое компенсируется атомами водорода – с протонами, расположенными в соединительных шестизвенных колодцах (венчиках) на максимальном удалении друг от друга. Для второго периода таблицы Менделеева такими производными являются метан (СН4), аммиак (NH3), вода (H2O) и фтороводород (HF). Причём в оболочке воды возможно не только угловое (мета-), но и прямое (пара-) расположение протонов.
Для атомов щелочных металлов (Li, Na, K, Rb, Cs, Fr) можно предложить несколько вариантов моделей их электронных оболочек, но для компенсации магнитных полей электронов они должны быть димерными, причём склонными к полимеризации. Димерная природа щелочных металлов редко упоминается в учебниках, но хорошо известна специалистам.
Полимеризацией двухэлектронной оболочки может объясняться и прочность металлического бериллия. А полимеризация трёхэлектронных оболочек способна определять сверхпрочность конструкционных волокон бора, получаемых его осаждением на тонкую нить или проволоку.

Рис. 11. Модели мономерных и полимерных электронных оболочек бериллия и бора
Полимерные трёхэлектронные оболочки трубчатого типа подходят также для металлов третьей группы, легкоплавкость которых (галлий - 29,76°C, индий - 156,6°C, таллий - 304°C) может объясняться лёгкостью перестроения полимерной формы в сферическую.

Рис. 12. Модель сферической трёхэлектронной оболочки
Неуравновешенность магнитных полей у таких трёхэлектронных сфер (нечётность количества их электронов) может определять и нелетучесть, и сравнительно высокие температуры кипения расплавов этих металлов (Ga – 2477°C; In – 2072°C; Tl - 1746°C).
Внешняя оболочка атома углерода содержит 4 электрона, из которых при соединении двух кольцевых и двух крестовых электронов можно построить очень компактную сферу. Но обладающие такой сферической оболочкой элементы должны быть если не газообразными, то хотя бы легкоплавкими, что для углерода явно не характерно. Его свойства проще объяснить формированием трубчатой оболочки из четырёх кольцевых электронов, которое может быть обусловлено нестабильностью крестовой структуры электрона, отличающейся высокой плотностью отрицательного заряда.

Рис. 13. Варианты четырёхэлектронных оболочек
Атомы углерода с трубчатыми четырёхэлектронными оболочками должны легко димеризоваться. А димеры – полимеризоваться, образуя при линейной полимеризации карбин, при двухмерной – графен, а при объёмной – фуллерен, нанотрубки и их многочисленные производные.

Рис. 14. Варианты полимерных оболочек углерода

Рис. 15. Двухслойный вариант 10-электронной оболочки
Для объяснения строения внутренних 10-электронных оболочек данный вариант вполне подходит, но элементы с внешней оболочкой такого типа должны быть если не летучими, то хотя бы легкоплавкими. А это явно не соответствует свойствам ковких и пластичных металлов - никеля и палладия. Им больше подходит полимерная оболочка, мономеры которой могут получаться трансформацией торцевых крестовых электронов в соединительные электронные кольца.

Рис. 16. Внешние 10-электронные оболочки никеля/палладия
Вероятно, компактные крестовые электроны внешних оболочек перестраиваются в менее компактные кольцевые из-за взаимного отталкивания составляющих их отрицательно заряженных звеньев. Во внутренних оболочках такое отталкивание может компенсироваться притяжением атомного ядра.

Рис. 17. Модели электронных оболочек железа и его углеродных соединений
За платиной в таблице Менделеева следует золото, полимерная оболочка которого может отличаться от платиновой присутствием одного внутреннего крестового электрона.

Рис. 18. Электронная оболочка золота
Уникальные свойства следующей за золотом ртути могут быть обусловлены соотношением размеров её внешнего двухэлектронного пояса и внутренней 4-электронной сферы, которая выступает по бокам и препятствует характерной для металлов полимеризации внешних электронных оболочек.
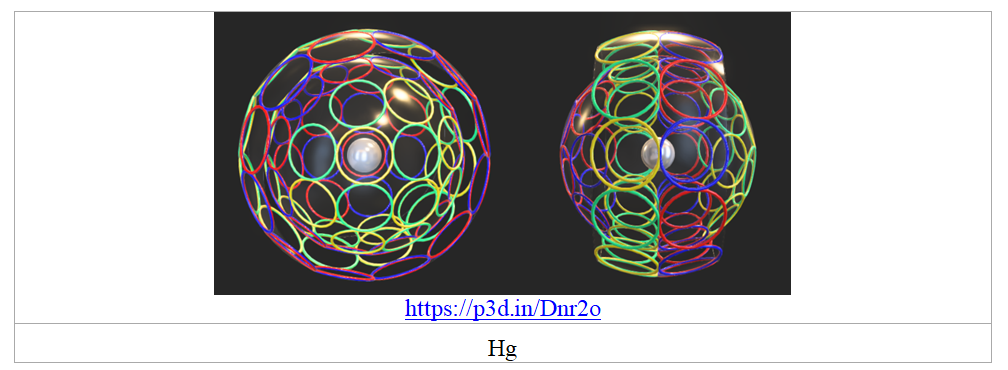
Рис. 19. Модель электронной оболочки ртути
Если оболочки атомов действительно состоят из 12-звенных электронов (что очень похоже на правду), то построить подобные модели можно и для всех молекул. Но для таких построений лучше использовать не трудоёмкое 3D-моделирование, а специально разработанные программы. Ещё лучше – компьютерные игры, позволяющие легко и просто собирать виртуальные электронные оболочки атомов и молекул любой сложности из готовых элементов, которых может быть совсем не много. Например, для моделирования структуры алмаза достаточно электронов всего одного типа.

Рис. 20. Моделирование электронной структуры алмазного кристалла
Ещё я ничего (вообще ничего!) не понимаю в UE5, Unity3D, Godot Engine и прочих платформах и программах для геймдева. Поэтому буду признателен за любые идеи, предложения и соображения по их использованию для молекулярного макетирования.
Строение атомов металлов и их особенности
Если провести в Периодической таблице Д.И. Менделеева символическую линию из верхнего левого угла в нижний правый угол, то все элементы, находящиеся ниже этой линии, будут металлами.
Металлы можно охарактеризовать при помощи нескольких свойств, которые будут общими для всех элементов. К таким характеристикам следует отнести высокую электрическую проводимость и теплопроводность, пластичность, благодаря которой металлы можно подвергать ковке, прокатке, штамповке или вытягиванию в проволоку, металлический блеск и непрозрачность.
В зависимости от температуры кипения все металлы подразделяют на тугоплавкие (Tкип> 1000 o С) и легкоплавкие (Tкип< 1000 o С). Примером тугоплавких металлов может быть – Au, Cu, Ni, W, легкоплавких – Hg, K, Al, Zn.
Электронное строение металлов и их особенности
Атомы металлов, также как, и неметаллов состоят из положительно заряженного ядра внутри которого находятся протоны и нейтроны, а по орбитам вокруг него движутся электроны. Однако, по сравнению с неметаллами, атомные радиусы металлов намного больше. Это связано с тем, что валентные электроны атомов металлов (электроны внешнего энергетического уровня) расположены на значительном удалении от ядра и, как следствие, связаны с ним слабее. По этой причине металлы характеризуются низкими потенциалами ионизации и легко отдают электроны (являются восстановителями в ОВР) при образовании химической связи.
Все металлы за исключением ртути представляют собой твердые вещества с атомной кристаллической решеткой. Рассмотрим строение металлов в кристаллическом состоянии. В атомах металлов имеются «свободные» электроны (электронный газ), которые могут перемещаться по кристаллу даже под действием слабых электрических полей, что обусловливает высокую электропроводимость металлов.
Среди металлов присутствуют s-, p-, d- и f-элементы. Так, s- элементы – это металлы I и II групп Периодической системы (ns 1 , ns 2 ), р- элементы – металлы, расположенные в группах III – VI (ns 2 np 1-4 ). Металлы d-элементы имеют большее число валентных электронов по сравнению с металлами s- и p-элементами. Общая электронная конфигурация валентных электронов металлов d-элементов – (n-1)d 1-10 ns 2 . Начиная с 6 периода появляются металлы f-элементы, которые объединены в семейства по 14 элементов (за счет сходных химических свойств) и носят особые названия лантаноидов и актиноидов. Общая электронная конфигурация валентных электронов металлов f-элементов – (n-2)f 1-14 (n-1)d 0-1 ns 2 .
Примеры решения задач
| Задание | При взаимодействии 6,0 г металла с водой выделилось 3,36 л водорода (н.у.). Определите этот металл, если он в своих соединениях двухвалентен. |
| Решение | Запишем уравнение реакции растворения металла в воде. Поскольку металл двухвалентен, его реакция с водой будет описываться уравнением следующего вида: |
Согласно уравнению реакции:
N (Ме) =n (Н2) = 3,36/22,4 = 0,15 моль.
Найдем относительную атомную массу металла:
Ar(Ме) = m / n= 6,0/0,15 = 40 г/моль
Следовательно, этот металл — кальций.
| Задание | При действии на смесь меди и железа массой 20 г избытком соляной кислоты выделилось 5,6 л газа (н.у.). Определить массовые доли металлов в смеси. |
| Решение | Известно, что медь не растворяется в соляной кислоте, поскольку стоит в ряду активности металлов после водорода, т.е. выделение водорода происходит только в результате взаимодействия хлороводородной кислоты с железом. |
Запишем уравнение реакции:
Найдем количество вещества водорода:
Согласно уравнению реакции n(H2) : n(Fe) = 1:1, т.е.n(H2) = n(Fe) = 0,25 моль. Тогда масса железа будет равна (молярная масса – 56 г/моль):
Занятие 1. Электронное строение и классификация металлов
Металлы, или вещества, находящиеся в металлическом состоянии, обладают электронным строением, характеризующимся наличием незаполненных подуровней в валентной зоне. Валентные электроны не связаны с определенными атомами, а принадлежат всему металлическому телу, образуя электронный газ, окружающий каркас из положительно заряженных ионов.
Металлическая связь между атомами ненаправленная. Каждый атом стремится окружить себя как можно большим числом соседних атомов, следствием чегоявляется высокая компактность металлов.
Электроны, образующие электронный газ, называют электронами проводимости, поскольку они легко перемещаются во внешнем электрическом поле, создаваяэлектрический ток.
Незаполненность валентных энергетических зон металлов определяет их высокую электропроводность,теплопроводность, металлический блеск и др. Все металлыимеют положительный температурный коэффициент электрического сопротивления, т. е. при Т→0 К R → 0 (у полупроводников и неметаллов при Т→0 К R→∞).
По ряду характерных признаков металлы делят на две группы: черные и цветные. К черным относят железо и его сплавы (стали, чугуны). Остальные металлы и сплавы на их основе – цветные.
Нередко к металлам железной группы относят Ni, Co и Мn.
Металлы с температурой плавления выше 1800 0 С называют тугоплавкими. К ним принадлежи Тi, Zг. Сг, V, Nb, Mo, Wи др.
Металлы с низкой температурой плавления (Hg, Sn, Bi, Cd, Pb, Zn, Sb и др.) относят к легкоплавким.
К легким относят металлы с низкой плотностью. К ним принадлежат нашедшие широкое техническое применение Mg, Be, Al, Ti.
Металлы (Ag, Au, Os, Ir, Pt, Rh, Pd и др.) составляют группу благородных. Они химически инертны.К благородным металлам часто относят медь, обладающую химической стойкостью в сухой атмосфере.
К редкоземельным металлам (РЗМ) относят металлы группы лантана – лантаноиды(Се, Рг, Nd и др.) и сходные с ними Y и Sc.
Металлы актиноидной (урановой) группы составляют используемые в атомной технике актиноиды (Th, Pa, U и др.).
Li, Na, К и др. (их используют в качестве теплоносителей в быстрых ядерных реакторах с высоко энергетической активной зоной) составляют группу щелочноземельных металлов.
Ряд металлов (Fe, Ni, Co, Gd), в связи с особенностями их электронного строения, обладает ферромагнетизмом –способностью сильно намагничиваться во внешнем магнитном поле. Основные свойства ферромагнетиков определяются доменной структурой их кристаллов. Домен –это область кристалла размером 10 -4 . 10 -6 м, которая при отсутствии внешнего магнитного поля спонтанно (самопроизвольно) намагничена до насыщения. Магнитные моменты отдельных доменов направлены различно, поэтому полный магнитный момент ферромагнетика равен нулю.
Занятие 2. Кристаллическое строение металлови дефекты кристаллических структур
Большинство металлов имеют кристаллическую решетку. Положительно заряженные ионы, образующие каркас металлического тела, совершают непрерывные тепловые колебания около точек, закономерно расположенных в определенных местах пространства. Эти точки являются узлами воображаемой пространственной кристаллической решетки.
Наименьший объем кристалла, при трансляции которого по координатным осями воспроизводится вся кристаллическая решетка, называется элементарной кристаллической ячейкой.Ячейка характеризуется параметрами а, Ь и с – периодами кристаллической решетки (расстояниями между атомами, расположенными на ребрах ячейки, направленных по осям х, у и z соответственно) и углами между координатными осями – a (между осями х и z), β (между у и z), γ (между x и у).
Различают простые и сложные кристаллические решетки. В элементарной ячейке простой решетки атомы (ионы) расположены только в вершинах образующего ячейку многогранника. В сложных – они могут находиться также внутри многогранника или на его гранях.
Металлы имеют сложные кристаллические решетки. В большинстве случаев – это кубическая объемно-центрированная (ОЦК), кубическая гранецентрированная (ГЦК) и гексагональная плотноупакованная (ГПУ).
В элементарной ячейке ОЦК атомы находятся в вершинах куба и внутри него, в точке пересечения пространственных диагоналей. В ячейке ГЦК атомы расположены в вершинах куба и в центре каждой грани. В ячейке ГПУ атомы находятся в вершинах правильной шестигранной призмы, в центре каждого ее основания и, кроме того, три атома заключены внутри призмы.
Размеры элементарной ячейки определяются размерами образующих ее атомов. При этом полагают, что атомы, представляемые в виде жестких шаров, касаются друг друга в направлениях ячейки с наиболее плотным их расположением.
Во многих случаях в разных температурных интервалах один и тот же металл обладает различными кристаллическими решетками. Такое явление носит название полиморфизм или аллотропия.
Важными характеристиками кристаллической решетки являются коэффициент компактности, координационное число, базис.
Коэффициент компактности – это отношение объема принадлежащих кристаллической ячейке атомов к объему всей ячейки. Следует иметь в виду, что в кристаллической решетке часть атомов, составляющих ячейку, относится не только к данной ячейке, но и к ячейкам, находящимся по соседству. Например, атом, расположенный в вершине кубической ячейки (простая кубическая, ОЦК, ГЦК) принадлежит еще семи соседним ячейкам, т.е. данной ячейке принадлежит лишь 1/8 атома.
Коэффициент компактности простой кубической решетки равен 52 %, ОЦК – 68 %, ГЦК – 74 % (столь же компактна решетка ГПУ). Остальное пространство занято порами. В ячейке ГЦК в центре расположена крупная октаэдрическая пора с радиусом, равным 0,41 радиуса атома. В ячейке ОЦК больших пор нет. Поры, расположенные на ребрах ячейки, имеют радиус, равный 0,16 радиуса атома.
Координационное число – это число атомов, находящихся в кристаллической решетке на равном наименьшем расстоянии от данного атома. Каждый атом простой кубической решетки имеет 6 ближайших соседей, расположенных на расстоянии длины ребра куба (на расстоянии периода решетки). Координационное число такой решетки обозначают К6. В ОЦК решетке у каждого атома 8 ближайших соседей и координационное число равно 8 (К8). В ГЦК и ГПУ решетках каждый атом имеет 12 ближайших соседей. Соответственно координационные числа К12 и Г12.
Чем выше координационное число, тем плотнее пространственная кристаллическая решетка материала.
Базис кристаллической решетки – это таблица координат атомов, принадлежащих элементарной ячейке, рассматриваемой в пространственных координатных осях. Базис простой кубической решетки (0,0,0), ОЦК – (0,0,0; 1/2,1/2,1/2), ГЦК – (0,0,0; 1/2,0,1/2; 0,1/2,1/2; 1/2,1/2,0).
Пространственное положение кристаллографических плоскостей (плоскостей, проходящих через определенные группы атомов кристаллической решетки), а также кристаллографических направлений характеризуется кристаллографическими индексами.
Индексы плоскости – это три целых числа, заключенных в круглые скобки и представляющих собой приведенные к целым числам значения обратных величин отрезков, отсекаемых плоскостью на осях х, у, z.За единицы длины принимают параметры решетки а, b, с. Например, плоскость, включающая пространственные диагонали куба, имеет индексы (101). Если плоскость отсекает отрицательные отрезки, то знак минус ставится над соответствующим индексом. Кристаллографические индексы отражают положение не только данной плоскости, но целого семейства плоскостей, ей параллельных.
Индексы направлений – это три числа, заключенных в квадратные скобки и представляющих собой приведенные к целым значениям координаты любой точки направления после его параллельного переноса в начало координат. За единицы принимают параметры кристаллической решетки. Например, направление совпадающее с пространственной диагональю куба, имеет индексы [111]. Если направление имеет отрицательные координаты, то над соответствующим индексом ставится знак минус.
В различных направлениях кристаллической решетки плотность расположения атомов различна, что влечет за собой различие в свойствах кристалла в зависимости от направления, в котором это свойство измерено – анизотропию. В поликристаллических телах в пределах отдельных зерен наблюдается явление анизотропии. Однако, поскольку ориентация кристаллической решетки в различных зернах различна, в целом по куску материала свойства усредняются. Поэтому реальные металлы являются изотропными,т.е. телами с примерно одинаковыми свойствами по всем направлениям. Поскольку их изотропность является не истиной, а усредненной, то их принято называть квазиизотропами. Если каким-либо способом, например давлением, сориентировать кристаллические решетки в зернах одинаково (создать текстуру деформации), то такое поликристаллическое тело станет анизотропным.
Реальные кристаллы всегда содержат дефекты – искажения правильного расположения атомов в пространстве. Различают точечные, линейные, поверхностные и объемные дефекты.
Точечные дефекты по размерам сравнимы с межатомными расстояниями. К ним относятся вакансии (отсутствие атома в узле кристаллической решетки), межузельные или дислоцированные атомы (атом находится в межузельном пространстве кристаллической решетки) и примесные атомы. Среди последних различают атомы замещения (чужеродный атом занимает место в узле кристаллической решетки) и атомы внедрения (чужеродный атом находится в межузельном пространстве решетки).
Линейные дефекты по размерам в двух направлениях сравнимы с межатомными расстояниями, а в третьем простираются на многие тысячи периодов кристаллической решетки. Важнейшими видами линейных несовершенств являются краевые (линейные) и винтовые дислокации.
Образование краевых дислокаций вызвано присутствием в кристаллической решетке неполных кристаллографических плоскостей. Такие полуплоскости, не имеющие продолжения в нижней или верхней частях кристаллической решетки, называются экстраплоскостями. Краевая дислокация представляет собой область упругих искажений, проходящих вдоль края экстраплоскости. Различают положительные и отрицательные дислокации. Положительная дислокация (ее отмечают знаком ┴.) возникает, если экстраплоскость находится в верхней части кристалла, если в нижней – отрицательная (ее отмечают знаком ┬).
Винтовая дислокация – это область упругих искажений кристаллической решетки, проходящая вдоль линии, вокруг которой атомные плоскости изогнуты по винтовой поверхности. В зависимости от направления изгиба различают правые и левые винтовые дислокации.
Дислокации (краевые и винтовые) не могут обрываться внутри кристалла. Они выходят на границы кристалла, прерываются другими дислокациями или образуют дислокационные петли.
Поверхностные дефекты малы только в одном направлении. Они представляют собой упругие искажения кристаллической решетки по границам зерен или их фрагментов (блоков мозаичной структуры). Различают большеугловые (высокоугловые) и малоугловые (низкоугловые) границы.
Большеугловые границы представляют собой области в несколько периодов кристаллической решетки, на протяжении которых решетка одной кристаллографической ориентации переходит в решетку другой ориентации. Такое строение имеют межзеренные границы.
Малоугловые границы представляют собой цепочки дислокаций (дислокационные стенки), отделяющие одну часть кристаллической решетки от другой (один блок мозаичной структуры от другого). Плотность расположения дислокаций зависит от угла между кристаллографическими плоскостями в соседних блоках. Чем угол больше (в пределах до нескольких угловых градусов), тем чаще расположены дислокации.
Объемные дефекты представляют собой искажения решетки, вызванные наличием пор, трещин, раковин и других макронарушений непрерывности кристаллической решетки.
Атомно-кристаллическое строение металла
Ковалентная связь образуется между атомами одного или нескольких химических элементов с близкими ионизационными потенциалами. В чистом виде ковалентная связь реализуется при взаимодействии элементов с наполовину заполненными электронными оболочками. H2 ,C, Si, Ge, Sn. Соседние атомы обмениваются электронами.
Появление между положительно заряженными ионами пары отрицательно заряженных электронов приводит к тому, что оба иона притягиваются к обобществленным электронам и, тем самым, притягиваются друг к другу. Каждый атом взаимодействует с ограниченным числом соседей, причем число соседей равно числу валентных электронов атома. Следовательно, ковалентная связь насыщенна. Кроме того, атом взаимодействует только с теми соседями, с которыми он обменялся электронами, то есть ковалентная связь имеет направление.
Ионная связь образуется при взаимодействии атомов с малым количеством валентных электронов и атомов с большим количеством электронов на валентных оболочках. При этом наружные электроны атомов с низкими потенциалами ионизации переходят на валентные оболочки атомов с высокими ионизационными потенциалами. Ионная связь ненасыщенна, поскольку каждый из отрицательно заряженных ионов притягивает к себе положительно заряженные, а каждый из положительно заряженных ионов притягивает к себе все отрицательно заряженные. Однако ионная связь направлена, поскольку ион притягивает к себе разноименно заряженные ионы и отталкивает одноименно заряженные.
Уменьшение размера иона и увеличение его заряда ведет к росту энергии связи, а следовательно, к росту температуру плавления материала, уменьшению коэффициента теплового расширения и к увеличению модуля упругости.
Металлическая связь образуется между атомами одного или нескольких химических элементов, у которых валентные электронные оболочки застроены меньше чем на половину. Поскольку энергия иона минимальна при полностью заполненной внешней оболочке, атомы отдают внешние валентные электроны и превращаются в положительно заряженные ионы, между которыми находятся свободные электроны (электронный газ).
Металлическая связь не имеет направления и ненасыщенна. Кристаллические решетки металлов упакованы плотно.
Атомно-кристаллическое строение металла.
Металлы, описываемые пространственной кристаллической решеткой, под которой понимают наименший комплекс атомов, при многократной трансляции которых по всем направлениям воспроизводится пространственная кристаллическая решетка.
В узлах кристаллической решетки располагаются атомы.
Пространственную кристаллическую решетку легче всего представить в виде элементарной кристаллической ячейки. Ячейка – это та часть решетки, при многократной трансляции которой она и воспроизводится.
Три основные вектора элементарной ячейки называются трансляционными плоскими осевыми единицами.
Абсолютная величина трансляции – это период кристаллической решетки.
Период кристаллической решетки измеряют в анкстреммах
1А=10 -8 см или в кХ (килоиксах), так называемых кристаллографических анкстреммах.
На одну элементарную ячейку приходится различное количество атомов; при чем атомы занимают определенные места в ячейке.
В зависимости от расположения атомов в ячейке различают простые, кубические, объемно-центрированные кубические, гранецентрированные кубические, гексагональные решетки.
Простейшая решетка описывается одним параметром, которым является ребро куба а.
а.
3.Гранецентрированная кубическая решетка (ГЦК) представляет собой куб, В центре каждой грани которого расположены дополнительно по одному атому.
а и с.
В случае, если отношение с/а=1,666, то решетка считается плотноупакованной, а иначе – неплотно упакованной.
ОЦК – вольфрам, молибден, железо Fea;
ГЦК – алюминий, медь, никель, железо Feg;
Некоторые металлы, например индий, имеют тетрагональную решетку.
Свойства металлов при прочих равных условиях определяются типом кристаллической решётки, т.е. количеством атомов, приходящихся на одну элементарную ячейку. На простую ячейку приходит с один полный атом.
На ОЦК ячейку приходится два атома: один атом вносится атомом и один принадлежит только этой ячейке.
Для ВЦК на одну ячейку приходится четыре атома.
Плотность кристаллической решетки определяется, так называемым координатным числом. Под координатным числом понимается число атомов, находящихся на кратчайшем расстоянии от данного атома. Для ОЦК решетки К=8, для ГЦК – К=12 и для ГПУ – К=12.
От величины координатного числа зависит компактность (плотность укладки) кристаллической решетки. Так в простой кристаллической решетки плотность укладки атомов в ячейке составляет менее 50%. В ОЦК – 50%, в решетках с координатным числом 12 – порядка 75%.
СТРОЕНИЕ ЭЛЕКТРОННОЙ ОБОЛОЧКИ АТОМА
1. Квантовые числа (главное, побочное, магнитное, спиновое).
2. Закономерности заполнения электронной оболочки атома:
- принцип наименьшей энергии;
3. Определения понятий: электронная оболочка, электронное облако, энергетический уровень, энергетический подуровень, электронный слой.
Атом состоит из ядра и электронной оболочки. Электронная оболочка атома – это совокупность всех электронов в данном атоме. От строения электронной оболочки атома напрямую зависят химические свойства данного хим. элемента. Согласно квантовой теории, каждый электрон в атоме занимает определенную орбиталь и образует электронное облако, которое является совокупностью различных положений быстро движущегося электрона.
Для характеристики орбиталей и электронов используют квантовые числа.
Главное квантовое число – n. Характеризует энергию и размер орбитали и электронного облака; принимает значения целых чисел от 1 до бесконечности (n = 1,2,3,4,5,6…). Орбитали, имеющие одинаковое значение n, близки между собой по энергии и по размеру и образуют один энергетический уровень.
Энергетический уровень – это совокупность орбиталей, имеющих одинаковое значение главного квантового числа. Энергетические уровни обозначают либо цифрами, либо большими буквами латинского алфавита (1-K, 2-L, 3-M, 4-N, 5-O, 6-P, 7-Q). С увеличением порядкового номера энергия и размер орбиталей увеличиваются.
Электронный слой – это совокупность электронов, находящихся на одном энергетическом уровне.
На одном энергетическом уровне могут находиться электронные облака, имеющие различные геометрические формы.
Побочное (орбитальное) квантовое число – l. Характеризует форму орбиталей и облаков; принимает значения целых чисел от 0 до n-l.
| УРОВЕНЬ | ГЛАВНОЕ КВАНТОВОЕ ЧИСЛО - n | ЗНАЧЕНИЕ ПОБОЧНОГО КВАНТОВОГО ЧИСЛА – l |
| K | 0 (s) | |
| L | 0,1 (s,p) | |
| M | 0,1,2 (s,p,d) | |
| N | 0,1,2,3 (s,p,d,f) |
Орбитали, для которых l=0, имеют форму шара (сферы) и называются s-орбиталями. Они имеются на всех энергетических уровнях, причем на К-уровне имеется только s-орбиталь. Схематично изобразите форму s-орбитали:
Орбитали, для которых l=1, имеют форму вытянутой восьмерки и называются р-орбиталями. Они имеются на всех энергетических уровнях, кроме первого (К). Схематично изобразите форму l-орбитали:
Орбитали, для которых l=2, называются d-орбиталями. Их заполнение электронами начинается с третьего энергетического уровня.
Заполнение f-орбиталей, для которых l=3, начинается с четвертого энергетического уровня.
Энергия орбиталей, находящихся на одном энергетическом уровне, но имеющих разную форму, неодинакова: Espdf, поэтому на одном уровне выделяют разные энергетические подуровни.
Энергетический подуровень – это совокупность орбиталей, которые находятся на одном энергетическом уровне и имеют одинаковую форму. Орбитали одного подуровня имеют одинаковые значения главного и побочного квантового числа, но отличаются направлением (ориентацией) в пространстве.
Магнитное квантовое число – ml. Характеризует ориентацию орбиталей (электронных облаков) в пространстве и принимает значения целых чисел от –l через 0 до +l. Число значений ml определяет число орбиталей на подуровне, например:
s-подуровень: l=0, ml=0, - 1 орбиталь.
p-подуровень: l=1, ml=-1, 0, +1, -3 орбитали
d-подуровень: l=2, ml=-2, -1, 0, +1, +2, - 5 орбиталей.
Таким образом, число орбиталей на подуровне можно вычислить как 2l+1. Общее число орбиталей на одном энергетическом уровне = n 2 . Общее число электронов на одном энергетическом уровне = 2n 2 . Графически любая орбиталь изображается в виде клетки (квантовой ячейки).
Схематично изобразите квантовые ячейки для разных подуровней и подпишите для каждой из них значение магнитного квантового числа:
Итак, каждая орбиталь и электрон, находящийся на этой орбитали, характеризуется тремя квантовыми числами: главным, побочным и магнитным. Электрон характеризуется еще одним квантовым числом – спином.
Спиновое квантовое число, спин (от англ. to spin – кружить, вращать) – ms. Характеризует вращение электрона вокруг своей оси и принимает только два значения: +1/2 и –1/2. Электрон со спином +1/2 условно изображают так: ; со спином –1/2: ¯.
Заполнение электронной оболочки атома подчиняется следующим законам:
Принцип Паули: в атоме не может быть двух электронов с одинаковым набором всех четырех квантовых чисел. Составьте наборы квантовых чисел для всех электронов атома кислорода и убедитесь в справедливости принципа Паули:
Принцип наименьшей энергии: Основное (устойчивое) состояние атома – это такое состояние, которое характеризуется минимальной энергией. Поэтому электроны заполняют орбитали в порядке увеличения их энергии.
Правило Клечковского: Электроны заполняют энергетические подуровни в порядке увеличения их энергии, который определяется значением суммы главного и побочного квантовых чисел (n + l): 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d.
Правила Гунда: На одном подуровне электроны располагаются так, чтобы абсолютное значение суммы спиновых квантовых чисел (суммарного спина) было максимальным. Это соответствует устойчивому состоянию атома.
Составьте электронно-графические формулы магния, железа и теллура:
Исключения составляют атомы хрома и меди, в которых происходит проскок (переход) одного электрона с 4s-подуровня на 3d-подуровень, что объясняется большой устойчивостью образующихся при этом электронных конфигураций 3d 5 и 3d 10 . Составьте электронно-графические формулы атомов хрома и меди:
Для характеристики электронного строения атома можно использовать схемы электронного строения, электронные и электронно-графические формулы.
Используя вышеперечисленные схемы и формулы, покажите строение атома серы:
ТЕСТ НА ТЕМУ «СТРОЕНИЕ ЭЛЕКТРОННОЙ ОБОЛОЧКИ АТОМА»
1. Элемент, невозбужденный атом которого не содержит неспаренных электронов, - это
| А) магний | Б) углерод | В) сера | Г) цинк |
2. Электронная конфигурация иона Cl + в основном электронном состоянии (этот ион образуется при действии ультрафиолетового излучения на сильно нагретый хлор) имеет вид:
| А) [Ne] 3s 2 3p 5 | Б) [Ne] 3s 1 3p 6 | В) [Ne] 3s 2 3p 4 | Г) [Ne] 3s 2 3p 6 |
3. Элементу второго периода для завершения внешнего уровня не хватает трех электронов. Этот элемент
| А) бор | Б) углерод | В) азот | Г) фосфор |
4. Формула высшего оксида некоторого элемента – ЭО3. Какую конфигурацию валентных электронов может иметь этот элемент в основном состоянии?
| А) 4d 6 | Б) 2s 2 2p 4 | В) 3s 2 3p 4 | Г) 3s 1 3d 5 |
5. Чему равно орбитальное квантовое число 3р электрона?
| А) 1 | Б) 3 | В) 0 | Г) +1/2 |
6. Число неспаренных электронов в атоме хрома в невозбужденном состоянии равно:
| А) 1 | Б) 4 | В) 5 | Г) 6 |
7. Электронную конфигурацию внешнего электронного слоя 3s 2 3p 6 имеют соответственно атом и ионы:
| А) Ar, Cl - , S -2 | Б) Kr, K + , Ca +2 | В) Ne, Cl - , Ca +2 | Г) Ar, Cl - , Ca +2 |
8. Число d-электронов у атома серы в максимально возбужденном состоянии равно:
| А) 1 | Б) 2 | В) 4 | Г) 6 |
9. Распределение электронов в нормальном состоянии в атоме хрома по энергетическим уровням соответствует ряду цифр:
| А) 2,8,12,2 | Б) 2,8,8,6 | В) 2,8,13,1 | Г) 2,8,14,0 |
10. Ионы О -2 и К + имеют соответственно следующие электронные формулы:
| А) 1s 2 2s 2 2p 4 | Б) 1s 2 2s 2 2p 6 | В)1s 2 2s 2 2p 6 3s 2 3p 6 4s 0 | Г)1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 |
| А,Г | В | В | В | А | Г | А,Г | Б | В | Б,В |
ЗАДАЧИ НА ОПРЕДЕЛЕНИЕ ФОРМУЛЫ ВЕЩЕСТВА ПО ПРОДУКТАМ СГОРАНИЯ
1. При полном сгорании 0,88 г вещества образовалось 0,51 г углекислого газа и 1,49 г сернистого газа. Определить простейшую формулу вещества. (CS2)
2. Установить истинную формулу органического вещества, если известно, что при сжигании 4,6 г его было получено 8,8 г углекислого газа и 5,4 г воды. Плотность паров этого вещества по водороду равна 23. (С2Н6О)
3. При полном сгорании 12,3 г органического вещества образовалось 26,4 г углекислого газа, 4,5 г воды и выделилось 1,4 г азота. Определить молекулярную формулу вещества, если его молярная масса в 3,844 раза больше молярной массы кислорода. (C6H5NO2)
4. При сгорании 20 мл горючего газа расходуется 50 мл кислорода, а получается 40 мл углекислого газа и 20 мл водяных паров. Определить формулу газа. (C2H2)
5. При сжигании 5,4 г неизвестного вещества в кислороде образовалось 2,8 г азота, 8,8 г углекислого газа и 1,8 г воды. Установите формулу вещества, если известно, что оно легче воздуха. (HCN)
6. При сжигании 3,4 г неизвестного вещества в кислороде образовалось 2,8 г азота и 5,4 г воды. Установить формулу вещества, если известно, что оно легче воздуха. (NH3)
7. При сжигании 1,7 г неизвестного вещества в кислороде образовалось 3,2 г сернистого газа и 0,9 г воды. Установить формулу вещества, если известно, что оно легче аргона. (H2S)
8. Образец вещества массой 2,96 г в реакции с избытком бария при комнатной температуре дает 489 мл водорода (Т=298°К, давление нормальное). При сожжении 55,5 мг того же вещества получили 99 мг углекислого газа и 40,5 мг воды. При полном испарении образца этого вещества массой 1,85 г его пары занимают объем 0,97 л при 473°К и 101,3 кПа. Определить вещество, привести структурные формулы двух его изомеров, отвечающих условиям задачи. (С3Н6О2)
9. При сгорании 2,3 г вещества образовалось 4,4 г углекислого газа и 2,7 г воды. Плотность паров этого вещества по воздуху равна 1,59. Определить молекулярную формулу вещества. (С2Н6О)
10. Определить молекулярную формулу вещества, если известно, что 1,3 г его при сгорании образует 2,24 л углекислого газа и 0,9 г паров воды. Масса 1 мл этого вещества при н.у. равна 0,00116 г. (C2H2)
11. При сжигании одного моля простого вещества образовалось 1,344 м 3 (н.у.) газа, который в 11 раз тяжелее гелия. Установить формулу сжигаемого вещества. (С60)
12. При сжигании 112 мл газа было получено 448 мл углекислого газа (н.у.) и 0,45 г воды. Плотность газа по водороду составляет 29. Найти молекулярную формулу газа. (С4Н10)
13. При полном сгорании 3,1 г органического вещества образовалось 8,8 г углекислого газа, 2,1 г воды и 0,47 г азота. Найти молекулярную формулу вещества, если масса 1 л паров его при н.у. составляет 4,15 г. (C6H7N)
14. При сгорании 1,44 г органического вещества образовалось 1,792 л углекислого газа и 1,44 г воды. Установите формулу вещества, если его относительная плотность по воздуху составляет 2,483. (С4Н8О)
15. При полном окислении 1,51 г гуанина образуется 1,12 л углекислого газа, 0,45 г воды и 0,56 л азота. Вывести молекулярную формулу гуанина. (C5H5N5O)
16. При полном окислении органического вещества массой 0,81 г образуется 0,336 л углекислого газа, 0,53 г карбоната натрия и 0,18 г воды. Установить молекулярную формулу вещества. (C4H4O4Na2)
17. При полном окислении 2,8 г органического вещества образовалось 4,48 л углекислого газа и 3,6 г воды. Относительная плотность вещества по воздуху 1,931. Установить молекулярную формулу данного вещества. Какой объем 20% раствора гидроксида натрия (плотность 1,219 г/мл) необходим для поглощения выделившегося при сгорании углекислого газа? Какова массовая доля карбоната натрия в полученном растворе? (С4Н8; 65,6 мл; 23,9%)
18. При полном окислении 2,24 г органического вещества образуется 1,792 л углекислого газа, 0,72 г воды и 0,448 л азота. Вывести молекулярную формулу вещества. (C4H4N2O2)
19. При полном окислении органического вещества массой 2,48 г образуется 2,016 л углекислого газа, 1,06 г карбоната натрия и 1,62 г воды. Установить молекулярную формулу вещества. (C5H9O2Na)
Читайте также:
