Этиленгликоль совместимость с металлами
Обновлено: 04.05.2024
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
| Атом кислорода в спиртах находится в состоянии sp 3 -гибридизации. |
В образовании химических связей с атомами C и H участвуют две 2sp 3 -гибридные орбитали, а еще две 2sp 3 -гибридные орбитали заняты неподеленными электронными парами атома кислорода.
Поэтому валентный угол C–О–H близок к тетраэдрическому и составляет почти 108 о .
Водородные связи и физические свойства спиртов
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Поэтому этиленгликоль – жидкость с относительно высокой температурой кипения.
Водородные связи образуются не только между молекулами спиртов, но и между молекулами спиртов и воды. Поэтому спирты очень хорошо растворимы в воде. Молекулы спиртов в воде гидратируются:
| Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Химические свойства этиленгликоля
Спирты – органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
1. Кислотные свойства
| Спирты – неэлектролиты, в водном растворе не диссоциируют на ионы; кислотные свойства у них выражены слабее, чем у воды. |
1.1. Взаимодействие с раствором щелочей
При взаимодействии этиленгликоля с растворами щелочей реакция практически не идет, т. к. образующийся алкоголят почти полностью гидролизуется водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому этиленгликоль не взаимодействует с растворами щелочей.
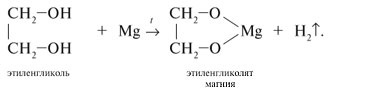
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Этиленгликоль взаимодействует с активными металлами (щелочными и щелочноземельными).
| Например, этиленгликоль взаимодействует с калием с образованием гликолята калия и водорода . |
Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии этиленгликоля с галогеноводородами группы ОН замещаются на галоген и образуются дигалогеналкан.
| Например, этиленгликоль реагирует с бромоводородом. |
2.2. Этерификация (образование сложных эфиров)
Многоатомные спирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры.
| Например, этиленгликоль реагирует с уксусной кислотой с образованием эфира: |

2.4. Взаимодействие с кислотами-гидроксидами
Этиленгликоль взаимодействует и с неорганическими кислотами, например, азотной или серной.
| Например, при взаимодействии этиленгликоля с азотной кислотой образуется нитроэтиленгликоль : |
3. Дегидратация
В присутствии концентрированной серной кислоты от спиртов отщепляется вода. При высокой температуре (180 о С) протекает внутримолекулярная дегидратация этиленгликоля и образуется соответствующий ацетальдегид.
4. Окисление этиленгликоля
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
4.1. Окисление оксидом меди (II)
Этиленгликоль можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества.

4.2. Окисление кислородом в присутствии катализатора
Этиленгликоль можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.).

4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) этиленгликоль окисляется до щавелевой кислоты.
| Например, при взаимодействии этиленгликоля с перманганатом калия в серной кислоте образуется щавелевая кислота |
4.4. Горение этиленгликоля
При сгорании этиленгликоля образуется углекислый газ и вода и выделяется большое количество теплоты.
5. Дегидрирование этаниленгликоля
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования.
| Например, при дегидрировании этиленгликоля образуется этандиаль |
Получение этиленгликоля
1. Щелочной гидролиз дигалогеналканов
При взаимодействии дигалогеналканов с водным раствором щелочей образуются двухатомные спирты. Атомы галогенов в дигалогеналканах замещаются на гидроксогруппы.
| Например, при нагревании 1,2-дихлорэтана с водным раствором гидроксида натрия образуется этиленгликоль |
2. Гидрирование карбонильных соединений
| Например, при гидрировании этандиаля образуется этиленгликоль |
О=CН-CH=O + 2H2 → CH2(OH)-CH2OH
3. Гидролиз сложных эфиров
При гидролизе сложных эфиров этиленгликоля и карбоновых кислот образуются этиленгликоль и карбоновая кислота.
4. Мягкое окисление алкенов
Мягкое окисление протекает при низкой температуре в присутствии перманганата калия. При этом раствор перманганата обесцвечивается.
В молекуле алкена разрывается только π-связь и окисляется каждый атом углерода при двойной связи.
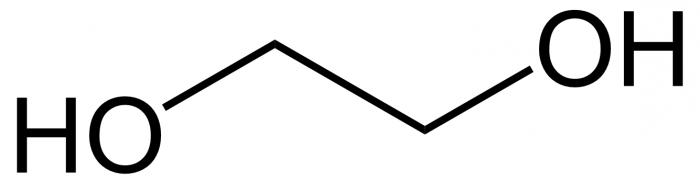
Строение этиленгликоля
Формула этиленгликоля
Этиленгликоль (этан-1,2-диол ) – сложное кислородсодержащее органическое соединение, двухатомный спирт.
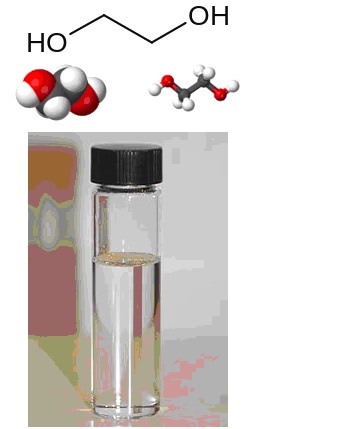
Химическая формула –
Молярная масса равна г/моль.
Физические свойства – это сиропообразная структура без цвета и запаха, сладкая на вкус.
По мнению большинства исторических источников, французский химик Вюрц первоначально получил этиленгликоль в 1856. Он обрабатывал йодистый этилен ацетатом серебра, а затем гидролизовал полученный «Этилен диацетат» гидроксидом калия. Вюрц назвал это новое соединение «гликоль», потому что ему присущи качества как этанола (с одной гидроксильной группой) так и и глицерина (с тремя гидроксильными группами).
Химические свойства этиленгликоля
- Этиленгликоль реагирует с различными щелочными и щелочно-земельными металлами:
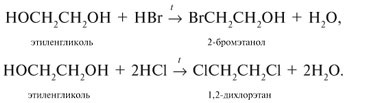
Получение
Этиленгликоль производят из этилена через промежуточное образование этиленоксида. Этиленоксид реагирует с водой с образованием этиленгликоля согласно химическому уравнению:
![\[ C_2H_4O + H_2O \rightarrow HO-CH_2CH_2-OH \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-8721947d8044c86fadb059177ae600c9_l3.png)
Качественная реакция
Качественной реакцией является взаимодействие спирта со свежеосажденным . Наблюдается растворение осадка и окрашивание раствора в насыщенно синий цвет — в результате образования гликолята меди (II).
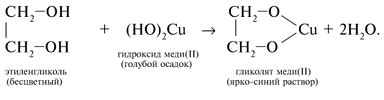
Применение
Этиленгликоль в основном используется в составе антифризов , а также в качестве сырья при производстве сложных полиэфиров, таких как полиэтилентерефталат (ПЭТ) .
Примеры решения задач
| Задание | Сколько щавелевой кислоты можно получить из 6,2 г этиленгликоля? |
| Решение | Рассмотрим химическую реакцию получения щавелевой кислоты из двухатомного спирта этиленгликоля: |
Из стехиометрии следует, что
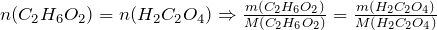
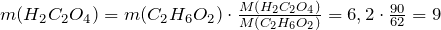
г
| Задание | Какова энтальпия испарения этиленгликоля, если давление его паров при равно мм.рт.ст., а при равно мм.рт.ст.? |
| Решение | Вычислим среднюю энтальпию испарения в данном интервале температур по уравнению Клаузиуса-Клайперона: |
![\[ \ln \frac{P_2}{P_1} = \frac{\Delta H \cdot (T_2 - T_1)}{R \cdot T_1 \cdot T_2} \Rightarrow \Delta H = \frac{R \cdot T_1 \cdot T_2 \cdot \ln \frac{P_2}{P_1}}{T_2 - T_1} \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-9143b44f52e38a1901ff0fab780a943f_l3.png)
— давление, — температура
Дж/моль — газовая постоянная
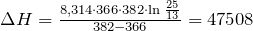
Дж/моль кДж/моль
Химические свойства этиленгликоля, характеристика. Двухатомный спирт. Эфиры этиленгликоля
Самые известные и применяемые в жизни человека и в промышленности вещества, принадлежащие к категории многоатомных спиртов – это этиленгликоль и глицерин. Их исследование и использование началось несколько веков назад, но свойства этих органических соединений во многом неповторимы и уникальны, что делает их незаменимыми и по сей день. Многоатомные спирты используют во многих химических синтезах, отраслях промышленности и сферах человеческой жизнедеятельности.
Первое «знакомство» с этиленгликолем и глицерином: история получения
В 1859 году, посредством двухстадийного процесса взаимодействия дибромэтана с ацетатом серебра и последующей обработки едким кали полученного в первой реакции этиленгликольдиацетата, Шарль Вюрц впервые синтезировал этиленгликоль. Некоторое время спустя был разработан метод прямого гидролиза дибромэтана, но в промышленных масштабах в начале двадцатого века двухатомный спирт 1,2-диоксиэтан, он же – моноэтиленгликоль, или просто гликоль, в США получали посредством гидролиза этиленхлоргидрина.
На сегодняшний день и в промышленности, и в лаборатории применяют ряд других методов, новых, более экономичных с сырьевой и энергетической точек зрения, и экологичных, так как применение реагентов, содержащих или выделяющих хлор, токсины, канцерогены и другие опасные для окружающей среды и человека вещества, сокращается по мере развития «зелёной» химии.

Аптекарем Карлом Вильгельмом Шееле в 1779 году был открыт глицерин, а особенности состава соединения изучил в 1836 году Теофиль Жуль Пелуз. Двумя десятилетиями позже было установлено и обосновано строение молекулы данного трёхатомного спирта в трудах Пьера Эжена Марселея Вертело и Шарля Вюрца. Наконец, ещё двадцать лет спустя Шарль Фридель провёл полный синтез глицерина. В настоящее время промышленность использует два метода его получения: через хлористый аллил из пропилена, а также через акролеин. Химические свойства этиленгиликоля, как и глицерина, широко используют в различных сферах химического производства.
Строение и структура соединения
В основе молекулы лежит непредельный углеводородный скелет этилена, состоящий из двух атомов карбона, в котором произошёл разрыв двойной связи. На освободившиеся валентные места у атомов углерода присоединились две гидроксильные группы. Формула этилена – С2Н4, после разрыва кранной связи и присоединения гидроксильных групп (через несколько стадий) она выглядит как С2Н4(ОН)2. Это и есть этиленгликоль.
Молекуле этилена присуща линейная структура, в то время как двухатомный спирт имеет некое подобие транс-конфигурции в размещении гидроксильных групп по отношению к углеродному остову и друг к другу (в полной мере этот термин применим к положению относительно кратной связи). Такая дислокация соответствует самому удаленному расположению водородов из функциональных групп, меньшей энергии, а значит – максимальной устойчивости системы. Попросту говоря, одна ОН-группа «смотрит» вверх, а другая - вниз. В то же время неустойчивыми являются соединения с двумя гидроксилами: при одном атоме карбона, образуясь в реакционной смеси, они тут же дегидратируются, переходя в альдегиды.
Классификационная принадлежность
Химические свойства этиленгликоля определяются его происхождением из группы многоатомных спиртов, а именно подгруппы диолов, то есть соединений с двумя гидроксильными фрагментами у соседних атомов карбона. Веществом, также содержащим несколько ОН-заместителей, является и глицерин. Он имеет три спиртовых функциональных группы и является самым распространённым представителем своего подкласса.
Многие соединения этого класса также получают и используют в химическом производстве для различных синтезов и прочих целей, но применение этиленгликоля имеет более серьёзные масштабы и задействовано практически во всех отраслях промышленности. Этот вопрос будет рассмотрен ниже более подробно.
Физические характеристики
Применение этиленгликоля объясняется наличием ряда свойств, которые присущи многоатомным спиртам. Это отличительные черты, характерные только для данного класса органических соединений.
Самое важно из свойств – это неограниченная способность смешиваться с Н2О. Вода + этиленгликоль даёт раствор, обладающий уникальной характеристикой: температура его замерзания, в зависимости от концентрации диола, ниже на 70 градусов, чем у чистого дистиллята. Важно отметить, что зависимость эта нелинейная, и по достижении определённого количественного содержания гликоля начинается обратный эффект – температура замерзания повышается при увеличении процентного содержания растворяемого вещества. Эта особенность нашла применение в области производства различных антифризов, жидкостей «незамерзаек», которые кристаллизуются при крайне низких термических характеристиках окружающей среды.
Кроме как в воде, процесс растворения отлично протекает в спирте и ацетоне, но не наблюдается в парафинах, бензолах, эфирах и тетрахлорметане. В отличие от своего алифатического родоначальника - такого газообразного вещества, как этилен, этиленгликоль – это сиропоподобная,прозрачная, с незначительным желтым оттенком жидкость, сладковатая по вкусу, с нехарактерным запахом, практически нелетучая. Замерзание стопроцентного этиленгликоля происходит при - 12,6 градусах Цельсия, а кипение – при +197,8. В нормальных условиях плотность составляет 1,11 г/см 3 .
Методы получения
Этиленгликоль можно получить несколькими способами, некоторые из них сегодня имеют лишь историческое или препаративное значение, а другие активно используются человеком в промышленных масштабах и не только. Следуя в хронологическом порядке, рассмотрим самые важные.

Выше уже был описан первый метод получения этиленгликоля из дибромэтана. Формула этилена, двойная связь которого разорвана, а свободные валентности заняты галогенами, - главного исходного вещества в данной реакции - помимо углерода и водорода имеет в своём составе два атома брома. Образование промежуточного соединения на первой ступени процесса возможно как раз благодаря их отщеплению, т. е. замещению ацетатными группами, которые при дальнейшем гидролизе превращаются в спиртовые.
В процессе дальнейшего развития науки стало возможным получение этиленгликоля прямым гидролизом любых этанов, замещенных двумя галогенами у соседних атомов карбона, с помощью водных растворов карбонатов металлов из щелочной группы или (менее экологичный реагент) Н2О и диоксида свинца. Реакция довольно «трудоёмкая» и протекает лишь при значительно повышенных температурах и давлении, но это не помешало немцам в периоды мировых войн использовать этот метод для производства этиленгликоля в промышленных масштабах.
Свою роль в становлении органической химии сыграл и способ получения этиленгликоля из этиленхлоргидрина путём его гидролиза угольными солями металлов щелочной группы. При повышении температуры реакции до 170 градусов выход целевого продукта достигал 90 %. Но был значительный недостаток – гликоль нужно было как-то извлекать из раствора соли, что непосредственно сопряжено с рядом трудностей. Учёные решили этот вопрос, разработав метод с тем же исходным веществом, но разбив процесс на две стадии.
Гидролиз этиленгликольацетатов, являясь ранее завершающей стадией метода Вюрца, стал отдельным способом, когда сумели получить исходный реагент окислением этилена в уксусной кислоте кислородом, то есть без применения дорогих и совсем неэкологичных соединений галогенов.
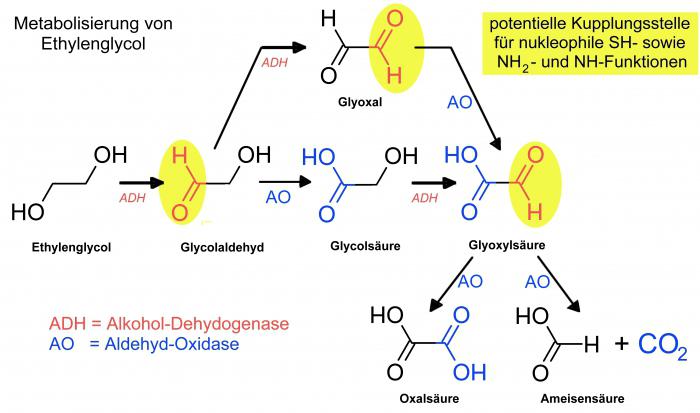
Известно также много способов производства этиленгликоля путём окисления этилена гидроперекисями, перекисями, органическими надкислотами в присутствии катализаторов (соединений осмия), хлоратом калия и др. Также существуют электрохимические и радиационно-химические методы.
Характеристика общих химических свойств
Химические свойства этиленгликоля определяются его функциональными группами. В реакциях может принимать участие один гидроксильный заместитель или оба, в зависимости от условий процесса. Главное отличие в реакционной способности заключается в том, что за счёт наличия у многоатомного спирта нескольких гидроксилов и их взаимного влияния проявляются более сильные кислотные свойства, чем у одноатомных "собратьев". Поэтому в реакциях со щелочами продуктами являются соли (для гликоля – гликоляты, для глицерина – глицераты).
В химические свойства этиленгликоля, равно как и глицерина, входят все реакции спиртов из категории одноатомных. Гликоль даёт полные и неполные эфиры в реакциях с одноосновными кислотами, гликоляты, соответственно, образуются с щелочными металлами, а при химическом процессе с сильными кислотами или их солями выделяется альдегид уксусной кислоты - за счёт отщепления от молекулы атома водорода.

Реакции с активными металлами
Взаимодействие этиленгликоля с активными металлами (стоящими после водорода в химическом ряде напряженности) при повышенных температурах даёт этиленгликолят соответствующего металла, плюс выделяется водород.
Качественная реакция на этиленгликоль
Отличить многоатомный спирт от любой другой жидкости можно с помощью наглядной реакции, характерной только для данного класса соединений. Для этого к бесцветному раствору спирта вливают свежеосажденный гидроксид меди (2), имеющий характерный голубой оттенок. При взаимодействии смешанных компонентов наблюдается растворение осадка и окрашивание раствора в насыщенно синий цвет - в результате образования гликолята меди (2).
Полимеризация
Химические свойства этиленгликоля имеют большое значение для производства растворителей. Межмолекулярная дегидратация упомянутого вещества, то есть отщепление воды от каждой из двух молекул гликоля и их последующее объединение (одна гидроксильная группа отщепляется полностью, а от другой отходит только водород), даёт возможность получения уникального органического растворителя – диоксана, который часто используется в органической химии, несмотря на его высокую токсичность.
Обмен гидроксила на галоген
При взаимодействии этиленгликоля с галогеноводородными кислотами наблюдается замена гидроксильных групп соответствующим галогеном. Степень замещения зависит от мольной концентрации галогенводорода в реакционной смеси:
Получение эфиров
В реакциях этиленгликоля с азотной кислотой (определённой концентрации) и одноосновными органическими кислотами (муравьиной, уксусной, пропионовой, масленой, валерьяновой и т. д.) происходит образование сложных и, соответственно, простых моноэфиров. При других концентрация азотной кислоты – ди- и тринитроэфиров гликоля. В качестве катализатора используется серная кислота заданной концентрации.

Важнейшие производные этиленгликоля
Ценными веществами, которые можно получить из многоатомных спиртов с помощью несложных химических реакций (описанных выше), являются эфиры этиленгликоля. А именно: монометиловый и моноэтиловый, формулы которых - НО-СН2-СН2-О-СН3 и НО-СН2-СН2-О-С2Н5 соответственно. По химические свойства они во многом похожи на гликоли, но, так же, как и любой другой класс соединений, имеют уникальные реакционные особенности, присущие только им:
- Монометилэтиленгликоль представляет собой жидкость без цвета, но с характерным отвратным запахом, закипающую при 124,6 градусах Цельсия, отлично растворяющуюся в этаноле, других органических растворителях и воде, значительно более летучую, чем гликоль, и с плотностью, меньшей, чем у воды (порядка 0,965 г/см 3 ).
- Диметилэтиленгликоль – также жидкость, но с менее характерным запахом, плотностью 0,935 г/см 3 , температурой закипания 134 градуса выше ноля и растворимостью, сравнительной с предыдущим гомологом.
Применение целлозольвов - так в общем называют моноэфиры этиленгликоля - довольно распространено. Они используются в качестве реагентов и растворителей в органическом синтезе. Также применяются и их физические свойства для антикоррозийных и антикристаллизационных добавок в антифризы и моторные масла.
Области применения и ценовая политика продукционного ряда
Стоимость на заводах и предприятиях, занимающихся производством и продажей подобных реактивов, колеблется в среднем около 100 рублей за килограмм такого химического соединения, как этиленгликоль. Цена зависит от чистоты вещества и максимального процентного содержания целевого продукта.

Применение этиленгликоля не ограничивается какой-то одной областью. Так, в качестве сырья его используют в производстве органических растворителей, искусственных смол и волокон, жидкостей, замерзающих при отрицательных температурах. Он задействован во многих промышленных отраслях, таких как автомобильная, авиационная, фармацевтическая, электротехническая, кожевенная, табачная. Неоспоримо весомо его значение для органического синтеза.
Важно помнить, что гликоль – это токсичное соединение, которое может нанести непоправимый вред здоровью человека. Поэтому его хранят в герметичных сосудах из алюминия или стали с обязательным внутренним слоем, защищающим ёмкость от коррозии, только в вертикальных положениях и помещениях, не снабженных отопительными системами, но с хорошей вентиляцией. Срок – не более пяти лет.
Антифриз на основе этиленгликоля: марки, различия, состав
Сегодня рынок антифризов для радиаторов автомобилей наполняют средства на основе этиленгликоля. Это вещество имеет ряд положительных качеств при эксплуатации. От правильного выбора средства для системы охлаждения зависит ее долговечность, а также работа двигателя.
Антифриз на основе этиленгликоля имеет низкую температуру замерзания, которая зависит от концентрации вещества. Жидкость внутри охлаждающей системы при этом начинает кристаллизироваться в интервале от 0 до -70ºС. При выборе качественного антифриза необходимо учитывать условия эксплуатации машины. В летний период он должен охлаждать двигатель максимально эффективно. Зимой жидкость не должна замерзать даже в сильные морозы.
Виды антифриза
Сегодня существует два основных типа антифриза – карбосиликатные и силикатные вещества. Второй тип применяется в автомобилях старого образца. Самым известным представителем этого класса средств является тосол. Силикатные антифризы имеют ряд недостатков, поэтому для иномарок их не используют.

Антифриз безсиликатный на основе этиленгликоля предпочтительнее для иностранных новых автомобилей. Присадки, которые входят в состав средства, в процессе работы автомобиля оседают исключительно на участках, где образуется коррозия. Это стало возможным благодаря включению в состав средства органических компонентов. В этом случае охлаждение двигателя происходит полноценно.
Силикатные разновидности, изготовленные на основе этиленгликоля, покрывают всю внутреннюю поверхность трубок неорганическими компонентами. Они эффективно предотвращают образование коррозии, но при этом снижают охлаждающую способность системы.
Состав антифриза
Антифризы на основе этиленгликоля имеют определенный состав. От этого зависят их основные характеристики. В чистом виде этиленгликоль выглядит как маслянистая субстанция. Его температура замерзания равна -13ºС, а кипения – +197ºС. Это вещество довольно плотное. Этиленгликоль – сильный пищевой яд. Это вещество токсично, особенно после выработки своего ресурса. Отходы антифризов на основе этиленгликоля, состав которых был загрязнен в процессе эксплуатации тяжелыми металлами, требуют правильной утилизации.

При смешивании его с водой температура замерзания может значительно снижаться (до -70ºС при соотношении воды и этиленгликоля 1:2). В качестве присадок могут применяться органические и неорганические компоненты. Первый вариант предпочтительнее. Ингибиторы коррозии сегодня бывают 4 типов: карбоксилатный, традиционный, органический и гибридный. Из-за разницы компонентов, входящих в состав антифриза, нельзя смешивать разные марки этих средств. В противном случае они будут конфликтовать между собой, снижая эффективность вещества.
Цвет антифриза
Изначально антифриз на основе этиленгликоля, цвет которого можно увидеть на производстве, выглядит как прозрачная субстанция. Он имеет только специфический запах. Независимо от марки антифриз не имеет цвета. Красители добавляют для идентификации его качества. Среди водителей и автомехаников бытует принятая ими классификация качества средства в зависимости от его цвета. Выделяется 3 группы антифризов.

- Класс G11 включает в себя голубые и зеленые средства. Это наиболее дешевые расходные материалы. В их состав входит этиленгликоль и силикатные присадки. Срок эксплуатации таких антифризов составляет около 30 тысяч км.
- К классу G12 относятся красный и розовый тип веществ. Они характеризуются более высоким качеством. В их состав входят этиленгликоль и органические присадки. Срок эксплуатации таких средств может достигать 150-200 тысяч км. Однако и стоимость их значительно выше.
- Существует и третий класс – G13. В его состав, помимо перечисленных в предыдущем разделе компонентов, входит пропиленгликоль. Окраска подобных средств чаще всего характеризуется оранжевыми и желтыми оттенками.
Система маркировки
Каждый антифриз на основе этиленгликоля для алюминиевых радиаторов, а также нагруженных систем охлаждения имеет в своем составе красители. Они никак не влияют на технические характеристики вещества. Выбор того или иного цвета зависит от прихоти производителя. Общепринятого стандарта маркировки, как и добавления красителей, не существует.

Представленные выше маркировки, которые чаще всего принимают во внимание водители и автомеханики, применялись раньше при выпуске антифризов VW coolant германского производства. Эти средства пользуются большой популярностью. Однако даже сам концерн Volkswagen уже изменил свои спецификации. Сегодня этот известный производитель изготавливает 3 основных класса антифризов на органической основе. Их маркировка имеет приставку G12++, G12+++ и G13. Поэтому перед покупкой средства для охладительной системы правильнее обращать внимание на рекомендации производителя автотехники, а также состав самого расходного материала. Единой маркировки для всех антифризов не существует.
Основные свойства антифризов
В процессе своей эксплуатации антифризы проявляют целый набор качеств. Их регламентируют нормы и допуски производителей автомобилей. Следует отметить, что этиленгликоль является токсичным веществом. При выработке его ресурса этот показатель увеличивается. Существуют правила, как утилизировать отходы антифризов основе этиленгликоля. Им приписывают различные негативные свойства. Поэтому при замене антифриза необходимо обращаться к специальной организации, которая выполнит утилизацию правильно.
Важно также учитывать вспениваемость антифризов. Для средств отечественного производства этот показатель составляет 30 см³, а для импортных – 150 см³. Смачиваемость у антифризов в 2 раза больше, чем у воды. Поэтому они способны просачиваться даже в очень тонкие трещины. Этим объясняется их способность вытекать наружу даже при наличии микротрещин.
Обзор популярных марок
В нашей стране применяют различные марки антифриза на основе этиленгликоля. К самым популярным относятся «Феликс», «Аляска», «Синтек», Long Life, Nord. Они характеризуются оптимальным соотношением цены и качества.

Представленные антифризы предназначены для суровых условий нашего климата. Также разработанная линейка средств позволяет водителю подобрать требуемое средство для двигателя своего автомобиля. Представленные средства эффективно противостоят образованию коррозии, а также обеспечивают хорошие охлаждающие свойства радиатора.
Популярные сегодня в нашей стране продукты эффективно защищают системы двигателя от образования отложений, особенно в водяном насосе, моторном отсеке и подводящих каналах.
Отзывы об антифризе «Синтек» G12
Рассматривая варианты, какой антифриз на основе этиленгликоля выбрать для своего автомобиля, в первую очередь необходимо обратить внимание на такое средство, как «Синтек» G12. В состав этого расходного материала входит комплекс органических добавок. Это средство предназначено для алюминиевых моторов, а также других разновидностей двигателей.

Температура кристаллизации антифриза составляет -41ºС. «АвтоВАЗ» применяет представленное средство в качестве первой заливки в систему охлаждения. Оно имеет широкий спектр рабочих температур. Относительно невысокая цена также делает средство популярным.
Отзывы об антифризе «Феликс»
Представленный антифриз широко применяется как в легковых, так и в грузовых автомобилях. Причем это справедливо даже для машин с форсированным, нагруженным движком, турбонаддувом. Этот антифриз на основе этиленгликоля применяется в условиях значительных колебаний температуры окружающей среды. Система защиты от коррозии действует выборочно. Она воздействует только на те участки, на которых определяются следы ржавчины.
Стоимость представленного продукта также относительно невелика. Многофункциональность и широкий спектр применения делают антифриз «Феликс» популярным. Однако температура его кристаллизации немного выше, чем допустимый техрегламентом уровень.
Отзывы об антифризе Totachi Long Life
Производителем Totachi Long Life является японская компания. Представленный ею продукт предназначен для систем охлаждения практически всех бензиновых или дизельных моторов. В состав средства входят органические компоненты. Рабочие температуры, при которых допускается эксплуатировать представленный расходный материал, соответствуют техрегламенту производителей транспортных средств. Преимуществом антифриза японского производства является длительный срок эксплуатации. Его замену проводят раз в 5 лет. Представленный антифриз на основе этиленгликоля продлевает срок службы всех элементов системы охлаждения.

Некоторые пользователи отмечают, что надписи на канистре нанесены только на английском и японском языках. Это вызывает определенный дискомфорт.
Рассмотрев состав, основные характеристики, которыми обладает антифриз на основе этиленгликоля, можно подобрать лучший вариант для своего двигателя. Учтя отзывы пользователей и экспертов о самых популярных марках расходных материалов, приобрести качественный продукт не составит труда.
Читайте также:


