Физические и химические свойства металлов
Обновлено: 04.10.2024
Благодаря наличию свободных электронов (“электронного газа”) в кристаллической решетке все металлы проявляют следующие характерные общие свойства:
1) Пластичность – способность легко менять форму, вытягиваться в проволоку, прокатываться в тонкие листы.
2) Металлический блеск и непрозрачность. Это связано со взаимодействием свободных электронов с падающими на металл светом.
3) Электропроводность. Объясняется направленным движением свободных электронов от отрицательного полюса к положительному под влиянием небольшой разности потенциалов. При нагревании электропроводность уменьшается, т.к. с повышением температуры усиливаются колебания атомов и ионов в узлах кристаллической решетки, что затрудняет направленное движение “электронного газа”.
4) Теплопроводность. Обусловлена высокой подвижностью свободных электронов, благодаря чему происходит быстрое выравнивание температуры по массе металла. Наибольшая теплопроводность – у висмута и ртути.
5) Твердость. Самый твердый – хром (режет стекло); самые мягкие – щелочные металлы – калий, натрий, рубидий и цезий – режутся ножом.
6) Плотность. Она тем меньше, чем меньше атомная масса металла и больше радиус атома. Самый легкий – литий (ρ=0,53 г/см3); самый тяжелый – осмий (ρ=22,6 г/см3). Металлы, имеющие плотность менее 5 г/см3 считаются “легкими металлами”.
7) Температуры плавления и кипения. Самый легкоплавкий металл – ртуть (т.пл. = -39°C), самый тугоплавкий металл – вольфрам (t°пл. = 3390°C). Металлы с t°пл. выше 1000°C считаются тугоплавкими, ниже – низкоплавкими.
Общие химические свойства металлов
Сильные восстановители: Me 0 – nē → Me n +
Ряд напряжений характеризует сравнительную активность металлов в окислительно-восстановительных реакциях в водных растворах.
1. Реакции металлов с неметаллами
1) С кислородом:
2Mg + O2 → 2MgO
2) С серой:
Hg + S → HgS
3) С галогенами:
Ni + Cl2 – t° → NiCl2
6) С водородом (реагируют только щелочные и щелочноземельные металлы):
2Li + H2 → 2LiH
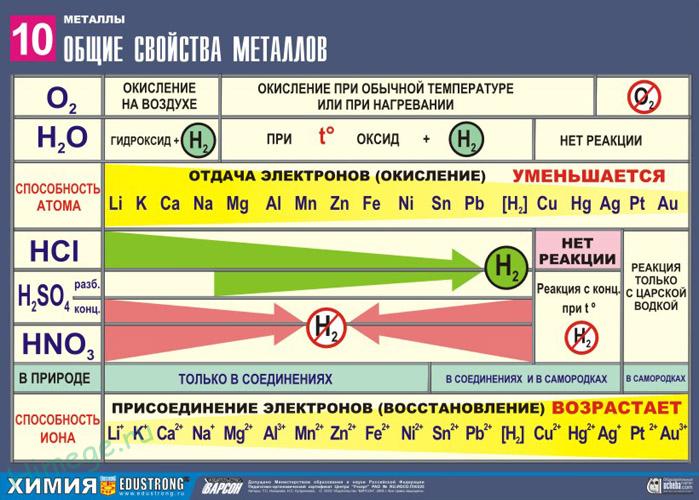
2. Реакции металлов с кислотами
1) Металлы, стоящие в электрохимическом ряду напряжений до H восстанавливают кислоты-неокислители до водорода:
2) С кислотами-окислителями:
При взаимодействии азотной кислоты любой концентрации и концентрированной серной с металлами водород никогда не выделяется!
3. Взаимодействие металлов с водой
1) Активные (щелочные и щелочноземельные металлы) образуют растворимое основание (щелочь) и водород:
2) Металлы средней активности окисляются водой при нагревании до оксида:
3) Неактивные (Au, Ag, Pt) – не реагируют.
4. Вытеснение более активными металлами менее активных металлов из растворов их солей:
В промышленности часто используют не чистые металлы, а их смеси — сплавы, в которых полезные свойства одного металла дополняются полезными свойствами другого. Так, медь обладает невысокой твердостью и малопригодна для изготовления деталей машин, сплавы же меди с цинком (латунь) являются уже достаточно твердыми и широко используются в машиностроении. Алюминий обладает высокой пластичностью и достаточной легкостью (малой плотностью), но слишком мягок. На его основе готовят сплав с магнием, медью и марганцем – дуралюмин (дюраль), который, не теряя полезных свойств алюминия, приобретает высокую твердость и становится пригодным в авиастроении. Сплавы железа с углеродом (и добавками других металлов) – это широко известные чугун и сталь.
Металлы в свободном виде являются восстановителями. Однако реакционная способность некоторых металлов невелика из-за того, что они покрыты поверхностной оксидной пленкой, в разной степени устойчивой к действию таких химических реактивов, как вода, растворы кислот и щелочей.
Например, свинец всегда покрыт оксидной пленкой, для его перехода в раствор требуется не только воздействие реактива (например, разбавленной азотной кислоты), но и нагревание. Оксидная пленка на алюминии препятствует его реакции с водой, но под действием кислот и щелочей разрушается. Рыхлая оксидная пленка (ржавчина), образующаяся на поверхности железа во влажном воздухе, не мешает дальнейшему окислению железа.
Под действием концентрированных кислот на металлах образуется устойчивая оксидная пленка. Это явление называется пассивацией. Так, в концентрированной серной кислоте пассивируются (и после этого не реагируют с кислотой) такие металлы, как Ве, Вi, Со, Fе, Мg и Nb, а в концентрированной азотной кислоте – металлы А1, Ве, Вi, Со, Сг, Fе, Nb, Ni, РЬ, Тh и U.
При взаимодействии с окислителями в кислых растворах большинство металлов переходит в катионы, заряд которых определяется устойчивой степенью окисления данного элемента в соединениях (Nа + , Са 2+ ,А1 3+ ,Fе 2+ и Fе 3+ )
Восстановительная активность металлов в кислом растворе передается рядом напряжений. Большинство металлов переводится в раствор соляной и разбавленной серной кислотами, но Сu, Аg и Нg – только серной (концентрированной) и азотной кислотами, а Рt и Аи – «царской водкой».
Коррозия металлов
Нежелательным химическим свойством металлов является их коррозия, т. е. активное разрушение (окисление) при контакте с водой и под воздействием растворенного в ней кислорода (кислородная коррозия). Например, широко известна коррозия железных изделий в воде, в результате чего образуется ржавчина, и изделия рассыпаются в порошок.
Коррозия металлов протекает в воде также из-за присутствия растворенных газов СО2 и SО2; создается кислотная среда, и катионы Н + вытесняются активными металлами в виде водорода Н2 (водородная коррозия).
Особенно коррозионно-опасным может быть место контакта двух разнородных металлов (контактная коррозия). Между одним металлом, например Fе, и другим металлом, например Sn или Сu, помещенными в воду, возникает гальваническая пара. Поток электронов идет от более активного металла, стоящего левее в ряду напряжений (Ре), к менее активному металлу (Sn, Сu), и более активный металл разрушается (корродирует).
Именно из-за этого ржавеет луженая поверхность консервных банок (железо, покрытое оловом) при хранении во влажной атмосфере и небрежном обращении с ними (железо быстро разрушается после появления хотя бы небольшой царапины, допускающей контакт железа с влагой). Напротив, оцинкованная поверхность железного ведра долго не ржавеет, поскольку даже при наличии царапин корродирует не железо, а цинк (более активный металл, чем железо).
Сопротивление коррозии для данного металла усиливается при его покрытии более активным металлом или при их сплавлении; так, покрытие железа хромом или изготовление сплава железа с хромом устраняет коррозию железа. Хромированное железо и сталь, содержащая хром (нержавеющая сталь), имеют высокую коррозионную стойкость.
Физические и химические свойства металлов
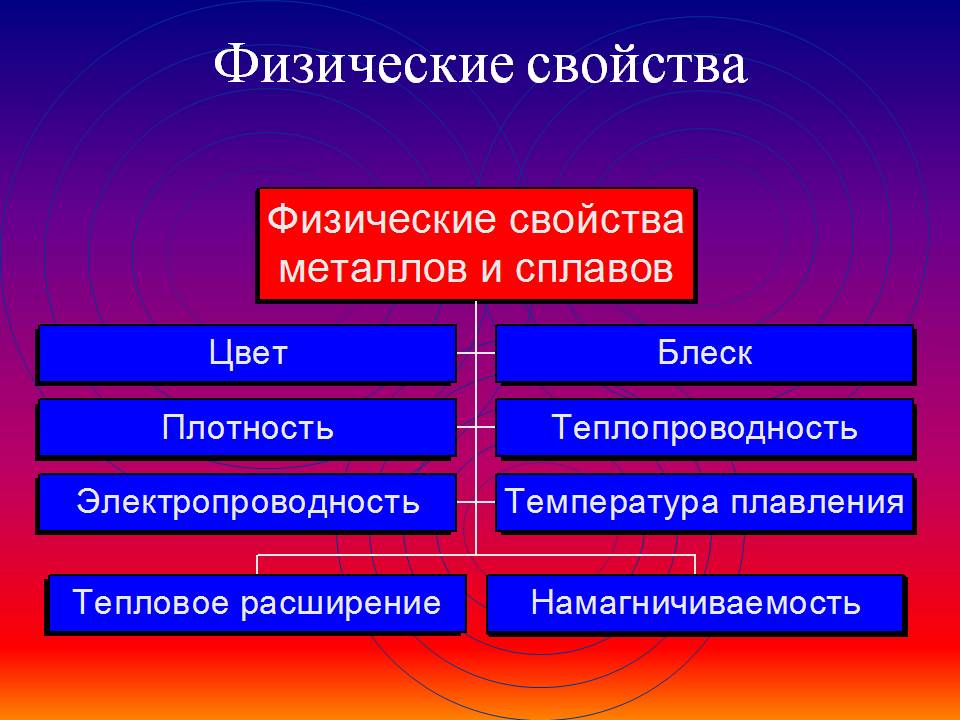
Различают технологические, физические, механические и химические свойства металлов. К физическим относят удельный вес, цвет, электропроводность. К характеристикам этой группы относятся также теплопроводность, плавкость и плотность металла.
К механическим характеристикам относят пластичность, упругость, твердость, прочность, вязкость.
Химические свойства металлов включают в себя коррозийную стойкость, растворимость и окисляемость.
Такие характеристики, как «жидкотекучесть», прокаливаемость, свариваемость, ковкость, являются технологическими.
Физические свойства
- Цвет. Металлы не пропускают свет сквозь себя, то есть непрозрачны. В отраженном свете каждый элемент обладает своим собственным оттенком – цветом. Среди технических металлов окраску имеет только медь и сплавы с ней. Для остальных элементов характерным является оттенок от серебристо-белого до серо-стального.
- Плавкость. Эта характеристика указывает на способность элемента под воздействием температуры переходить в жидкое состояние из твердого. Плавкость считается важнейшим свойством металлов. В процессе нагревания все металлы из твердого состояния переходят в жидкое. При охлаждении же расплавленного вещества происходит обратный переход – из жидкого в твердое состояние.
- Электропроводность. Данная характеристика свидетельствует о способности переноса свободными электронами электричества. Электропроводность металлических тел в тысячи раз больше, чем неметаллических. При увеличении температуры показатель проводимости электричества снижается, а при уменьшении температуры, соответственно, повышается. Необходимо отметить, что электропроводность сплавов будет всегда ниже, нежели какого-либо металла, составляющего сплав.
- Магнитные свойства. К явно магнитным (ферромагнитным) элементам относят только кобальт, никель, железо, а также ряд их сплавов. Однако в процессе нагревания до определенной температуры указанные вещества теряют магнитность. Отдельные сплавы железа при комнатной температуре не относятся к ферромагнитным.
- Теплопроводность. Эта характеристика указывает на способность перехода тепла к менее нагретому от более нагретого тела без видимого перемещения составляющих его частиц. Высокий уровень теплопроводности позволяет равномерно и быстро нагревать и охлаждать металлы. Среди технических элементов наибольшим показателем обладает медь.
Металлы в химии занимают отдельное место. Наличие соответствующих характеристик позволяет применять то или иное вещество в определенной области.
Химические свойства металлов
- Коррозийная стойкость. Коррозией называют разрушение вещества в результате электрохимического или химического взаимоотношения с окружающей средой. Самым распространенным примером считается ржавление железа. Коррозийная стойкость относится к важнейшим природным характеристикам ряда металлов. В связи с этим такие вещества, как серебро, золото, платина получили название благородных. Обладает высокой коррозийной сопротивляемостью никель и прочие цветные металлы. Черные металлы подвержены разрушению быстрее и сильнее, нежели цветные.
- Окисляемость. Эта характеристика указывает на способность элемента вступать в реакцию с О2 под влиянием окислителей.
- Растворимость. Металлы, обладающие в жидком состоянии неограниченной растворимостью, при затвердении могут формировать твердые растворы. В этих растворах атомы от одного компонента встраиваются в кристаллическую решетку другого составляющего только в определенных пределах.
Необходимо отметить, что физические и химические свойства металлов являются одними из основных характеристик этих элементов.
Металлы (от лат. «metallum» — шахта, рудник) — группа элементов, в виде простых веществ, обладающих характерными металлическими свойствами, такими, как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность и металлический блеск.
Металлы широко распространены в природе и могут встречаться в различном виде: в самородном состоянии (Ag, Au, Rt, Cu), в виде оксидов (Fe3O4, Fe2O3, (NaK)2O×AlO3), солей (KCl, BaSO4, Ca3(PO4)2), а также сопутствуют различным минералам (Cd – цинковые руды, Nb, Tl – оловянные и т.д.).
Физические свойства металлов
Всем металлам присущи металлический блеск (однако In и Ag отражают свет лучше других металлов), твердость (самый твердый металл – Cr, самые мягкие металлы – щелочные), пластичность (в ряду Au, Ag, Cu, Sn, Pb, Zn, Fe наблюдается уменьшение пластичности), ковкость, плотность (самый легкий металл – Li, самый тяжелый – Os), тепло – и электропроводность, которые уменьшаются в ряду Ag, Cu, Au, Al, W, Fe.
В зависимости от температуры кипения все металлы подразделяют на тугоплавкие (Tкип > 1000 С) и легкоплавкие (Tкип < 1000 С). Примером тугоплавких металлов может быть – Au, Cu, Ni, W, легкоплавких – Hg, K, Al, Zn.
Среди металлов присутствуют s-, p-, d- и f-элементы. Так, s- элементы – это металлы I и II групп Периодической системы (ns 1 , ns 2 ), р- элементы – металлы, расположенные в группах III – VI (ns 2 np 1-4 ). Металлы d-элементы имеют большее число валентных электронов по сравнению с металлами s- и p-элементами. Общая электронная конфигурация валентных электронов металлов d-элементов – (n-1)d 1-10 ns 2 . Начиная с 6 периода появляются металлы f-элементы, которые объединены в семейства по 14 элементов (за счет сходных химических свойств) и носят особые названия лантаноидов и актиноидов. Общая электронная конфигурация валентных электронов металлов f-элементов – (n-2)f 1-14 (n-1)d 0-1 ns 2 .
Химические свойства металлов
Металлы способны реагировать с простыми веществами, такими как кислород (реакция горения), галогены, азот, сера, водород, фосфором и углеродом:
2Na + Cl2 = 2NaCl (хлорид натрия)
2K +S = K2S (сульфид калия)
2Na + H2 = NaH (гидрид натрия)
3Ca + 2P = Ca3P2 (фосфид кальция)
Металлы взаимодействуют друг с другом, образуя интерметаллические соединения:
Щелочные и некоторые щелочноземельные металлы (Ca, Sr, Ba) взаимодействуют с водой с образованием гидроксидов:
В ОВР металлы являются восстановителями – отдают валентные электроны и превращаются в катионы. Восстановительная способность металла — его положение в электрохимическом ряду напряжений металлов. Так, чем левее в ряду напряжений стоит металл, тем более сильные восстановительные свойства он проявляет.
Металлы, стоящие в ряду активности до водорода способны реагировать с кислотами:
Получение металлов
Щелочные, щелочноземельные металлы и алюминий получают электролизом расплавов солей или оксидов этих элементов:
Тяжелые металлы получают восстановлением из руд при высоких температурах и в присутствии катализатора (пирометаллургия) (1) или восстановлением из солей в растворе (гидрометаллургия) (2):
Cu2O + C = 2Cu + CO (1)
Некоторые металлы получают термическим разложением их неустойчивых соединений:
Примеры решения задач
| Задание | При взаимодействии 6,0 г металла с водой выделилось 3,36 л водорода (н.у.). Определите этот металл, если он в своих соединениях двухвалентен. |
| Решение | Т.к. металл двухвалентен, его реакция с водой будет описываться уравнением, которое в общем виде будет выглядеть следующим образом: |
Согласно написанному выше уравнению, количества вещества металла и выделяющегося в ходе реакции водорода будут равны:
Металлы
Металлы — группа элементов, в виде простых веществ, обладающих характерными металлическими свойствами, такими, как высокие теплопроводность и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность, ковкость и металлический блеск.
Нахождение металлов в природе
По распространенности в земной коре (в массовых процентах) металлы распределяются следующим образом: Al, Fe, Ca, Na, Mg, K, Ti – 8,2%, 4,1%, 4,1%, 2,3% 2,3%, 2,1%, и 0,56%, соответственно. Натрий и магний содержатся в морской воде – 0,12 и 1,05%, соответственно.
Электронное строение металлов
Все металлы, в зависимости от их окислительно-восстановительной активности объединяют в ряд, который называется электрохимическим рядом напряжения металлов (так как металлы в нем расположены в порядке увеличения стандартных электрохимических потенциалов) или рядом активности металлов:
Li, K, Ва, Ca, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb, H2, Cu, Hg, Ag, Рt, Au
Наиболее химически активные металлы стоят в ряду активности до водорода, причем, чем левее расположен металл, тем он активнее. Металлы, занимающие в ряду активности, место после водорода считаются неактивными.
Взаимодействие с простыми веществами
Металлы способны реагировать с простыми веществами, такими как кислород (реакция горения), галогены, азот, сера, водород, фосфором и углеродом. В реакцию взаимодействия с кислородом вступают все металлы (исключение составляют Au, Pt), в результате чего возможно образование трех различных продуктов — пероксидов, оксидов и надпероксидов:
K + O2 = KO2 (надпероксид калия)
Металлы средней активности (начиная с Al) и неактивные металлы реагируют с кислородом только при нагревании:
В реакцию взаимодействия с азотом способны вступать только активные металлы, в результате чего образуются азиды, причем при н.у. с азотом реагирует только литий, остальные активные металлы – только при нагревании:
Только активные металлы способны взаимодействовать с углеродом и водородом, причем в случае реакции с водородом – это только щелочные и щелочноземельные металлы:
С серой реагируют все металлы кроме Au и Pt:
Также металлы способны взаимодействовать с галогенами и фосфором:
Все реакции взаимодействия с простыми веществами носят окислительно-восстановительный характер, металлы в них окисляются, проявляя свойства восстановителей, т.е. демонстрируют способность отдавать электроны:
Fe -2e = Fe 2+ процесс окисления, железо — восстановитель
S +2e = S 2- процесс восстановления, сера – окислитель
Взаимодействие металлов друг с другом
Взаимодействие металлов с водой
Активные металлы (щелочные и некоторые щелочноземельные металлы — Ca, Sr, Ba) способны взаимодействовать с водой с образованием гидроксидов:
Металлы, характеризующиеся средней активностью (начиная с Al) вступают в реакцию с водой в более жестких условиях (наличие щелочной или кислотной среды и др. условия); при этом образуется соответствующий оксид и выделяется водород:
Неактивные металлы с водой не реагируют.
Реакции взаимодействия металлов с водой также относятся к ОВР и металлы в них являются восстановителями.
Взаимодействие металлов с кислотами
Неактивные металлы взаимодействуют с кислотами при особых условиях. Так, концентрированная серная кислота способна растворять медь (1), а при взаимодействии меди с концентрированной азотной кислотой в зависимости от её концентрации (60% или 30%) образуются различные продукты реакции (2, 3):
Взаимодействие металлов с солями
Более активные металлы способны взаимодействовать с солями, образованными менее активными металлами, и вытеснять их (металлы) из солей:
Читайте также:
