Фтор это металл или нет
Обновлено: 01.05.2024
F, химический элемент VII группы периодической системы Менделеева, относится к галогенам (См. Галогены), атомный номер 9, атомная масса 18,998403; при нормальных условиях (0 °С; 0,1 Мн/м 2 , или 1 кгс/см 2 ) — газ бледно-жёлтого цвета с резким запахом.
Природный Ф. состоит из одного стабильного изотопа 19 F. Искусственно получены пять радиоактивных изотопов: 16 F с периодом полураспада Т1/2 17 F (T1/2 = 70 сек), 18 F (T1/2 = 111 мин), 20 F (T1/2 = 11,4 сек), 21 F (T1/2 = 5 сек).
Историческая справка. Первое соединение Ф. — флюорит (плавиковый шпат) CaF2 — описано в конце 15 в. под название «флюор» (от лат. fluo — теку, по свойству CaFa2 делать жидкотекучими вязкие шлаки металлургических производств). В 1771 К. Шееле получил плавиковую кислоту. Свободный Ф. выделил А. Муассан в 1886 электролизом жидкого безводного фтористого водорода, содержащего примесь кислого фторида калия KHF3.
Химия Ф. начала развиваться с 1930-х гг., особенно быстро — в годы 2-й мировой войны 1939 — 45 и после неё в связи с потребностями атомной промышленности и ракетной техники. Название «Ф.» (от греч. phthóros — разрушение, гибель), предложенное А. Ампером в 1810, употребляется только в рус. языке; во многих странах принято название «флюор».
Распространение в природе. Среднее содержание Ф. в земной коре (кларк) 6,25·10 -2 % по массе; в кислых изверженных породах (гранитах) оно составляет 8·10 -2 %, в основных — 3,7·10 -2 %, в ультраосновных — 1·10 -2 %. Ф. присутствует в вулканических газах и термальных водах. Важнейшие соединения Ф. — Флюорит, Криолит и топаз (см. Фториды природные). Всего известно 86 фторсодержащих минералов. Соединения Ф. находятся также в Апатитах, фосфоритах (См. Фосфориты) и др. Ф. — важный биогенный элемент (См. Биогенные элементы). В истории Земли источником поступления Ф. в биосферу были продукты извержения вулканов (газы и др.).
Физические и химические свойства. Газообразный Ф. имеет плотность 1,693 г/л (0°С и 0,1 Мн/м 2 , или 1 кгс/см 2 ), жидкий — 1,5127 г/см 3 (при температуре кипения); tпл — 219,61°С; tkип — 188,13°С. Молекула Ф. состоит из двух атомов (F2); при 1000°С 50% молекул диссоциирует, энергия диссоциации около 155 ± 4 кдж/моль (37 ± 1 ккал/моль). Ф. плохо растворим в жидком фтористом водороде; растворимость 2,5·10 -3 г в 100 г HF при —70°С и 0,4·10-3 при —20°С; в жидком виде неограниченно растворим в жидком кислороде и озоне. Конфигурация внешних электронов атома Ф. 2s 2 2p 2 . В соединениях проявляет степень окисления — 1. Ковалентный радиус атома 0,72Å, ионный радиус 1,33Å. Сродство к электрону 3,62 эв, энергия ионизации (F → F + ) 17,418 эв. Высокими значениями сродства к электрону и энергии ионизации объясняется сильная электроотрицательность атома Ф., наибольшая среди всех др. элементов. Высокая реакционная способность Ф. обусловливает экзотермичность фторирования, которая, в свою очередь, определяется аномально малой величиной энергии диссоциации молекулы Ф. и большими величинами энергии связей атома Ф. с др. атомами. Прямое фторирование имеет цепной механизм и легко может перейти в горение и взрыв. Ф. реагирует со всеми элементами, кроме гелия, неона и аргона. С кислородом взаимодействует в тлеющем разряде, образуя при низких температурах Фториды Кислорода O2F2, O3F2 и др. Реакции Ф. с др. галогенами экзотермичны, в результате образуются Межгалогенные соединения. Хлор взаимодействует с Ф. при нагревании до 200—250°С, давая монофтористый хлор CIF и трёхфтористый хлор ClF3. Известен также CIF5, получаемый фторированием ClF3 при высокой температуре и давлении 25 Мн/м 2 (250 кгс/см 2 ). Бром и йод воспламеняются в атмосфере Ф. при обычной температуре, при этом могут быть получены BrF3, BrF5, IF5, IF7. Ф. непосредственно реагирует с криптоном, ксеноном и радоном, образуя соответствующие фториды (например, XeF4, XeF6, KrF2). Известны также оксифториды ксенона.
Взаимодействие Ф. с серой сопровождается выделением тепла и приводит к образованию многочисленных серы фторидов (См. Серы фториды). Селен и теллур образуют высшие фториды SeF6 TeF6. Ф. с водородом реагируют с воспламенением; при этом образуется Фтористый водород. Это радикальная реакция с разветвлением цепей: HF* + H2 = HF + H2*; H2* + F2 = HF + Н + F (где HF* и H2* — молекулы в колебательно-возбуждённом состоянии); реакция используется в химических лазерах. Ф. с азотом реагирует лишь в электрическом разряде (см. Фториды азота). Древесный уголь при взаимодействии с Ф. воспламеняется при обычной температуре; графит реагирует с ним при сильном нагревании, при этом возможно образование твёрдого фтористого графита (CF)x или газообразных перфторуглеродов CF4, C2F6 и др. С бором, кремнием, фосфором, мышьяком Ф. взаимодействует на холоду, образуя соответствующие фториды. Ф. энергично соединяется с большинством металлов; щелочные и щёлочноземельные металлы воспламеняются в атмосфере Ф. на холоду, Bi, Sn, Ti, Mo, W — при незначительном нагревании, Hg, Pb, U, V реагируют с Ф. при комнатной температуре, Pt — при температуре темно-красного каления. При взаимодействии металлов с Ф. образуются, как правило, высшие фториды, например UF6, MoF6, HgF2. Некоторые металлы (Fe, Cu, Al, Ni, Mg, Zn) реагируют с Ф. с образованием защитной плёнки фторидов, препятствующей дальнейшей реакции.
При взаимодействии Ф. с окислами металлов на холоду образуются фториды металлов и кислород; возможно также образование оксифторидов металлов (например, MoO2F2). Окислы неметаллов либо присоединяют Ф., например SO2 + F2 = SO2F2, либо кислород в них замещается на Ф., например SiO2 + 2F2 = SiF4 + O2. Стекло очень медленно реагирует с Ф.; в присутствии воды реакция идёт быстро. Вода взаимодействует с Ф.: 2H2O + 2F2 = 4HF + O2; при этом образуется также OF2 и перекись водорода H2O2. Окислы азота NO и NO2 легко присоединяют Ф. с образованием соответственно фтористого нитрозила FNO и фтористого нитрила FNO2. Окись углерода присоединяет Ф. при нагревании с образованием фтористого карбонила: CO + F2 = COF2.
Гидроокиси металлов реагируют с Ф., образуя фторид металла и кислород, например 2Ba(OH)2 + 2F2 = 2BaF2 + 2H2O + O2. Водные растворы NaOH и KOH реагируют с Ф. при 0°С с образованием OF2.
Галогениды металлов или неметаллов взаимодействуют с Ф. на холоду, причём Ф. замещает все галогены, Легко фторируются сульфиды, нитриды и карбиды. Гидриды металлов образуют с Ф. на холоду фторид металла и HF; аммиак (в парах) — N2 и HF. Ф. замещает водород в кислотах или металлы в их солях, например HNO3 (или NaNO3) + F2 → FNO3 + HF (или NaF); в более жёстких условиях Ф. вытесняет кислород из этих соединений, образуя сульфурилфторид, например Na2SO4 + 2F2 = 2NaF + SO2F2 + O2. Карбонаты щелочных и щёлочноземельных металлов реагируют с Ф. при обычной температуре; при этом получаются соответствующий фторид, CO2 и O2.
Получение. Источником для производства Ф. служит фтористый водород, получающийся в основном либо при действии серной кислоты H2SO4 на флюорит CaF2, либо при переработке апатитов и фосфоритов. Производство Ф. осуществляется электролизом расплава кислого фторида калия KF·(1,8—2,0)HF, который образуется при насыщении расплава KF·HF фтористым водородом до содержания 40—41% HF. Материалом для электролизёра обычно служит сталь; электроды — угольный анод и стальной катод. Электролиз ведётся при 95—100°С и напряжении 9—11 в; выход Ф. по току достигает 90—95%. Получающийся Ф. содержит до 5% HF, который удаляется вымораживанием с последующим поглощением фторидом натрия. Ф. хранят в газообразном состоянии (под давлением) и в жидком виде (при охлаждении жидким азотом) в аппаратах из никеля и сплавов на его основе (Монель-металл), из меди, алюминия и его сплавов, латуни, нержавеющей стали.
Применение. Газообразный Ф. служит для фторирования UF4, в UF6, применяемого для изотопов разделения (См. Изотопов разделение) урана, а также для получения трёхфтористого хлора ClF3 (фторирующий агент), шестифтористой серы SF6 (газообразный изолятор в электротехнической промышленности), фторидов металлов (например, W и V). Жидкий Ф. — окислитель ракетных топлив.
Широкое применение получили многочисленные соединения Ф. — Фтористый водород, Алюминия фторид, Кремнефториды, фторсульфоновая кислота (растворитель, катализатор, реагент для получения органических соединений, содержащих группу — SO2F), BF3 (катализатор), фторорганические соединения и др.
Техника безопасности. Ф. токсичен, предельно допустимая концентрация его в воздухе примерно 2·10 -4 мг/л, а предельно допустимая концентрация при экспозиции не более 1 ч составляет 1,5·10 -3 мг/л.
Фтор в организме. Ф. постоянно входит в состав животных и растительных тканей; микроэлемент. В виде неорганических соединений содержится главным образом в костях животных и человека — 100—300 мг/кг; особенно много Ф. в зубах. Кости морских животных богаче Ф. по сравнению с костями наземных. Поступает в организм животных и человека преимущественно с питьевой водой, оптимальное содержание Ф. в которой 1—1,5 мг/л. При недостатке Ф. у человека развивается Кариес зубов, при повышенном поступлении — Флюороз. Высокие концентрации ионов Ф. опасны ввиду их способности к ингибированию ряда ферментативных реакций, а также к связыванию важных в биологическом отношении элементов (Р, Ca, Mg и др.), нарушающему их баланс в организме. Органические производные Ф. обнаружены только в некоторых растениях (например, в южноафриканском Dichapetalum cymosum). Основные из них — производные фторуксусной кислоты, токсичные как для др. растений, так и для животных. Биологическая роль Ф. изучена недостаточно. Установлена связь обмена Ф. с образованием костной ткани скелета и особенно зубов. Необходимость Ф. для растений не доказана.
Отравления Ф. возможны у работающих в химической промышленности, при синтезе фторсодержащих соединений и производстве фосфорных удобрений. Ф. раздражает дыхательные пути, вызывает ожоги кожи. При остром отравлении возникают раздражение слизистых оболочек гортани и бронхов, глаз, слюнотечение, носовые кровотечения; в тяжёлых случаях — отёк лёгких, поражение центрльной нервной системы и др.; при хроническом — конъюнктивит, бронхит, пневмония, пневмосклероз, флюороз. Характерно поражение кожи типа экземы. Первая помощь: промывание глаз водой, при ожогах кожи — орошение 70%-ным спиртом; при ингаляционном отравлении — вдыхание кислорода. Профилактика: соблюдение правил техники безопасности, ношение специальной одежды, регулярные медицинские осмотры, включение в пищевой рацион кальция, витаминов. Препараты, содержащие Ф., применяют в медицинской практике в качестве противоопухолевых (5-фторурацил, фторафур, фторбензотэф), нейролептических (трифлуперидол, или триседил, фторфеназин, трифтазин и др.), антидепрессивных (фторацизин), наркотических (фторотан) и др. средств.
Лит.: Рысс И. Г., Химия фтора и его неорганических соединений, М., 1956; Фтор и его соединения, пер. с англ., т. 1—2, М., 1953—56; Профессиональные болезни, 3 изд., М., 1973.
Большая советская энциклопедия. — М.: Советская энциклопедия . 1969—1978 .
Характеристика химического элемента Фтор
ФТОР (лат. Fluorum), F, химический элемент VII группы периодической системы Менделеева, атомный номер 9, атомная масса 18,998403, относится к галогенам.
Свойства: бледно-желтый газ с резким запахом; tпл -219,699 °С, tкип -188,200 °С. Плотность 1,70 г/см3. Самый активный неметалл: реагирует со всеми элементами, кроме гелия (He), неона (Ne) и аргона (Ar). Взаимодействие фтора со многими веществами легко переходит в горение и взрыв. Фтор разрушает многие материалы.
История: название от греческого "phthoros" (разрушение) .
Главные минералы: флюорит, криолит, фторапатит.
Нахождение в природе: фтор входит в состав тканей живых организмов (кости, зубная эмаль) .
Применение: применяют фтор для получения фторорганических соединений и фторидов.
А знаете ли Вы, что.. .
КАК ПАХНЕТ ФТОР? Запахи хлора, брома и йода, как известно трудно отнести к разряду приятных. В этом отношении фтор мало отличается от своих собратьев - галогенов. Его запах - резкий и раздражающий - напоминает одновременно запахи хлора и азона. Одной миллионой доли фтора в воздухе достаточно, чтобы человеческий нос уловил его присутствие.
КАК ВЫГЛЯДИТ ФТОР? В обычных условиях фтор - бледно-жёлтый газ, при температуре -188 °С - жидкость канареечно-жёлтого цвета, при -228 °С фтор замерзает и превращается в светло-жёлтые кристаллы. Если температуру понизить до -252 °С, эти кристаллы обесцветятся.
Гугл, гугл вам вообще на что нужен? !
ФТОР (лат. Fluorum), F, химический элемент с атомным номером 9, атомная масса 18,998403. Природный фтор состоит из одного стабильного нуклида 19F. Конфигурация внешнего электронного слоя 2s2p5. В соединениях проявляет только степень окисления -1 (валентность I). Фтор расположен во втором периоде в группе VIIА периодической системы элементов Менделеева, относится к галогенам.
1.Общая характеристика.
Радиус нейтрального атома фтора 0,064 нм, радиус иона F- 0,115 (2), 0,116 (3), 0,117 (4) и 0,119 (6) нм (в скобках указано значение координационного числа) . Энергии последовательной ионизации нейтрального атома фтора равны, соответственно, 17,422, 34,987, 62,66, 87,2 и 114,2 эВ. Сродство к электрону 3,448 эВ (самое большое среди атомов всех элементов) . По шкале Полинга электроотрицательность фтора 4 (самое высокое значение среди всех элементов) . Фтор -- самый активный неметалл.
2.Свойства.
При обычных условиях фтор -- газ (плотность 1,693 кг/м3) с резким запахом. Температура кипения -188,14°C, температура плавления -219,62°C. В твердом состоянии образует две модификации: a-форму, существующую от температуры плавления до -227,60°C, и b-форму, устойчивую при температурах, более низких, чем -227,60°C.
Как и другие галогены, фтор существует в виде двухатомных молекул F2. Межъядерное расстояние в молекуле 0,14165 нм. Молекулу F2 характеризует аномально низкая энергия диссоциации на атомы (158 кДж/моль) , что, в частности, обусловливает высокую реакционную способность фтора.
Химическая активность фтора чрезвычайно велика. Из всех элементов со фтором не образуют фторидов только три легких инертных газа -- гелий, неон и аргон. Во всех соединениях фтор проявляет только одну степень окисления -1.
Со многими простыми и сложными веществами фтор реагирует напрямую. Так, при контакте с водой фтор реагирует с ней (часто говорят, что «вода горит во фторе») :
2F2 + 2H2O = 4HF + O2.
Фтор реагирует со взрывом при простом контакте с водородом (H):
H2 + F2 = 2HF.
При этом образуется газ фтороводород HF, неограниченно растворимый в воде с образованием сравнительно слабой плавиковой кислоты.
Фтор вступает во взаимодействие с большинством неметаллов. Так, при реакции фтора с графитом образуются соединения общей формулы CFx, при реакции фтора с кремнием (Si) -- фторид SiF4, с бором -- трифторид BF3. При взаимодействии фтора с серой (S) образуются соединения SF6 и SF4 и т. д.
Известно большое число соединений фтора с другими галогенами, например, BrF3, IF7, ClF, ClF3 и другие, причем бром (Br) и иод (I) воспламеняются в атмосфере фтора при обычной температуре, а хлор (Cl) взаимодействует с фтором при нагревании до 200-250°С.
Не реагируют со фтором непосредственно, кроме указанных инертных газов, также азот (N), кислород (O), алмаз, углекислый и угарный газы.
Косвеным путем получен трифторид азота NF3 и фториды кислорода О2F2 и OF2, в которых кислород имеет необычные степени окисления +1 и +2.
При взаимодействии фтора с углеводородами происходит их деструкция, сопровождающаяся получением фторуглеводородов различного состава.
При небольшом нагревании (100-250°C) фтор реагирует с серебром (Ag), ванадием (V), рением (Re) и осмием (Os). С золотом (Au), титаном (Ti), ниобием (Nb),хромом (Cr) и некоторыми другими металлами реакция с участием фтора начинает протекать при температуре выше 300-350°C. С теми металлами, фториды которых нелетучи (алюминий (Al)железо (Fe), медь (Cu) и др.) , фтор с заметной скоростью реагирует при температуре выше 400-500°C.
Синтезировано также большое число различных фторорганических соединений, в том числе и знаменитый тефлон -- материал, представляющий собой полимер.
Фтор (устар. флюор ; F, лат. fluorum ) — химический элемент 17-й группы, второго периода периодической системы (по устаревшей короткой форме периодической системы принадлежит к главной подгруппе VII группы, или к группе VIIA) с атомным номером 9. Самый химически активный неметалл и сильнейший окислитель, самый лёгкий элемент из группы галогенов. Как простое вещество при нормальных условиях фтор представляет собой двухатомный газ (формула F2) бледно-жёлтого цвета с резким запахом, напоминающим озон или хлор. Токсичен.
Содержание
- 1 История
- 1.1 Происхождение названия
- 3.1 Электронное строение
- 3.1.1 Строение молекулы
- 3.3.1 Ядерные свойства изотопов фтора
- 3.3.2 Магнитные свойства ядер
- 5.1 Лабораторный метод
- 5.2 Промышленный метод
- 7.1 Ракетная техника
- 7.2 Применение в медицине
![Фтор]()
История
Первое соединение фтора — флюорит (плавиковый шпат) CaF2 — описано в конце XV века под названием «флюор». В 1771 году Карл Шееле получил плавиковую кислоту. При обработке минерала флюорита CaF2 серной кислотой он выделил HF в виде водного раствора. Это событие рассматривается в истории химии как открытие фтора. Аналогию с хлором предложил в 1810 г. Андре Ампер, его поддержал Гемфри Дэви. Дэви изучил растворения стекла в плавиковой кислоте.
Как химический элемент, входящий в состав плавиковой кислоты, фтор был предсказан в 1810 году, а выделен в свободном виде лишь 76 лет спустя Анри Муассаном в 1886 году электролизом жидкого безводного фтористого водорода, содержащего примесь кислого фторида калия KHF2.
Происхождение названия
Название «фтор» (от др.-греч. φθόρος — «разрушение, порча, вред»), предложенное Андре Ампером в 1810 году, употребляется в русском и некоторых других языках; во многих странах приняты названия, производные от лат. fluorum (от fluere — «течь», — по способности некоторых соединений фтора, например флюорита (CaF2), понижать температуру плавления металлургического шлака, образующегося при восстановлении металлов из руд, и увеличивать его текучесть.
Распространение в природе
Содержание фтора в атомных процентах в природе показано в таблице:
Объект Содержание Почва 0,02 Воды рек 0,00002 Воды океана 0,0001 Зубы человека 0,01 В природе значительные скопления фтора содержатся, в основном, в минерале флюорите (CaF2), содержащем по массе 51,2 % Ca и 48,8 % F. Кларк в земной коре 650 г/т.
Из растений относительно богаты фтором чечевица и лук.
В почве фтор накапливается в результате вулканической деятельности, в составе вулканических газов обычно содержится большое количество фтороводорода.
Физические свойства
При нормальных условиях представляет собой бледно-жёлтый газ. В малых концентрациях в воздухе его запах напоминает одновременно озон и хлор. Очень агрессивен и ядовит.
Фтор имеет аномально низкую температуру кипения (85,03 К, −188,12 °C) и плавления (53,53 К, −219,70 °C). Это связано с тем, что фтор не имеет d-подуровня и не способен образовывать полуторные связи, в отличие от остальных галогенов (кратность связи в остальных галогенах примерно 1,1).
Ниже температуры плавления образует кристаллы бледно-жёлтого цвета.
Электронное строение
Электронная конфигурация атома фтора: 1s 2 2s 2 2p 5 .
Атомы фтора в соединениях могут проявлять степень окисления, равную −1. Положительные степени окисления в соединениях неизвестны, так как фтор является самым электроотрицательным элементом.
Квантовохимический терм атома фтора — 2 P3/2.
Строение молекулы
![Фтор]()
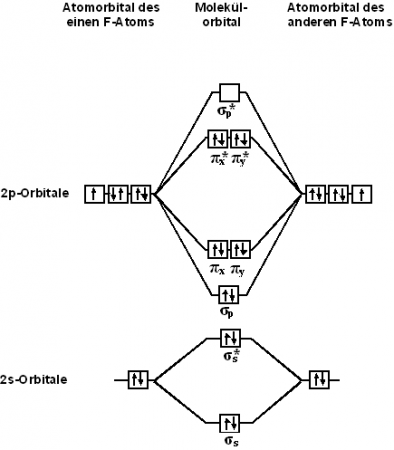
С точки зрения теории молекулярных орбиталей, строение двухатомной молекулы фтора можно охарактеризовать следующей диаграммой. В молекуле присутствует 4 связывающих орбитали и 3 разрыхляющих. Порядок связи в молекуле равен 1.
Кристаллы
![Фтор]()
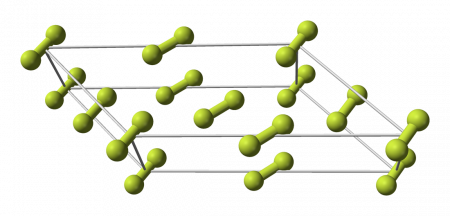
Фтор образует молекулярные кристаллы с двумя кристаллическими модификациями, стабильными при атмосферном давлении:
Фазовый переход между этими кристаллическими фазами фтора более экзотермичен, чем затвердевание жидкого фтора. Фаза ромбической сингонии у твёрдого фтора не обнаружена, в отличие от всех прочих галогенов. Молекулы α -фтора разупорядочены по направлению. Длина связи F—F в молекулах составляет 0,1404(12) нм .
Даже при столь низких температурах взаимодействие кристаллов фтора со многими веществами приводит к взрыву.
Изотопный состав
Фтор является моноизотопным элементом: в природе существует только один стабильный изотоп фтора 19 F. Известны ещё 17 радиоактивных изотопов фтора с массовым числом от 14 до 31, и один ядерный изомер — 18m F. Самым долгоживущим из радиоактивных изотопов фтора является 18 F с периодом полураспада 109,771 минуты, важный источник позитронов, использующийся в позитрон-эмиссионной томографии.
Ядерные свойства изотопов фтора
Изотоп Относительная масса, а. е. м. Период полураспада Тип распада Ядерный спин Ядерный магнитный момент 17 F 17,0020952 64,5 c β + -распад в 17 O 5/2 4,722 18 F 18,000938 1,83 часа β + -распад в 18 O 1 19 F 18,99840322 Стабилен — 1/2 2,629 20 F 19,9999813 11 c β − -распад в 20 Ne 2 2,094 21 F 20,999949 4,2 c β − -распад в 21 Ne 5/2 22 F 22,00300 4,23 c β − -распад в 22 Ne 4 23 F 23,00357 2,2 c β − -распад в 23 Ne 5/2 Магнитные свойства ядер
Ядра изотопа 19 F имеют полуцелый спин, поэтому возможно применение этих ядер для ЯМР-исследований молекул. Спектры ЯМР- 19 F являются достаточно характеристичными для фторорганических соединений.
Химические свойства
Самый активный неметалл, бурно взаимодействует почти со всеми веществами (кроме фторидов в высших степенях окисления и редких исключений — фторопластов) и с большинством из них — с горением и взрывом. Образует соединения со всеми химическими элементами, кроме гелия, неона, аргона.
К воздействию фтора при комнатной температуре устойчивы некоторые металлы за счёт образования на их поверхности плотной плёнки фторида, тормозящей реакцию со фтором, например, Al, Mg, Cu, Ni. Контакт фтора с водородом приводит к воспламенению и взрыву в кварцевых сосудах даже при очень низких температурах (до −252 °C), в магниевых сосудах для начала реакции нужен небольшой нагрев.
В атмосфере фтора горят даже вода и платина.
Продукты реакции фтора с водой, в зависимости от условий её протекания, могут различаться:
К реакциям, в которых фтор формально является восстановителем, относятся реакции разложения высших фторидов, например:
Фтор также способен окислять в электрическом разряде кислород, образуя дифторид кислорода OF2 и диоксидифторид O2F2. Под давлением или при облучении ультрафиолетом реагирует с криптоном и ксеноном с образованием фторидов благородных газов.
Во всех соединениях фтор проявляет степень окисления −1. Чтобы фтор проявлял положительную степень окисления, требуется создание эксимерных молекул или иные экстремальные условия. Это требует искусственной ионизации атомов фтора.
Не реагирует с гелием, неоном, аргоном, азотом, кислородом, тетрафторметаном. При комнатной температуре не реагирует с сухим сульфатом калия, углекислым газом и закисью азота. Без примеси фтороводорода при комнатной температуре не действует на стекло.
Получение
![Фтор]()
Промышленный способ получения фтора включает добычу и обогащение флюоритовых руд, сернокислотное разложение их концентрата с образованием безводного HF и его электролитическое разложение.
Для лабораторного получения фтора используют разложение некоторых соединений, но все они не встречаются в природе в достаточном количестве, и их получают с помощью свободного фтора.
Лабораторный метод
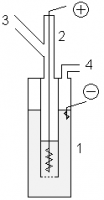
- В лабораторных условиях фтор можно получать с помощью показанной установки. В медный сосуд 1, заполненный расплавом KF·3HF, помещают медный сосуд 2, имеющий отверстия в дне. В сосуд 2 помещают толстый никелевый анод. Катод помещается в сосуд 1. Таким образом, в процессе электролиза газообразный фтор выделяется из трубки 3, а водород — из трубки 4. Важным требованием является обеспечение герметичности системы, для этого используют пробки из фторида кальция со смазкой из оксида свинца(II) и глицерина.
- В 1986 году, во время подготовки к конференции по поводу празднования 100-летия открытия фтора, Карл Кристе открыл способ чисто химического получения фтора с использованием реакции во фтороводородном растворе K2MnF6 и SbF5 при 150 °C:
Хотя этот метод не имеет практического применения, он демонстрирует, что электролиз необязателен; кроме того, все компоненты для данных реакций могут быть получены без использования газообразного фтора.
Также для лабораторного получения фтора можно использовать нагрев фторида кобальта(III) до 300 °C, разложение фторидов серебра и некоторые другие способы.
Промышленный метод
Промышленное производство фтора осуществляется электролизом расплава кислого фторида калия KF·2HF (часто с добавлениями фторида лития), который образуется при насыщении расплава KF фтористым водородом до содержания 40—41 % HF. Процесс электролиза проводят при температурах около 100 °C в стальных электролизёрах со стальным катодом и угольным анодом.
Хранение
Фтор хранят в газообразном состоянии (под давлением) и в жидком виде (при охлаждении жидким азотом) в аппаратах из никеля и сплавов на его основе (монель-металл), из меди, алюминия и его сплавов, латуни, нержавеющей стали (это возможно потому, что эти металлы и сплавы покрываются плёнкой фторидов, которая защищает от дальнейшей реакции с фтором).
Применение
Фтор используется для получения:
- фреонов — широко распространённых хладагентов;
- фторопластов — химически инертных полимеров;
- элегаза SF6 — газообразного изолятора, применяемого в высоковольтной электротехнике;
- гексафторида урана UF6, применяемого для разделения изотопов урана в ядерной промышленности;
- гексафтороалюмината натрия — электролита для получения алюминия электролизом;
- фторидов металлов (например, W и V), которые обладают некоторыми полезными свойствами;
![Фтор]()
Ракетная техника
Фтор и некоторые его соединения являются сильными окислителями, поэтому могут применяться в качестве окислителя в ракетных топливах. Очень высокая эффективность фтора вызывала значительный интерес к нему и его соединениям. На заре космической эры в СССР и других странах существовали программы исследования фторсодержащих ракетных топлив. Однако продукты горения с фторсодержащими окислителями токсичны. Поэтому топлива на основе фтора не получили распространения в современной ракетной технике.
Применение в медицине
Фторированные углеводороды (например перфтордекалин) применяются в медицине как кровезаменители. Существует множество лекарств, содержащих фтор в структуре (фторотан, фторурацил, флуоксетин, галоперидол и др.). Фториды натрия, калия и др. применяются для профилактики кариеса (см. ниже).
Биологическая и физиологическая роль
Фтор является жизненно необходимым для организма элементом. В организме человека фтор в основном содержится в эмали зубов в составе фторапатита — Ca5F(PO4)3 — и в костях. Общее содержание составляет 2,6 г, в том числе в костях 2,5 г. Нормальное суточное поступление фтора в организм человека равно 2,5—3,5 мг. При недостаточном (менее 0,5 мг/литр питьевой воды) или избыточном (более 1 мг/литр) потреблении фтора организмом могут развиваться заболевания зубов: кариес и флюороз (крапчатость эмали) и остеосаркома, соответственно.
Малое содержание фтора разрушает эмаль за счёт вымывания фтора из фторапатита с образованием гидроксоапатита, и наоборот.
Для профилактики кариеса рекомендуется использовать зубные пасты с добавками фторидов (натрия и/или олова) или употреблять фторированную воду (до концентрации 1 мг/л), или применять местные аппликации 1—2 % раствором фторида натрия или фторида олова. Такие действия могут сократить вероятность появления кариеса на 30—50 %.
Предельно допустимая концентрация связанного фтора (в виде фторидов и фторорганических соединений) в воздухе промышленных помещений равна 0,0005 мг/литр воздуха.
Токсикология
Фтор представляет собой чрезвычайно агрессивное ядовитое вещество. Является сильным окислителем. Раздражающие свойства в несколько раз сильнее, чем у фтороводорода. Резорбтивное действие объясняется возможностью фтора вступать в свободнорадикальные реакции с тканями организма. Контакт кожи с газом в течение 2 секунд вызывает термический ожог II степени; воздействие в концентрации 0,15-0,30 мг/л приводит к раздражению открытых участков кожи. При обследовании 252 человек, подвергающихся воздействию фтора, у 57 обнаружены конъюнктивиты или экзема век.
Фтор это металл или нет
![Фиг. 1.]()
В то же время было найдено, что для разложения не нужно брать очень сильной батареи, и что 20 элементов Бунзена вполне достаточно. После того как были сделаны эти изменения, тогда наконец Муассану удалось получить Ф.; он выделялся на положительном электроде в виде почти бесцветного газа с сильным, неприятным запахом, похожим на запах хлорноватистой кислоты. Чтобы изучить действие его на различные твердые тела, он клал их на крышку платинового тигля и подносил к платиновой трубочке, из которой выходил Ф. Оказалось, что Ф. очень энергично действует на очень многие тела. Сера плавится и воспламеняется при соприкосновении с Ф.; теллур воспламеняется, образуя много дыма; фосфор, мышьяк и сурьма тоже воспламеняются, давая фтористые соединения. Кристаллик йода горит в атмосфере Ф. бледным пламенем; в парах йода Ф. горит пламенем. С бромом в парах соединение Ф. происходит очень энергично, иногда со взрывом. Уголь аморфный в виде сажи, промытый петролейным эфиром и спиртом и высушенный, но не прокаленный, в атмосфере Ф. загорается при обыкновенной температуре. Легкий древесный уголь, помещенный в струю Ф., в первое мгновение, кажется, как будто сгущает Ф., а затем воспламеняется и горит, разбрасывая блестящие искры; уголь более плотный, не содержащий на поверхности угольной пыли, загорается после нагревания до 56—60°. Графит из чугуна загорается при темно-красном калении; цейлонский графит, очищенный сплавлением с едким кали, требует несколько более высокой температуры для соединения с Ф., а ретортный уголь — красного каления. Алмаз, накаленный докрасна несколько мгновений на бунзеновской горелке, не изменяет своего веса в струе Ф. Кремний кристаллический на холоде воспламеняется при соприкосновении с Ф. и горит с ослепительным блеском; то же происходит с бором. Водород соединяется с Ф. с сильным взрывом; если во время электролиза водород придет случайно в соприкосновение с Ф., то взрыв может быть очень опасным. На металлы Ф. действует вообще менее энергично, чем на металлоиды, благодаря, вероятно, образованию нелетучего слоя фтористого металла, прекращающего доступ Ф. к поверхности металла. Калий и натрий на холоде воспламеняются; магний и алюминий на холоде изменяются только с поверхности; при нагревании до темно-красного каления загораются с ослепительным блеском; то же относится к железу и марганцу в порошке. Свинец и ртуть соединяются с Ф. на холоде; серебро при легком нагревании покрывается слоем фтористого серебра. Ф. не действует на холоде на платину и золото; при 300—400° получаются соединения с Ф., которые при накаливании распадаются, выделяя Ф. При действии на хлористые, бромистые и йодистые металлы Ф. вытесняет хлор, бром и йод. Ф. разлагает воду, образуя HF, а кислород выделяется в виде озона; газообразные HCl, HBr, HI, H2S и NH3 воспламеняются с Ф.; крепкая серная кислота (моногидрат) разлагается только отчасти; фосфорный ангидрид на холоде не изменяется, при накаливании же дает газообразный POF3. Мышьяковистый ангидрид вступает в энергичную реакцию с Ф. с появлением пламени. Из пятихлористого фосфора или мышьяка и хлористого бора Ф. выделяет хлор; на окись углерода или углекислоту он не действует. Циан и сероуглерод воспламеняются с Ф.; то же происходит и с цианистыми металлами, например KCN, AgCN, Zn(CN)2 и K4Fe(CN)6. Расплавленное едкое кали, помещенное в атмосферу Ф., покрывается слоем KF, который постепенно уменьшает реакцию, также и едкий натр; при этом выделяется озон. Известь, окись бария, глинозем на холоде ярко накаливаются в струе Ф., выделяя кислород и переходя во фтористые металлы. Магнитный железняк и окись железа на холоде не изменяются Ф.; при нагревании же происходит энергичная реакция; то же самое наблюдается с окисью цинка, свинца, меди, ртути и проч. Сернистые металлы реагируют с Ф. таким же образом. Азотистый бор уже на холоде воспламеняется в атмосфере Ф., азотистый же титан требует предварительного нагревания. Карбиды лития, кальция, стронция, бария, урана воспламеняются в струе Ф. на холоде; другие же требуют некоторого нагревания. Сернокислые соли, например K2SO4, CaSO4, MnSO4 на холоде не изменяют Ф., при накаливании же переходят во фтористые соединения. На KNO3 и ΝΗ4ΝΟ3 Φ. не действует даже при темно-красном калении. Азотнокислые серебро и свинец разлагаются при накаливании. Фосфорно-натриевая соль изменяется только при накаливании; фосфорнокислый же кальций воспламеняется в атмосфере Ф. на холоде, переходя в CaF2. Поташ не изменяется при накаливании, углекислые же соли натрия, лития, кальция, стронция, свинца воспламеняются даже на холоде. Борно-натриевая соль не изменяется в струе Ф. даже при накаливании; медная же соль воспламеняется на холоде. Ф. очень энергично действует на органические соединения, содержащие в составе водород: спирт, бензол, скипидар, керосин воспламеняются в соприкосновении с ним. Чтобы получить Ф. в большом количестве Муассан несколько видоизменил свой прибор, придав ему большие размеры, и присоединил к нему платиновый змеевик, который охлаждался до —50°, чтобы освободить выделяющийся Ф. от паров фтористо-водородной кислоты; для высушивания Ф., вслед за змеевиком он ставил платиновую трубку с кусками плавленого фтористого калия и проч. (фиг. 2); при разложении прибавлял на 90—100 г безводной фтористо-водородной кислоты 20—25 г KF.HF.
![Фиг. 2.]()
Чтобы удешевить свой прибор, Муассан в последнее время вместо U-образной платиновой трубки стал применять медную, так как, по его опытам, из других металлов медь меньше всего изменяется Ф. Электроды делались по-прежнему из платины (лучше иридистой), а пробки из плавикового шпата.
![]()
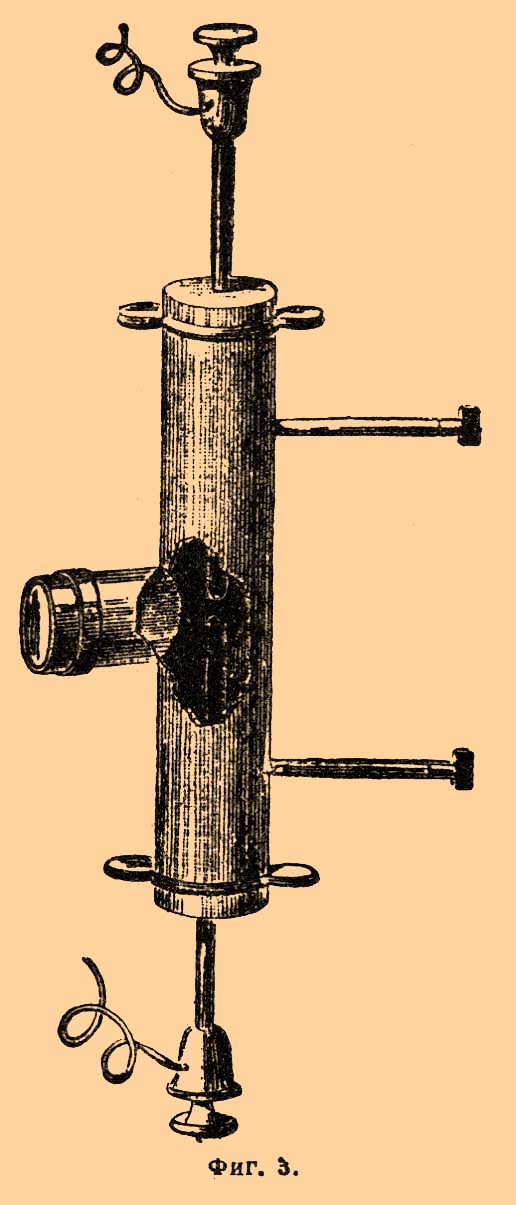
Получив возможность готовить Ф. в желаемом количестве, Муассан подробно изучил его физические и химические свойства. Прежде всего была определена плотность Ф. при обыкновенных условиях температуры и давления. Для этой цели служил платиновый флакон с платиновой пришлифованной пробкой, в которой находилась платиновая трубочка, идущая до дна флакона; через нее впускался Ф., для выхода же его служила трубочка на горле флакона. Перед опытом флакон наполнялся сухим азотом, который затем вытеснялся Ф.; флакон взвешивался до опыта, затем по наполнении Ф., причем замечалось атмосферное давление и температура. Количество оставшегося азота определялось, поглощая после опыта Ф. водой. Муассан нашел, что при 0° и 760 мм плотность Ф. около 1,265 и немного отличается от теоретической плотности (1,316, принимая атомный вес Ф.=19, и 1,314, если принять атомный вес его=19,05, как нашел Муассан). Так как Ф. стоит во главе группы галоидов F, Cl, Br, I, которые окрашены и окраска которых уменьшается с уменьшением атомного веса, то было интересно определить цвет Ф. Для этой цели брались платиновые трубки 0,5 или 1 м длиной с боковыми трубочками, и через них пропускался Ф. Концы платиновой трубки закрывались тонкими, совершенно прозрачными пластинками плавикового шпата. Если смотреть на белую поверхность через такую трубку, наполненную Ф., и сравнивать ее с трубкой, наполненной воздухом, то ясно видно, что Ф. имеет зеленовато-желтый цвет более слабый, чем хлор. Подобным же образом в платиновой трубке был определен и спектр Ф., пропуская в нем ряд электрических искр и наблюдая их в спектроскоп через отверстие, закрытое пластинкой прозрачного плавикового шпата (фиг. 3).
![Фиг. 3.]()
Кроме свободного Ф., через прибор пропускались также различные газообразные фтористые соединения, и изучался спектр, получающийся при действии на них электрических искр. Выбирая линии, общие всем исследованным веществам, удалось составить таблицу спектральных линий Ф.; из них наиболее характерны 13 линий, лежащих в красной части спектра между длинами волн 744 и 623. Муассан вместе с Дьюаром делали опыты сгущения Ф., пользуясь охлаждением, которое получалось, применяя жидкий воздух. При температуре —187° Ф. сгущается в светло-желтую очень подвижную жидкость, удельного веса около 1,14. Чтобы определить удельный вес, в жидкий Ф. погружались различные вещества известного удельного веса, например каучук, эбонит, дерево, амбра, щавелево-метиловый эфир и проч.; при этом наблюдалось, которые из этих тел плавают во Ф. и которые тонут; причем предварительными опытами убеждались, что Ф. на них не действовал. Попытки обратить Ф. в твердое тело при —210° не имели успеха. Для жидкого Ф. изучался спектр поглощения, магнитные и капиллярные свойства. Жидкий Ф. не дает линий поглощения и помещенный между полюсами сильного электромагнита не показывает никаких магнитных свойств. Коэффициент капиллярности найден меньше, чем для жидкого кислорода; например, в капиллярной трубке жидкий Ф. поднимается на высоту 3,5 мм, жидкий кислород — 5 мм, спирт — 14 мм и вода — 22 мм. Была изучена способность к реакциям жидкого Ф. Водород даже при —210° очень энергично соединяется с Ф. с пламенем. Жидкие Ф. и кислород смешиваются между собой во всех пропорциях. На лед и на ртуть жидкий Ф. не действует. Скипидар, охлажденный до —210°, разлагается жидким Ф. со взрывом; кремний, бор, сера, фосфор, восстановленное порошковатое железо не воспламеняются в нем и йод не выделяется им из йодистых металлов. Применение низкой температуры, доставляемой жидким воздухом, дало Муассану возможность получить Ф., не содержащий даже следов фтористо-водородной кислоты. Он нашел, что чистый и сухой Ф. при обыкновенной температуре и при 100° (опыт тянулся 2 часа) на стекло действует очень медленно; при этом выделяется кислород; если же на стекле находится влага или следы органических веществ, то образуется HF, который быстро разъедает стекло.
Соединения Ф. По форме своих соединений Ф. напоминает другие галоиды — хлор, бром и йод, стоя ближе всего к хлору. Прежде всего, как тот, так и другой — газы при обыкновенной температуре, сходные по окраске; затем, например, подобно тому, как хлор с водородом дает HCl, Ф. дает HF; с кремнием они дают SiCl4 и SiF4; с фосфором — PCl3, PCl5, POCl3 и PF3, PF5, PF3O и т. д. Фтористые металлы часто изоморфны с хлористыми; это относится, например, к щелочным и щелочноземельным металлам. Ф., соединяясь с металлоидами, дает соединения более летучие, чем хлор, а с металлами — наоборот. Это видно из следующей таблицы:
![F,9.jpg]()
Почти бесцветный газ (в толстых слоях — зеленовато-жёлтый) [1]
Фтор/Fluorum (F), 9
3,98 (шкала Полинга)
(при −188,14 °C, ж.) 1,108 г/см³
a=5,50 b=3,28 c=7,28 β=90,0 Å
(300 K) 0,028 Вт/(м·К)
Фтор — элемент 17-й группы периодической таблицы химических элементов (по устаревшей классификации — элемент главной подгруппы VII группы), второго периода, с атомным номером 9 [3] . Обозначается символом F (лат. Fluorum ). Фтор — чрезвычайно химически активный неметалл и самый сильный окислитель, является самым лёгким элементом из группы галогенов. Простое вещество фтор (CAS-номер: 7782-41-4) при нормальных условиях — двухатомный газ (формула F2) бледно-жёлтого цвета с резким запахом, напоминающим озон или хлор.
Первое соединение фтора — флюорит (плавиковый шпат) CaF2 — описано в конце XV века под названием «флюор». В 1771 году Карл Шееле получил плавиковую кислоту.
Как один из атомов плавиковой кислоты элемент фтор был предсказан в 1810 году, а выделен в свободном виде лишь 76 лет спустя Анри Муассаном в 1886 году электролизом жидкого безводного фтористого водорода, содержащего примесь кислого фторида калия KHF2.
Название «фтор» (от др.-греч. φθόρος — разрушение), предложенное Андре Ампером в 1810 году, употребляется в русском и некоторых других языках; во многих странах приняты названия, производные от латинского «fluorum» (которое происходит, в свою очередь, от fluere — «течь», по свойству соединения фтора, флюорита (CaF2), понижать температуру плавления руды и увеличивать текучесть расплава).
Объект Содержание, Почва 0,02 Воды рек 0,00002 Воды океана 0,0001 Зубы человека [4] 0,01 В природе значимые скопления фтора содержатся в основном в минерале флюорите (CaF2), содержащем по массе 51,2 % Ca и 48,8 % F. Кларк в земной коре 650 г/т.
Относительно богаты фтором чечевица и лук.
Содержанием в почве фтор обязан вулканическим газам, за счёт того, что в их состав обычно входит большое количество фтороводорода.
Изотопный состав
Фтор является моноизотопным элементом, так как в природе существует только один стабильный изотоп фтора 19 F. Известны ещё 17 радиоактивных изотопов фтора с массовым числом от 14 до 31, и один ядерный изомер — 18 F m . Самым долгоживущим из радиоактивных изотопов фтора является 18 F с периодом полураспада 109,771 минуты, важный источник позитронов, использующийся в позитрон-эмиссионной томографии.
Ядерные свойства изотопов фтора
Электронное строение
![]()
![]()
Электронная конфигурация атома фтора следующая: 1s 2 2s 2 2p 5 . Атомы фтора в соединениях могут проявлять степень окисления, равную −1. Положительные степени окисления в соединениях не реализуются, так как фтор является самым электроотрицательным элементом.
Квантовохимический терм атома фтора — 2 P3/2
Строение молекулы
Кристаллическая решётка
![]()
Фтор образует две кристаллические модификации, стабильные при атмосферном давлении:
- α-фтор — существует при температуре меньше 45,6 K, кристаллическая решетка моноклинная, пространственная группа C 2/c, параметры a = 0,550 нм, b = 0,328 нм, c = 0,728 нм, β = 102,17°, Z = 4 [5][6] .
- β-фтор — существует в интервале температур 45,6 ÷ 53,53 K, кристаллическая решетка кубическая, параметры a = 0,667 нм, Z = 8.
![]()
Для лабораторного получения фтора используют разложение некоторых соединений, но все они не встречаются в природе в достаточном количестве и их получают с помощью свободного фтора.
- В лабораторных условиях фтор можно получать с помощью показанной установки. В медный сосуд 1, заполненный расплавом KF·3HF помещают медный сосуд 2, имеющий отверстия в дне. В сосуд 2 помещают толстый никелевый анод. Катод помещается в сосуд 1. Таким образом, в процессе электролиза газообразный фтор выделяется из трубки 3, а водород из трубки 4. Важным требованием является обеспечение герметичности системы, для этого используют пробки из фторида кальция со смазкой из оксида свинца (II) и глицерина.
- В 1986 году, во время подготовки к конференции по поводу празднования 100-летия открытия фтора, Карл Кристе открыл способ чисто химического получения фтора с использованием реакции во фтороводородном растворе K2MnF6 и SbF5 при 150 °C [7] :
Также для лабораторного получения фтора можно использовать нагрев фторида кобальта (III) до 300 °С, разложение фторидов серебра (слишком дорого) и некоторые другие способы.
Промышленное производство фтора осуществляется электролизом расплава кислого фторида калия KF·3HF (часто с добавлениями фторида лития), который образуется при насыщении расплава KF фтористым водородом до содержания 40—41 % HF. Процесс электролиза проводят при температурах около 100 °C в стальных электролизёрах со стальным катодом и угольным анодом.
Бледно-жёлтый газ, в малых концентрациях запах напоминает одновременно озон и хлор, очень агрессивен и ядовит.
Фтор имеет аномально низкую температуру кипения (плавления). Это связано с тем, что фтор не имеет d-подуровня и не способен образовывать полуторные связи, в отличие от остальных галогенов (кратность связи в остальных галогенах примерно 1,1) [8] .
Самый активный неметалл, бурно взаимодействует почти со всеми веществами кроме, разумеется, фторидов в высших степенях окисления и редких исключений — фторопластов, и с большинством из них — с горением и взрывом. К фтору при комнатной температуре устойчивы некоторые металлы за счет образования плотной плёнки фторида, тормозящей реакцию со фтором — Al, Mg, Cu, Ni. Контакт фтора с водородом приводит к воспламенению и взрыву даже при очень низких температурах (до −252°C). В атмосфере фтора горят даже вода и платина:
" />
Фтор также способен окислять в электрическом разряде кислород, образуя фторид кислорода OF2 и диоксидифторид O2F2.
Во всех соединениях фтор проявляет степень окисления −1. Чтобы фтор проявлял положительную степень окисления, требуется создание эксимерных молекул или иные экстремальные условия. Это требует искусственной ионизации атомов фтора [9] .
Фтор хранят в газообразном состоянии (под давлением) и в жидком виде (при охлаждении жидким азотом) в аппаратах из никеля и сплавов на его основе (монель-металл), из меди, алюминия и его сплавов, латуни, нержавеющей стали (это возможно потому, что эти металлы и сплавы покрываются непреодолимой для фтора пленкой фторидов [10] ).
Применение в химии
Газообразный фтор используется для получения:
- UF6 из UF4, применяемого для разделения изотопов урана для ядерной промышленности. ClF3 — фторирующий агент и мощный окислитель ракетного топлива SF6 — газообразный изолятор в электротехнической промышленности металлов (например, W и V), которые обладают некоторыми полезными свойствами — хороших хладагентов — химически инертных полимеров
- гексафтороалюмината натрия — для последующего получения алюминияэлектролизом
- различных соединений фтора
Соединения фтора и сам фтор применяются в ракетной технике как окислители ракетного топлива.
Фторированные углеводороды (напр. перфтордекалин) применяются в медицине как кровезаменители. Существует множество лекарств, содержащих фтор в структуре (фторотан, фторурацил и др.).
Фтор является жизненно необходимым для организма элементом. В организме человека фтор, в основном, содержится в эмали зубов в составе фторапатита — Ca5F(PO4)3. При недостаточном (менее 0,5 мг/литр питьевой воды) или избыточном (более 1 мг/литр) потреблении фтора организмом могут развиваться заболевания зубов: кариес и флюороз (крапчатость эмали) и остеосаркома, соответственно [11] .
Малое содержание фтора разрушает эмаль за счет вымывания фтора из фторапатита с образованием гидроксоапатита, и наоборот.
Для профилактики кариеса рекомендуется использовать зубные пасты с добавками фторидов (натрия и/или олова) или употреблять фторированную воду (до концентрации 1 мг/л), или применять местные аппликации 1-2 % раствором фторида натрия или фторида олова. Такие действия могут сократить вероятность появления кариеса на 30-50% [12] .
Предельно допустимая концентрация связанного фтора [13] в воздухе промышленных помещениях равна 0,0005 мг/литр воздуха.
См. также
Литература
- Рысс И. Г. Химия фтора и его неорганических соединений. М. Госхимиздат, 1966 г. — 718 с.
- Некрасов Б. В. Основы общей химии. (издание третье, том 1) М. Химия, 1973 г. — 656 с.
- L. Pauling, I. Keaveny, and A.B. Robinson, J. Solid State Chem., 1970, 2, p. 225. англ. — Подробней о кристаллической структуре фтора
Примечания
Ссылки
- Химические элементы
- Фториды
- Галогены
- Неметаллы
- Высокоопасные вещества
- Фтор
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Фтор" в других словарях:
фтор — фтор, а … Русский орфографический словарь
фтор — фтор/ … Морфемно-орфографический словарь
фтор — а; м. [от греч. phthoros гибель, разрушение] Химический элемент (F), светло жёлтый газ с едким запахом. Добавлять в питьевую воду ф. * * * фтор (лат. Fluorum), химический элемент VII группы периодической системы, относится к галогенам. Свободный… … Энциклопедический словарь
ФТОР — (лат. Fluorum) F, химический элемент VII группы периодической системы Менделеева, атомный номер 9, атомная масса 18,998403, относится к галогенам. Бледно желтый газ с резким запахом, tпл ?219,699 .С, tкип ?188,200 .С, плотность 1,70 г/см³.… … Большой Энциклопедический словарь
Фтор — F (от греч. phthoros гибель, разрушение, лат. Fluorum * a. fluorine; н. Fluor; ф. fluor; и. fluor), хим. элемент VII группы периодич. системы Mенделеева, относится к галогенам, ат. н. 9, ат. м. 18,998403. B природе 1 стабильный изотоп 19F … Геологическая энциклопедия
ФТОР — (Fluorum), F, химический элемент VII группы периодической системы, атомный номер 9, атомная масса 18,9984; относится к галогенам; газ, tкип 188,2шC. Фтор используют в производстве урана, хладонов, медицинских препаратов и других, а также в… … Современная энциклопедия
Фтор — (Fluorum), F, химический элемент VII группы периодической системы, атомный номер 9, атомная масса 18,9984; относится к галогенам; газ, tкип 188,2°C. Фтор используют в производстве урана, хладонов, медицинских препаратов и других, а также в… … Иллюстрированный энциклопедический словарь
ФТОР — (символ F), газообразный токсичный элемент группы ГАЛОГЕНОВ (элементы VII группы периодической таблицы), впервые выделенный в 1886 г. Его основными источниками являются флюорит и криолит. Это бледно желтое вещество, получаем в результате… … Научно-технический энциклопедический словарь
ФТОР — ФТОР, фтора, муж. (греч. phthoros гибель) (хим.). Химический элемент, бесцветный газ с едким запахом. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
ФТОР — ФТОР, а, муж. Химический элемент, ядовитый бесцветный газ с едким запахом. | прил. фтористый, ая, ое. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
ФТОР — ФТОР, см. флюор. Толковый словарь Даля. В.И. Даль. 1863 1866 … Толковый словарь Даля
Читайте также: