Галогениды щелочных металлов это
Обновлено: 16.05.2024
ГАЛОГЕНИДЫ
ГАЛОГЕНИДЫ, хим. соед. галогенов с др. элементами. К галогенидам обычно относят соед., в к-рых атомы галогена имеют большую электроотрицательность, чем др. элемент. Галогенидов не образуют Не, Ne и Аг. К простым, или бинарным, галогенидам ЭХn (n-чаще всего целое число от 1 у моногалогенидов до 7 у IF7 и ReF7, но м. б. и дробным, напр. 7 /6 у Bi6Cl7) относят, в частности, соли галогеноводородных к-т и межгалогенные соединения (напр., галогенфториды). Существуют также смешанные галогениды, полигалогениды, гидрогалогениды, оксогалогениды, оксигалогениды, гидроксогалогениды, тиогалогениды и комплексные галогениды.
По характеру связи элемент-галоген простые галогениды подразделяют на ионные и ковалентные. В действительности связи имеют смешанный характер с преобладанием вклада той или иной составляющей. Галогениды щелочных и щел.-зем. металлов, а также многие моно- и дигалогениды др. металлов-типичные соли, в к-рых преобладает ионный характер связи. Большинство из них относительно тугоплавки и малолетучи, хорошо растворимы в воде; в водных р-рах почти полностью диссоциируют на ионы. Св-вами солей обладают также тригалогениды Р3Э. Р-римость в воде ионных галогенидов, как правило, уменьшается от иодидов к фторидам. Хлориды, бромиды и иодиды Ag + , Сu + , Hg + и Pb + плохо растворимы в воде.
Увеличение числа атомов галогенов в галогенидах металлов или отношения заряда металла к радиусу его иона приводит к повышению ковалентной составляющей связи, снижению р-римости в воде и термич. устойчивости галогенидов, увеличению его летучести, повышению окислит. способности и склонности к гидролизу. Эти зависимости наблюдаются для галогенидов металлов одного и того же периода и в ряду галогенидов одного и того же металла. Их легко проследить на примере термич. св-в. Напр., для галогенидов металлов 4-го периода т-ры плавления и кипения составляют соотв. 771 и 1430°С для КС1, 772 и 1960°С для СаС12, 967 и 975 °С для ScCK, - 24,1 и 136°С для Т1С14. Для UF3 т. пл. ~ 1500°С, UF4 1036 °С, UF5 348 °С, UF6 64,0 °С В рядах соед. ЭХn при неизменном п ковалентность связи обычно увеличивается при переходе от фторидов к хлоридам и уменьшается при переходе от последних к бромидам и иодидам. Так, для A1F3 т. возг. 1280°С, А1С13 180°С, т. кип. А1Вг3 254,8 °С, АlI3 407 °С. В ряду ZrF4, ZrCl4, ZrBr4, ZrI4 т-ра возгонки равна соотв. 906, 334, 355 и 418°С. В рядах MF,, и МС1„, где М-металл одной подгруппы, ковалентность связи уменьшается с ростом атомной массы металла. Фторидов и хлоридов металлов с примерно одинаковым вкладом ионной и ковалентной составляющей связи немного.
Галогениды неметаллов более ковалентны, чем галогениды металлов. Так, т-ры возгонки SiF4 ( - 95 °C и GeF4 ( - 36 °C гораздо ниже, чем у TiF4 и ZrF4, также и т-ры кипения SiCl4 (57,0 °С) и GeCl4(83,12°C) ниже, чем у Т1С14 и ZrCl4. Ковалентные SiF4 и GeF4, в отличие от TiF4 и ZrF4, почти мгновенно гидролизуются водой.
Средняя энергия связи элемент - галоген уменьшается при переходе от фторидов к иодидам и с повышением п (см. табл.).
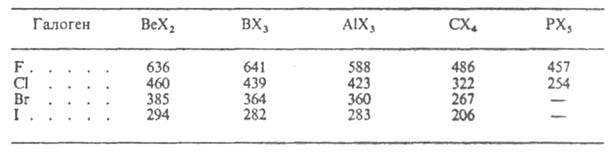
ЭНЕРГИЯ СВЯЗИ В НЕКОТОРЫХ ГАЗООБРАЗНЫХ ГАЛОГЕНИДАХ, кДж/моль
К смешанным галогенидам, содержащим наряду с атомами к.-л. элемента атомы двух или большего числа галогенов, относятся, напр., хлоропентафторид серы SC1F5, бромохлороди-фторид углерода CBrClF2, к межгалогенным соед. ХХn' (п = = 1, 3, 5 или 7)-ClF, BrF3, BrF5, IF7 и др. Полигалогениды содержат анионы Хn - (X == Вг, I; п = 3, 5, 9), напр. КВr3, К19. Гидрогалогениды МНn Хn+1 , или МНn Хn+2 - продукты присоединения галогеноводородов к галогенидам металлов; содержат ионы HnX - n+1. Наиболее устойчивы гидрофториды металлов.
Многие металлы и неметаллы образуют галогениды, содержащие изолированные или мостиковые атомы О (соотв. оксо-и оксигалогениды), напр. оксотрифторид ванадия VOF3, диоксифторид ниобия NbO2F, диоксодииодид вольфрама WO2I2, карбонилгалогениды СОХ2, нитрилгалогениды NO2X, нитрозилгалогениды NOX, тионилгалогениды SOX2. Характер связей элементов с галогенами в окси-и оксогалогенидах неметаллов более ковалентный, чем в соответствующих соед. металлов.
Комплексные галогениды (галогенометаллаты) содержат комплексные анионы, в к-рых атомы галогенов являются лигандами, напр. гексахлороплатинат(IV) калия K2[PtCl6], гептафторотанталат(V) натрия Na[TaF7], гексафтороарсенат(V) лития Li[AsF6]. наиб. термич. устойчивостью обладают фторо-, оксофторо- и хлорометаллаты. По характеру связей к комплексным галогенидам близки ионные соед. с катионами NF4 + , N2F3 + , C1F2 + , XeF + и др.
Для многих галогенидов характерны ассоциация и полимеризация в жидкой и газовой фазах с образованием мостиковых связей. наиб. склонны к этому галогениды металлов I и II групп, А1С13, пентафториды Sb и переходных металлов, оксофториды состава MOF4. Известны галогениды со связью металл - металл, напр. Hg2Cl2.
Фториды значительно отличаются по св-вам от др. галогенидов. Однако в простых галогенидах эти отличия выражены менее резко, чем в самих галогенах, а в комплексных галогенидах-слабее, чем в простых.
Многие ковалентные галогениды (особенно фториды)-сильные к-ты Льюиса, напр. AsF5, SbF5, BF3, A1C13. Фториды входят в состав сверхкислот. Высшие галогениды восстанавливаются металлами и Н2, напр.:Галогениды металлов V-VIII групп, кроме Сr и Мn, восстанавливаются Н2 до металлов, напр.:
Многие ковалентные и ионные галогениды металлов взаимодействуют между собой с образованием комплексных галогенидов, напр.:
Более легкие галогены могут вытеснять более тяжелые из галогенидов. Кислород может окислять галогениды с выделением С12, Вr2 и I2. Одна из характерных р-ций ковалентных галогенидов-взаимод. с водой (гидролиз) или ее парами при нагр. (пирогидролиз), приводящее к образованию оксидов, окси- или оксогалогенидов, гидроксидов и галогеноводородов. Исключение составляют CF4, CC14 и SF6, устойчивые к парам воды при высоких т-рах.
Галогениды получают непосредственно из элементов, взаимод. галогеноводородов или галогеноводородных к-т с элементами, оксидами, гидроксидами или солями, а также обменными р-циями.
Галогениды широко используют в технике как исходные в-ва для получения галогенов, щелочных и щел.-зем. металлов, как компоненты стекол и др. неорг. материалов; они являются промежут. продуктами в произ-ве редких и нек-рых цветных металлов, U, Si, Ge и др.
В природе галогениды образуют отдельные классы минералов, в к-рых представлены фториды (напр., минералы флюорит, криолит) и хлориды (сильвин, карналлит). Бром и иод входят в состав нек-рых минералов в виде изоморфных примесей. Значительные кол-ва галогенидов содержатся в воде морей и океанов, в соляных и подземных рассолах. Некоторые галогениды, напр. NaCl, К.С1, СаС12, входят в состав живых организмов.
О псевдогалогенидах см., напр., Галогены, об орг. галогенидах-Галогенангидриды карбоновых кислот, Галогензамещенные углеводородов. Э.Г. Раков.
===
Исп. литература для статьи «ГАЛОГЕНИДЫ» : нет данных
Большая Энциклопедия Нефти и Газа
Галогениды щелочных металлов ( за исключением, может быть, лития), щелочноземельных металлов ( кроме бериллия) и большинства лантанидов и нескольких галогенидов актинидов можно считать чисто ионными галогенидами. По мере увеличения отношения заряд / радиус, однако, ковалентность возрастает. Нечто подобное имеет место и для металлов с переменной степенью окисления; низшие галогениды в большей мере являются ионными, в то время как высшие галогениды - ковалентные соединения. В качестве примеров можно привести РЬС12 и РЬС14, а также UF4, который является ионным соединением, тогда как UF6 - газообразное ковалентное соединение. [16]
Когда галогенид щелочного металла стехиометрического состава окрашивается, то при облучении электроны переводятся из заполненной зоны в зону проводимости и затем попадают в ловушки, которыми служат анионные вакансии. Возникновение каждого / г-центра должно сопровождаться образованием положительной дырки в заполненной зоне. По аналогии можно ожидать, что положительные дырки связываются катионными вакансиями и вызывают появление поглощающих свет центров другого типа. Кристаллы, содержащие избыток электроотрицательного компонента над стехиометрическим составом, также должны содержать такие центры. Молво [47] показал в 1937 г., что спектр бромид калия, подвергнутого действию паров брома, имеет в ультрафиолетовой области серию полос поглощения, которые были названы V-полосами ( в этой серии были выделены полосы от Уг до V6); он предположил, что их возникновение связано с центрами, которые образуются при взаимодействии положительных дырок с катионными вакансиями. [17]
Катализаторами служат галогениды щелочных металлов , четвертичного аммония или аминов, а также смеси веществ, при взаимодействии которых получается нужный катализатор. [18]
Согласно Полингу, галогениды щелочных металлов в сущности обладают ионным характером, HF в большой степени также ионное соединение, тогда как НС1, НВг и HJ содержат двухэлектронные связи. [19]
Следует использовать только очень чистые галогениды щелочных металлов . Некоторые фирмы выпускают очень чистый КВг, уже размельченный, осушенный и готовый для приготовления таблеток. Имеет смысл проверять чистоту каждой новой партии КВг, изготовляя контрольную таблетку толщиной 2 мм. Если КВг хранится в эксикаторе, то его следует регулярно осушать при температуре 110 для поддержания возможно низкого содержания влаги. [20]
Чистый, сухой галогенид щелочного металла ( 150 - 250 мг) - хлористый калий или бромистый калий - тщательно размалывается с твердым образцом так же, как это описано в разделе о приготовлении взвесей. При молекулярном весе вещества менее 200 берется концентрация примерно 1 мг образца на 100 мг галогенида щелочного металла, при большем молекулярном весе вещества его концентрация пропорционально выше. Если прессовать эту смесь при комнатной температуре, под вакуумом и при высоком давлении, то получается твердая, обычно прозрачная таблетка. Таблетка укрепляется в специально изготовленном по ее форме металлическом держателе и помещается в основной пучок прибора. Таблетки имеют то преимущество перед взвесями, что в этом случае и концентрация, и толщина слоя легко определяются и таблетки можно, таким образом, использовать для количественного анализа ( стр. Однако потери на рассеяние и здесь имеют место, а получить достаточно гомогенную дисперсную систему образца не всегда легко. Определение этих потерь очень сложно, а их воспроизводимость от таблетки к таблетке весьма сомнительна. [21]
Типу А приблизительно отвечают галогениды щелочных металлов . [23]
Ингибирующей способностью обладают также галогениды щелочных металлов . На их основе разработаны порошковые огнегасительные вещества. Известны порошки карбонатные бикарбонатные, порошки на основе хлоридов, фосфатов, сульфатов и др. Наиболее широко используются составы на основе карбонатов и бикарбонатов натрия и калия. [24]
При обычных температурах все галогениды щелочных металлов кристаллизуются в структурном типе NaCl, за исключением CsCl, CsBr и Csl, имеющих структуру типа CsCl. [25]
Совсем другими свойствами обладают галогениды щелочных металлов . Из данных табл. 14.10 видно, что в газовой фазе эти соединения существуют в виде очень полярных двухатомных молекул. Если в такой жидкости и существуют двухатомные молекулы, они встречаются крайне редко и, по-видимому, оказывают небольшое влияние на свойства жидкости. Подавляющая часть атомов существует в такой жидкости в виде однозарядных ионов. [26]
Из каких частиц состоят галогениды щелочных металлов в твердом, жидком и газообразном состояниях. [27]
Ингибирующей способностью обладают также галогениды щелочных металлов . На их основе разработаны порошковые огнегасительные вещества. Известны порошки карбонатные, бикарбонатные, порошки на основе хлоридов, фосфатов, сульфатов и др. Наиболее широко используются составы на основе карбонатов и бикарбонатов натрия и калия. Количество огне-гасительного вещества, необходимое для прекращения реакции горения, определяют экспериментально в каждом конкретном случае. Она включает в себя датчик обнаружения взрыва; контрольно-усилительное и исполнительное устройство, усиливающее сигнал, поступающий от датчика, и выдающее команду на взрывоподавители; взрывоподавительные устройства, распыляющие огнегасительное вещество в зону воспламенения. Основные требования, предъявляемые к системам взрывоподавления, сводятся к быстродействию, высокой чувствительности к импульсу возбуждения, безотказности срабатывания, недопущению ложных срабатываний, эффективности подавления взрыва. [28]
В исследованных системах, содержащих галогениды щелочных металлов , активность растворителя увеличивается с ростом температуры и соответственно стехиометрическая смесь ионов должна быть сольватиро-вана положительно. В растворах, изученных в работе [51], при соответствующей температуре должна была бы наблюдаться смена знака наклона температурной зависимости активности растворителя. Однако сейчас мы не располагаем аппаратурой, на которой можно было бы с достаточной точностью изучить температурную зависимость активности спиртов в растворах электролитов ниже 243 К. [29]
Из неорганических соединений наиболее изучены галогениды щелочных металлов , серебра и ртути. Было найдено, что халькогенидгалогениды ртути и смешанные халькогенидгалогениды ртути и серебра представляют собой достаточно перспективные фотохромные материалы для изготовления слоев, предназначенных для многократной записи информации. Характерная особенность этих слоев - образовавшееся на них изображение исчезает не самопроизвольно, а лишь при нагревании. [30]
Большинство галогенидов щелочных металлов кристаллизуется в решетке каменной соли - хорошо известной структуре из двух взаимно проникающих кубических гранецентрированных решеток из катионов и анионов. Такую структуру имеют фториды, хлориды, бромиды и иодиды лития, натрия, калия и рубидия. Соли цезия, как правило, имеют другую структуру, хотя CsF, так же как и CsCl при повышенных температурах, кристаллизуется в структуре каменной соли. Ион цезия - самый большой катион этой группы - может иметь координационное число больше шести, как в структуре каменной соли. [1]
Второй механизм из-за присутствия Хм ( атом галогена имеет больше электронов, чем замещаемый им атом металла) привел бы к проводимости я-типа, чего, однако, не наблюдается. Более того, в большинстве галогенидов щелочных металлов пространственные затруднения не позволяют атомам галогена размещаться в узлах металла. Следовательно, от второй модели можно смело отказаться. [2]
По типу каменной соли построено большинство галогенидов щелочных металлов . Следует отметить, что-гидриды щелочных металлов обладают таким же типом строения ( см. стр. [4]
По типу каменной соли построено большинство галогенидов щелочных металлов . Следует отметить, что гидриды щелочных металлов обладают таким же типом строения ( см. стр. [6]
При этом если выбор значения т - 6 является в какой-то мере обоснованным ( если иметь в виду лондоновские диполь-дипольные дисперсионные силы), то значение п 12 взято совершенно произвольно. Было показано, что параметр р почти не меняется для большинства галогенидов щелочных металлов и составляет приближенно 0 35 А. Позднее Блейк и Майер [3] подтвердили преимущества использования экспоненциального закона перед степенным. Они вычислили по методу Гайтлера - Лондона отталкивание между двумя атомами с заполненными оболочками ( с восемью электронами) и установили, что во всем интервале межатомных расстояний от 1 8 А до 3 1 А экспоненциальная функция приводит к лучшему соответствию с экспериментом. Однако значение р, вычисленное этими авторами, оказалось несколько меньшим ( на 0 2 А), чем это следовало из экспериментов по сжимаемости кристаллов галогенидов щелочных металлов. [7]
При этом если выбор значения т 6 является в какой-то мере обоснованным ( если иметь в виду лондоновские диполь-дипольные дисперсионные силы), то значение п 12 взято совершенно произвольно. Было показано, что параметр р почти не меняется для большинства галогенидов щелочных металлов и составляет приближенно 0 35 А. Позднее Блейк и Майер [3] подтвердили преимущества использования экспоненциального закона перед степенным. Они вычислили по методу Гайтлера - Лондона отталкивание между двумя атомами с заполненными оболочками ( с восемью электронами) и установили, что во всем интервале межатомных расстояний от 1 8 А до 3 1 А экспоненциальная функция приводит к лучшему соответствию с экспериментом. Однако значение р, вычисленное этими авторами, оказалось несколько меньшим ( на 0 2 А), чем это следовало из экспериментов по сжимаемости кристаллов галогенидов щелочных металлов. [8]
Титанат бария обладает сегнето-электрическими свойствами в широком диапазоне температур и в этом отношении имеет ряд преимуществ перед другими сегнето-электриками. Монокристаллы титаната бария могут быть получены из расплавленных систем титаната бария и фторидов, хлоридов, сульфатов, силикатов, карбонатов и других соединений щелочных металлов; титанат бария плохо растворим в расплавах большинства галогенидов щелочных металлов , за. [9]
По расчетам Борна и Мейера, при нормальных давлении и температуре кристаллы всех галогенидов щелочных металлов должны иметь структуру типа NaCl. Катионы и анионы образуют две вставленные друг в друга гранецентрированные кубические решетки. Давно известно, что большинство галогенидов щелочных металлов действительно образуют кристаллы типа NaCl. Но в ряду Na, К, Rb, Cs кристаллическая решетка типа NaCl постепенно теряет устойчивость. Хлористый, бромистый и йодистый цезий кристаллизуются в решетке типа CsCl. Катионы и анионы располагаются в узлах двух вставленных друг в друга простых кубических решеток. [10]
Затем пропускают ток и измеряют толщину электродов и пластинок кристалла. Если двигался только отрицательный ион, то пластинка, расположенная ближе к аноду, будет толще другой, так как отрицательные ионы соединяются с металлом анода. Если двигались только ионы металла, то толщина пластинок кристалла не изменится, а металл будет перенесен от катода к аноду. Опыты такого рода показывают, что отрицательные ионы подвижны только в ВаС12, РЬС12 и РЬВг2; положительные ионы - только в AgCl, AgBr, Agl, a - CuBr, a - Cul и в большинстве галогенидов щелочных металлов ниже 500 С, а оба типа ионов - только в РЫ2 и галогенидах щелочных металлов при высоких температурах. Высокотемпературные формы Agl и Ag2HgI4 характеризуются ненормально высокой ионной электропроводностью, о которой будет сказано ниже. [11]
Описание препаратов галогенидов щелочных металлов и качественный анализ
Из этой группы фармакопейными препаратами является: натрия хлорид (NaCI) , калия хлорид (KCI), натрия бромид (NaBr), калия бромид (KBr), Натрия йодид (NaJ), калия йодид (KJ). Все эти препараты являются фармакопейные и имеют много общего в способах получения и свойствах, методах анализах, но действие их на организм различно
Natrium chloratum
Natrii chloridum
Натрий хлористый. Поваренная соль.
NaClМ.м. 58,45
Свойства. Белые кубические кристаллы или белый кристаллический порошок соленого вкуса, без запаха. Растворим в 3ч. воды.
Испытание на подлинность. 1) Раствор препарата (1:100) подкисляют несколькими каплями разведенной азотной кислоты и прибавляют 0,5 мл раствора нитрата серебра. Образуется белый творожистый осадок, легко растворимый в растворе аммиака.
2) Крупинка препарата, внесенная в бесцветное пламя, окрашивает его в желтый цвет.
Хранение. В хорошо закуренных банках, в сухом месте. [3]
Применение. Натрия хлорид является основной частью солевых и коллоидно-солевых растворов, применяющихся в качестве плазмо-заменяющих жидкостей. Натрия хлорид содержится в крови и тканевых жидкостях организма (концентрация в крови 0,5%). Основная роль его- обеспечить постоянство осмотического давления крови. При дефиците натрия хлорида в организм вводят в/в или п/к 0,9% раствор (изотонический раствор). В большом количестве (500 мл и больше ) вводят при больших потерях крови, явлениях диспепсии. 0,9% раствор применяется в качестве растворителя различных лекарственных препаратов. Применяют также 3%, 5%, 10% растворы - гипертонические: наружно для компрессов, примочек, при лечении гнойных ран (отделения гноя) иногда в/в 10% (10-20 мл) медленно при легочных, желудочных и кишечных кровотечениях, для усиления диуреза. Натрия хлорид используют также для ванн, обтираний, полосканий при заболевании верхних дыхательных путей, как противоядие при отравлении AgNO3.
Формы выпуска: порошок, таблетки 0,9, р-ры для инъекций 0,9% в ампулах, флаконах- в/в 10% р-р, Комбинированные; спрей «Салин», р-ры Рингера, Рингера-Локка, Трисоль, Дисоль.[11]
Kalii chloridum
Kalium chloratum
KCIМ.м. 74,56
Свойства. Белый кристаллический порошок или бесцветные кристаллы без запаха, соленого вкуса. Растворим в 3-х частях холодной воды и практически не растворим в 95% спирте. Растворы нейтральной реакции.
Испытание на подлинность. На хлорид ион: добавляют раствор нитрата серебра, выпадает белый творожистый осадок.
На К+-ион: 1) по окрашиванию пламени горелки в фиолетовый цвет, а если смотреть на пламя через синее стекло, то оно кажется окрашенным в пурпурно-красный цвет.
2) c виннокаменной кислотой в присутствии ацетата натрия (можно с солью гидротартратом натрия- сегнетова соль) осадок белого цвета. Осаждению способствует охлаждение смеси, встряхивание и потирание стеклянной палочкой о стенки пробирки.
3) с раствором гексанитрокобальтата (III) натрия выпадает жёлтый осадок, реакцию проводят в уксуснокислой среде при потирании палочкой о стенки пробирки.
Хранение: в условиях предупреждающих окисление: сухое место, закупоренные банки. [3]
Применение.При нарушении сердечного ритма (антиаритмическое), особенно в связи с интоксикацией сердечными гликозидами, когда происходит обеднение клеток миокарда ионами калия , улучшает сокращение мышц- дистрофия, миостения. - в случае гипокалиемии (снижение калия в организме), которая происходит при длительном приёме диуретических средств.
Форма выпуска: порошок, таблетки по 0,5 и 1,0, таблетки «Панангин», «Аспаркам», шипучие таблетки К-Лайт, пролонгированные таблетки К-Дур. Калий-норм, Калипоз. Назначают внутрь в виде 10% водного раствора, при тяжёлой интоксикации в/в 4% р-р.[11]
Natrium bromatum
Natrii bromidum
NaBrМ.м. 102,91
Свойства. Белый кристаллический порошок без запаха ,соленого вкуса. Растворим в 1,5 ч. воды и в 10 ч. спирта. Гигроскопичен.
Испытание на подлинность. 1) К 10 мл раствора препарата (1:10) прибавляют 2 мл разведенной соленой кислоты 0,5 мл хлорной воды или раствора хлорамина,1мл хлороформа и взбалтывают; хлороформный слой окрашивается в желто-бурый цвет.
Хранение. В хорошо закупоренных стеклянных банках, в сухом защищенном от света месте.[3]
Применение. Успокаивающее, седативное средство. Действие основано на способности его усиливать процессы торможения в коре большого мозга, применяют при неврастении, повышенной раздражительности, бессоннице, эпилепсии. Доза для взрослых 0,5г внутрь.
Формы выпуска:порошок, таблетки по 0,5 , микстуры 3% ( Павлова, с адонисом). Водный р-р с фруктовым сиропом 1%,2%, 3%. Р-р натрия бромида и калия бромида с фруктовым сиропом 1%,2%, 3%.[11]
Kalium bromatum
Kalii bromidum
KBrМ.м.119,02
Свойства. Бесцветные или белые блестящие кристаллы или мелкокристаллический порошок без запаха, сильно соленого вкуса. Растворим в 1,7 ч. воды, мало растворим в спирте. На воздухе устойчив.
Испытание на подлинность. К 10 мл раствора препарата (1:10) прибавляют 2 мл разведенной соляной кислоты ,0,5 мл раствора хлорамина или хлорной воды, 1мл хлороформа и взбалтывают. Хлороформный слой окрашивается в желто-бурый цвет.
К 2 мл такого же раствора прибавляют 2 мл разведенной уксусной кислоты и 2 мл раствора виннокаменной кислоты. Выпадает белый кристаллический осадок, растворимый в разведенных минеральных кислотах и растворах едких щелочей.
Хранение. В хорошо закупоренных стеклянных банках, в сухом, защищенном от света месте.[3]
Применение . Как натрия бромид доза 0,3-0,5 г на приём Выпуск: пилюли и таблетки по 0,5, порошки, мази 1-2% для кожи. Р-р натрия бромида и калия бромида с фруктовым сиропом 1%,2%, 3%. [11]
Natrii iodadum
Свойства. Белый кристаллический порошок без запаха, соленого вкуса. Растворим в 0,6 ч. воды, в 3 ч. спирта и 2 ч.глицерина. На воздухе сыреет.
Испытание на подлинность. 1)К 10 мл раствора препарата (1:20) прибавляют несколько капель раствора хлорида окисного железа, 2 капли соляной кислоты и 2мл хлороформа. Хлороформный слой окрашивается в фиолетовый цвет.
Хранение. В хорошо закупоренных банках оранжевого стекла, в сухом месте.[3]
Применение. Источник микроэлемента. Антитириоидное. Применяют как препараты йода, при гипотиреозе (мало йода в пище, воде), эндемическом зобе- болезни щитовидной железы. Если пища или вода не содержит достаточного количества йода, то возникает кретинизм (зобная болезнь). При воспалительных заболеваниях дыхательных путей, астме. Назначают в виде микстур.
Формы выпуска: порошок, микстуры 3%, р-р 10% в/в .[11]
Kalium iodatum
Kalii iodatum
Калий йодистый
KJМ.м.166,01
Свойства. Бесцветные или белые кубические кристаллы или белый мелкокристаллический порошок без запаха, солено-горького вкуса .
Растворим в 0,75 ч. воды, в 12 ч. спирта и в 2,5 ч глицерина. Стойкий в сухом воздухе, сыреющий во влажном.
Испытание на подлинность. 1) К 10 мл раствора препарата (1:20) прибавляют несколько капель раствора хлорида окисного железа 2 капли соляной кислоты,2 мл хлороформа и взбалтывают. Хлороформный слой окрашивается в фиолетовый цвет.
2) к 2мл раствора препарата (1:10) прибавляют 2 мл разведенной уксусной кислоты и 2мл раствора виннокаменной кислоты. Выпадает белый кристаллический осадок, растворимый в разведенных минеральных кислотах и растворах едких щелочей.
Хранение. В хорошо закупоренных банках оранжевого стекла.[3]
Применение. Как препарат йода при эндемическом зобе. Противомикробное (катаракта, коньюктивит, воспаление роговицы, травмы). Применяют в пилюлях, растворах микстурах по 0,3-0,5г на 1 приём. Препарат прописывают вместе с NaHCO3 (чтобы не было раздражения слизистой). Формы выпуска: порошок, таб. 0,04, 0,10, 0,125, 0,2, 0,5,1,0; р-р 3% внутрь, таб. «Йодтирокс», глазные капли 3%.[11]
Читайте также:
