Гальванический элемент коррозия металлов
Обновлено: 17.05.2024
Электрохимическая коррозия — самопроизвольный окислительно-восстановительный процесс разрушения металлов и сплавов под влиянием внешних факторов, в котором, в отличие от химической коррозии, наблюдается направленное движение электронов от окисляемого металла к окислителю.
Электрохимическая коррозия возникает, когда соприкасаются два металла различной активности . Различие в энергиях ионизации и в величине сродства к электрону заставляет электроны переходить от более активного металла к менее активному, что и запускает процесс электрохимической коррозии.
Механизм электрохимической коррозии.
Процессы электрохимической коррозии протекают по законам электрохимической кинетики, когда общая реакция взаимодействия может быть разделена на следующие процессы:
1) анодный процесс — переход ионов окисленного металла в раствор, сопровождающийся гидратацией (сольватацией):
2) омический процесс — перетекание освободившихся электронов от анодных участков к катодным и движение ионов в растворе;
3) катодный процесс — ассимиляция электронов каким-либо окислителем, при этом происходит катодное восстановление окислителя Ох:
Окислителями при коррозии служат молекулы кислорода О2, хлора Cl2, ионы Н + , Fe 3+ , NO3 – и др. Наиболее часто при коррозии в нейтральной и щелочной среде наблюдается восстановление кислорода:
а в кислой среде — выделение водорода:
Коррозия с участием молекулярного кислорода называется коррозией с кислородной деполяризацией. Коррозия с участием ионов водорода называется коррозией с водородной деполяризацией.
Кроме электрохимических реакций при коррозии обычно протекают вторичные химические процессы, например взаимодействие образующихся ионов металла с гидроксид-ионами, концентрация которых повышается в результате катодных реакций:
 |
| Рис. 5. Атмосферная коррозия в результате контакта меди и железа |
Например, если железо находится в контакте с медью в атмосфере влажного воздуха (рис. 5), то менее активный металл медь выступает в роли катода, на котором происходит восстановление окислителя, а материал анода окисляется.
Возникает гальванопара, при работе которой происходят процессы:
анод Fe 0 – 2 → Fe 2+ ;
Далее происходят вторичные процессы:
Образующийся гидроксид железа (II) легко окисляется кислородом воздуха, что в конечном итоге приводит к образованию ржавчины mFe2O3 · nFeO · pH2O.
Образование гальванического элемента (гальванопары) из двух различных по активности металлов приводит к коррозии более сильной, чем для исходного активного металла. Например, цинк в растворе соляной кислоты (Е 0 Zn2+/Zn 0 = – 0,762 B) реагирует с выделением водорода:
или в ионном виде:
Zn + 2H + = Zn 2+ + H2↑;
но постепенно изолируется от раствора мелкими пузырьками образовавшегося газа, в результате чего его дальнейшее растворение прекращается.
Медь с разбавленной соляной кислотой не реагирует, так как находится в ряду напряжений после водорода, её стандартный электродный потенциал Е 0 Cu2+/Cu 0 = +0,34 B. Но цинк в контакте с медью образует в разбавленной соляной кислоте коррозионную гальванопару:
В кислой среде наблюдается электрохимическая коррозия Zn с водородной деполяризацией, в которой роль анода играет более электроотрицательный (более активный) металл — цинк, так как
В процессе коррозии цинк растворяется:
анод: Zn – 2 → Zn 2+ (окисление);
омический процесс — переход электронов с анода на катод:
катод: 2H + + 2 → H2 (на поверхности меди).
Продукт коррозии в кислой среде — хлорид цинка:
Zn 2+ + 2Cl – = ZnCl2.
Очень часто электрохимическая коррозия возникает, когда металл содержит вкрапления металла меньшей активности или неметаллические, но, вместе с тем, токопроводящие включения (как, например, происходит в стали, где есть многочисленные включения карбида железа FeC3), становящиеся катодными участками электрохимической коррозии.
В качестве примера рассмотрим железо, которое в качестве примеси содержит включения меди (рис. 6). Вся конструкция погружена в разбавленный раствор соляной кислоты HCl. На поверхности меди происходит восстановление окислителя, а материал анода окисляется и растворяется:
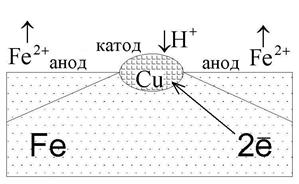 | HCl ←→ H + + Cl – . Анод Fe 0 – 2? → Fe 2+ ; Fe 2+ +2Cl – ←→ FeCl2. Катод H + + ? → Н 0 ; 2H 0 ←→ H2↑. |
| Рис. 6. Коррозия железа с включениями меди |
Электрохимическая коррозия и ЭДС гальванопары.
Возможность протекания коррозии может быть установлена по знаку ЭДС образующегося гальванического элемента. Если ЭДС > 0, то коррозия возможна. ЭДС равна разности потенциалов окислителя и восстановителя (катода и анода), поэтому коррозия возможна при условии, что потенциал катода (окислителя) положительнее потенциала анода (восстановителя). Если на аноде идет растворение металла, то должно быть ЕОх > ЕMen + /Me 0 .
Потенциал кислородного электрода при 298 К описывается уравнением:
Потенциал водородного электрода описывается уравнением:
Графики зависимостей приведены на рис. 7, по ним можно определить возможность протекания коррозии различных металлов в водных средах.
Если потенциал металла положительнее потенциала кислородного электрода (который равен +1,2 В в кислой среде при pH = 1 и составляет около +0,8 В в нейтральной среде при pH = 7), то коррозия металла невозможна (область III).
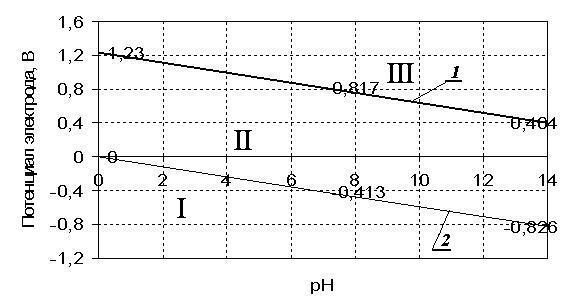 |
| Рис. 7. Зависимость потенциала кислородного (линия 1) и водородного (линия 2) электродов от значения pH среды при PO2 и PH2 = 1 атм |
Если потенциал металла положительнее потенциала водородного электрода (последний равен нулю в кислых средах при pH = 1 и составляет около – 0,41 В в нейтральной среде при pH = 7) и отрицательнее потенциала кислородного электрода (область II), то коррозия возможна с поглощением кислорода и невозможна с выделением водорода.
Если потенциал металла отрицательнее потенциала водородного электрода (область I), то возможна коррозия как с поглощением кислорода, так и с выделением водорода. К таким металлам относятся щелочные, щелочноземельные, алюминий, цинк, и др.
Скорость электрохимической коррозии.
Действие гальванических элементов в значительной мере зависит от поляризации и деполяризации. При этом может происходить как поляризация анода, которая выражается в том, что его потенциал становится более положительным, так и поляризация катода, вызываемая смещением его потенциала в отрицательную сторону.
Поляризация снижает скорость коррозии во много раз. Без поляризации многие металлы, в том числе и железо, корродировали бы с такой высокой скоростью, что потеряли бы свое техническое значение.
Скорость электрохимической коррозии можно определить по формуле:
где I — сила тока, величина которого указывает на скорость коррозии; R — омическое сопротивление раствора электролита; Па — поляризация анода, Пк — поляризация катода; Е — электродвижущая сила.
В зависимости от того, какая из величин (R, Па, Пк) оказывает ограничительное действие на скорость процесса, различают коррозию с различным контролем:
Контролирующая стадия является лимитирующей для всего процесса, т.е. ограничивает скорость коррозии в целом, так как протекает медленнее других. Возможен и смешанный контроль, когда слагаемые в знаменателе приблизительно равны по величине.
Коррозия металлов
Ежегодно из-за коррозии теряются огромные количества металла. По ориентировочным данным от 5 до 30% получаемых чёрных металлов разрушается в результате коррозии. Однако во многих случаях косвенные убытки от коррозии могут значительно превышать прямые потери за счёт растворения металла.
Это и выход из строя металлических конструкций, сложных приборов и аппаратуры, простой оборудования, утечки нефти и газа из прокорродировавших трубопроводов, сопровождаемые при этом нанесением природе невосполнимого экологического ущерба. Поэтому изучение причин, вызывающих коррозию, установление влияния различных факторов на скорость коррозии имеют своей практической целью защиту металлов и сплавов от коррозионного разрушения при их обработке и эксплуатации.
Механизм коррозии.
По механизму протекания коррозионного процесса различают химическую и электрохимическую коррозию.
Химическая коррозия характерна для сред, не проводящих электрический ток. В процессе химической коррозии происходит прямое гетерогенное взаимодействие металлов с окислителем окружающей среды, в результате которого между ними совершается обмен электронами, т.е. протекает обычная ОВР. Примером может служить окисление металлов кислородом воздуха при высоких температурах: Me + O2 ® MeO.
Электрохимическая коррозия возникает при контакте металлов с электролитами (во влажном воздухе, в почве, в растворах электролитов и т.п.) и является результатом протекания сопряжённых электродных процессов в образующихся короткозамкнутых гальванических элементах.
Процессы электрохимической коррозии подобны процессам, протекающим в гальванических элементах. Основным отличием процессов электрохимической коррозии от процессов в гальваническом элементе является отсутствие внешней цепи. Электроны в процессе коррозии двигаются внутри металла от анодных участков к катодным, т.е. образуются короткозамкнутые гальванические элементы, в которых анодные и катодные участки замкнуты накоротко через сам металл.
Отличающиеся по своим физическим и химическим свойствам участки корродирующей поверхности металла, на которых происходит анодный или катодный процессы, являются в зависимости от их размеров короткозамкнутыми макрогальваническими элементами (имеющими размеры, хорошо различимые невооружённым глазом) и микрогальваническими (обнаруживаемыми лишь при помощи микроскопа), т.е. явлются коррозионными элементами.
Обычно поверхность корродирующего металла представляет собой многоэлектродный коррозионный элемент (чередование катодных и анодных участков – рис. 10.6). В первом приближении эту поверхность можно считать как двухэлектродную систему, т.е. состоящую из участков двух видов: анодных и катодных. Коррозионный элемент (короткозамкнутый гальванический элемент) схематично можно изобразить:
(–) А | коррозионная среда | К (+)
При работе коррозионных элементов, т.е. при электрохимической коррозии имеют место три основных процесса (рис. 10.7):
1. Анодный процесс – окисление металла, образование гидратированных ионов металла в электролите и некомпенсированных электронов на анодных участках по реакции:
2. Процесс перетекания электронов по металлу от анодных участков к катодным и соответствующее перемещение катионов и анионов в растворе.
3. Катодный процесс – приём электронов каким – либо окислителем окружающей коррозионной среды (какими – либо ионами или молекулами – деполяризаторами) на границе раздела фаз металл - коррозионная среда:
Ох + ne?® Red или Д + ne? ® [Дne?].
В коррозионных процессах окислитель часто называют деполяризатором 1 (Д); [Дne?] – восстановленная форма окислителя.
Таким образом, электрохимическая коррозия на неоднородной (гетерогенной) поверхности металла аналогична работе короткозамкнутого гальванического элемента.
Наиболее распространёнными окислителями, деполяризаторами в коррозионном процессе являются ионы водорода и молекулы кислорода. Коррозия с участием ионов водорода называется коррозией с выделением водорода или коррозией с водородной деполяризацией.
В наиболее простом виде электродные процессы для этого случая могут быть представлены уравнениями:
а) в кислых растворах (pH < 7)
б) в деаэрированных 2 (удален растворенный кислород) нейтральных и щелочных растворах (рН7)
Потенциал восстановления ионов водорода (потенциал водородного электрода) зависит от парциального давления водорода и рН. При (101кПа) данный потенциал рассчитывается по уравнению:
Например, при рН = 0 ;
Коррозия с водородной деполяризацией возможна, если потенциал восстановления ионов водорода больше потенциала окисляемого металла, т.е. когда ЭДС образующегося короткозамкнутого гальванического элемента больше нуля: Еэ = jк - jа = jок-ль - jв-ль > О.
Скорость коррозии с водородной деполяризацией зависит от рН и температуры среды, природы металла.
Коррозия с участием кислорода называется коррозией с поглощением кислорода или коррозией с кислородной деполяризацией. Электродные процессы в этом случае могут быть представлены уравнениями:
Необходимо отметить, что в обычных условиях во всех растворах есть растворённый кислород – О2. Потенциал восстановления кислорода (потенциал кислородного электрода) зависит от парциального давления кислорода и рН среды. При (101 кПа) данный потенциал рассчитывается по уравнению
Коррозия с кислородной деполяризацией возможна, если потенциал восстановления кислорода больше потенциала окисляемого металла. Данный вид коррозии имеет место в нейтральных, щелочных растворах, во влажном воздухе (О2+Н2О). Скорость коррозии в этом случае определяется скоростью диффузии кислорода и возрастает при перемешивании раствора и увеличении концентрации растворённого кислорода. В кислых растворах в обычных условиях также есть растворённый кислород, но скорость его восстановления в кислых средах мала по сравнению со скоростью восстановления ионов водорода. Поэтому коррозией с кислородной деполяризацией в кислых средах пренебрегают.
На рис. 10.8 представлена диаграмма потенциал – рН, позволяющая определять возможность коррозии различных металлов с водородной и кислородной деполяризацией. Если ЭДС коррозионного элемента Еэ > О, то коррозия возможна. Так как ЭДС равна разности потенциалов окислителя и восстановителя Еэ = jок-ль - jв-ль , то коррозия возможна при условии, что потенциал окислителя больше потенциала металла: . На данной диаграмме выделяются три области.
Область 3: если > , то коррозия металла невозможна, исключая случаи наличия других деполяризаторов. Потенциалы золота, платины, например, в отсутствие комплексообразователя во всей области рН больше потенциала кислородного электрода, поэтому золото и платина корродировать с поглощением О2 и выделением Н2 не могут.
Катодами в коррозионных элементах, как правило, являются:
1. Включения металлов, имеющих больший электродный потенциал.
2. Токопроводящие неметаллические примеси (углерод, нитриды карбиды, оксиды). Например, чугун легко ржавеет во влажном воздухе из-за примеси углерода.
3. Хорошо окисленные участки металла при неодинаковой аэрации.
Коррозия возможна при неодинаковом доступе воздуха (аэрации) к различным частям металла. Наиболее окисленный участок металла является электрохимически более пассивным (электродный потенциал такого участка больше электродного потенциала неокисленного металла). Возникновением короткозамкнутых гальванических элементов вследствие неодинакового доступа кислорода воздуха можно объяснить ржавление железа, сложенного в пачки, внутри пачек; по этой же причине наблюдается ржавление проволочных тросов изнутри, а не снаружи.
4. Недеформированные, необработанные механически участки металла.
При обточке, сверлении, штамповке и других видах механической обработки затраченная энергия частично превращается в тепловую, а частично идёт на увеличение поверхностной энергии обработанного участка (явление наклёпа). В результате обработанная часть детали по сравнению с необработанной обладает повышенным запасом энергии и большей химической активностью и поэтому служит анодом. В присутствии электролита деформированный участок разрушается, катодный процесс восстановления окислителя происходит на поверхности необработанной части детали.
Практическими примерами разрушения металла в результате неодинаковой механической обработки являются ржавление кровельного железа на крыше в местах стыка, где листы подвергались ударам и изгибу, коррозия металлических деталей в местах сверлений.
В реальных условиях в химической устойчивости механических конструкций большую роль играют свойства поверхностных оксидных слоёв, приводящих к пассивации металла.
Пассивность металлов.
Пассивностью металла называют состояние повышенной коррозионной устойчивости, вызываемое торможением анодного процесса в результате образования на поверхности металла защитных плёнок. Продукт окисления (коррозии) создает на поверхности металла плёнку, которая в дальнейшем влияет на процесс коррозии. Например, на поверхности алюминия образуется сплошная, хорошо сцепленная с металлом оксидная плёнка Al2O3, которая защищает его от дальнейшего окисления. Подобные защитные пленки имеются у хрома, цинка, титана и других металлов, что позволяет использовать их в качестве распространённых конструкционных материалов.
У других металлов, например у железа, в условиях контакта с воздухом и влагой образуется пористая, рыхлая, плохо сцепленная с металлом поверхностная плёнка ржавчины, не способная защитить металл от последующего окислительно-восстановительного взаимодействия с окружающей средой. Ржавчина образуется в ходе превращений:
Таким образом, ржавчина – сложные гидратированные оксиды железа. Однако железо можно запассивировать с помощью обработки его концентрированной азотной кислотой:
При этом образуется плотный, предотвращающий дальнейшее разрушение поверхностный оксидный слой. Защиту железа обеспечивает также тонкий плотный слой ортофосфата железа, не растворимый в воде. Фосфатирование сталей и чугуна осуществляется в специальных растворах.
Рассмотрим примеры возникновения и работы короткозамкнутых гальванических элементов в результате контакта двух металлов.
Пример 1. Железо с медью находятся в контакте. Какой металл будет корродировать в растворе хлорида натрия?
Решение. На любом металле, находящемся в электролите, за счёт процессов обмена возникает электродный потенциал, величина которого отражает физико – химическую природу этого элемента и электролита. Чем активнее металл, тем отрицательнее его электродный потенциал. В большинстве случаев состав электролита и внешние условия отличаются от стандартных, поэтому возникающие потенциалы не будут стандартными. В данном случае нас интересуют лишь их относительные величины: какой из двух контактирующих металлов электроотрицательнее, какой – положительнее. Для получения ответа на этот вопрос можно пользоваться таблицей стандартных электродных потенциалов, помня, что потенциалы в этих случаях отличаются от стандартных:
При контакте двух металлов, имеющих различные потенциалы, пойдёт локальный электрический ток – перемещение электронов от железа к меди (рис. 10.9). Несмотря на ушедшие к медному электроду электроны, потенциал железного электрода восстановит свою первоначальную величину за счёт процесса окисления, т.е. железо будет разрушаться с переходом ионов Fe 2+ из металлической решетки в электролит. Электроны, поступившие к меди, казалось бы должны изменить имеющийся у меди потенциал, но этот потенциал будет поддерживаться, т.к. поступившие к меди электроны израсходуются в ходе процесса, потребляющего электроны (процесса восстановления).
Какой именно процесс восстановления будет протекать на меди - зависит от состава электролита. В нейтральном водном растворе NaCl, контактирующем с воздухом, энергетически выгодным будет процесс восстановления кислорода, растворённого в воде. Рис. 10.8 подтверждает термодинамическую возможность коррозии железа с кислородной деполяризацией: .
Схема работы коррозионного элемента для данного случая имеет вид
(-) Fe | водный раствор NaCl | Cu (+)
A: Fe – 2e? = Fe 2+ 2
2Fe + O2 + 2H2O = 2 Fe 2+ + 4OH - = 2 Fe(OH)2$
Ответ: корродирует железо с кислородной деполяризацией; первичные продукты коррозии – Fe 2+ и OH; вторичный продукт коррозии – Fe(OH)2.
Образующийся гидроксид железа (II) подвергается дальнейшему окислению: 4Fe(OH)2 + O2 + 2H2O = 4 Fe(OH)3 .
Аналогичные электродные процессы будут протекать при коррозии железа во влажном воздухе.
Пример 2. Цинк с медью находятся в контакте. Какой металл будет корродировать в деаэрированном растворе хлорида натрия?
(-) Zn | деаэрированный раствор NaCl | Cu (+).
В растворе отсутствует окислитель О2, поэтому здесь можно ожидать коррозию цинка с водородной деполяризацией. Термодинамически этот процесс возможен (см. рис. 10.8), т.к. < .
Ответ: корродирует цинк с водородной деполяризацией. Первичные продукты коррозии – Н2, Zn 2+ и OH; вторичный продукт коррозии – Zn(OH)2.
Пример 3. Марганец содержит примесь меди. Какой металл будет корродировать в растворе соляной кислоты (pH=2)?
(-) Mn раствор HCl Cu(+)
то термодинамически возможна коррозия марганца с водородной деполяризацией (см. рис. 10.8).
Mn + 2H + = Mn 2+ + H2
Ответ: происходит коррозия марганца с водородной деполяризацией, продукты коррозии – Mn 2+ и Н2.
Если в условии задачи неизвестна концентрация кислоты, водородный показатель рН, то решение выполняется для рН = 0.
Гальванический элемент коррозия металлов
8.2 ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ
Причиной электрохимической коррозии * является возникновение на поверхности металла короткозамкнутых гальванических элементов *.
В тонком слое влаги, обычно покрывающем металл, растворяются кислород, углекислый, сернистый и другие газы, присутствующие в атмосферном воздухе. Это создает условия соприкосновения металла с электролитом *. Различные участки поверхности любого металла обладают разными потенциалами. Причинами этого могут быть наличие примесей в металле, различная обработка отдельных его участков, неодинаковые условия (окружающая среда), в которых находятся различные участки поверхности металла. При этом участки поверхности металла с более электроотрицательным потенциалом становятся анодами и растворяются.
Электрохимическая коррозия может развиваться в результате контакта различных металлов. В этом случае будет возникать не микр о- , а макрогальванопара , и коррозия называется контактной (см. детальную классификацию видов коррозии). Сочетания металлов, сильно отличающихся значениями электродных потенциалов *, в технике недопустимы (например, алюминий – медь). В случае коррозии, возникающей при контакте какого-либо металла со сплавом, последний имеет потенциал, соответствующий наиболее активному металлу, входящему в состав сплава. Например, при контакте латуни (сплав цинка и меди) с железом корродировать будет латунь за счет наличия в ней цинка.
Представим схематично работу короткозамкнутого гальванического элемента, возникающего на поверхности металла, подверженного коррозии в электролите * (рисунок 8.1). Анодный участок имеет более электроотрицательный потенциал, поэтому на нем идет процесс окисления металла. Образовавшиеся в процессе окислен ия ио ны переходят в электролит, а часть освободившихся при этом электронов может перемещаться к катодному участку (на рисунке 8.1 показано стрелками). Процесс коррозии будет продолжаться в том случае, если электроны, перешедшие на катодный участок, будут с него удаляться. Иначе произойдет поляризация электродов *, и работа коррозионного гальванического элемента прекратится.
Рисунок 8.1 – Схема электрохимической коррозии. Д – деполяризатор
Процесс отвода электронов с катодных участков называется деполяризацией. Вещества, при участии которых осуществляется деполяризация, называются деполяризаторами. На практике чаще всего приходится встречаться с двумя типами деполяризации: водородной и кислородной. Тип деполяризации (катодный процесс) зависит от реакции среды раствора электролита.
В кислой среде электрохимическая коррозия протекает с водородной деполяризацией. Рассмотрим коррозию железной пластинки с примесями меди во влажной хлористоводородной атмосфере Имеется в виду атмосфера с примесью газообразного HCl. . В этом случае железо будет анодом (E ° = –0,44В), а медь – катодом (E ° =+0,34В). На анодном участке будет происходить процесс окисления железа, а на катодном – процесс деполяризац ии ио нами водорода, которые присутствуют в электролите:
А: Fe – 2e → Fe 2+ – окисление
К: 2 H + + 2e → H2 ↑ – восстановление
Схема возникающего короткозамкнутого гальванического элемента выглядит следующим образом:
A (–) Fe | HCl | Cu (+) К
В нейтральной среде коррозия протекает с кислородной деполяризацией, т.е. роль деполяризатора выполняет кислород, растворенный в воде. Этот вид коррозии наиболее широко распространен в природе: он наблюдается при коррозии металлов в воде, почве и в незагрязненной промышленными газами атмосфере. Если коррозии во влажном воздухе подвергается железо с примесями меди, то электродные процессы можно записать в виде:
(А) Fe – 2e → Fe 2+ – окисление
(К) 2 H2O + O2 + 4e → 4 OH – – восстановление
У поверхности металла в электролите протекают следующие реакции:
Fe 2+ + 2 OH – → Fe( OH)2
Основная масса черных металлов разрушается вследствие процесса ржавления, в основе которого лежат вышеуказанные реакции.
Коррозия металла в результате неравномерного доступа кислорода . Случаи электрохимической коррозии, возникающей вследствие неравномерной аэрации кислородом различных участков металла, очень часто встречаются в промышленности и в подземных сооружениях. Примером может служить коррозия стальной сваи, закопанной в речное дно (рис 8.2).
Рисунок 8.2 – Коррозия в результате неравномерного доступа кислорода. Б – техническое сооружение; А – анодный участок; К – катодный участок.
Часть конструкции, находящаяся в воде, омывается растворенным в ней кислородом и, в случае возникновения условий для электрохимической коррозии, будет выполнять роль катода. Другая же часть конструкции, находящаяся в почве, будет анодом и подвергнется разрушению.
X Международная студенческая научная конференция Студенческий научный форум - 2018

Машины и аппараты, изготовленные из металлов и сплавов, при эксплуатации в природных или технологических средах, подвержены коррозии.
Коррозия – самопроизвольное разрушение материалов вследствие их физико-химического взаимодействия с окружающей средой (агрессивной атмосферой, морской водой, растворами кислот, щелочей, солей, различными газами и т.п.).
Актуальность темы работы: коррозия металлов наносит государству большой экономический ущерб и может приводить к аварийным ситуациям, угрожающим жизни и здоровью людей.
Разработка эффективных методов защиты металлов от коррозии приведет к уменьшению материальных потерь в результате коррозии трубопроводов, деталей машин, судов, мостов, морских конструкций и т.д. Не менее важной задачей является повышение надежности оборудования, которое в результате коррозии может разрушаться с катастрофическими последствиями, к примеру, паровые котлы, металлические контейнеры, сосуды высокого давления, мосты, детали самолётов. Надёжность является важнейшим условием при разработке оборудования АЭС и систем захоронения радиоактивных отходов. Большое значение имеет сохранность металлического фонда, мировые ресурсы которого ограничены. Кроме того, человеческий труд, затрачиваемый на проектирование и реконструкцию металлического оборудования, пострадавшего от коррозии, может быть направлен на решение других общественно полезных задач.
Цель работы: изучить сущность электрохимической коррозии металлов и способы защиты металлов от коррозии.
- изучить виды коррозии металлов;
- изучить механизм электрохимической коррозии;
- изучить методы защиты металлов от коррозии;
- провести экспериментальное исследование процесса коррозии металлов.
Теоретическаячасть
Электрохимическая коррозия – взаимодействие металла с коррозионной средой, при котором ионизация металла и восстановление окислителя протекают раздельно, но являются сопряженными процессами, сопровождающимися протеканием электрического тока. Электрохимическая коррозия следует законам электрохимической кинетики, и её скорость зависит от величины электродного потенциала. Электрохимическая коррозия может иметь место только в электропроводных системах материал – среда, т.е. для металлических материалов – в растворах и расплавах электролитов.
Причиной ее возникновения является химическая, энергетическая и другие виды неоднородности поверхности любого металла или сплава, т.е. разделение на катодные и анодные участки. Последние, имея очень малые размеры и чередуясь друг с другом, в токопроводящей среде представляют собой совокупность огромного числа короткозамкнутых микрогальванических элементов, поэтому электрохимическую коррозию часто называют гальванической коррозией.
Процессы электрохимической коррозии протекают в водных растворах. При соприкосновении металлической поверхности с раствором электролита происходит взаимодействие металла с заряженными частицами раствора и переход ионов металла в раствор. Согласно теории А.Н. Фрумкина, при взаимодействии металла и раствора протекают два сопряженных процесса:
1. Переход ионов из металла в раствор с образованием гидратированных ионов (анодный процесс): Me + mН2O = Меn + · mН2O + ne
2. Переход ионов из раствора с выделением их на поверхности металла в виде нейтральных атомов, входящих в состав кристаллической решетки металла (катодный процесс): Меn + · mН2O + ne = Ме + mН2O
Поверхность любого металла состоит из множества короткозамкнутых через сам металл микроэлектродов. Контактируя с коррозионной средой образующиеся гальванические элементы способствуют его электрохимическому разрушению.
Отличительными особенностями электрохимического процесса коррозии являются следующие:
– одновременное протекание двух раздельных процессов − окислительного (растворение металла) и восстановительного (выделение водорода, восстановление кислорода, выделение металла из раствора и др.);
– процесс растворения металла сопровождается направленным перемещением электронов в металле и ионов в электролите, т.е. возникновением электрического тока;
– продукты коррозии образуются в результате вторичных реакций.
Окислительно−восстановительные процессы, протекающие при электрохимической коррозии, могут быть представлены в виде следующих реакций:
Ме − nē→ Меn + (анодный процесс) (1)
R(ox) + nē → Rn - (катодный процесс), (2)
где R(ox) – окислитель;
Rn - (red) – восстановленная форма окислителя;
nē – количество переданных электронов.
В качестве примера электрохимической коррозии можно привести процесс окисления (ржавления) железа под воздействием воды:
А(–) Fe − 2ē → Fе 2+ (анодный процесс – растворение железа) К(+) H2O + ½О2 +2ē → 2OH - (катодный процесс – восстановление кислорода)
Fe 2+ + 2OH - → Fe(OH)2 (образование продуктов коррозии)
Реакции (1) и (2) протекают сопряженно, но подчиняются своим кинетическим закономерностям. При этом необходимо соблюдение условий стационарности процесса, т.е. равенства скоростей окисления металла и восстановления окислителя. Данные реакции могут быть территориально разделены – протекать на разных участках поверхности. Из условий стационарности вытекает, что достаточно затормозить одну из сопряженных реакций, чтобы скорость всего процесса уменьшилась.
Виды электрохимической коррозии:
Коррозия в кислой среде.
Железо в кислой среде окисляется до Fe 2+ .
Процессы окисления-восстановления на электродах:А (–) Fe 0 - 2ē → Fe 2+ │1 - процесс окисления на аноде К (+) 2Н + + 2ē → Н2↑ │1 - процесс восстановления на катоде
Суммируя реакции на аноде и катоде, получаем уравнение, которое в ионной форме, выражает происходящую в гальванической паре реакцию: Fe 0 + 2H + → Fe 2+ + Н2↑
Уравнение электрохимической коррозии в молекулярной форме:Fe + H2SO4 → FeSO4 + Н2↑
Схема коррозионного элемента: А (–) Fe | Fe 2+ ||2H + | H2 (+) К
Коррозия в атмосфере влажного воздуха.
Процессы окисления-восстановления на электродах: А (–) Fe 0 - 2ē → Fe 2+ │2 - процесс окисления на аноде К (+) 2H2O + О2 + 4ē → 4OH - │1 - процесс восстановления на катоде
Суммируя реакции на аноде и катоде, получаем уравнение, которое в ионной форме, выражает происходящую в гальванической паре реакцию:2Fe 0 + 2H2O + О2 → 2Fe 2+ + 4OH -
Уравнение электрохимической коррозии в молекулярной форме:2Fe + 2H2O + О2 → 2Fe(OH)2↓
Схема коррозионного элемента:
Коррозия в морской воде.
А (–) Fe 0 -2ē → Fe 2+
Схема коррозионного элемента: А (–) Fe | Fe 2+ ||2H2O | H2; 2OH - (+) К
Основным отличием процессов электрохимической коррозии от процессов в гальваническом элементе является отсутствие внешней цепи. Электроны в процессе коррозии не выходят из корродирующего металла, а двигаются внутри металла.
Процесс отвода электронов с катодных участков называется деполяризацией. Вещества, при участии которых осуществляется деполяризация, называются деполяризаторами. На практике чаще всего приходится встречаться с двумя типами деполяризации: водородной и кислородной.
В кислой среде электрохимическая коррозия протекает с водородной деполяризацией. Рассмотрим коррозию железной пластинки с примесями меди во влажной хлористоводородной атмосфере. В этом случае железо будет анодом (E°= –0,44В), а медь – катодом (E°=+0,34В). На анодном участке будет происходить процесс окисления железа, а на катодном – процесс деполяризации ионами водорода, которые присутствуют в электролите:
А (–) Fe – 2ē → Fe 2+ – окисление
К (+) 2H + + 2ē → H2↑ – восстановление
К (+) 2H2O + O2 + 4ē → 4OH - – восстановление
Схема короткозамкнутого гальванического элемента:
Методы защиты металлов от коррозии
При разработке методов защиты от коррозии используют различные способы снижения скорости коррозии, которые выбираются в зависимости от характера коррозии и условий ее протекания. Выбор того или иного способа определяется его эффективностью, а также экономической целесообразностью.
В зависимости от причин, вызывающих коррозию, различают следующие методы защиты.
1) Легирование. Применяется для изменения или улучшения физических и химических свойств металлов, сплавов. В особенности, для придания металлам и сплавам повышенной коррозионной стойкости. Металл, подвергшийся легированию, называется легированным.
2) Наиболее распространены неметаллические защитные покрытия –эмали, лаки, краски, пластмассы, различные смолы, полимеры. Защитное действие этих покрытий сводится в основном к изоляции металлов от окружающей среды. Достоинство этого способа защиты – простота технологии их нанесения. Недостаток – легко разрушаются из-за хрупкости и растрескивания при тепловых и механических ударах; эти покрытия защищают до тех пор, пока сохраняется их целостность.
3) Металлические защитные покрытия.
Классифицируя металлопокрытия по способу защиты основного металла, их обычно подразделяют на катодные и анодные.
Анодные покрытия. Если на металл нанести покрытие из другого, более электроотрицательного металла, то в случае возникновения условий для электрохимической коррозии разрушаться будет покрытие, т.к. оно будет выполнять роль анода. В этом случае покрытие называется анодным. Примером анодного покрытия может служить хром, нанесенный на железо. В случае нарушения целостности покрытия при контакте с влажным воздухом будет работать гальванический элемент:
на аноде: Cr – 2ē → Cr 2+
Cr 2+ + 2 OH – → Cr(OH)2
Гидроксид хрома (II) окисляется кислородом воздуха до Cr(OH)3:
Катодные покрытия. У катодного покрытия стандартный электродный потенциал более положителен, чем у защищаемого металла. Пока слой покрытия изолирует металл от окружающей среды, электрохимическая коррозия не протекает. При нарушении целостности катодного покрытия оно перестает защищать металл от коррозии. Более того, оно даже интенсифицирует коррозию основного металла, т.к. в возникающей гальванопаре анодом служит основной металл, который будет разрушаться. В качестве примера можно привести оловянное покрытие на железе (луженое железо). Рассмотрим работу гальванического элемента, возникающего в этом случае (например, в атмосфере влажного воздуха).
на аноде: Fe – 2ē → Fe 2+
Fe 2+ + 2 OH – → Fe(OH)2
Разрушается защищаемый металл. Таким образом, при сравнении свойств анодных и катодных покрытий можно сделать вывод, что наиболее эффективными являются анодные покрытия. Они защищают основной металл даже в случае нарушения целостности покрытия, тогда как катодные покрытия защищают металл лишь механически.
4) Электрохимическая защита - перевод металла в коррозионно-устойчивое состояние путём торможения катодных и анодных реакций коррозионного процесса электрохимическими методами. Различают три вида электрохимической защиты: катодная, протекторная и анодная.
Катодная защита. Суть катодной защиты заключается в том, что защищаемое изделие подключается к отрицательному полюсу источника электрического напряжения, т.о. становится катодом. В качестве противоэлектрода используется металлический лом или графит.
Протекторная защита. Суть протекторной защиты состоит в следующем. К изделию, подвергающемуся электрохимической коррозии, присоединяют деталь-протектор из более активного металла, чем металлы изделия: протектор является анодом и будет разрушаться, а изделие останется неизменным.
Анодная защита. Анодная защита используется только для тех металлов, которые при анодной нагрузке способны образовывать на своей поверхности пассивные оксидные или солевые пленки, защищающие металл от коррозии, например, железо в серной кислоте. Анодная защита отличается от катодной тем, что защищаемая конструкция присоединяется к положительному полюсу внешнего источника тока.
5) Обработка внешней среды, в которой протекает коррозия. Сущность метода заключается либо в удалении из окружающей среды тех веществ, которые выполняют роль деполяризатора, либо в изоляции металла от деполяризатора. Максимально замедлить процесс коррозии можно путем введения в окружающую среду специальных веществ – ингибиторов. Механизм действия ингибиторов заключается в том, что их молекулы адсорбируются на поверхности металла, препятствуя протеканию электродных процессов.
Данные способы защиты находят широкое применение в промышленности в силу многих своих преимуществ – уменьшения потерь материалов, увеличения толщины покрытия, наносимого за один слой, уменьшения расхода растворителей, улучшение условий производства окрасочных работ и т.д. Защита от коррозии является одной из важнейших проблем, имеющей большое значение для народного хозяйства.
Задачи практической части работы:
- исследовать влияние различных сред на коррозию железа;
- изучить электрохимическую коррозию при контакте металлов;
- ознакомиться с защитными свойствами анодных и катодных покрытий.
Опыт 1. Изучение влияния среды на коррозию железа
Посуда и реактивы: пять химических пробирок, пять железных гвоздей, водопроводная вода, дистиллированная вода, 0,1н раствор хлорида натрия, 0,1н раствор гидроксида натрия, 0,1н раствор соляной кислоты.
Порядок выполнения работы
Пять одинаковых железных гвоздей опускают в пять пробирок. В первую пробирку приливают 0,1н раствор NaCl, во вторую – 0,1н раствор NaOH, в третью – 0,1н раствор HCl, в четвертую – дистиллированную воду, в пятую – водопроводную воду. Закрывают пробирки пробками и в течение месяца наблюдают за происходящими изменениями.
Читайте также:
