Характеристика металла по плану
Обновлено: 04.10.2024
Графическим изображением Периодического закона является Периодическая система (таблица). Горизонтальные ряды системы называют периодами, а вертикальные столбцы – группами.
Всего в системе (таблице) 7 периодов, причем номер периода равен числу электронных слоев в атоме элемента, номеру внешнего (валентного) энергетического уровня, значению главного квантового числа для высшего энергетического уровня. Каждый период (кроме первого) начинается s-элементом — активным щелочным металлом и заканчивается инертным газом, перед которым стоит p-элемент — активный неметалл (галоген). Если продвигаться по периоду слева направо, то с ростом заряда ядер атомов химических элементов малых периодов будет возрастать число электронов на внешнем энергетическом уровне, вследствие чего свойства элементов изменяются – от типично металлических (т.к. в начале периода стоит активный щелочной металл), через амфотерные (элемент проявляет свойства и металлов и неметаллов) до неметаллических (активный неметалл – галоген в конце периода), т.е. металлические свойства постепенно ослабевают и усиливаются неметаллические.
В больших периодах с ростом заряда ядер заполнение электронов происходит сложнее, что объясняет более сложное изменение свойств элементов по сравнению с элементами малых периодов. Так, в четных рядах больших периодов с ростом заряда ядра число электронов на внешнем энергетическом уровне остается постоянным и равным 2 или 1. Поэтому, пока идет заполнение электронами следующего за внешним (второго снаружи) уровня, свойства элементов в четных рядах изменяются медленно. При переходе к нечетным рядам, с ростом величины заряда ядра увеличивается число электронов на внешнем энергетическом уровне (от 1 до 8), свойства элементов изменяются также, как в малых периодах.
Вертикальные столбцы в Периодической системе – группы элементов со сходным электронным строением и являющимися химическими аналогами. Группы обозначают римскими цифрами от I до VIII. Выделяют главные (А) и побочные (B) подгруппы, первые из которых содержат s- и p-элементы, вторые – d – элементы.
Номер А подгруппы показывает число электронов на внешнем энергетическом уровне (число валентных электронов). Для элементов В-подгрупп нет прямой связи между номером группы и числом электронов на внешнем энергетическом уровне. В А-подгруппах металлические свойства элементов усиливаются, а неметаллические – уменьшаются с возрастанием заряда ядра атома элемента.
Между положением элементов в Периодической системе и строением их атомов существует взаимосвязь:
— атомы всех элементов одного периода имеют равное число энергетических уровней, частично или полностью заполненных электронами;
— атомы всех элементов А подгрупп имею равное число электронов на внешнем энергетическом уровне.
План характеристики химического элемента на основании его положения в Периодической системе
Обычно характеристику химического элемента на основании его положения в Периодической системе дают по следующему плану:
— указывают символ химического элемента, а также его название;
— указывают порядковый номер, номер периода и группы (тип подгруппы), в которых находится элемент;
— указывают заряд ядра, массовое число, число электронов, протонов и нейтронов в атоме;
— записывают электронную конфигурацию и указывают валентные электроны;
— зарисовывают электронно-графические формулы для валентных электронов в основном и возбужденном (если оно возможно) состояниях;
— указывают семейство элемента, а также его тип (металл или неметалл);
— сравнивают свойства простого вещества со свойствами простых веществ, образованных соседними по подгруппе элементами;
— сравнивают свойств простого вещества со свойствами простых веществ, образованных соседними по периоду элементами;
— указывают формулы высших оксидов и гидроксидов с кратким описанием их свойств;
— указывают значения минимальной и максимальной степеней окисления химического элемента.
Характеристика химического элемента на примере магния (Mg)
Рассмотрим характеристику химического элемента на примере магния (Mg) согласно плану, описанному выше:
2. Порядковый номер – 12. Элемент находится в 3 периоде, в II группе, А (главной) подгруппе.
3. Z=12 (заряд ядра), M=24 (массовое число), e=12 (число электронов), p=12 (число протонов), n=24-12=12 (число нейтронов).
4.12Mg 1s 2 2s 2 2p 6 3s 2 – электронная конфигурация, валентные электроны 3s 2 .
5. Основное состояние


6. s-элемент, металл.
7. Высший оксид – MgO — проявляет основные свойства:
В качестве гидроксида магнию соответствует основание Mg(OH)2, которое проявляет все типичные свойства оснований:
8. Степень окисления «+2».
9. Металлические свойства у магния выражены сильнее, чем у бериллия, но слабее, чем у кальция.
10. Металлические свойства у магния выражены слабее, чем у натрия, но сильнее, чем у алюминия (соседние элементы 3-го периода).
Примеры решения задач
| Задание | Охарактеризуйте химический элемент серу на основании её положения в Периодической системе Д.И. Менделеева |
| Решение | 1. S – сера. |
2. Порядковый номер – 16. Элемент находится в 3 периоде, в VI группе, А (главной) подгруппе.
3. Z=16 (заряд ядра), M=32 (массовое число), e=16 (число электронов), p=16 (число протонов), n=32-16=16 (число нейтронов).
4.16S 1s 2 2s 2 2p 6 3s 2 3p 4 – электронная конфигурация, валентные электроны 3s 2 3p 4 .


6. p-элемент, неметалл.
7. Высший оксид – SO3 — проявляет кислотные свойства:
8. Гидроксид, соответствующий высшему оксиду – H2SO4, проявляет кислотные свойства:
9. Минимальная степень окисления «-2», максимальная – «+6»
10. Неметаллические свойства у серы выражены слабее, чем у кислорода, но сильнее, чем у селена.
11. Неметаллические свойства у серы выражены сильнее, чем у фосфора, но слабее, чем у хлора (соседние элементы в 3-м периоде).
| Задание | Охарактеризуйте химический элемент натрий на основании её положения в Периодической системе Д.И. Менделеева |
| Решение | 1. Na – натрий. |
2. Порядковый номер – 11. Элемент находится в 3 периоде, в I группе, А (главной) подгруппе.
3. Z=11 (заряд ядра), M=23 (массовое число), e=11 (число электронов), p=11 (число протонов), n=23-11=12 (число нейтронов).
4.11 Na 1s 2 2s 2 2p 6 3s 1 – электронная конфигурация, валентные электроны 3s 1 .

7. Высший оксид – Na2O — проявляет основные свойства:
В качестве гидроксида натрию соответствует основание NaOH, которое проявляет все типичные свойства оснований:
8. Степень окисления «+1».
9. Металлические свойства у натрия выражены сильнее, чем у лития, но слабее, чем у калия.
10. Металлические свойства у натрия выражены сильнее, чем у магния (соседний элемент 3-го периода).
"Характеристика металлов"

Подробная презентация по теме "Металлы" содержит 20 слайдов и дает полную информацию по характеристике металлов как химических элементов и как простых веществ. Может использоваться и в 11 классе при закреплении темы "Металлы"
Просмотр содержимого документа
«"Характеристика металлов"»


Химические элементы- металлы
I. Характеристика химического элемента под
№ 56 на основании его положения в ПСХЭ

Простые вещества – металлы ( стр. 192 – 201)
II. Характеристика простых веществ – металлов по плану:
- Тип химической связи, тип кристаллической решетки
2) Аллотропия металлов
3) Физические свойства
4) Химическая активность металлов
5) Нахождение в природе
6) Роль в жизни человека

Общие химические свойства металлов
Все металлы
проявляют только
восстановительные
свойства

Взаимодействие металлов с неметаллами
Так как металлы являются восстановителями, то они отдают свои электроны неметаллам, которые, разумеется, проявляют при этом окислительные свойства. В результате образуются бинарные соединения, названия которых формируются по единому принципу:
« неметалл ИД» + « металл а» (с.о ., если переменная)

Взаимодействие с галогенами
металлы взаимодействуют с галогенами с образованием солей, поэтому галогены так и называют, т.е. «рождающие соли»
2 Na 0 + Cl 2 0 = 2 Na + Cl -
2 Sb 0 + 3 Cl 2 0 = 2 Sb +3 Cl 3 -
2 Sb 0 + 5 Cl 2 0 = 2 Sb +5 Cl - 5

Взаимодействие с серой и хлором
В случае переменной степени окисления у металла продукт его взаимодействия с неметаллом зависит от окислительных свойств последнего.
Например, при взаимодействии железа с серой образуется сульфид железа (II), а с хлором – хлорид железа (III):
Fe 0 + S 0 = Fe +2 S -2 2 Fe 0 + 3 Cl 0 2 = 2 Fe +3 Cl 3 -

Взаимодействие с кислородом
При взаимодействии с кислородом металлы образуют различные по составу продукты: оксиды, а также пероксиды. Полученные в результате таких реакций оксиды проявляют или основные или амфотерные свойства.
Например, при горении лития и магния образуются основные оксиды:
4 Li 0 + O 0 2 = 2 Li 2 + O -2 2 Mg 0 + O 2 0 = 2 Mg +2 O -2

Последняя реакция сопровождается выделением такого яркого света, что использовалась первыми фотографами в качестве вспышки при съемке

Горение алюминия – основа пиротехнических средств
Алюминий сгорает ярким, ослепительным пламенем, а потому в порошке применяется в качестве компонента зажигательных ракет, фейерверков, салютов, бенгальских огней и других пиротехнических средств:
4 Al 0 + 3 O 2 0 = 2 Al 2 +3 O 3 -2

Взаимодействие железа с кислородом
Железо сгорает в кислороде с образованием оксида, формула которого Fe 3 O 4 - железная окалина ( Fe +2 O -2 ∙ Fe 2 +3 O 4 -2 )
3 Fe 0 + 2 O 2 0 = Fe 3 O 4

Взаимодействие натрия с кислородом
Натрий при взаимодействии с кислородом образует не оксид, а пероксид:
2Na 0 + O 2 0 = Na 2 +1 O 2 -1
пероксид натрия обязательный химикат на борту подводной лодки или космического корабля, так как обладает способностью регенерировать кислород из углекислого газа: 2 Na 2 O 2 + 2 CO 2 = 2 Na 2 CO 3 + O 2

Взаимодействие металлов с водой
При обычных условиях энергично взаимодействуют с водой щелочные и щелочноземельные металлы, при этом образуются щелочь и водород:
Ca 0 + 2 H 2 O = Ca(OH) 2 + H 2

Взаимодействие металлов с растворами кислот
Способность металлов взаимодействовать с растворами кислот и следующие свойства металлов вытекают из их положения в электрохимическом ряду напряжений:
K, Ca, Na, Mg, Al, Zn, Fe, Sn, Pb, (H 2 ) , Cu, Hg, Ag, Au
Металлы взаимодействуют с растворами кислот при соблюдении ряда условий:

- Металл должен находиться в ряду напряжений левее водорода;
2) В результате реакции должна образоваться растворимая соль , так как в противном случае она покроет металл осадком и доступ кислоты к металлу прекратится;
3) Для этих реакций не рекомендуется использовать щелочные металлы;
4) по-особому взаимодействуют с металлами концентрированная серная кислота и азотная кислота любой концентрации
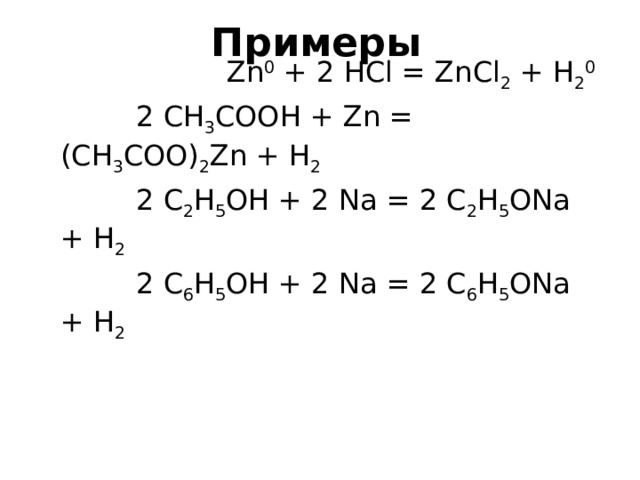
Zn 0 + 2 HCl = ZnCl 2 + H 2 0
2 CH 3 COOH + Zn = (CH 3 COO) 2 Zn + H 2
2 C 2 H 5 OH + 2 Na = 2 C 2 H 5 ONa + H 2
2 C 6 H 5 OH + 2 Na = 2 C 6 H 5 ONa + H 2

Взаимодействие металлов с растворами солей
при соблюдении ряда условий:
1) Металл должен находиться в ряду напряжений левее металла, образующего соль;
2) Должна образоваться растворимая соль
3) Для этих реакций не рекомендуют щелочные металлы
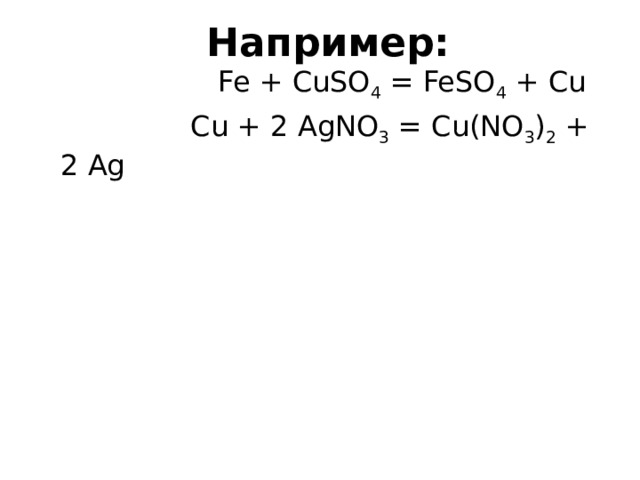
Fe + CuSO 4 = FeSO 4 + Cu
Cu + 2 AgNO 3 = Cu(NO 3 ) 2 + 2 Ag

Металлотермия
Некоторые активные металлы – литий, магний, кальций, алюминий – способны вытеснять другие металлы из их оксидов. Это свойство используют для получения некоторых металлов, а также для изготовления термитных смесей. Так, хром получают с помощью алюмотермии:
2 Al + Cr 2 O 3 = Al 2 O 3 + 2 Cr
Характеристика химического элемента-металла на основании его положения в Периодической системе Д. И. Менделеева

Оборудование: Таблица Д. И. Менделеева. Простые вещества — металлы и неметаллы, компьютер, проектор, презентация по теме.
Ход и содержание урока
I . Организационный момент
Приветственное слово учителя. Поздравление ребят с началом нового учебного года.
П. Повторение основных теоретических вопросов программы 8 класса
Основным вопросом программы 8 класса является Периодическая система химических элементов Д. И. Менделеева. Она же является базой для изучения курса химии 9 класса.
Напоминаю, что таблица Д. И. Менделеева представляет собой «дом», в котором живут все химические элементы. Каждый элемент имеет номер (порядковый), который можно сравнить с номером квартиры. «Квартира» расположена на определенном «этаже» (т. е. периоде) и в определенном «подъезде» (т. е. группе). Каждая группа в свою очередь делится на подгруппы: главную и побочную. Пример: элемент магний Mg имеет порядковый номер (№) 12 и расположен в третьем периоде, в главной подгруппе второй группы.
Свойства химического элемента зависят от его положения в таблице Д. И. Менделеева. Поэтому очень важно научиться характеризовать свойства химических элементов на основании их положения в Периодической системе.
III . План характеристики химического элемента на основании его положения в Периодической системе Д. И. Менделеева
Алгоритм характеристики: (3-5 слайды)
1. Положение элемента в ПС
а) порядковый номер химического элемента
б) период (большой или малый).
г) подгруппа (главная или побочная)
д) относительная атомная масса.
2. Состав и строение атома элемента
а) число протонов (р + ), нейтронов ( n 0 ), электронов (е - )
в) число энергетических уровней в атоме
г) число электронов на уровнях
д) электронная формула атома
е) графическая формула атома
ж) семейство элемента.
Три последних пункта, для хорошо подготовленных классов.
3. Свойства атома
а) способность отдавать электроны (восстановитель)
б) способность принимать электроны (окислитель).
Записать в виде схем-уравнений. Сравнить с соседними атомами.
4. Возможные степени окисления.
5. Формула высшего оксида, его характер.
6. Формула высшего гидроксида, его характер.
7. Формула летучего водородного соединения, его характер.
Обратить внимание: При рассмотрении пунктов 5 и 7 все формулы высших оксидов и летучих водородных соединений помещены внизу таблицы Д. И. Менделеева, что фактически является «законной шпаргалкой».
Так как в начале, при характеристике элементов ребята могут испытывать определенные трудности, поэтому им полезно пользоваться «законными шпаргалками» — табл. 1 и др. Потом, по мере накопления опыта и знаний, эти помощники уже не потребуются.
Задание: Охарактеризуйте химический элемент натрий на основании его положения в периодической системе Д.И. Менделеева. (слайд 6)
Работает весь класс, записи поочередно ведут обучающиеся на доске.
Образец ответа. (слайд 7)
Na – натрий
1) 11, 3 период, малый, 1 группа, А
2) 11 р + , 12n 0 , 11 е -
1s 2 2s 2 2p 6 3s 1 3p 0 3d 0 - s - элемент
3) Na 0 – 1 e → Na +
восстановитель
R a: Li Mg
по группе по периоду
Ме св-ва: Li Na K Na Mg
4) Na : 0, +1
5) Na 2 O – основный оксид
6) NaOH – основание, щелочь.
7) Не образует
IV . План характеристики простого вещества.
Каждый химический элемент образует простое вещество, обладающее определенным строением и свойствами. Простое вещество характеризуют по следующим параметрам: (слайд 8)
2) Тип кристаллической решетки.
3) Физические свойства.
4) Химические свойства (схема).
Образец ответа: (слайд 9)
- Металлическая связь [ Na 0 – 1 e → Na + ]
- Металлическая кристаллическая решетка
- Твердое вещество, мягкий металл (режется ножом), белого цвета, блестящий, тепло-и электропроводен.
Металл продемонстрировать. Отметить, что в связи с высокой химической активностью, его хранят под слоем керосина.
- Na 0 – 1 e → Na + → взаимодействует с веществами-окислителями
+ неметаллы + оксиды металлов (менее активные)
Задание: Запишите уравнения реакций, характеризующие свойства простого вещества натрия. Рассмотрите уравнения с позиций окислительно-восстановительных процессов. (слайд 10)
Пять учащихся по желанию работают у доски.
1) 2 Na + Cl 2 → 2 NaCl
Na 0 – 1 e → Na + │2 восстановитель - окисление
Cl 2 0 + 2 e → 2 Cl - │1 окислитель - восстановление
2) 2 Na + 2 HCl → 2 NaCl + H 2
2 H + + 2 e → H 2 0 │1 окислитель - восстановление
3) 2 Na + 2 H 2 O → 2 NaOH + H 2
4) 2 Na + MgO → Na 2 O + Mg
Mg 2+ + 2 e → Mg 0 │1 окислитель - восстановление
5) 2 Na + CuCl 2(расплав) → 2 NaCl + Cu
Cu 2+ + 2 e → Cu 0 │1 окислитель - восстановление
V . План характеристики соединений.
Для каждого химического элемента характерно образование сложных веществ различных классов – оксиды, основания, кислоты, соли. Основными параметрами характеристики сложного вещества являются: (слайд 11)
- Химические свойства соединения (схема).
I . Оксид (слайд 12)
Солеобразующий, основный оксид.
основный оксид + кислота → соль и вода
основный оксид + кислотный оксид → соль
основный оксид + Н2О → щелочь
II. Гидроксид (слайд 13)
3) Основание, щелочь.
4) Химические свойства:
основание (любое) + кислота = соль + вода
щёлочь + соль = новое основание + новая соль
щёлочь + оксид неметалла = соль + вода
Самостоятельная работа.
Задание: Запишите уравнения реакций, характеризующие свойства оксида и гидроксида. Уравнения рассмотрите с позиций окислительно-восстановительных процессов и ионного обмена. (слайд 14)
Оксид натрия:
l ) Na 2 O + 2 HC 1 = 2 NaCl + Н2О (реакция обмена)
2) Na 2 O + SO 2 = Na 2 SO 3 (реакция соединения)
3) Na 2 O + H 2 O = 2 NaOH (реакция соединения)
Гидроксид натрия:
2 Na + + 2ОН - + 2Н + + SO 4 2- = 2 Na + + SO 4 2- + 2Н2О
2) 2 NaOH + СО2 = Na 2 CO 3 + Н2О (реакция обмена)
2 Na + + 2ОН- + СО2 = 2 Na + + СО3 2- + Н2О
3) 2NaOH + CuSO 4 = Na 2 SO 4 + Cu (OH) 2 ( реакция обмена )
2Na + + 2 ОН - + Cu 2+ + SO 4 2- = 2Na + + SO 4 2- + Cu (OH) 2
2 OH - + Cu 2+ = Cu ( OH )2
Вспомнить условия протекания реакций обмена до конца (образование осадка, газа или слабого электролита).
Для натрия, как и для всех металлов, характерно образование генетического ряда: (слайд 15)
Металл → основный оксид → основание (щелочь) → соль
Домашнее задание (слайд 16)
§ 1, упр. 1 (б), 3; составить уравнения реакций для генетического ряда Na
Просмотр содержимого презентации
«Характеристика элемента-металла»

Урок: «Характеристика химического элемента-металла на основании его положения в Периодической системе Д. И. Менделеева» урок химии, 9 класс

характеристики элемента
д) относительная атомная масса
а) число протонов (р+), нейтронов ( n 0 ), электронов (е - )
Задание: Охарактеризуйте химический элемент натрий на основании его положения в периодической системе Д.И. Менделеева.
План характеристики простого вещества
Образец ответа
- Металлическая связь [ Na 0 – 1 e → Na + ]
- Металлическая кристаллическая решетка
- Твердое вещество, мягкий металл (режется ножом), белого цвета, блестящий, тепло - и электропроводен.
- Na – восстановитель → взаимодействует с веществами-окислителями
+ оксиды металлов (менее активные )

Задание : Запишите уравнения реакций, характеризующие свойства простого вещества натрия.
Рассмотрите уравнения с позиций окислительно-восстановительных процессов.

План характеристики соединений
Образец ответа: Оксид натрия
- Na 2 O
- Ионная связь
- Солеобразующий, основный оксид.
- Химические свойства:
- основный оксид + кислота → соль и вода
- основный оксид + кислотный оксид → соль
- основный оксид + Н 2 О → щелочь

Гидроксид натрия
- NaOH
- Ионная связь
- Основание, щелочь.
- Химические свойства:
- щёлочь + кислота = соль + вода
- щёлочь + соль = новое основание + новая соль
- щёлочь + оксид неметалла = соль + вода

Самостоятельная работа
Задание: Запишите уравнения реакций, характеризующие свойства оксида и гидроксида.
Уравнения рассмотрите с позиций окислительно-восстановительных процессов и ионного обмена.

Генетический ряд натрия
Металл → Основный оксид →
→ Основание (щелочь) → Соль
Na → Na 2 O → NaOH → NaCl ( Na 2 SO 4 , NaNO 3 , Na 3 PO 4 )
Конспект урока: "Положение элемента-металла в ПСХЭ"
Тема урока: « Характеристика химического элемента-металла на основании его положения в Периодической системе Д. И. Менделеева.
Тип урока: изучение нового материала.
Цель урока: разработка плана (опорной схемы) характеристики химического элемента-металла на основании его положения в Периодической системе химических элементов Д.И. Менделеева.
Задачи урока:
Образовательные: рассмотреть положение металлов в ПСХЭ; изучить особенности электронного строения металлов, изменение их свойств в периодах и группах;; повторить и обобщить знания учащихся о физических свойствах металлов.
Развивающие: развивать: умения для поиска взаимосвязи между изученным ранее и новым материалом; логическое мышление (умения сравнивать, наблюдать, обобщать, делать выводы);
Воспитательные: воспитывать самостоятельность, терпимость и уважение к своим партнерам, чувство ответственности, уверенность в себе.
Ход и содержание урока
I . Организационный момент (1 – 2 мин)
Приветственное слово учителя, проверка готовности кабинета и рабочего места ученика.
II . Актуализация знаний: химическая разминка (10 мин)
Таблица Д. И. Менделеева представляет собой «дом», в котором живут все химические элементы. Каждый элемент имеет номер (порядковый), который можно сравнить с номером квартиры. «Квартира» расположена на определенном «этаже» (т. е. периоде) и в определенном «подъезде» (т. е. группе). Каждая группа в свою очередь делится на подгруппы: главную и побочную. Пример: элемент магний Mg имеет порядковый номер (№) 12 и расположен в третьем периоде, в главной подгруппе второй группы.
1. Сколько групп находится в ПСХЭ?
2. Какая подгруппа называется главной, а какая побочной?
3. Какие периоды относят к большим, а какие к малым?
4. Чему равен заряд ядра атома?
5. Как определить максимальное количество электронов на внешнем энергетическом уровне?
6. Какие вещества называют оксидами?
7. Какие оксиды называют основными?
кислотными?
8. Какие вещества называют гидроксидами?
III . Изучениее нового материала (15 мин)
План характеристики химического элемента на основании его положения в Периодической системе Д. И. Менделеева
в ) число энергетических уровней в атоме
IV . Закрепление изученного (15 мин)
Задание: Охарактеризуйте химический элемент натрий на основании его положения в периодической системе Д.И. Менделеева.
Образец ответа.
Na – натрий
1) 11, 3 период, малый, 1 группа, А
2) 11 р + , 12n 0 , 11 е -
1s 2 2s 2 2p 6 3s 1 3p 0 3d 0 - s - элемент
3) Na 0 – 1e → Na +
восстановитель
по группе по периоду
4) Na : 0, +1
5) Na 2 O – основный оксид
6) NaOH – основание, щелочь.
Для натрия, как и для всех металлов, характерно образование генетического ряда:
V . Домашнее задание:
Общая характеристика металлов 9 класс
Древние алхимики говорили: «Семь металлов создал свет по числу семи планет», – и полагали, что под влиянием лучей планет в недрах Земли и рождаются металлы. Солнце – золото (Au), Юпитер – олово (Sn), луна – серебро (Ag), Марс – железо (Fe), Меркурий – ртуть (Hg), Сатурн – свинец (Pb), Венера – медь (Cu). Само слово «металл», по-видимому, происходит от греческого «металлон», что означает «рудники», «копи». В истории человечества выделяют века: медный, бронзовый, железный.
Если провести диагональ от бора к астату, то в левом нижнем углу ПСХЭ будут находиться металлы. Всего в ПТ 110 химических элементов из них 96 металлы и 22 неметалла.
К металлам относятся все s -элементы (искл. Водород и гелий), большинство p -элементов, все d - и f -элементы. У металлов на внешнем энергетическом уровне 1-3, реже 4 (у олова) и 5 (у висмута) электрона, поэтому проявляют восстановительные свойства.
В периодах слева направо металлические свойства химических элементов ослабевают, так как происходит уменьшение радиуса атома, увеличивается заряд ядра атома, электроотрицательность химических элементов. В главных подгруппах сверху вниз металлические свойства усиливаются, увеличивается заряд ядра атома, уменьшается электроотрицательность
Металлы – простые вещества, обладающие в обычных условиях характерными свойствами: высокими электропроводностью и теплопроводностью, способностью хорошо отражать свет (что обуславливает их блеск и непрозрачность), возможностью принимать нужную форму под воздействием внешних сил (пластичностью). Существует и другое определение металлов – это химические элементы, характеризующиеся способностью отдавать внешние (валентные) электроны.
Из всех известных химических элементов около 90 являются металлами. Большинство неорганических соединений – это соединения металлов.
Металлическая связь – это химическая связь, образующаяся между катионами и свободно движущимися электронами в металлической кристаллической решетке.
Изобразить электронную и графическую формулу атома магния; показать схему образования катиона магния.
Определить вид химической связи и тип кристаллической решетки для магния и хлорида магния.
- Сделать вывод о количестве электронов на последнем энергетическом уровне атома и иона магния.
- Сравнить количество электронов на последнем уровне у металлов и неметаллов. Есть ли металлы, у которых на последнем уровне больше трех электронов?
- Сравнить атомный радиус металлов и неметаллов.
- Рассмотреть влияние атомного радиуса металлов на их окислительно-восстановительные свойства.
1 вариант: распределить металлы по возрастанию температуры плавления
2 вариант: распределить металлы по возрастанию плотности
Что такое металлическая связь?
Какие силы существуют между катионами и электронами в металлической кристаллической решетке?
Почему медь проводит электрический ток?
Почему железо обладает ковкостью?
Опираясь на расположение металлов в ПСХЭ, сравните температуры плавления у металлов проставьте знаки «˃» «˂» между парами металлов:
Объясните свой выбор
Анализируют факты и ставят знакХимические свойства металлов.
Слева направо по ряду химическая активность металлов убывает. Активные металлы (до алюминия). Металлы средней активности (между алюминием и водородом). Неактивные металлы (правее водорода).
Металлы расположены в порядке убывания восстановительных свойств при реакциях в растворах. Ме, стоящие в ряду до водорода, вытесняют его из растворов кислот. Ме, стоящие в рядулевее, вытесняют правее стоящий Ме из растворов его солей.
Ме, стоящие в ряду до алюминия, взаимодействуют с водой с образованием щелочей и выделением водорода.
Остальные Ме- в жестких условиях с образованием оксида Ме и водорода. Ме, стоящие в ряду за водородом, не взаимодействуют с водой.
Читайте также:
