Характерными признаками металлов являются
Обновлено: 01.07.2024
Определение металлов можно дать с позиций химии, физики и техники.
В химии металлы — это химические элементы, находящиеся в левой части периодической системы элементов Д. И. Менделеева, которые обладают особым механизмом взаимодействия валентных электронов (ионов) с ядром как в самих металлах, так и при вступлении в химические реакции с другими элементами, в том числе с металлами.
Физика характеризует металлы как твердые тела, обладающие цветом, блеском, способностью к плавкости (расплавлению) и затвердеванию (кристаллизации), тепло- и электропроводностью, магнитными и другими свойствами.
В технике металлы — это конструкционные материалы, обладающие высокой обрабатываемостью (ковкостью, штампуемостью, обрабатываемостью резанием, паяемостью, свариваемостью и др.), прочностью, твердостью, ударной вязкостью и рядом других ценных свойств, благодаря которым они находят широкое применение.
Русский ученый М. В. Ломоносов (1711 — 1765), исследуя металлы и неметаллы в своем труде «Первые основания металлургии или рудных дел», дал металлам определение: «Металлом называется светлое тело, которое ковать можно. Таких тел находим только шесть: золото, серебро, медь, олово, железо и свинец». Это определение М. В. Ломоносов дал в 1773 г., когда известны были только шесть металлов.
Из металлов, добываемых из недр земли, получают большую группу конструкционных материалов, применяемых в различных отраслях промышленности. В природе одни металлы встречаются в чистом, самородном виде, другие — в виде оксидов (соединений металла с кислородом), нитридов и сульфидов, из которых состоят различные руды этих металлов.
Самыми распространенными металлами, применяемыми в качестве конструкционных материалов, являются железо, алюминий, медь и сплавы на основе этих металлов.
К металлам относятся более 80 элементов периодической системы Менделеева. Все эти металлы подразделяются на две большие группы: черные металлы и цветные металлы.
Характерными признаками черных металлов являются темно-серый цвет, блеск, высокие плотность и температура плавления, твердость, прочность, вязкость и полиморфизм (аллотропия). По физикохимическим свойствам черные металлы подразделяют на пять групп:
- железистые (железо, кобальт, никель, марганец);
- тугоплавкие (вольфрам, рений, тантал, молибден, ниобий, ванадий, хром, титан и др.);
- урановые — актиниды (уран, торий, плутоний и др.);
- редкоземельные — лантаниды (лантан, церий, иттрий, скандий и др.);
- щелочно-земельные (литий, натрий, калий, кальций и др.).
Из этих пяти групп черных металлов особенно широкое применение в промышленном производстве находят железистые и тугоплавкие металлы.
Железистые металлы, кроме марганца, называют еще ферромагнетиками. Ферромагнетики способны намагничиваться и притягивать металлы своей группы.
К тугоплавким относятся металлы, которые имеют температуру плавления выше температуры плавления железа (1 539 °С): титан — 1 667 °С, ванадий — 1 902 °С, хром — 1 903 °С, молибден — 2 615 °С, ниобий — 2 460 °С, тантал — 2 980 °С, вольфрам — 3 410 °С. Тугоплавкие металлы в основном применяются как легирующие элементы в производстве жаропрочных, жаростойких, теплостойких и специальных сплавов, в том числе твердых сплавов и высоколегированных сталей.
2. Строение металлов
Атомно-кристаллическая структура металлов. Как известно, все вещества состоят из атомов, в том числе и металлы. Каждый металл (химический элемент) может находиться в газообразном, жидком или твердом агрегатных состояниях. Каждое агрегатное состояние будет иметь свои особенности, отличные друг от друга. В газообразном металле расстояние между атомами велико, силы взаимодействия малы и атомы хаотично перемещаются в пространстве; газ стремится к расширению в сторону большего объема. При понижении температуры и давления вещество переходит в жидкое состояние. Свойства жидкого вещества резко отличаются от свойств газообразного. В жидком металле атомы сохраняют лишь так называемый ближний порядок атомов, т. е. в объеме расположено небольшое количество атомов, а не атомы всего объема. При понижении температуры жидкий металл переходит в твердое состояние, которое имеет строгую закономерность расположения атомов.
Если условно провести вертикальные и горизонтальные линии связи через центры атомов, можно увидеть, что у металлов в твердом состоянии атомы расположены в строго определенном порядке и представляют собой множество раз повторяющиеся элементарные геометрические фигуры — параллелепипеды (рис. 1). Наименьшую геометрическую фигуру называют элементарной ячейкой. Элементарные ячейки, расположенные на горизонтальных и вертикальных кристаллографических плоскостях (рис. 2), образуют пространственную кристаллическую решетку.
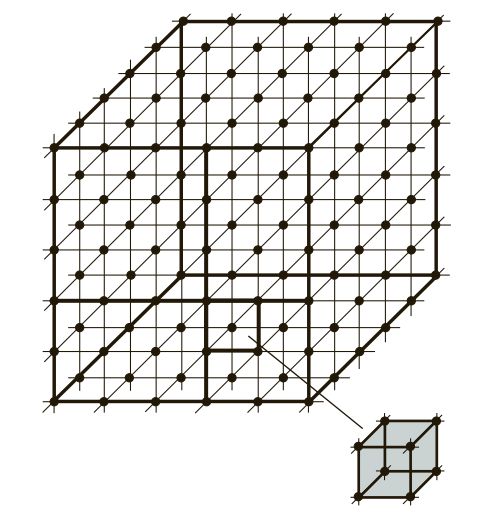
Рис. 1. Схема расположения элементарных геометрических ячеек в атомных решетках металлов и сплавов
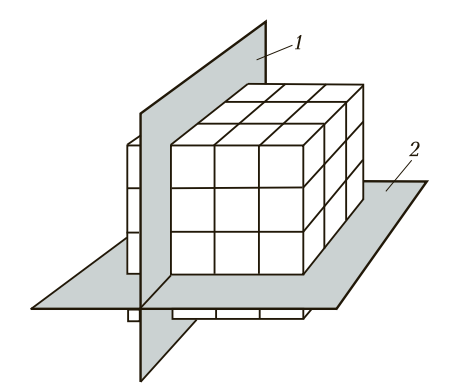
Рис. 2. Расположение кристаллографических плоскостей: 1 и 2 — соответственно горизонтальная и вертикальная кристаллографические плоскости
Элементарные кристаллические решетки характеризуют следующие основные параметры: расстояние между атомами по осям координат (по линиям связи), углы между линиями связи, координационное число — число атомов, находящихся на наиболее близком и равном расстоянии от любого атома в решетке. Форму элементарной ячейки рассматривают по кристаллографическим плоскостям в трех измерениях.
Таким образом, любой металл можно представить не как однородную цельную массу, а как массу, сложенную из множества элементарных ячеек. Блок элементарных атомных кристаллических ячеек образует атомно-кристаллическую ячейку (решетку). Если выделить эту элементарную ячейку, то в зависимости от металла получим следующие типы кристаллических ячеек (рис. 3): куб (К), объемно-центрированный куб (ОЦК), гранецентрированный куб (ГЦК), гексагональная плотноупакованная ячейка (ГПУ), гексагональная простая ячейка (Г) и др.
Простая кубическая ячейка (рис. 3, а) характерна для неметаллов, которые обладают наибольшими плотностью и удельным весом, и имеет восемь атомов, которые расположены в каждой вершине куба.
Объемно-центрированная кубическая ячейка (рис. 3, б ) состоит из восьми атомов, которые расположены по одному атому в каждой вершине куба, и одного, находящегося в центре куба на равных расстояниях от его граней. Эту форму атомной кристаллической ячейки имеют железо модификации Fe-α, ванадий, вольфрам, молибден, тантал и хром, т. е. в основном черные металлы.
Гранецентрированная кубическая ячейка (рис. 3, в) имеет 14 атомов — по одному атому в каждой вершине куба (восемь атомов) и по одному атому в центре каждой грани (шесть атомов). Гранецентрированную кубическую ячейку имеют алюминий, железо модификации Fe-γ, золото, кобальт, медь, никель, платина и серебро, в основном это цветные металлы и часть черных металлов.
Гексагональная плотноупакованная ячейка (рис. 3, г) состоит из 17 атомов. Форма геометрического тела, которую образуют эти атомы, является шестигранной призмой. При этом по шесть атомов расположены в каждой вершине верхнего и нижнего оснований, по одному атому в центре этих оснований и три атома в центре одной их трех граней (через грань). Гексагональную плотноупакованную ячейку имеют бериллий, кадмий, магний, ванадий, тантал.
Простая гексагональная ячейка (рис. 3, д) состоит из 12 атомов, которые расположены в вершинах верхнего и нижнего оснований шестигранной призмы. Такую кристаллическую ячейку имеют ртуть и цинк.
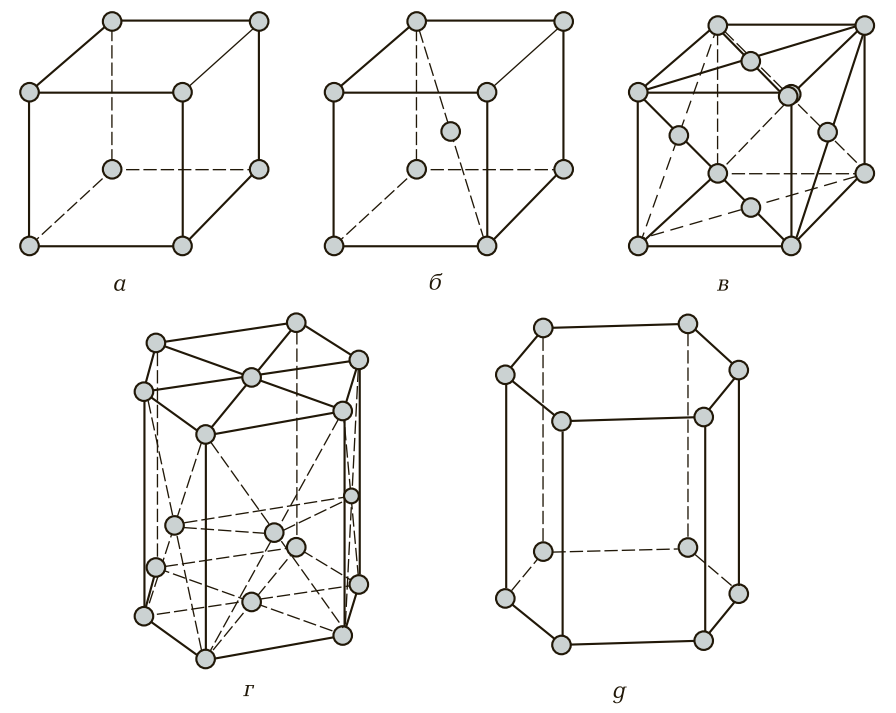
Рис. 3. Геометрические формы элементарных кристаллических ячеек: а — куб; б — объемно-центрированный куб; в — гранецентрированный куб; г — гексагональная плотноупакованная ячейка; д — гексагональная простая ячейка
Связь между атомами в кристаллической решетке и между решетками осуществляется за счет так называемой металлической связи. От прочности этой связи зависят прочность и твердость металлов. Чем выше эта связь, тем бо´льшую прочность и твердость имеют металлы. Механизм связи между атомами в решетке и между решетками имеет сложную физико-химическую природу.
В практике идеальное расположение кристаллических решеток обычно не наблюдается. Кристаллы, образуемые кристаллическими решетками, имеют искаженную геометрическую форму и различную величину.
Анизотропия металлов. Анизотропия (от гр. anisos — неравный и tropos — направление) — неодинаковость физических свойств среды (тела) в различных направлениях. Анизотропия предполагает зависимость свойств металлов от направления по плоскостям атомно-кристаллических решеток. Чем больше в плоскости атомов, тем выше свойства металлов. В горизонтальных плоскостях в любой форме атомно-кристаллических решеток больше, чем в вертикальных плоскостях. Следовательно, прочность металлов, испытанная в горизонтальном направлении, выше, чем в вертикальном. Анизотропия проявляется в процессе обработки конструкционных материалов давлением (проката, волочения, штамповки и других технологических способов получения заготовок и изделий).
На рис. 2 кристаллографические плоскости совпадают с линиями связи, проходящими через атомы металла. Форма элементарной кристаллической ячейки, расстояние между атомами и прочность металлической связи определяют физические, механические и технологические свойства металлов. Если исследуемый металл рассматривать по трем кристаллографическими плоскостям, по линиям связи между атомами, то можно заметить, что свойства по этим трем измерениям будут различны. Число атомов в этих плоскостях неодинаково. Металлическая связь между горизонтально и вертикально расположенными атомами также неодинакова. Это, в свою очередь, приводит к различной прочности металлов в продольном и поперечном направлениях. Например, предел прочности меди в продольном направлении будет в 2 раза больше, чем в поперечном.
Все металлы анизотропны, так как они состоят из кристаллов. Кристаллическое строение металлов обусловливает пластическую деформацию, т. е. изменение внешней формы и размеров под действием нагрузок без разрушения. Способность металлов и сплавов пластически деформироваться положена в основу их обработки давлением (прокатка, волочение, ковка, штамповка и прессование). При обработке давлением, например прокатке (рис. 4, а), происходит перемещение одного слоя атомных решеток по другому по кристаллографическим плоскостям (рис. 4, б).
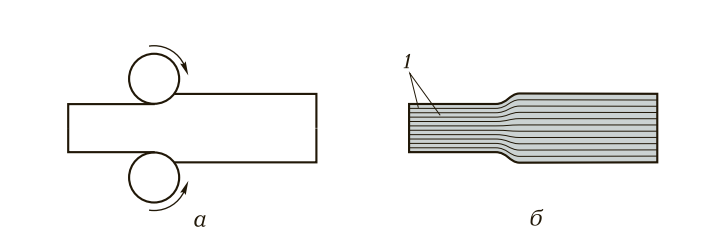
Рис. 4. Схема деформации металлов и сплавов (прокатка): а — деформация; б — скольжение металлов по кристаллографическим плоскостям в процессе деформации; 1 — кристаллографические плоскости
В процессе деформации металла при прокатке происходит не только изменение поперечных и продольных размеров заготовок, но и изменение микроструктуры металла.
Зерна под действием давления прокатных валков искажаются, приобретая продолговатую или пластинчатую форму, а затем преобразуются в волокна. Изменение микроструктуры металла в процессе деформации условно показано на рис. 5.
Процесс кристаллизации. Рассмотрим, как происходит образование кристаллов у чистых металлов. Установлено, что процесс кристаллизации металлов из жидкого состояния в твердое идет в две стадии:
- образование центров кристаллизации;
- рост кристаллов вокруг этих центров (рис. 6).
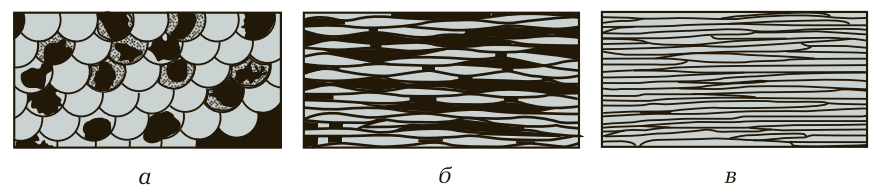
Рис. 5. Изменение микроструктуры металла в процессе деформации: а — микроструктура металла до деформации; б — микроструктура металла после первой операции деформации; в — микроструктура металла после окончательной деформации
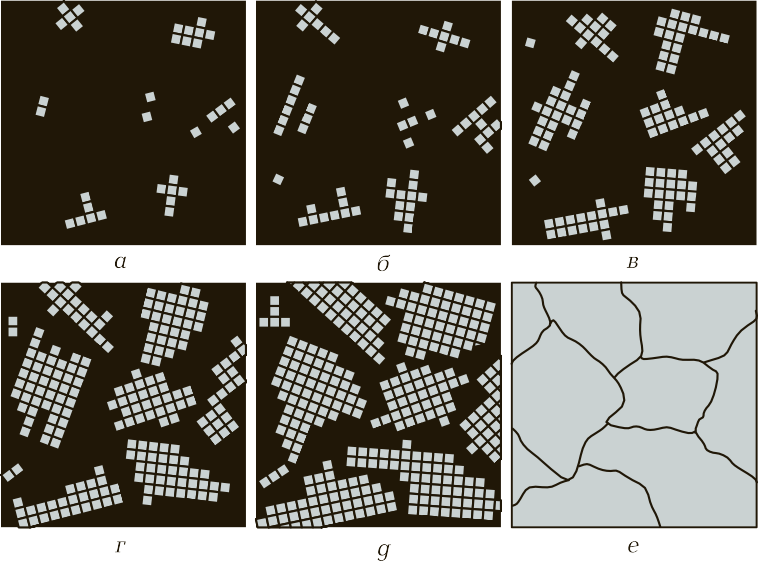
Рис. 6. Процесс кристаллизации металлов и сплавов: а — е — последовательные этапы процесса
Далее вновь появляются новые центры, и происходит рост твердой фазы вокруг первичных и вторичных центров. Процесс происходит до того момента, пока образованные таким образом кристаллы не будут соприкасаться друг с другом и не будет наличия жидкой фазы металла (см. рис. 6, г — е). Когда образование кристалла идет в жидкой фазе (в расплавленном металле), он будет иметь правильную форму, т. е. состоять из определенных геометрических фигур правильной формы. Когда кристаллы начинают соприкасаться друг с другом, а процесс затвердевания еще не закончен, тогда происходят искажения формы зерен. В практике замечено, что когда идет быстрое охлаждение, образуются мелкие зерна — мелкозернистая структура. При медленном охлаждении появление новых центров кристаллизации замедляется, но происходит рост зерна вокруг первичных центров кристаллизации. В этом случае металл будет иметь крупнозернистую структуру.
Процесс образования кристаллов в жидком состоянии и перехода металла в твердое состояние называется первичной кристаллизацией. Величина и форма зерна влияет на механические свойства металлов. Чем зерна мельче и чем правильнее их форма, тем большую твердость и прочность будет иметь металл. Чем зерна больше и чем искаженнее их форма, тем ниже твердость и прочность металла.
Аллотропия металлов. Такие металлы, как железо, кобальт, никель и др., обладают способностью изменять кристаллическую решетку при нагревании в твердом состоянии. Процесс изменения кристаллических решеток в твердом состоянии называется вторичной кристаллизацией, или аллотропией, а состояние вещества (металла) при наличии нескольких кристаллических решеток при изменении параметров (давления, температуры) — аллотропическими модификациями, или полиморфизмом. Такие металлы, как железо, молибден, вольфрам, литий в твердом состоянии при нормальной температуре имеют объемно-центрированную кубическую ячейку; алюминий, медь, серебро в твердом состоянии при нормальной температуре имеют форму гранецентрированной кубической ячейки.
На рис. 7 представлены кривые нагрева и охлаждения металла (на примере марганца). Аллотропные состояния (модификации), имеющие те или иные кубические ячейки, обозначаются греческими буквами. Первоначальное аллотропное состояние при нормальной температуре обозначается буквой α, при дальнейших повышении температуры и перекристаллизации металла — буквами β, γ, δ и т. д. При охлаждении металлов и сплавов процесс аллотропного превращения происходит в обратном порядке, как правило при тех же температурах.
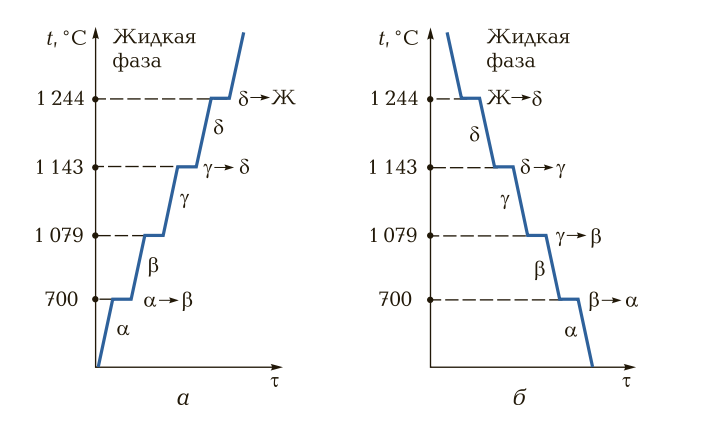
Рис. 7. Кривые нагрева (а) и охлаждения (б) марганца: t — температура; τ — время
Характерными признаками металлов являются
Положение в периодической системе
1. Типичные металлы – s - элементы: IА - IIА группы (искл.Н)
2. Нетипичные металлы: р-элементы: IIIА гр. (кроме В), IV гр – Ge , Sn , Pb ; V гр.- Sb , Bi ; VI гр.- Po .
3. Переходные металлы: d -элементы – все элементы побочных подгрупп; f - элементы: лантоноиды, актиноиды.
У атомов металлов небольшое количество электронов (ē) на внешнем энергетическом уровне и большие радиусы атомов ( R )
Кристаллическая решетка – металлическая: состоит из чередующихся в пространстве атомов и положительных ионов, внутри-общие электроны– «электронный газ».
Тип химической связи – металлическая.
Металлические (восстановительные) свойства в группе (А п/гр) усиливаются (растет R атома , и электроны легче отрываются), в периоде – ослабляются (растет заряд ядра, электроны внешнего уровня сильнее удерживаются).
Восстановительные свойства уменьшаются (активность металлов уменьшается)
Li, Cs,Rb,K, Ba, Ca, Na, Mg, Al, Mn, Cr, Zn, Fe, Cd, Co, Sn, Ni, Pb, H2, Cu, Ag, Hg, Pt, Au
Физические свойства
Наличие свободных электронов обуславливает:
- Металлический блеск (непрозрачность)-ē отражают световые лучи, большинство металлов в порошкообразном состоянии теряют свой блеск, за исключением алюминия и магния.
- Цвет Большинство металлов светло-серого цвета (Исключение: золото - желтое, медь- красная, цезий - светло-желтый)
- Электропроводность (свободные ē приобретают направленное движение) Лучшие проводники электричества: Cu , Ag , далее Au , Al , Fe. С повышением температуры – электропроводность понижается, т.к. усиливаются колебания атомов, электронам трудно перемещаться.
- Теплопроводность
- Пластичность
- Плотность ( Самый легкий - Li , самые тяжелые - Os и Ir)
- Температура плавления ( самый легкоплавкий - Hg −39 °C , самый тугоплавкий – W 3410 °C )
- Твердость (щелочные металлы можно резать ножом, самый твердый – Cr) Большинство металлов твердые, за исключением ртути и ,условно, франция.
Получение
· Пирометаллургия- получение из руд при высоких температурах при взаимодействии с хорошими восстановителями (H2, CO,C и др.)
Выделяют два этапа: 1) Обжиг металлсодержащей руды; 2) Получение чистого металла
· Металлотермия- восстановление металлами (алюминотермия, кальцийтермия, магнийтермия и т.д.):
· Гидрометаллургия- соединения металлов переводят в раствор и восстанавливают:
· Электрометаллургия – электролиз растворов и расплавов:
Запомнить: Алюминий получают из оксида (глинозема, бокситов и т.д.) в расплаве криолита Na 3 AlF 6
Запомнить: Металлы никогда не вытесняют из Н N О3(к) H 2 SO 4(к) водород; они пассивируют Al , Cr , Fe
в) Взаимодействие с солями ( более активные металлы вытесняют менее активные из растворов их солей )
CuCl 2 + Fe = FeCl 2 + Cu;
- но если металл взаимодействует с водой, то
CuCl 2 +2К +2 H 2 O = 2К Cl + Cu (ОН)2↓+ Н2↑; т.к.: 1) 2К + 2 H 2 O = 2КОН+ Н2
2) CuCl 2 +2КОН= Cu (ОН)2↓+ 2К Cl
г) Взаимодействуют с оксидами металлов и неметаллов:
е)Другое:
Между собой образуют интерметаллические соединения, сплавы: Na 2 Sb
С органическими веществами ( со спиртами, фенолами, карбоновыми кислотами и др. )
назовите характерные признаки металлов.
еталлами называют несомненно вещества, обладающие следующими основными и характерными для них признаками:
хорошей проводимостью тепла и электричества, ковкостью, непрозрачностью и особым блеском в изломе, называемым в народе металлическим;
металлы одноатомны и образуют обычно основного характера окислы;
ионы металлов электроположительны;
в обычных условиях в твердом состоянии металл имеет определенное кристаллическое строение.
О структуре строения различных металлов можно получить представление прежде всего по самому виду излома, наблюдаемого простым невооруженным глазом; структура наблюдаемая невооруженным глазом или с увеличением не больше чем в десять раз называется макро структурой. Таким образом из числа открытых в мире элементов к собственно металлам следует отнести семьдесят один элемент.
На современном и стремительном этапе развития экономической деятельности появилась тенденция к применению более редких металлов и всевозможных экстравагантных соединений, которые способны выполнять совсем новые, мало изученные действия и реакции, особенно в результате перестановки атомов с применением нанотехнологий.
Кроме того к преимуществам металла можно отнести и высокую электро- и теплопроводность, которая имеет свойство увеличиваться, когда температура понижается.
Свойства металлов
Именно благодаря своему электронному строению металл обладает отмеченными свойствами.
Сплавы металлов - состоящие из двух и более металлов вещества с примесью неметаллов. Получают сплавлением.
Свойствами и строением металлы отличаются друг от друга, тем не менее имеют схожие признаки, по которым их можно сортировать в определённые группы.
В первую очередь, металлы относят к двум большим группам - цветные металлы и чёрные. Характерная окраска (красная, желтая, белая) говорит о том, что это цветной металл. Металлы такого типа обладают большой пластичностью, плавятся при относительно низкой температуре, особой твёрдостью не обладают, полиморфизм отсутствует. Медь является наиболее типичным металлом этой группы.
Цветные металлы можно разделить на: благородные, лёгкие и лёгкоплавкие металлы. Темно-серый цвет имеют черные металлы. К его свойствам можно также отнести достаточно большую плотность, относительно не малую твёрдость, полиморфизм, высокую температуру плавления. Наиболее ярким примером этой группы является железо. А как известно, железо - это основа стали.
Чёрные металлы разделяются следующим образом:
тугоплавкие металлы (температура плавления которых выше, чем железа) ;
железные металлы - кобальт, марганец, железо и никель;
урановые металлы - актиниды, применяются в основном в сплавах использующихся атомной энергетикой;
редкоземельные металлы - церий, неодим, празеодим, лантан и другие;
щелочноземельные металлы (используют только в особых случаях) .
Использование того или металла зависит от его распространённости в природе, а также зависит от уровня и развития техники.
Медь, серебро и золото - первые металлы, с которыми начал работать человек. Человечество ещё ничего не знало о металлургии, не было знакомо со способами извлечения металлов из руд, а эти металлы можно встретить в природе в самородном (чистом) виде. Затем нашлось применение металлам, которые относительно не сложно восстанавливаются (свинец и олово) их также достаточно в природе.
Металлы их признаки и свойства
Металлами называют несомненно вещества, обладающие следующими основными и характерными для них признаками:
хорошей проводимостью тепла и электричества, ковкостью, непрозрачностью и особым блеском в изломе, называемым в народе металлическим;
металлы одноатомны и образуют обычно основного характера окислы;
ионы металлов электроположительны;
в обычных условиях в твердом состоянии металл имеет определенное кристаллическое строение.
свой-ва (физические -проводит эл ток, твердые, магнитятся. (химические -окисление (взаимодействие с кислородом). а признаки металлов смотря какие и про чего надо ??
Металлы. Основные признаки металлов.
Все металлы – тела кристаллические. В них сущ. закономерное расположение + ионов (дальний порядок) образующих кристаллическую решетку. В основе кристалл. строения металлов лежит металлический тип связи характеризующийся наличием большого кол-ва свободных электронов или электронного газа. Именно этой особенностью металл. связей и объясняются основные признаки металлов позволяющие отнести металлы к ед. классу. К этим признакам относят следующие: -высокая тепло и электропроводимость; - высокая отражающая способность и не прозрачность; - положительный терм. коэф сопротивления. Ряд металлов и сплавов обладают сверхпроводимостью; - высокая способность к термоэлектронной эмиссии (способность излучать Эл. с нагретой поверхности); - относительно высокая прочность при увеличении пластичности.
Классификация металлов
Большинство элементов в периодической системе – металлы. Все эти металлы обладают самыми разными св-вами, однако по ряду признаков все металлы и их сплавы могут быть разбиты на несколько классов и групп. Прежде всего различают класс черных металлов и класс цветных. К черным металлам относят железо и ряд металлов похожих на железо по след. признакам: 1)высокая твердость и прочность; 2)высокая t плавления; 3)ферромагнетизм; 4)полиморфизм.
К этим металлам относят: марганец, кобальт, хром, никель. Все остальные цветные.
По комплексу эксплуатационных и потр. св-в. металлы и их сплавы делятся на следующие группы: 1)легкие (низкая плотность) (Al,Ti,Zn,Mg,Be) 2)Легкоплавкие(t плавления <1539) (Pb, Sn, Al,Mq,Zn) 3)Тугоплавкие(t>1539)(W, Mo, V, Pt,Ti) 4)Благородные(высокая коррозионная стойкость) (Ag,Pt,Au) 5)Щелочно-земельные (высокая хим. активность) – I и II гр. 6)Редкоземельные (встречаются только в виде полиметаллов- лантаноиды) 7)Уравнение (склонность к радиоактивному распаду)- актиноиды.
Чистые металлы обладают не удовлетворительными мех. свойствами. Они либо очень мягкие и пластичные, либо твердые и хрупкие и по этому в качестве конструкционных материалов практически не используются. Основными констр. мат. явл. различные сплавы металлов др. с др. и с не металлами. Именно эти сложные вещ-ва могут иметь любые, сколь угодно сложные комплексы св-в требуемых в технике.
Механические св-ва и их классификация
Под мех свойствами подразумеваем реакцию материала под воздействием внешних механических сил. В зависимости от того как материал реагирует на это воздействие различают след. св-ва и соответствующие количественные характеристики этих свойств: 1)упругость – способность материала принимать свою форму и размеры после снятия нагрузки.
σу- предел упругости
2)пластичность- способность материала изменять свою форму и размеры без разрушения.
ψ- относительное сужение
3)прочность – св-во материала сопротивляться разрушению
σвр- предел прочности
4)твердость- способность материала сопротивляться упругой деформации, пластической деформации или разрушению в поверхностном слое. Кол. характеристики мех. св-в в знач. степени опр. условиями их определения – схемой нагружения (раст-сж, изгиб, кручение) и законом изменения сил во времени. В зависимости от этого закона различают 3 варианта условий нагружения и соотв. испытаний мех. св-в материала.
Механические свойства, опр. при статических испытаниях.
Эти свойства определяются в условиях когда воздействующие силы неизменны или медленно изменяются во времени. Эти свойства определяются при статических испытаниях очень часто по схеме растяжения спец. образцов на испытательных (разрывных) машинах.
l0,a0,b0-соответствующая нач. рабочая длина, нач. толщина, нач. ширина.
lк,aк,bк-соотв. размеры после разрушения образца.
I участок линейной упругой деформации
Ркр – усилие пропорц.
К-коэф. пропорц. (К=Е=tgα)
II участок нелинейной упругой деформации
III полка текучести
Рт - усилие текучести
Рвр - усилие прочности
Определение количественных характеристических статических мех. св-в производится после обработки диаграммы растяжения и обмера разрушенного образца путем перехода от абс. показателей усилия и деформации к относ. по след. формулам:
σ=P/S – переход от усилия к напряжению
δ=Δ/l0 – переход от Δàδ
σпр=Pпр/S0, где S0=a0/b0
δ=((lк-l0)/l0)*100% - отн. растяжение
ψ=(S0-Sк)/S0*100% - отн. сжатие
6.Твердость. Способы определения твердости.
Исследование мех. св-в мет. и сплавов обычно начинается с определения их твердости.
Преимущество этого вида испытаний:
1.Можно производить без разрушения исследуемого образца
3)Простота приборов и методик по сравнению с другими методами исследований.
4)Полученные результаты измерения твердости позволяют сделать выводы о других свойствах образцов, а так же предварительно сделать заключение о присутствии слоя химико-термической обработки.
В промышленности используются около 30 методов измерения твердости, однако можно выделить несколько основных: метод царапины, отскока, статического и динамического вдавливания. Оценки твердости исследуемых материалов полученные различными способами базирующимися на критериях, с различными физическим смыслом. Метод царапания характеризует сопротивление материала разрушению; твердость определяемая внедрением в материал более тела характеризует сопротивление пластической деформации. Твердость определяемая по высоте отскока наконечника или шарика от поверхности испытуемого образца характеризует упругие св-ва материала. Под твердостью понимаем св-в материала оказывает сопротивление упругой и пластической деформации или разрушению при местных контактных воздействиях со стороны другого более твердого тела, определенной формы и размера не получающий остаточную деформацию.
На практике применяются следующие способы измерения твердости
1)Вдавливание стального шарика (метод Бринелля) 2)Вдавливание алмазного конуса (метод Роквелла) 3)Вдавливание четырехгранной алмазной пирамиды (метод Виккерса)
Определение твердости по методу Роквелла.
При исследовании по методу Роквелла за критерий оценки твердости принимают глубину отпечатка, измеряемого в процессе испытаний. В качестве индентора применяют либо алмазный конус, с углом при вершине 120±30 м радиусом закругления при вершине r=(0,200±0,005)мм либо стальной шарик диаметром 1,588±0,001 мм, твердостью больше 850 HB.
Достоинством этого метода является возможность измерения твердости в широком диапазоне как очень твердых, так и сравнительно мягких материалов.
Но не рекомендуется измерять твердость серых чугунов и цветных металлов.
Мех. св-ва, опр. при динамических испытаниях.
Эти св-ва опр. при условии когда воздействующие силы меняются очень быстро во времени или ударно. Одним из главных показателей динамических мех. св-в является ударная вязкость или работа разрушения. Она опр. при ударном разрушении спец. обрацов на испытательных ударных машинах – копрах.
Механический тип связей и кристаллические строения металлов.
Под атомно-крист. строением понимают взаимное закономерное расположение эл. частиц (атомов или ионов) в реальном кристалле.
Устойчивость кристаллов строения металлов опр. прежде всего взаимодействия сил отталкиваясь и притяжения между ионами. Ионы расположены на расстоянии на расстояниях( равновесных а0) при которых энергия их взаимодействия (свободная энергия Гиббса) min. По этому эл. частицы в кристалле расп. закономерно образуя правильную кристаллическую решетку. Кристаллическая решетка – воображаемая система линий и плоскостей проходящих через центры тяжестей элементарных частиц.
Читайте также:
