Химическая активность металлов возрастает в ряду
Обновлено: 21.09.2024
Задания Д2 № 2543Верны ли следующие суждения об элементах IA группы?
А. Элементы IA группы образуют водородные соединения состава .
Б. Химическая активность металлов в ряду возрастает.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Да, элементы IA группы образуют водородные соединения состава .
Химическая активность металлов в ряду (они расположены по группе сверху вниз) - возрастает, потому что радиус увеличивается и внешний электрон притягивается слабее
В таблице Менделеева указаны формулы летучих водородных соединений. RH - формула для 7 группы.
А слова "ЛЕТУЧИЕ" в условии не было.
Элементы IA группы образуют ионные соединения состава
Самый активный металл Литий, и сверху вниз активность ослабевает! Может вы имеете в виду увеличение атомного радиуса?
Ваше утверждение не является верным.
Мы имели в виду химическую активность металлов
И по химической активности, Литий - самый активный металл! дальше идет уже Калий, Натрий и т.д! Покажите мне источники, подтверждающая вашу правоту :(
Возьмите любой учебник и он подтвердит нашу правоту.
Химическая активность щелочных металлов определяется лёгкостью отдачи электрона, что характеризуется энергией ионизации. Чем меньше энергия ионизации, тем легче от атома отнять электрон, тем большую химическую активность он проявляет
| Li | Na | K | Rb | Cs | |
|---|---|---|---|---|---|
| Энергия ионизации, кДж/моль | 520 | 496 | 419 | 403 | 376 |
В ряду элементов
1) усиливаются неметаллические свойства
2) уменьшается число электронов во внешнем электронном слое атомов
3) увеличивается число электронных слоев в атомах
4) возрастают радиусы атомов
Это элементы III периода расположенные по ряду слева направо. Поэтому в данном ряду усиливаются неметаллические свойства.
Задания Д2 № 3768В каком ряду химические элементы расположены в порядке возрастания их атомного радиуса?
Атомный радиус увеличивается по периоду справа налево и по группе сверху вниз. Значит, верен ответ №3.
Задания Д2 № 4521В каком ряду химические элементы расположены в порядке возрастания радиуса их атомов?
Радиус увеличивается по группе сверху вниз, и по периоду справа налево, значит, верен вариант ответа №4.
Задания Д2 № 63721) увеличивается радиус атома
2) уменьшается электроотрицательность атома
3) уменьшается число электронов на внешнем уровне
4) усиливается кислотный характер высшего оксида
Это элементы разных периодов и разных групп, но расположенные в ряду по увеличению групп, значит, для них:
4) усиливается кислотный характер высшего оксида.
Тип 2 № 7080Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде.
Расположите выбранные элементы в порядке возрастания их металлических свойств. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Для выполнения заданий 1–3 используйте следующий ряд химических элементов:
Ответом в заданиях 1–3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
Тип 1 № 7079Определите, атомы каких двух из указанных в ряду элементов имеют на внешнем энергетическом уровне четыре электрона. Запишите в поле ответа номера выбранных элементов.
На внешнем энергетическом уровне четыре электрона имеют элементы IV группы: углерод и кремний.
Тип 3 № 7081Из числа указанных в ряду элементов выберите два элемента, которые проявляют низшую степень окисления, равную –4. Запишите в поле ответа номера выбранных элементов.
Низшую степень окисления, равную –4, проявляют элементы IV группы: кремний и углерод.
Металлические свойства усиливаются по периоду справа налево: , и .
Источник: Демонстрационная версия ЕГЭ—2017 по химии, Демонстрационная версия ЕГЭ—2018 по химии, Демонстрационная версия ЕГЭ−2019 по химии
Тип 2 № 9690Выберите три элемента, которые в Периодической системе находятся в одном периоде, и расположите эти элементы в порядке увеличения электроотрицательности. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Тип 1 № 9689Определите, атомы каких двух из указанных элементов имеют в основном состоянии два неспаренных электрона. Запишите в поле ответа номера выбранных элементов.
1. Сера имеет конфигурацию . На p подуровне, где должно быть 6 электронов, т.е 3 электронные пары, только 4 электрона, по правилу Хунда 2 спарены, образуя 1 электронную пару, а 2 неспарены.
2. Магний имеет конфигурацию . На s орбитали все электроны спарены, на p орбитали их нет.
3. Углерод имеет конфигурацию . На p подуровне, где должно быть 6 электронов, т.е 3 электронные пары, только 2 электрона, по правилу Хунда оба неспарены.
4. Бор имеет конфигурацию . На p подуровне, где должно быть 6 электронов, т.е 3 электронные пары, только 1 электрон, который неспарен.
5. Литий имеет конфигурацию . На s подуровне, где максимум может быть 2 электрона, у него только 1, он же как раз неспаренный.
Тип 3 № 9691Выберите два элемента, которые в соединениях могут иметь степень окисления +4. Запишите в поле ответа номера выбранных элементов.
Элемент может иметь степень окисления от максимальной положительной до максимальной отрицательной. Максимальная положительная степень окисления элемента обычно численно совпадает с номером его группы в периодической системе. Максимальная отрицательная степень окисления элемента равна максимальной положительной степени окисления минус восемь.
Сера в 6 группе, имеет степени окисления −2; −1; 0; +1; +2; +4; +6.
Магний это металл и не проявляет отрицательной степени окисления, находится во 2 группе, следовательно, степени окисления 0; +2.
Углерод находится в 4 группе и имеет степени окисления −4; −3; −2; −1; 0; +1; +2; +3; +4. (Максимальная положительная «+№ группы», т. е. +4; максимальная отрицательная 4−8 = −4).
Бор в 3 группе, т. е. +3; 0.
Литий — это металл и не проявляет отрицательную степень окисления, поэтому для него возможны 0 и +1.
Урок №48. Химические свойства металлов. Ряд активности (электрохимический ряд) металлов
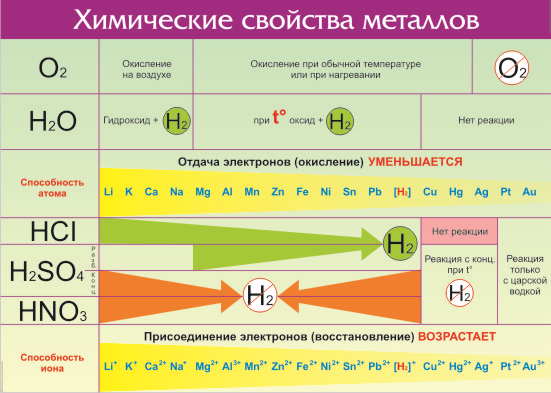
Химические свойства металлов определяются их активностью. Простые вещества – металлы в химических реакциях всегда являются восстановителями . Положение металла в ряду активности характеризует то, насколько активно данный металл способен вступать в химические реакции (т. е. то, насколько сильно у него проявляются восстановительные свойства).
Среди металлов традиционно выделяют несколько групп.
благородные металлы (серебро, золото, платина, иридий);
щелочные металлы – I(A) группа ;
щелочноземельные металлы – II(A) группа , кроме Be, Mg.
Металлы встпают в реакции с простыми веществами – неметаллами (кислород, галогены, сера, азот, фосфор и др.) и сложными веществами (вода, кислоты, растворы солей)
Взаимодействие с простыми веществами-неметаллами
1. Металлы взаимодействуют с кислородом, образуя оксиды:
4Li + O 2 = обыч. усл . = 2Li 2 O
2Mg + O 2 = t, °C = 2MgO
Серебро, золото и платина с кислородом не реагируют
2. Металлы взаимодействуют с галогенами (фтором, хлором, бромом и йодом), образуя галогениды – Ме +n Г -1 n
2Na + Cl 2 = 2NaCl
3. Металлы взаимодействуют с серой, образуя сульфиды.
4. Активные металлы при нагревании реагируют с азотом, фосфором и некоторыми другими неметаллами.
3Na + P = t, °C = Na 3 P
Взаимодействие со сложными веществами
I. Взаимодействие воды с металлами
1). Взаимодействие с самыми активными металлами, находящимися в периодической системе в I(А) и II(А) группах (щелочные и щелочноземельные металлы) и алюминий . В результате образуются основание и газ водород .
Me + H 2 O = Me(OH) n + H 2 (р. замещения)
Внимание! Алюминий и магний ведут себя также:
Магний (в горячей воде):
2) Взаимодействие воды с менее активными металлами, которые расположены в ряду активности от алюминия до водорода.
Металлы средней активности, стоящие в ряду активности до (Н 2 ) – Be, Fe, Pb, Cr, Ni, Mn, Zn – реагируют с образованием оксида металла и водорода
Me + Н 2 О = Ме х О у + Н 2 (р. замещения)
Бериллий с водой образует амфотерный оксид:
Be + H 2 O = t°C = BeO + H 2
Раскалённое железо реагирует с водяным паром, образуя смешанный оксид — железную окалину Fe 3 O 4 и водород:
3) Металлы, стоящие в ряду активности после водорода, не реагируют с водой.
Cu + H 2 O ≠ нет реакции
II. Взаимодействие растворов кислот с металлами
Металлы, стоящие в ряду активности металлов левее водорода, взаимодействуют с растворами кислот ( раствор азотной кислоты – исключение ), образуя соль и водород.
Кислота (раствор) + Me до (Н2) = Соль + H 2 ↑
III. Взаимодействие кислот-окислителей с металлами
Металлы особо реагируют с серной концентрированной и азотной кислотами:
H 2 SO 4 (конц.) + Me = Сульфат + H 2 O + Х
HNO 3 + Me = Нитрат + H 2 O + Х
4Zn + 10HNO 3 (раствор горячий) = t˚C = 4Zn(NO 3 ) 2 + N 2 O + 5H 2 O
4Zn + 10HNO 3 (оч. разб. горячий) = t˚C = 4Zn(NO 3 ) 2 + NH 4 NO 3 + 3H 2 O
IV. С растворами солей менее активных металлов
Ме + Соль = Новый металл + Новая соль
Активность металла в реакциях с кислотами, водными растворами солей и др. можно определить, используя электрохимический ряд, предложенный в 1865 г русским учёным Н. Н. Бекетовым: от калия к золоту восстановительная способность (способность отдавать электроны) уменьшается, все металлы, стоящие в ряду левее водорода, могут вытеснять его из растворов кислот; медь, серебро, ртуть, платина, золото, расположенные правее, не вытесняют водород.
Ряд активности металлов

Химия
Что же из себя представляет ряд активности металлов давайте разбираться. Металлы — группа химических элементов, обладающих сходными свойствами. Среди них — электропроводность, пластичность, температурная зависимость сопротивления. По виду металлы можно отличить по характерному блеску, который так и назвали — металлический. Но химические свойства элементов отличаются в зависимости от строения их молекул и кристаллической решетки. Особенно ярко отличия проявляются по отношению взаимодействия с кислотами и щелочами. Всего на данный момент насчитывается 96 металлов. Общие свойства металлов показаны в таблице:
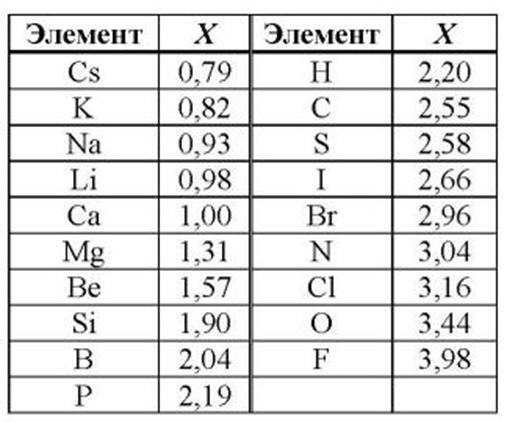
Все металлы в той или иной степени являются восстановителями, то есть, отдают электроны при течении окислительно-восстановительных реакций. Таблица электроотрицательности металлов показывает, какой металл является наиболее активным восстановителем. Если цифра напротив элемента больше 2, то это окислитель с характерными свойствами и выходит из ряда металлов, проявляя типичные свойства неметалла.
Электрохимический ряд активности металлов показывает, какие из металлов более активные, какие менее. Расположение элементов в горизонтальном ряду слева направо показывает направление снижения восстановительной способности и возрастание окислительной.
Восстановительная способность — свойство отдавать электроны в химических реакциях с водными растворами солей и щелочей.
Окислительная способность — свойство присоединять электроны в реакциях с теми же веществами.

Металлы в правой стороне более слабые восстановители, они вытесняются при реакциях с солевыми растворами металлами, расположенными левее. Пример реакции — Zn + Cu 2+ → Zn 2+ + Cu, которая протекает только в одном направлении. Цинк вытесняет медь, реагируя с водным раствором любой соли меди. Цинковая пластинка, при этом, растворяется, а медная восстанавливается.
Такую последовательность элементов еще называют ряд напряженности металлов, или ряд Бекетова. На всех вариантах записи ряда можно заметить, что последовательность металлов разделена знаком водорода (гидрогена), который металлом никак не является. Это своеобразный маркер, показывающий, что стоящие левее металлы вытесняют водород из водных растворов кислот, не обладающих окислительными свойствами. Некоторые металлы, например, литий, кальций, барий и остальные, стоящи до алюминия, вытесняют водород и при реакции с водой.
2Al +3H2SO4 = Al2(SO4)3 + 3H2↑
Fe + 2HCl = FeCl2 + H2↑
Стоящие правее знака водорода металлы с кислотами-неокислителями не взаимодействуют при нормальных условиях.
Шкала активности металлов широко используется для практических целей, например, в гальванике. Если электроды сделаны из разных металлов, то разрушаться будет тот, который стоит левее. Чем больше промежуток между металлами в ряду, тем активнее проходит процесс коррозии.
Например, метод оцинковки позволяет защитить железо именно потому, что цинк находится левее железа в ряду активности. Пока он не разрушится, то ржавчина на железе не появится. При электролизе, расположенные за водородом металлы осаживаются на катоде, а самые активные, занимающее места до алюминия, выделить из солевых растворов в не получится при нормальных температуре и давлении.
Малоактивные металлы, так называемые переходные элементы с электроотрицательностью в пределах 1,5 – 2. Это:
- Ртуть;
- Олово;
- Серебро;
- Никель;
- Рений;
- Медь;
- Марганец и еще несколько элементов.
К металлам средней активности относятся элементы с числом электроотрицательности от 1 до 1,5. В эту группу входят такие известные элементы, как магний, плутоний, неодим, кальций. Остальные элементы обладают высокой химической активностью. Лидирует в этом списке Франций, который практически не встречается в чистом виде. Из более известных можно назвать калий и натрий, которые приходится хранить в керосине, чтобы они не взаимодействовали с водой и воздухом. Если извлечь их из керосина, то металлы практически мгновенно сгорают.
Реакции кальция и натрия с водой при комнатной температуре выглядят так:
2Na + 2H2O = 2NaOH + H2↑
Сa + 2H2O = Сa(OH)2 + H2↑Стоящие в ряду электронапряжения металлов правее элементы тоже взаимодействуют с водой, но реакция протекает при более высокой температуре с образованием оксида и водорода.
3Fe + 4H2O = Fe3O4 + 4H2↑
Если вступает в реакцию металл и неметалл, то электрический ряд напряжений металлов тоже дает возможность заранее узнать, в каком направлении будет протекать реакция. Скорость реакции зависит как от восстановительной активности металла, так и от окислительных свойств неметалла. Стоящие до водорода металлы реагируют с кислородом уже при комнатной температуре, некоторые — достаточно бурно, например, литий и кальций.
4Li + O2 = 2Li2O
2Ca + O2 = 2CaO.
При таком взаимодействии образуются оксиды. Менее активные металлы, например железо, реагируют с кислородом спокойнее, а некоторые, например, золото и серебро, платина не окисляются вовсе, благодаря чему получили определение благородных.
С хлором реагируют практически все активные металлы с выделением теплоты.
2Fe + 3Cl2 = 2FeCl3
Также выделяется теплота при реакции активных металлов с серой, но начинается она при нагревании. После начала реакции нагрев не нужен — образовавшегося тепла достаточно для поддержания реакции.
2Al + 3S = Al2S3
Внимательно изучив ряд металлов, несложно определить тип реакции при контакте с другими элементами в зависимости от места в последовательности. Также легко назвать основные характеристики металла, как химического элемента, и возможность его использования на практике.
Ряд активности металлов. Алюминий. Кальций. Железо и его соединения. Производство чугуна и стали
Все металлы, в зависимости от их окислительно-восстановительной активности объединяют в ряд, который называется электрохимическим рядом напряжения металлов (так как металлы в нем расположены в порядке увеличения стандартных электрохимических потенциалов) или рядом активности металлов:
Li, K, Ва, Ca, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb, H2, Cu, Hg, Ag, Рt, Au
Наиболее химически активные металлы стоят в ряду активности до водорода, причем, чем левее расположен металл, тем он активнее. Металлы, занимающие в ряду активности, место после водорода считаются неактивными.
Алюминий
Алюминий представляет собой серебристо-белого цвета. Основные физические свойства алюминия – легкость, высокая тепло- и электропроводность. В свободном состоянии при пребывании на воздухе алюминий покрывается прочной пленкой оксида Al2O3, которая делает его устойчивым к действию концентрированных кислот.
Алюминий относится к металлам p-семейства. Электронная конфигурация внешнего энергетического уровня – 3s 2 3p 1 . В своих соединениях алюминий проявляет степень окисления равную «+3».
Алюминий получают электролизом расплава оксида этого элемента:
Однако из-за небольшого выхода продукта, чаще используют способ получения алюминия электролизом смеси Na3[AlF6] и Al2O3. Реакция протекает при нагревании до 960 С и в присутствии катализаторов – фторидов (AlF3, CaF2 и др.), при этом на выделение алюминия происходит на катоде, а на аноде выделяется кислород.
Алюминий способен взаимодействовать с водой после удаления с его поверхности оксидной пленки (1), взаимодействовать с простыми веществами (кислородом, галогенами, азотом, серой, углеродом) (2-6), кислотами (7) и основаниями (8):
Кальций
В свободном виде Ca – серебристо-белый металл. При нахождении на воздухе мгновенно покрывается желтоватой пленкой, которая представляет собой продукты его взаимодействия с составными частями воздуха. Кальций – достаточно твердый металл, имеет кубическую гранецентрированную кристаллическую решетку.
Электронная конфигурация внешнего энергетического уровня – 4s 2 . В своих соединениях кальций проявляет степень окисления равную «+2».
Кальций получают электролизом расплавов солей, чаще всего – хлоридов:
Кальций способен растворяются в воде с образованием гидроксидов, проявляющих сильные основные свойства (1), реагировать с кислородом (2), образуя оксиды, взаимодействовать с неметаллами (3 -8), растворяться в кислотах (9):
Железо и его соединения
Железо – металл серого цвета. В чистом виде оно довольно мягкое, ковкое и тягучее. Электронная конфигурация внешнего энергетического уровня – [Ar]3d 6 4s 2 . В своих соединениях железо проявляет степени окисления «+2» и «+3».
Металлическое железо реагирует с водяным паром, образуя смешанный оксид (II, III) Fe3O4:
На воздухе железо легко окисляется, особенно в присутствии влаги (ржавеет):
Как и другие металлы железо вступает в реакции с простыми веществами, например, галогенами (1), растворяется в кислотах (2):
2Fe + Br2 = 2FeBr3 (при нагревании) (1)
Железо образует целый спектр соединений, поскольку проявляет несколько степеней окисления: гидроксид железа (II), гидроксид железа (III), соли, оксиды и т.д. Так, гидроксид железа (II) можно получить при действии растворов щелочей на соли железа (II) без доступа воздуха:
Гидроксид железа (II) растворим в кислотах и окисляется до гидроксида железа (III) в присутствии кислорода.
Соли железа (II) проявляют свойства восстановителей и превращаются в соединения железа (III).
Оксид железа (III) нельзя получить по реакции горения железа в кислороде, для его получения необходимо сжигать сульфиды железа или прокаливать другие соли железа:
Соединения железа (III) проявляют слабые окислительные свойства и способны вступать в ОВР с сильными восстановителями:
Производство чугуна и стали
Стали и чугуны – сплавы железа с углеродом, причем содержание углерода в стали до 2%, а в чугуне 2-4%. Стали и чугуны содержат легирующие добавки: стали– Cr, V, Ni, а чугун – Si.
Выделяют различные типы сталей, так, по назначению выделяют конструкционные, нержавеющие, инструментальные, жаропрочные и криогенные стали. По химическому составу выделяют углеродистые (низко-, средне- и высокоуглеродистые) и легированные (низко-, средне- и высоколегированные). В зависимости от структуры выделяют аустенитные, ферритные, мартенситные, перлитные и бейнитные стали.
Стали нашли применение во многих отраслях народного хозяйства, таких как строительная, химическая, нефтехимическая, охрана окружающей среды, транспортная энергетическая и другие отрасли промышленности.
В зависимости от формы содержания углерода в чугуне — цементит или графит, а также их количества различают несколько типов чугуна: белый (светлый цвет излома из-за присутствия углерода в форме цементита), серый (серый цвет излома из-за присутствия углерода в форме графита), ковкий и жаропрочный. Чугуны очень хрупкие сплавы.
Области применения чугунов обширны – из чугуна изготавливают художественные украшения (ограды, ворота), корпусные детали, сантехническое оборудование, предметы быта (сковороды), его используют в автомобильной промышленности.
Примеры решения задач
| Задание | Сплав магния и алюминия массой 26,31 г растворили в соляной кислоте. При этом выделилось 31,024 л бесцветного газа. Определите массовые доли металлов в сплаве. |
| Решение | Вступать в реакцию с соляной кислотой способны оба металла, в результате чего выделяется водород: |
Найдем суммарное число моль выделившегося водорода:
v(H2) = 31,024/22,4 = 1,385 моль
Пусть количество вещества Mg – х моль, а Al –y моль. Тогда, исходя из уравнений реакций можно записать выражение для суммарного числа моль водорода:
Химические свойства металлов

Основным химическим свойством металлов является способность их атомов легко отдавать свои валентные электроны и переходить в положительно заряженные ионы.
Типичные металлы никогда не присоединяют электронов; их ионы всегда заряжены только положительно. Поэтому металлы называются «электроположительными» элементами, в отличие от «электроотрицательных» элементов — металлоидов, для которых более характерна способность при соединять электроны.
Удельный вес и температура плавления некоторых металлов
Почему типичные металлы восстановители
Легко отдавая при химических реакциях свои валентные электроны, типичные металлы являются энергичными восстановителями.
Способность к отдаче электронов проявляется у отдельных металлов далеко не в одинаковой степени. Чем легче металл отдает свои электроны, тем он активнее, тем энергичнее вступает во взаимодействие с другими веществами.
Для сравнительного изучения активности металлов можно воспользоваться различными реакциями. Особенно удобны для этой цели реакции вытеснения металлов из их солей другими металлами. Опустим, например, кусочек цинка в раствор какой-нибудь свинцовой соли. Цинк начинает растворяться, а из раствора выделяется свинец. Реакция выражается уравнением
или в ионной форме
Zn + Pb •• = Pb + Zn ••
Из уравнения видно, что эта реакция является типичной реакцией окисления-восстановления. Сущность ее сводится к тому, что атомы цинка отдают свои валентные электроны ионам Рb •• , тем самым превращаясь в ионы Zn •• , а ионы Рb •• разряжаются и выделяются в виде металлического свинца. Если поступить наоборот, т. е погрузить кусочек свинца в раствор цинковой соли, то никакой реакции не произойдет. Это показывает, что цинк более активен, чем свинец, что его атомы легче отдают, а ионы труднее присоединяют электроны, чем атомы и ионы свинца.
Сравнивая таким же способом активность свинца и меди, легко убедиться, что свинец более активен, чем медь, так как он вытесняет медь из ее солей, а медь не может вытеснять свинец:
Рb + Cu •• = Сu + Рb ••
Следовательно, из трех сравниваемых металлов — цинка, свинца и меди — наиболее активным, легче других отдающим электроны, является цинк, менее активен свинец и еще менее активна медь.
Вытеснение металлов из соединений металлами
Вытеснение одних металлов из их соединений другими металлами впервые было подробно изучено Н. Н. Бекетовым (1865 г.), расположившим металлы по их убывающей химической активности в так называемый «вытеснительный ряд». В настоящее время вытеснительный ряд Бекетова носит название ряда напряжений, так как положение каждого металла в ряду точно определяется величиной электрического напряжения, или разности потенциалов, возникающей при погружении данного металла в раствор его соли. Об измерении этих величин и их значении будет сказано несколько позже.
Для наиболее важных металлов ряд напряжений, как уже было указано , имеет следующий вид:
Уменьшение химической активности нейтральных атомов
К, Na, Са, Mg, Al, Mn, Zn, Fe, Ni, Sn, Pb, H2, Cu, Hg, Ag, Au
Уменьшение способности ионов к присоединению электронов
В этом ряду помещен и водород, так как он тоже может вытеснять некоторые металлы из растворов их солей и в свою очередь вытесняется многими металлами из растворов кислот.
Определения положения водорода в вытеснительном ряду
Для определения положения водорода в «вытеснительном ряду» Бекетовым производились следующие опыты. В колена изогнутой стеклянной трубки (рис.) помещали отдельно друг от друга раствор соли металла, кислоту и цинк. Трубку запаивали» затем наклоняли ее так, что цинк падал в кислоту и выделяющийся водород действовал под давлением на раствор соли.
Наблюдая явления, происходящие в колене трубки, наполненном раствором соли, можно было судить о том, вытесняется ли металл водородом. На основании проведенных опытов Бекетов пришел к заключению, что в «вытеснительном ряду» водород занимает место после свинца и может вытеснять(восстанавливать) следующие за ним металлы: медь, ртуть, серебро, золото из растворов их солей.
Бекетов был убежден, что реакции вытеснения водорода металлами являются обратимыми и что для каждого металла должно существовать такое давление, при котором направление реакции меняется на обратное, т. е. водород начинает вытеснять металл из раствора его соли.
Взгляды Бекетова получили позднее полное подтверждение.
Рассмотрим, например, реакцию вытеснения водорода цинком:
Константа равновесия этой реакции выражается следующей формулой:
где вместо концентрации водорода взято его давление рн2 в атмосферах. Вычисление показывает, что при обычной температуре К = 36 • 10 24 . Значит, потребовалось бы недостижимое при современной технике давление водорода, чтобы сделать ощутимой обратную реакцию, т. е. вытеснение цинка водородом. При обычном же давлении равновесие реакции практически нацело смещено вправо.
Однако для реакции
Sn + 2H • ⇄ Sn •• + H2
Это значит, что равновесие будет достигнуто, например, при концентрациях: [Sn •• ]= l г-ион/л,[Н • ] = 0,01 г-ион/л и давлении водорода рн2 = 4 ат. Следовательно, при сравнительно небольшом давлении водород может вытеснить олово из раствора его соли.
Электрохимический ряд напряжений
Ряд напряжений дает много общих указаний относительно химического поведения отдельных металлов при реакциях в растворах:
- Каждый металл этого ряда, а также и водород, находящийся под давлением, вытесняет (восстанавливает) все следующие за ним металлы из растворов их солей. В свою очередь сам он может быть вытеснен (восстановлен) любым из металлов, стоящих впереди него.
- Только те металлы, которые стоят в ряду напряжений впереди водорода, могут вытеснять его из разбавленных кислот («солей водорода»). Металлы, стоящие вправо от водорода, не способны вытеснять водород из кислот.
- Чем левее в ряду напряжений стоит металл, тем он активнее, тем больше его восстановительная способность в отношении ионов других металлов, тем легче он сам превращается в ионы, тем труднее восстанавливаются его ионы.
Вы читаете, статья на тему Химические свойства металлов
Похожие страницы:
Вытеснительный ряд металлов Бекетова Рассматривая способы получения водорода, мы уже отмечали, что одни металлы легко вытесняют из воды водород, другие —.
Ряд активности металлов это последовательность в которой металлы расположены в порядке увеличения их стандартных электрохимических потенциалов. Примером может служить расширенный.
Химические свойства воды Из химических свойств воды прежде всего следует отметить большую устойчивость ее молекул по отношению к нагреванию. Однако.
Водород в природе Водород (Hydrogenium; ат. вес 1,008) в свободном состоянии встречается в природе лишь в незначительных количествах, главным образом.
Содержание статьи1 Химические уравнения и расчеты по ним1.1 Что такое химические уравнения1.2 Для чего нужны химические уравнения1.3 Пример решения химического.
Соединения фосфора с водородом и галогенами С водородом фосфор образует три соединения: РН3 — газообразный фосфористый водород, Р2Н4 — жидкий фосфористый.
Читайте также:
