Химические свойства серы с металлами
Обновлено: 13.05.2024
Сера – шестнадцатый элемент Периодической таблицы. Обозначение – S от латинского «sulfur». Расположена в третьем периоде, VIА группе. Относится к неметаллам. Заряд ядра равен 16.
Сера встречается в природе как в свободном состоянии (самородная сера), так и в различных соединениях. Очень распространены соединения серы с различными металлами. Многие из них являются ценными рудами (например, свинцовый блеск PbS, цинковая обманка ZnS, медный блеск Cu2S) и служат источником получения цветных металлов.
Из соединений серы в природе также распространены сульфаты, главным образом, кальция и магния, Наконец, соединения серы содержатся в организмах растений и животных.
Общее содержание серы земной коре составляет приблизительно 0,1%.
Атомная и молекулярная масса серы
Относительной молекулярная масса вещества (Mr) – это число, показывающее, во сколько раз масса данной молекулы больше 1/12 массы атома углерода, а относительная атомная масса элемента (Ar) – во сколько раз средняя масса атомов химического элемента больше 1/12 массы атома углерода.
Значения атомной и молекулярной масс серы совпадают; они равны 32,059.
Аллотропия и аллотропные модификации серы
Сера существует в виде двух аллотропных модификаций – ромбической и моноклинной.
При обычных давлениях сера образует хрупкие кристаллы желтого цвета, плавящиеся при 112,8 o С; плотность равна 2,07 г/см 3 . Она нерастворима в воде, но довольно хорошо растворима в сероуглероде, бензоле и некоторых других жидкостях. При испарении этих жидкостей сера выделяется из раствора в виде желтых кристаллов ромбической системы, имеющих форму октаэдров, у которых обычно часть углов или ребер как бы срезана (рис.1). Эта модификация серы называется ромбической.
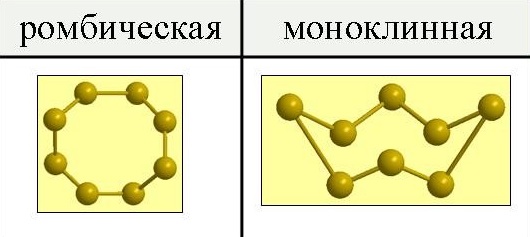
Рис. 1. Аллотропные модификации серы.
Иной формы кристаллы получаются, если медленно охлаждать расплавленную серу и, когда она частично затвердевает, слить еще не успевшую застыть жидкость. При этих условиях стенки сосуда оказываются покрыты изнутри длинными темно-желтыми игольчатыми кристаллами моноклинной системы. Эта модификация серы называется моноклинной. Она имеет плотность 1,96 г/см 3 , плавится при 119,3 o С и устойчива только при температуре выше 96 o С.
Изотопы серы
Известно, что в природе сера может находиться в виде четырех стабильных изотопов 32 S, 33 S, 34 S и 36 S. Их массовые числа равны 32, 33, 34 и 36 соответственно. Ядро атома изотопа серы 32 S содержит шестнадцать протонов и шестнадцать нейтронов, а изотопов 33 S, 34 S и 36 S– такое же количество протонов, семнадцать, восемнадцать и двадцать нейтронов соответственно.
Существуют искусственные изотопы серы с массовыми числами от 26-ти до 49-ти, среди которых наиболее стабильным является 35 S с периодом полураспада равным 87 суток.
Ионы серы
На внешнем энергетическом уровне атома серы имеется шесть электронов, которые являются валентными:
1s 2 2s 2 2p 6 3s 2 3p 4 .
В результате химического взаимодействия сера может терять свои валентные электроны, т.е. являться их донором, и превращаться в положительно заряженные ионы или принимать электроны другого атома, т.е. являться их акцептором, и превращаться в отрицательно заряженные ионы:
Молекула и атом серы
Молекула серы одноатомна — S. Приведем некоторые свойства, характеризующие атом и молекулу серы:
Энергия ионизации атома, эВ
Радиус атома, нм
Примеры решения задач
| Задание | Какая масса серы потребуется для получения сульфида алюминия Al2S3 массой 30 г? В каких условиях может быть получен этот сульфид из простых веществ? |
| Решение | Запишем уравнение реакции получения сульфида серы: |
Вычислим количество вещества сульфида алюминия (молярная масса – 150 г/моль):
Согласно уравнению реакции n(Al2S3) : n(S) = 1:3, значит:
Соединения серы
Сера относится к семейству p-элементов. Электронная конфигурация серы [Ne]3s 2 3p 4 . Для серы характерно наличие трех степеней окисления «-2», «+4» и «+6».
Для получения серы используют реакцию Вакенродера (1) или получают ее неполным окислением сероводорода (2):
Из-за наличия нескольких степеней окисления сера способна проявлять и окислительные (в реакциях с металлами) и восстановительные (в реакциях с сильными окислителями) свойства:
Fe 0 -2e = Fe 2+ — процесс окисления (восстановитель)
S 0 +2e = S 2- — процесс восстановления (окислитель)
S 0 – 4e = S 4+ — процесс окисления (восстановитель)
O2 0 + 2e = 2O 2- — процесс восстановления (окислитель)
Сера взаимодействует с концентрированными растворами кислот (растворяется в них) и со щелочами (диспропорционирует):
Сероводород. Сероводородная кислота. Сульфиды
При нагревании серы с водородом происходит обратимая реакция в результате которой выделяется сероводород – бесцветный газ с запахом тухлых яиц, ядовитый и плохо растворимый в воде:
Однако, выход сероводорода в этой реакции невелик и для его получения чаще всего используют реакцию действия разбавленных кислот на сульфиды (соли сероводородной кислоты):
Водный раствор сероводорода – очень слабая кислота, диссоциация которой протекает в две ступени:
В связи с этим, для сероводородной кислоты характерна способность к образованию солей двух видов – средних – сульфидов (кислотный остаток — S 2- ) и кислых – гидросульфидов (кислотный остаток — HS — ).
Сероводородная кислота – сильный восстановитель, т.к. сера, входящая в состав этого вещества, находится в низшей степени окисления и способна повысить её до «+4» или «+6», поэтому состав продуктов реакции определяется силой и количеством окислителя:
Для сульфидов, как для солей образованных слабой кислотой, характерна способность к гидролизу. Сульфиды металлов, стоящих в ряду активности левее железа, растворимы в сильных кислотах:
Качественной реакцией на H2S и растворимые в воде сульфиды является:
S 2- + Pb 2+ = PbS↓ (осадок черного цвета)
Оксид серы (IV). Сернистая кислота
В степени окисления «+4» сера образует оксид, которому соответствует кислота. Оксид серы (IV) представляет собой газообразное вещество (сернистый газ) без цвета, но обладающее резким запахом, хорошо растворимое в воде.
Выделяют промышленные и лабораторные способы получения оксида серы (IV). Так, в промышленности (1), его получают при обжиге сульфидов, а в лаборатории (2) – при действии сильных кислот на сульфиты:
В водном растворе оксида серы (IV) возможно одновременное существование нескольких химических равновесий:
Образующаяся в результате сернистая кислота (H2SO3) является двухосновной, поэтому способна к образованию двух типов солей – средних — сульфитов (кислотный остаток SO3 2 ) и кислых — гидросульфитов (кислотный остаток HSO2 — ).
Для оксида серы (IV), сернистой кислоты и её солей характерны химические свойства, которые можно разделить на 3 группы: кислотно-основные реакции (1), реакции окисления (2) и реакции восстановления (2):
Качественная реакция на SO2 и сульфиты – обесцвечивание раствора перманганата калия:
Оксид серы (VI). Серная кислота
Оксид серы (VI) представляет собой бесцветную жидкость, которую получают окислением оксида серы (IV) кислородом в присутствии катализатора (V2O 5):
Оксид серы (VI) хорошо растворим в воде (образуется серная кислота) и в 100%-ной серной кислоте (образуется олеум):
Серная кислота представляет собой тяжелую вязкую жидкость, которая хорошо смешивается с водой в любых отношениях. Водный раствор серной кислоты – сильная кислота. Поскольку H2SO4 двухосновная кислота, она способна образовывать два типа солей – средние – сульфаты (кислотный остаток SO4 2- ) и кислые – гидросульфиты (кислотный остаток HSO4 — ).
При взаимодействии с металлами (как, стоящими в ряду активности до водорода, так и после него) серная кислота восстанавливается до оксида серы (IV):
Разбавленная серная кислота окисляет только металлы, стоящими в ряду активности до водорода:
Качественной реакцией на серную кислоту и растворимые сульфаты является образование осадка сульфата бария – осадка белого цвета, нерастворимого в щелочах и кислотах:
| Задание | Осуществите ряд превращений S→H2S→SO2→SO3→H2SO4 |
| Решение | Получение сероводорода из серы осуществляют путем её восстановления водородом: |
Оксид серы (IV) из сероводорода получают путем его окисления кислородом:
Чтобы получить оксид серы (VI) из оксида серы (IV) необходимо окислить оксид серы (IV) кислородом:
Оксид серы (VI) типичный кислотный оксид, который при взаимодействии с водой образует кислоту, поэтому, для того, чтобы получить серную кислоту из оксида серы (VI) необходимо пропустить его через воду:
| Задание | При взаимодействии серы с концентрированной азотной кислотой (массовая доля 60%, плотность раствора 1,27 г,мл) образовалась серная кислота и оксид азота (II) объемом 67,2 л (н.у.). Вычислите массу серы и объем раствора азотной кислоты, вступивших в реакцию. |
| Решение | Запишем уравнение реакции: |
Найдем количество вещества оксида азота:
моль.
Вычислим массу серы:
Для расчета объема азотной кислоты необходимо знать её количество. По уравнению реакции для образования 2 моль оксида азота (II) необходимо 2 моль азотной кислоты:
Определим массу азотной кислоты:
Вычислим массу раствора азотной кислоты, зная массовую долю HNO3 в растворе. По определению:
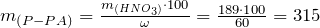
(г).
Определим объем раствора 60 %-ной азотной кислоты, необходимый для взаимодействия:
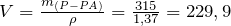
(мл).
Физические и химические свойства серы
Электронная конфигурация 1s 2 2s 2 2p 6 3s 2 3p 4 . Символ – S . Относительная атомная масса – 32 а.е.м. Температура кипения – 444,67 С, плавления – 112,85 С. Неметалл.
Химические свойства серы
Сера взаимодействует с простыми веществами – неметаллами, проявляя при этом свойства восстановителя. Непосредственно сера взаимодействует только с фтором. Реакции взаимодействия с другими металлами происходят при нагревании:
В реакциях взаимодействия с простыми веществами – металлами сера проявляет свойства окислителя. Эти реакции протекают при нагревании и очень бурно:
Сера вступает в реакции взаимодействия со сложными веществами. Она способна растворяться в концентрированных кислотах и расплавах щелочей, причем в последнем случае сера диспропорционирует. Эти реакции происходят при кипении реакционной смеси:
При взаимодействии серы с сульфидами металлов происходит образование полисульфидов:
Физические свойства серы
Сера – кристаллическое вещество желтого цвета. Существует в виде двух аллотропных модификаций – α-серы (ромбическая кристаллическая решетка) и β-серы (моноклинная кристаллическая решетка), а также аморфной формы – пластическая сера (рис. 1). В кристаллическом состоянии сера построена из неплоских циклических молекул S8. Сера плохо растворяется в этаноле, хорошо в сероуглероде и жидком аммиаке. Не реагирует с жидкой водой и йодом.
Рис. 1. Формы существования серы.
Получение и применение серы
В промышленных масштабах серу получают из природных месторождений самородной серы. Сера является сырьем для производства серной кислоты. Е1 используют в бумажной промышленности, в сельском хозяйстве, в производстве резины, красителей, пороха и т.д. Широкое применение сера нашла в медицине, например, сера входит в состав различных мазей и присыпок, применяемых при кожных заболеваниях и т.д.
| Задание | Какое количество вещества атомарной серы содержится в сульфиде железа (II) массой 22 г. |
| Решение | Молярная масса сульфида железа (II), рассчитанная с использованием таблицы химических элементов Д.И. Менделеева – 88 г/моль. Тогда, количество вещества сульфида железа (II) будет равно: |
n(FeS) = m(FeS) / M(FeS);
n(FeS) = 22 / 88 = 0,25 моль.
Т.к. в состав молекулы сульфида железа (II) входит один атом серы, то количество вещества атомарной серы будет также равно 0,25 моль.
| Задание | При взаимодействии серы с концентрированной азотной кислотой (ω = 60%, ρ = 1,27 г/мл) образовалась серная кислота и выделился оксид азота (II), объемом 67,2 л. Какая масса серы и какой объем раствора азотной кислоты потребовались для этого? |
| Решение | Запишем уравнение реакции: |
Рассчитаем количество вещества оксида азота (II):
n(NO) = 67,2 / 22,4 = 3 моль.
Согласно уравнению n(NO):n(S) = 2:1, следовательно n(S) = 1/2×n(NO) = 1,5 моль. Молярная масса серы, рассчитанная с использованием таблицы химических элементов Д.И. Менделеева – 32 г/моль. Тогда масса серы, вступившей в реакцию будет равна:
m(S) = n(S) × M(S) = 1,5 × 32 = 48 г.
Согласно уравнению n(NO):n(HNO3) = 2:2, следовательно n(HNO3) = n(NO) = 3 моль. Молярная масса азотной кислоты, рассчитанная с использованием таблицы химических элементов Д.И. Менделеева – 63 г/моль. Тогда масса азотной кислоты, вступившей в реакцию будет равна:
Масса раствора азотной кислоты:
Тогда объем раствора азотной кислоты, вступившей в реакцию:
V(HNO3) = m(HNO3)solution / ρ = 315 / 1,27 = 229,9 мл.
Химические свойства серы с металлами
Сера - элемент VIa группы 3 периода периодической таблицы Д.И. Менделеева. Относится к группе халькогенов - элементов VIa группы.
Сера - S - простое вещество имеет светло-желтый цвет. Использовалась еще до нашей эры в составе священных курений при религиозных обрядах.

Основное и возбужденное состояние атома серы
Электроны s- и p-подуровня способны распариваться и переходить на d-подуровень. Как и всегда, количество валентных электронов отражает количество возможных связей у атома.
В разных электронных конфигурациях сера способна принимать валентности: II, IV и VI.

Природные соединения
- FeS2 - пирит, колчедан
- ZnS - цинковая обманка
- PbS - свинцовый блеск (галенит), Sb2S3 - сурьмяный блеск, Bi2S3 - висмутовый блеск
- HgS - киноварь
- CuFeS2 - халькопирит
- Cu2S - халькозин
- CuS - ковеллин
- BaSO4 - барит, тяжелый шпат
- CaSO4 - гипс
В местах вулканической активности встречаются залежи самородной серы.

В промышленности серу получают из природного газа, который содержит газообразные соединения серы: H2S, SO2.
Серу можно получить разложением пирита
В лабораторных условиях серу можно получить слив растворы двух кислот: серной и сероводородной.
- Реакции с неметаллами
На воздухе сера окисляется, образуя сернистый газ - SO2. Реагирует со многими неметаллами, без нагревания - только со фтором.

При нагревании сера бурно взаимодействует со многими металлами с образованием сульфидов.
При взаимодействии с концентрированными кислотами (при длительном нагревании) сера окисляется до сернистого газа или серной кислоты.
Сера вступает в реакции диспропорционирования с щелочами.
Сера вступает в реакции с солями. Например, в кипящем водном растворе сера может реагировать с сульфитами с образованием тиосульфатов.

Сероводород - H2S
Бесцветный газ с характерным запахом тухлых яиц. Огнеопасен. Используется в химической промышленности и в лечебных целях (сероводородные ванны).

Сероводород получают в результате реакции сульфида алюминия с водой, а также взаимодействия разбавленных кислот с сульфидами.

Сероводород плохо диссоциирует в воде, является слабой кислотой. Реагирует с основными оксидами, основаниями с образованием средних и кислых солей (зависит от соотношения основания и кислоты).
KOH + H2S = KHS + H2O (гидросульфид калия, избыток кислоты)
Металлы, стоящие в ряду напряжений до водорода, способны вытеснить водород из кислоты.
Сероводород - сильный восстановитель (сера в минимальной степени окисления S 2- ). Горит в кислороде синим пламенем, реагирует с кислотами.

Качественной реакцией на сероводород является реакция с солями свинца, в ходе которой образуется сульфид свинца.
Оксид серы - SO2
Сернистый газ - SO2 - при нормальных условиях бесцветный газ с характерным резким запахом (запах загорающейся спички).

В промышленных условиях сернистый газ получают обжигом пирита.
В лаборатории SO2 получают реакцией сильных кислот на сульфиты. В ходе подобных реакций образуется сернистая кислота, распадающаяся на сернистый газ и воду.
Сернистый газ получается также в ходе реакций малоактивных металлов с серной кислотой.
С основными оксидами, основаниями образует соли сернистой кислоты - сульфиты.

Химически сернистый газ очень активен. Его восстановительные свойства продемонстрированы в реакциях ниже.
В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства (понижать степень окисления).
Сернистая кислота
Слабая, нестойкая двухосновная кислота. Существует лишь в разбавленных растворах.
Диссоциирует в водном растворе ступенчато.
В реакциях с основными оксидами, основаниями образует соли - сульфиты и гидросульфиты.
H2SO3 + KOH = H2O + KHSO3 (соотношение кислота - основание, 1:1)
С сильными восстановителями сернистая кислота принимает роль окислителя.
Как и сернистый газ, сернистая кислота и ее соли обладают выраженными восстановительными свойствами.

Оксид серы VI - SO3
Является высшим оксидом серы. Бесцветная летучая жидкость с удушающим запахом. Ядовит.
В промышленности данный оксид получают, окисляя SO2 кислородом при нагревании и присутствии катализатора (оксид ванадия - Pr, V2O5).
В лабораторных условиях разложением солей серной кислоты - сульфатов.
Является кислотным оксидом, соответствует серной кислоте. При реакции с основными оксидами и основаниями образует ее соли - сульфаты и гидросульфаты. Реагирует с водой с образованием серной кислоты.
SO3 + 2KOH = K2SO4 + 2H2O (основание в избытке - средняя соль)
SO3 + KOH = KHSO4 + H2O (кислотный оксид в избытке - кислая соль)

SO3 - сильный окислитель. Чаще всего восстанавливается до SO2.

Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Читайте также:
