Химические связи ковалентная полярная ионная металлическая
Обновлено: 20.05.2024

Какая сила удерживает вместе атомы в молекуле вещества и почему они не разбегаются в разные стороны? Эта сила называется химической связью, школьники узнают о ней в 8 классе. Еще Ньютон предположил, что она имеет электростатическую природу, но подробнее в этом разобрались лишь в начале ХХ века. Сейчас расскажем, что такое химическая связь и какой она бывает.
О чем эта статья:
Химическая связь и строение вещества
| Химическая связь — это взаимодействие между атомами в молекуле вещества, в ходе которого два электрона (по одному от каждого атома) образуют общую электронную пару либо электрон переходит от одного атома к другому. |
Как понятно из определения химической связи, при взаимодействии двух атомов один из них может притянуть к себе внешние электроны другого. Эта способность называется электроотрицательностью (ЭО). Атом с более высокой электроотрицательностью (ЭО) при образовании химической связи с другим атомом может вызвать смещение к себе общей электронной пары.
Существует несколько систем измерения ЭО, но пользоваться для расчетов можно любой из них. Для образования химической связи важно не конкретное значение ЭО, а разница между этими показателями у двух атомов.
Механизм образования химической ковалентной связи
Существует два механизма взаимодействия атомов:
обменный — предполагает выделение по одному внешнему электрону от каждого атома и соединение их в общую пару;
донорно-акцепторный — происходит, когда один атом (донор) выделяет два электрона, а второй атом (акцептор) принимает их на свою свободную орбиталь.
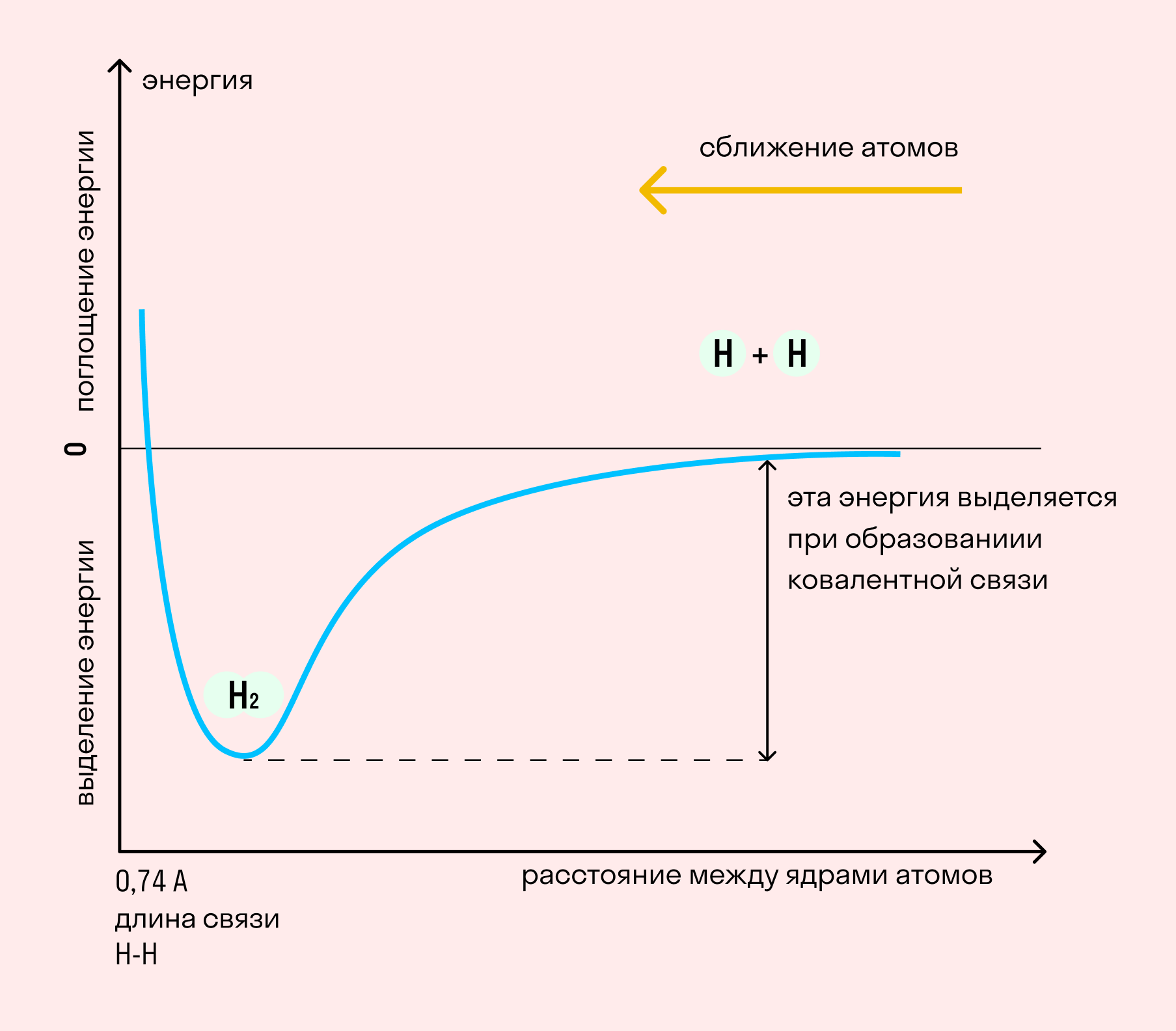
Независимо от механизма химическая связь между атомами сопровождается выделением энергии. Чем выше ЭО атомов, т. е. их способность притягивать электроны, тем сильнее и этот энергетический всплеск.
| Энергией связи называют ту энергию, которая выделяется при взаимодействии атомов. Она определяет прочность химической связи и по величине равна усилию, необходимому для ее разрыва. |
Также на прочность влияют следующие показатели:
Длина связи — расстояние между ядрами атомов. С уменьшением этого расстояния растет энергия связи и увеличивается ее прочность.
Кратность связи — количество электронных пар, появившихся при взаимодействии атомов. Чем больше это число, тем выше энергия и, соответственно, прочность связи.
На примере химической связи в молекуле водорода посмотрим, как меняется энергия системы при сокращении расстояния между ядрами атомов. По мере сближения ядер электронные орбитали этих атомов начинают перекрывать друг друга, в итоге появляется общая молекулярная орбиталь. Неспаренные электроны через области перекрывания смещаются от одного атома в сторону другого, возникают общие электронные пары. Все это сопровождается нарастающим выделением энергии. Сближение происходит до тех пор, пока силу притяжения не компенсирует сила отталкивания одноименных зарядов.
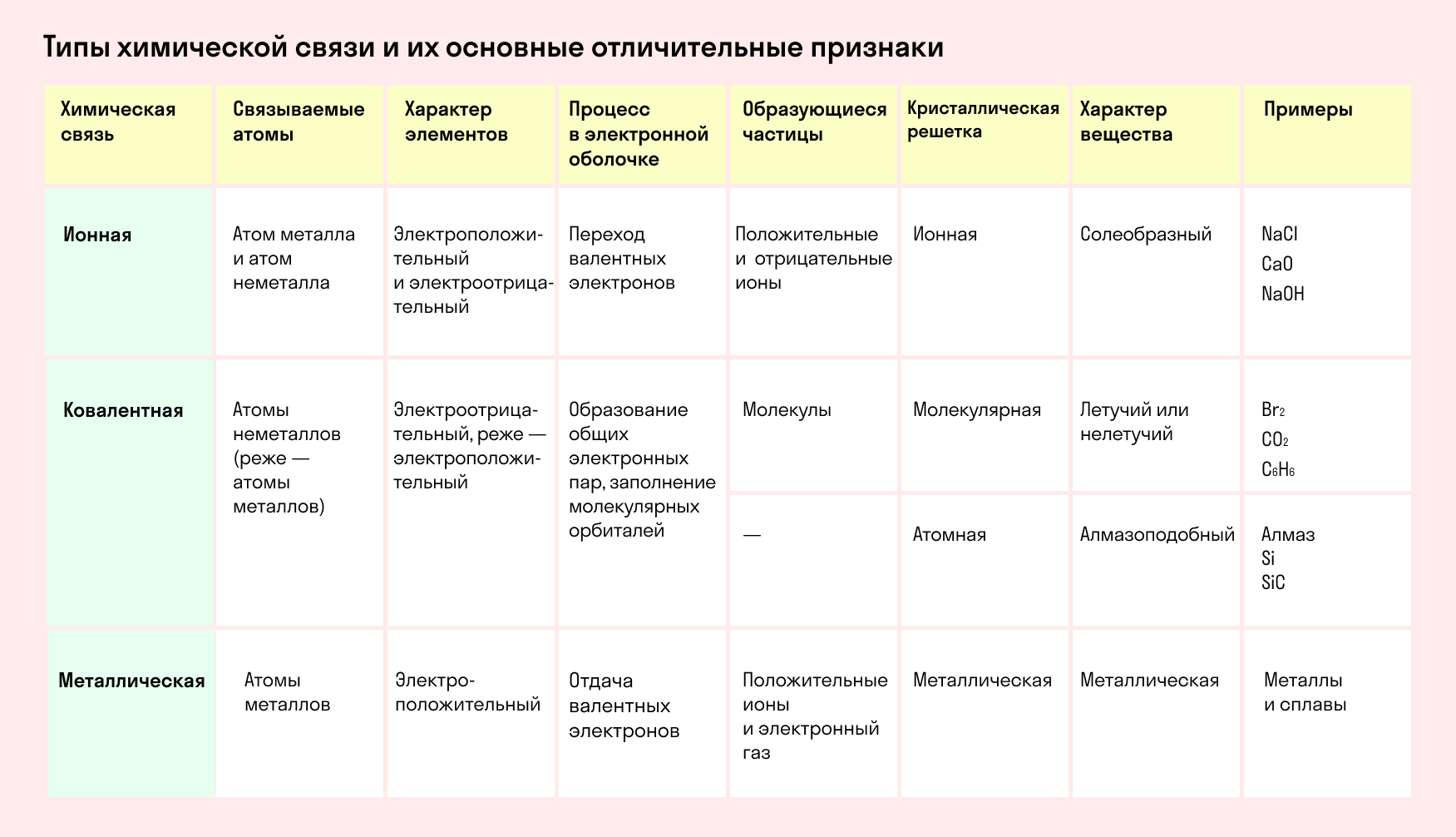
Основные типы химических связей
Различают четыре вида связей в химии: ковалентную, ионную, металлическую и водородную. Но в чистом виде они встречаются редко, обычно имеет место наложение нескольких типов химических связей. Например, в молекуле фосфата аммония (NH4)3PO4присутствует одновременно ионная связь между ионами и ковалентная связь внутри ионов.
Также отметим, что при образовании кристалла от типа связи между частицами зависит, какой будет кристаллическая решетка. Влияя на тип кристаллической решетки, химическая связь определяет и физические свойства вещества: твердость, летучесть, температуру плавления и т. д.
Основные характеристики химической связи:
насыщенность — ограничение по количеству образуемых связей из-за конечного числа неспаренных электронов;
полярность — неравномерная электронная плотность между атомами и смещение общей пары электронов к одному из них;
направленность — ориентация связи в пространстве, расположение орбиталей атомов под определенным углом друг к другу.
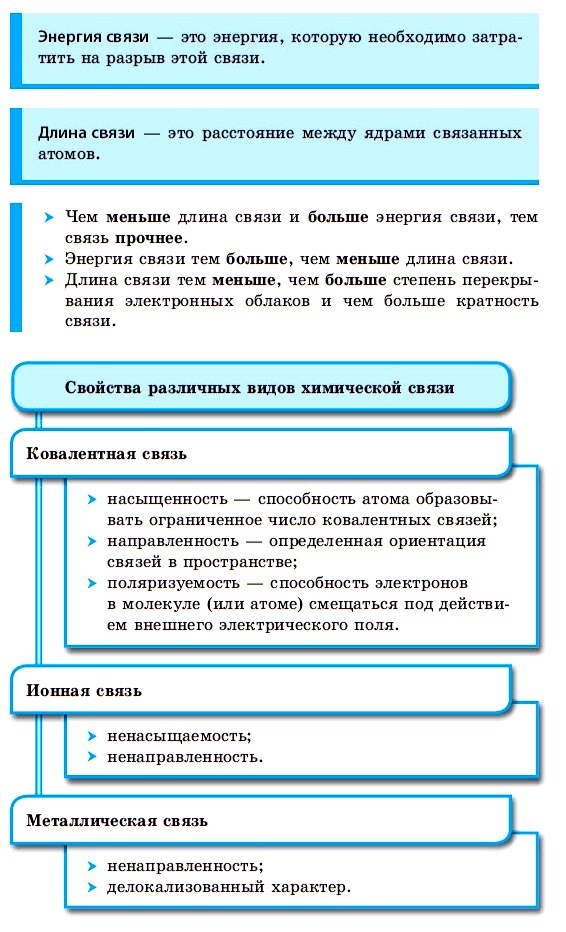
Ковалентная связь
Как уже говорилось выше, этот тип связи имеет два механизма образования: обменный и донорно-акцепторный. При обменном механизме объединяются в пару свободные электроны двух атомов, а при донорно-акцепторном — пара электронов одного из атомов смещается к другому на его свободную орбиталь.
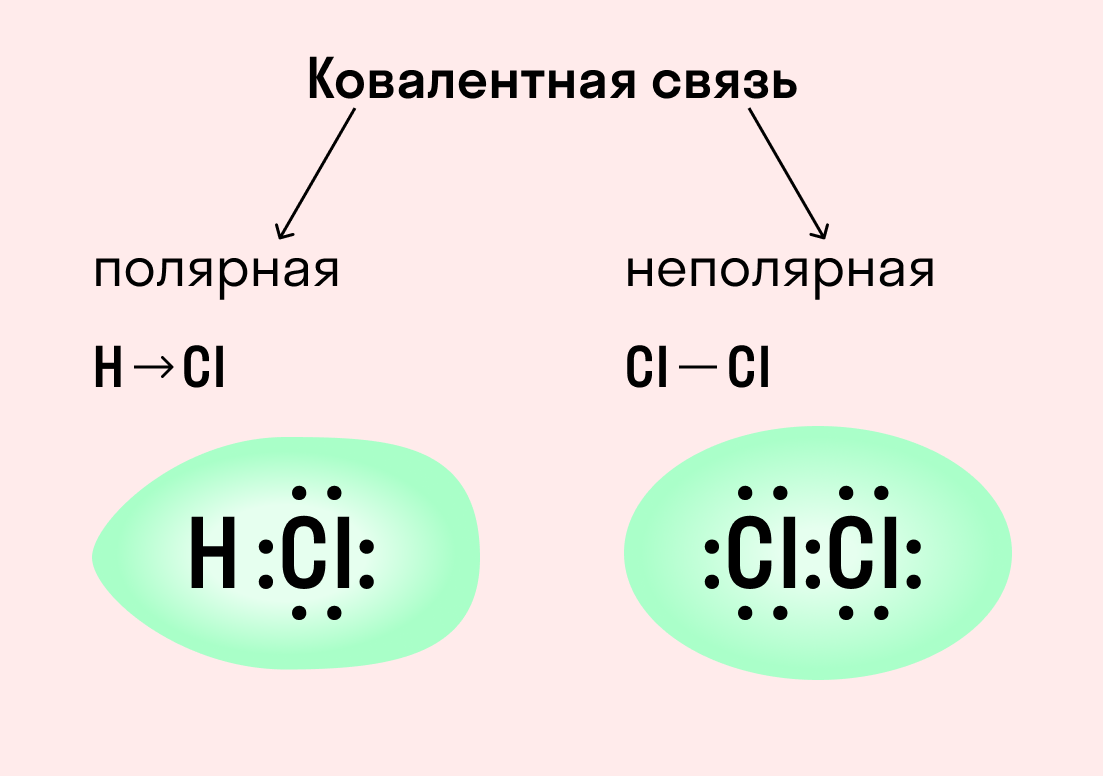
| Ковалентная связь — это процесс взаимодействия между атомами с одинаковыми или близкими радиусами, при котором возникает общая электронная пара. Если эта пара принадлежит в равной мере обоим взаимодействующим атомам — это неполярная связь, а если она смещается к одному из них — это полярная связь. |
Как вы помните, сила притяжения электронов определяется электроотрицательностью атома. Если у двух атомов она одинакова, между ними будет неполярная связь, а если один из атомов имеет большую ЭО — к нему сместится общая электронная пара и получится полярная химическая связь.
В зависимости от того, сколько получилось электронных пар, химические связи могут быть одинарными, двойными или тройными.
Ковалентная неполярная связь образуется в молекулах простых веществ, неметаллов с одинаковой ЭО: Cl2, O2, N2, F2 и других.
Посмотрим на схему образования этой химической связи. У атомов водорода есть по одному внешнему электрону, которые и образуют общую пару.
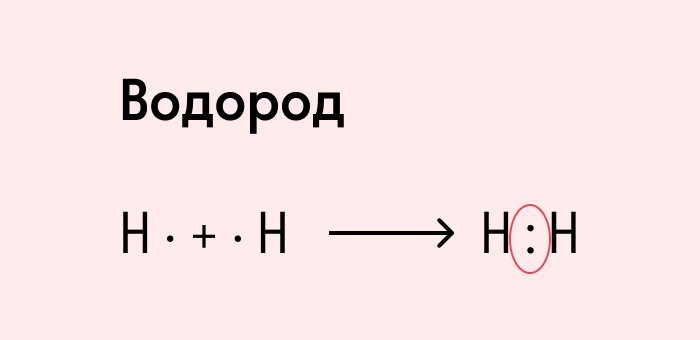
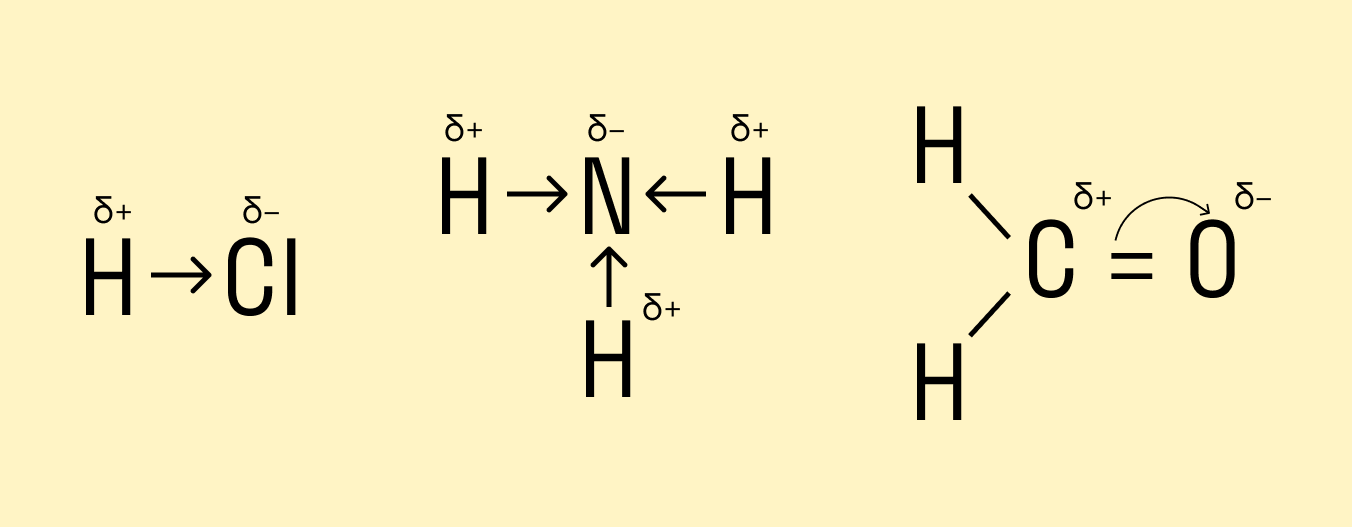
Ковалентная полярная связь характерна для неметаллов с разным уровнем ЭО: HCl, NH3,HBr, H2O, H2S и других.
Посмотрим схему такой связи в молекуле хлороводорода. У водорода имеется один свободный электрон, а у хлора — семь. Таким образом, всего есть два неспаренных электрона, которые соединяются в общую пару. Поскольку в данном случае ЭО выше у хлора, эта пара смещается к нему.
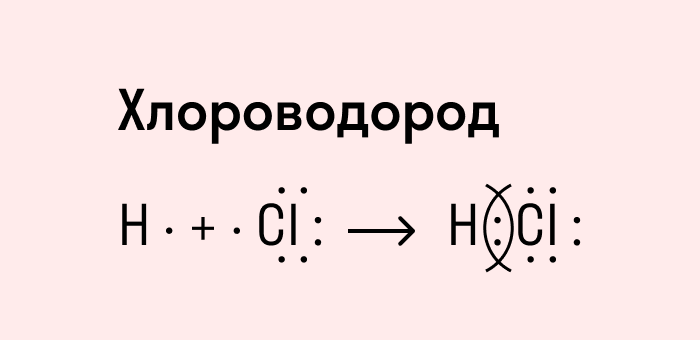
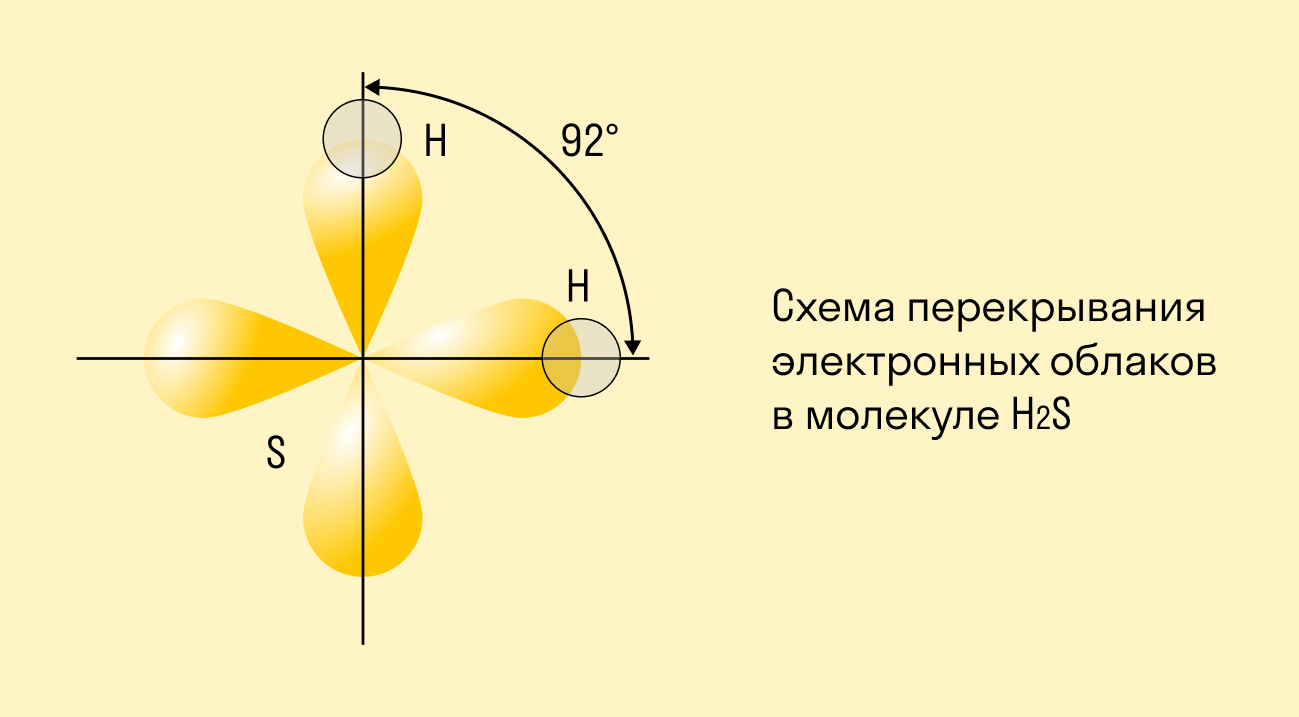
Другой пример — молекула сероводорода H2S. В данном случае мы видим, что каждый атом водорода имеет по одной химической связи, в то время как атом серы — две. Количество связей определяет валентность атома в конкретном соединении, поэтому валентность серы в сероводороде — II.
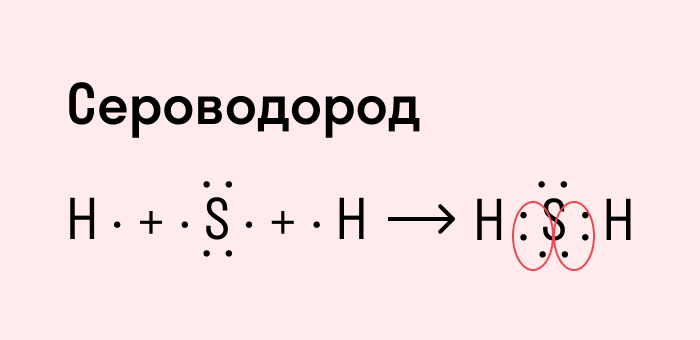
Число связей, которые могут быть у атома в молекуле вещества, называется валентностью.
Характеристики ковалентной связи:
Ионная связь
Как понятно из названия, данный тип связи основан на взаимном притяжении ионов с противоположными зарядами. Он возможен между веществами с большой разницей ЭО — металлом и неметаллом. Механизм таков: один из атомов отдает свои электроны другому атому и заряжается положительно. Второй атом принимает электроны на свободную орбиталь и получает отрицательный заряд. В результате этого процесса образуются ионы.
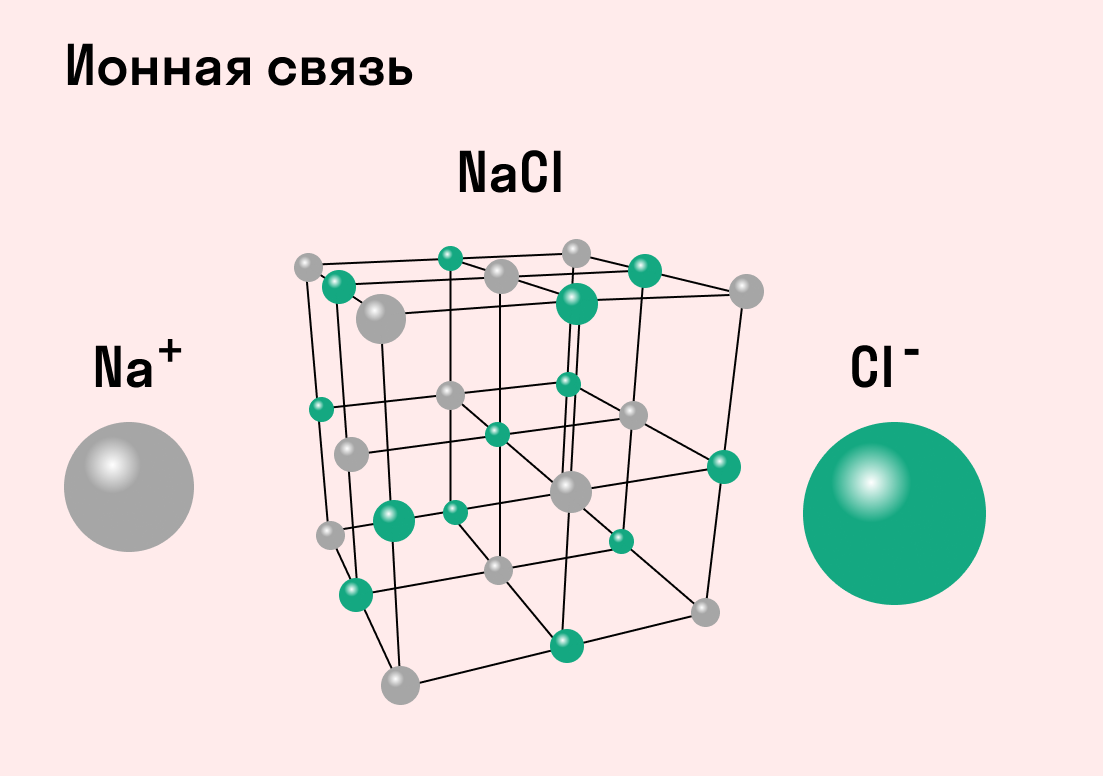
| Ионная связь — это такое взаимодействие между атомами в молекуле вещества, итогом которого становится образование и взаимное притяжение ионов. |
Разноименно заряженные ионы стремятся друг к другу за счет кулоновского притяжения, которое одинаково направлено во все стороны. Благодаря этому притяжению образуются ионные кристаллы, в решетке которых заряды ионов чередуются. У каждого иона есть определенное количество ближайших соседей — оно называется координационным числом.
Обычно ионная связь появляется между атомами металла и неметалла в таких соединениях, как NaF, CaCl2, BaO, NaCl, MgF2, RbI и других. Ниже схема ионной связи в молекуле хлорида натрия.

Все соли образованы с помощью ионных связей, поэтому в задачах, где нужно определить тип химической связи в веществах, в качестве подсказки можно использовать таблицу растворимости.
Характеристики ионной связи:
не имеет направленности.
Ковалентная и ионная связь в целом похожи, и одну из них можно рассматривать, как крайнее выражение другой. Но все же между ними есть существенная разница. Сравним эти виды химических связей в таблице.
Характеризуется появлением электронных пар, принадлежащих обоим атомам.
Характеризуется появлением и взаимным притяжением ионов.
Общая пара электронов испытывает притяжение со стороны обоих ядер атомов.
Ионы с противоположными зарядами подвержены кулоновскому притяжению.
Имеет направленность и насыщенность.
Ненасыщенна и не имеет направленности.
Количество связей, образуемых атомом, называется валентностью.
Количество ближайших соседей атома называется координационным числом.
Образуется между неметаллами с одинаковой или не сильно отличающейся ЭО.
Образуется между металлами и неметаллами — веществами со значимо разной ЭО.
Металлическая связь
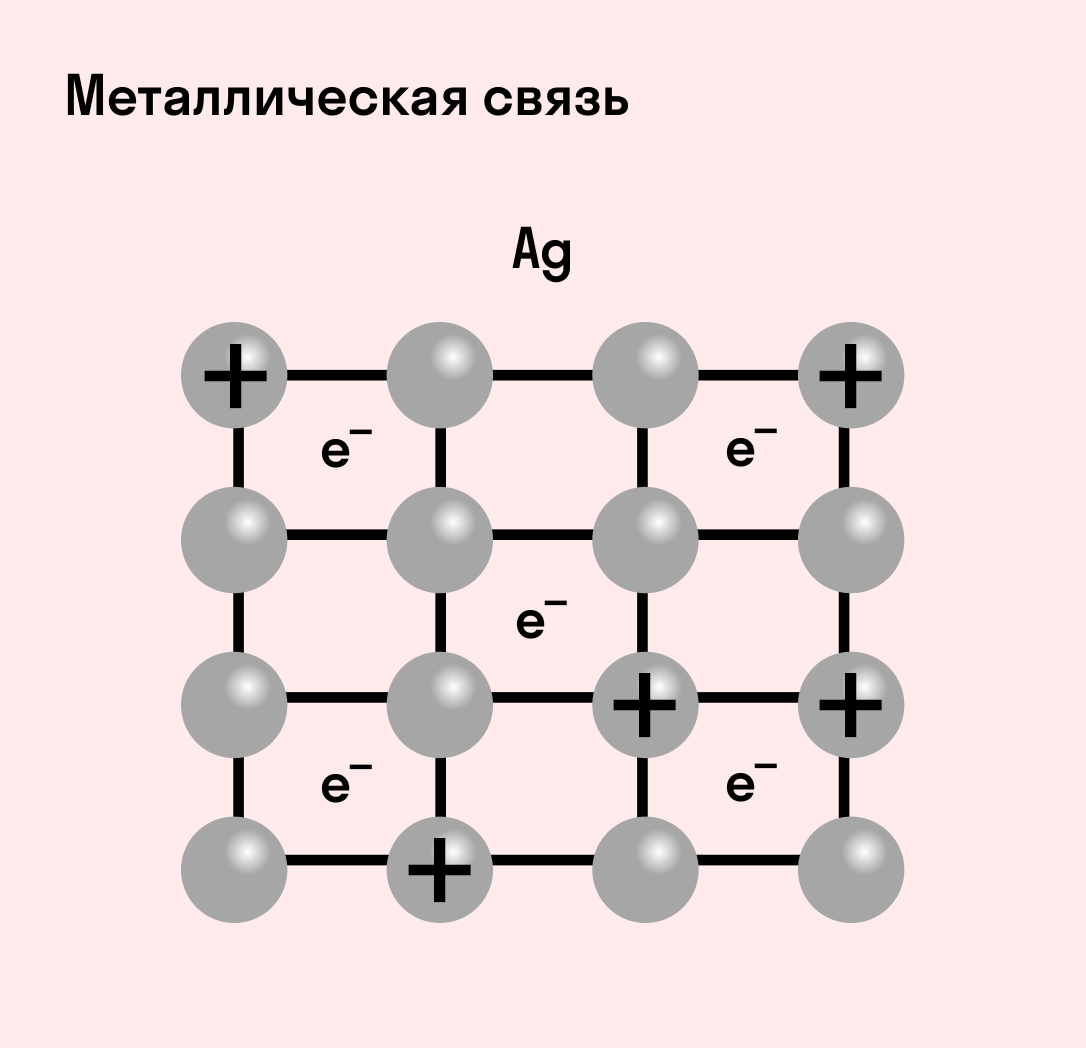
Отличительная особенность металлов в том, что их атомы имеют достаточно большие радиусы и легко отдают свои внешние электроны, превращаясь в положительно заряженные ионы (катионы). В итоге получается кристаллическая решетка, в узлах которой находятся ионы, а вокруг беспорядочно перемещаются электроны проводимости, образуя «электронное облако» или «электронный газ».
Свободные электроны мигрируют от одного иона к другому, временно соединяясь с ними и снова отрываясь в свободное плавание. Этот механизм по своей природе имеет сходство с ковалентной связью, но взаимодействие происходит не между отдельными атомами, а в веществе.
| Металлическая связь — это взаимодействие положительных ионов металлов и отрицательно заряженных электронов, которые являются частью «электронного облака», рассеянного по всему объему вещества. |
Наличие такого «электронного облака», которое может прийти в направленное движение, обусловливает электропроводность металлов. Другие их качества — пластичность и ковкость, объясняются тем, что ионы в кристаллической решетке легко смещаются. Поэтому металл при ударном воздействии способен растягиваться, но не разрушаться.
Характеристики металлической связи:
Металлическая связь присуща как простым веществам — таким как Na, Ba, Ag, Cu, так и сложным сплавам — например, AlCr2, CuAl11Fe4, Ca2Cu и другим.
Схема металлической связи:
M — металл,
n — число свободных внешних электронов.
К примеру, у железа в чистом виде на внешнем уровне есть два электрона, поэтому его схема металлической связи выглядит так:
Обобщим все полученные знания. Таблица ниже описывает кратко химические связи и строение вещества.
Водородная связь
Данный тип связи в химии стоит отдельно, поскольку он может быть как внутри молекулы, так и между молекулами. Как правило, у неорганических веществ эта связь происходит между молекулами.
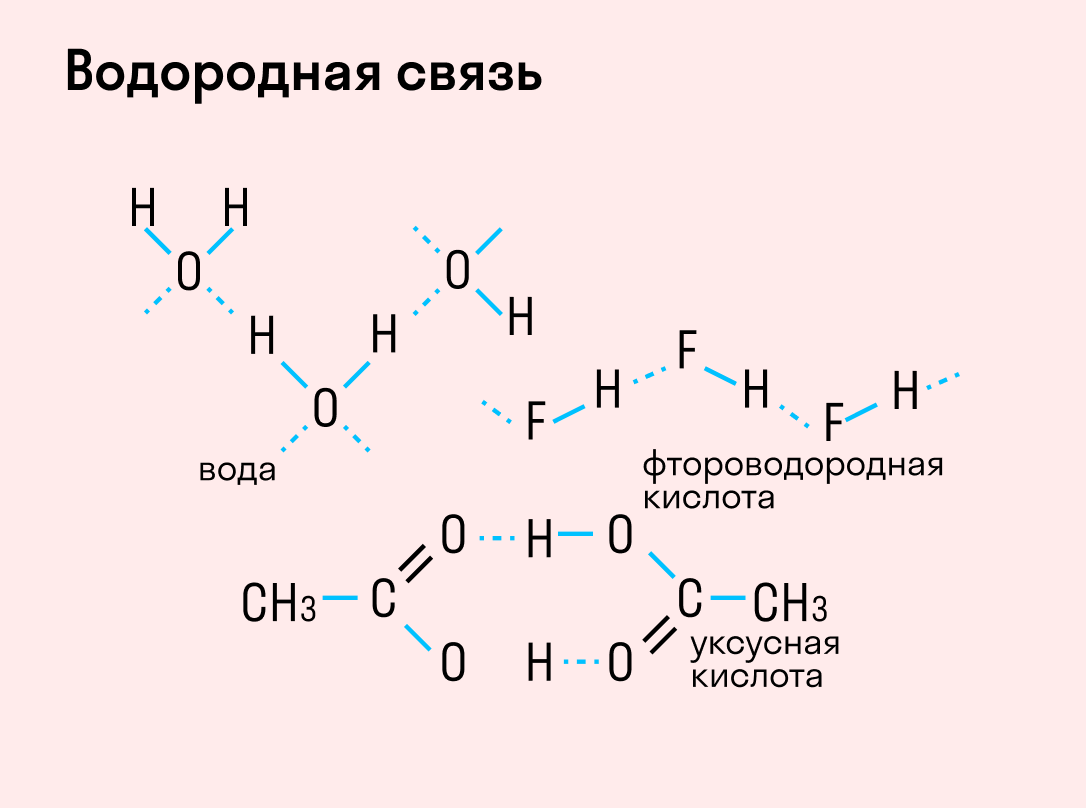
| Водородная связь образуется между молекулами, содержащими водород. Точнее, между атомами водорода в этих молекулах и атомами с большей ЭО в других молекулах вещества. |
Объясним подробнее механизм этого вида химической связи. Есть молекулы А и В, содержащие водород. При этом в молекуле А есть электроотрицательные атомы, а в молекуле В водород имеет ковалентную полярную связь с другими электроотрицательными атомами. В этом случае между атомом водорода в молекуле В и электроотрицательным атомом в молекуле А образуется водородная связь.
Графически водородная связь обозначается тремя точками. Ниже приведена схема такого взаимодействия на примере молекул воды.
В отдельных случаях водородная связь может образоваться внутри молекулы. Это характерно для органических веществ: многоатомных спиртов, углеводов, белковых соединений и т. д.
Характеристики водородной связи:
Кратко о химических связях
Итак, самое главное. Химической связью называют взаимодействие атомов, причиной которого является стремление системы приобрести устойчивое состояние. Во время взаимодействия свободные внешние электроны атомов объединяются в пары либо внешний электрон одного атома переходит к другому.
Образование химической связи сопровождается выделением энергии. Эта энергия растет с увеличением количества образованных электронных пар и с сокращением расстояния между ядрами атомов.
Основные виды химических связей: ковалентная (полярная и неполярная), ионная, металлическая и водородная. В отличие от всех остальных водородная ближе к молекулярным связям, поскольку может быть как внутри молекулы, так и между разными молекулами.
Как определить тип химической связи:
Ковалентная полярная связь образуется в молекулах неметаллов между атомами со сходной ЭО.
Ковалентная неполярная связь имеет место между атомами с разной ЭО.
Ионная связь ведет к образованию и взаимному притяжению ионов. Она происходит между атомами металла и неметалла.
Металлическая связь бывает только между атомами металлов. Это взаимодействие положительных ионов в кристаллической решетке и свободных отрицательных электронов. Масса рассеянных по всему объему свободных электронов представляет собой «электронное облако».
Водородная связь появляется при условии, что есть атом с высокой ЭО и атом водорода, связанный с другой электроотрицательной частицей ковалентной связью.
Химическая связь и строение молекулы: типом химической связи определяется кристаллическая решетка вещества: ионная, металлическая, атомная или молекулярная.
Ковалентные неполярные и полярные связи

Алмаз и кремний имеют высокую твердость и не растворяются в воде, а кристаллы поваренной соли хоть и тверды, но отлично растворимы. Эти физические свойства обусловлены разным строением вещества и разными химическими связями между атомами. В этом материале, основанном на программе 9 класса, мы рассмотрим наиболее прочные химические связи в молекуле — ковалентные.
Что такое ковалентная связь
На примере ковалентных связей удобно описывать механизм химической связи в целом. Впервые это сделал американский ученый Гилберт Льюис, анализируя взаимодействие между частицами в молекулах водорода, азота, кислорода и других простых неметаллов.
Как происходит такое взаимодействие? Атом водорода отличается очень простым строением — его электронное облако или орбиталь содержит лишь один свободный (валентный) электрон. При сближении двух атомов водорода их орбитали пересекаются и начинают частично перекрывать друг друга.
Свободные электроны на этих орбиталях объединяются в пару, которая принадлежит обоим участникам взаимодействия. Это и есть процесс образования ковалентной связи. По ее итогам каждый атом имеет уже два электрона и приобретает устойчивую внешнюю оболочку.
Ковалентная связь — это образование общей электронной пары у двух атомов вещества при сближении ядер этих атомов.
В зависимости от того, будет ли пара принадлежать обоим атомам в равной мере или сместится к одному из них, ковалентная связь бывает полярной или неполярной.
Ковалентная неполярная связь
Приведенный выше пример с атомами водорода иллюстрирует ковалентную неполярную связь. Образованная пара электронов находится на общей молекулярной орбитали и принадлежит обоим атомам. Это происходит потому, что в простых веществах взаимодействуют атомы с одинаковой электроотрицательностью (ЭО), т. е. они имеют равную способность притягивать электроны.
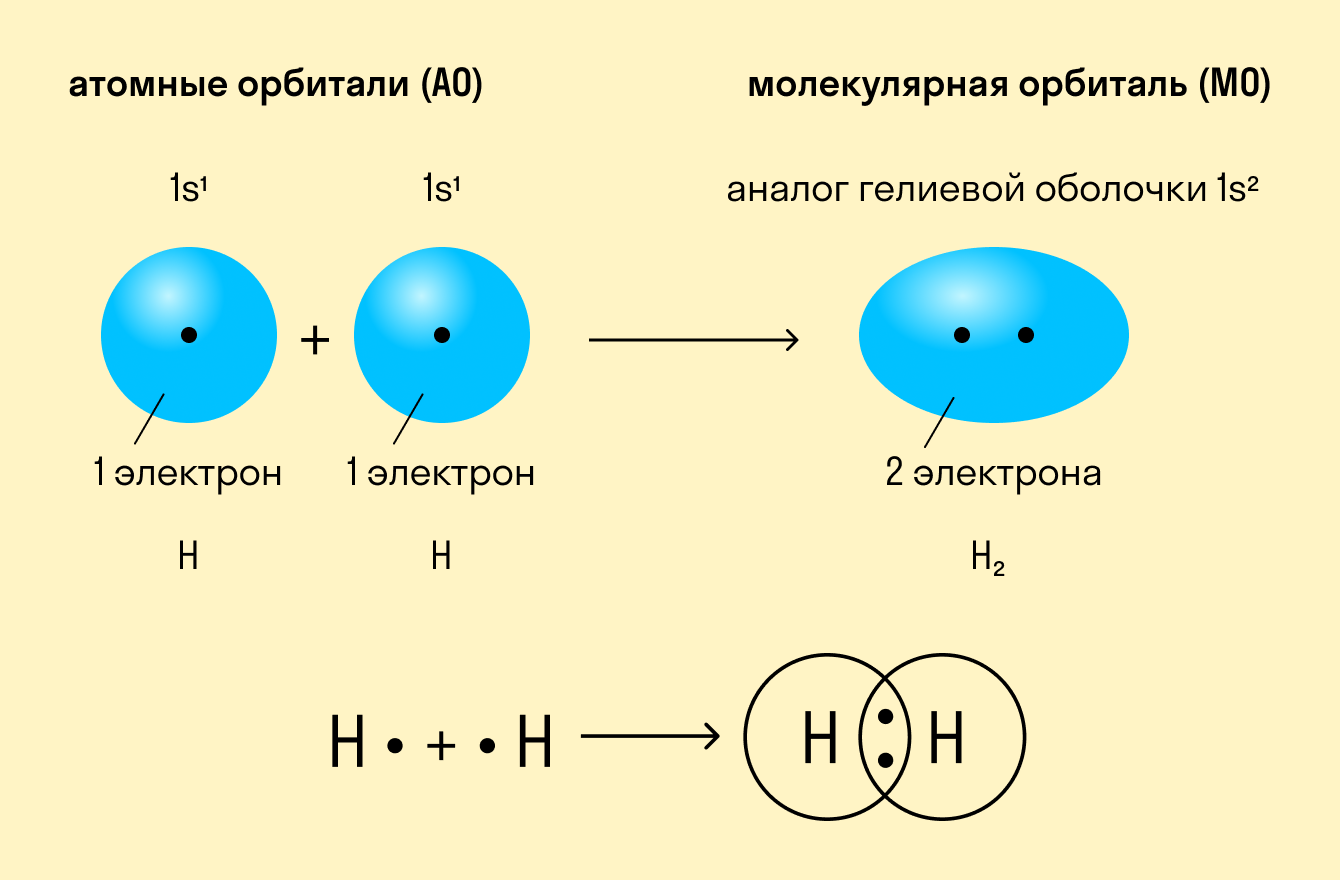
Ковалентная неполярная связь — это такое взаимодействие двух атомов, при котором их общая пара электронов равноудалена от атомных ядер и одинаково принадлежит обоим атомам. Другими словами, электронная плотность (область, в которой наиболее вероятно нахождение электронов) распределена равномерно.
Ковалентная неполярная связь образуется между атомами элементарных веществ с одинаковой ЭО.
Интересный пример ковалентной связи этого типа — молекула ромбической серы S8. У атома серы есть 2 свободных электрона, поэтому он может образовать 2 связи. Это простое вещество, а значит, все атомы будут притягивать электроны с одинаковой силой.
Формула данного вещества с ковалентной неполярной связью:

Ковалентная полярная связь
Мы рассмотрели, как проходит ковалентная химическая связь в молекулах, где все частицы одинаковы. Но если сблизить два атома с разной ЭО — например, водорода и хлора, получится другая картина. Поскольку у хлора ЭО выше и он притягивает электроны немного сильнее, чем водород, общая пара смещается в его сторону. Другими словами, у такой химической связи есть полярность.
Атом, принимающий электроны (в данном случае хлор), приобретает условно отрицательный заряд. Второй же атом, отдающий валентные электроны, заряжается положительно.
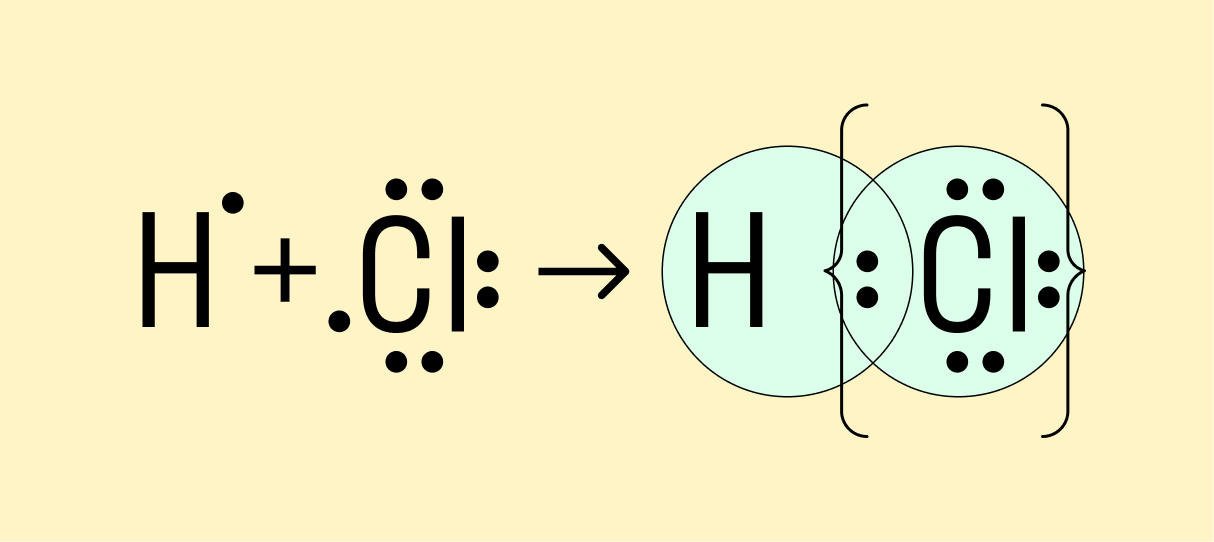
Ковалентная полярная связь — это электронный обмен между двумя атомами в молекуле вещества, при котором общая пара электронов смещается к одному атому (более электроотрицательному). Электронная плотность распределена неравномерно.
Ковалентная полярная связь образуется между атомами неметаллов с разной ЭО в составе сложных веществ.
Проиллюстрируем все, о чем сказано в определении ковалентной полярной связи, на примерах.
В молекуле аммиака NH3 атом азота имеет 3 свободных электрона, т. е. может образовать 3 химические связи. Поскольку это сложное вещество, состоящее из атомов неметаллов, можно говорить о полярности. Атом азота имеет общие электронные пары с тремя атомами водорода. При этом азот обладает более высокой ЭО, чем водород, поэтому электронная плотность смещена в его сторону.
Формула данного вещества с ковалентной полярной связью:
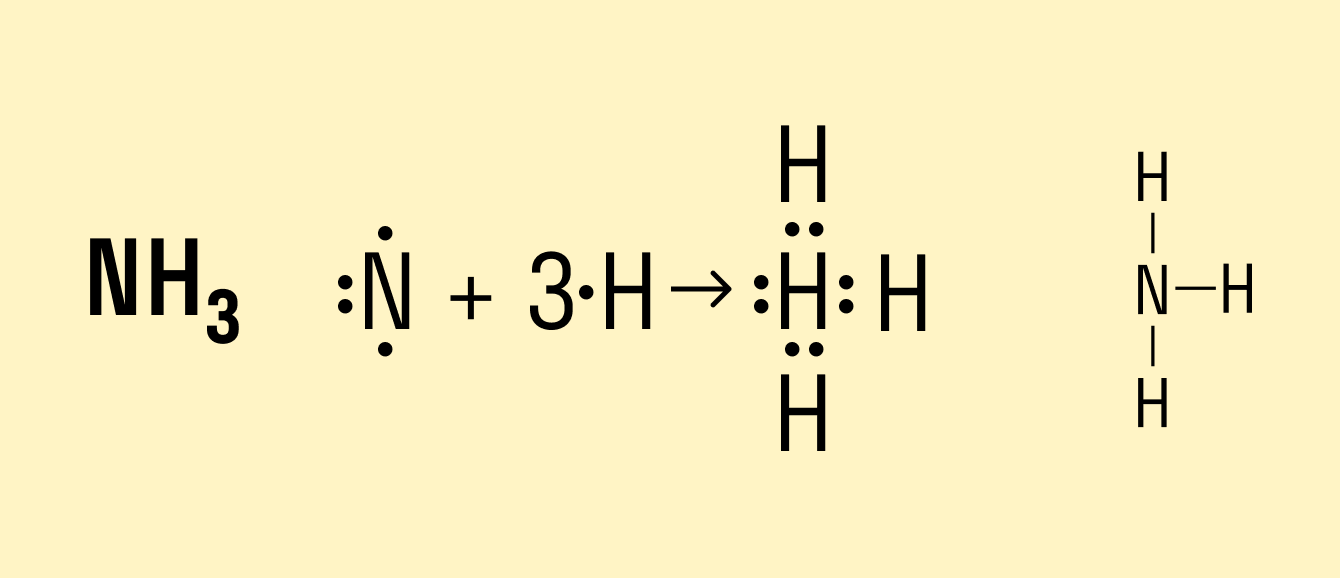
Механизмы образования ковалентной связи
Не всегда взаимодействие атомов происходит так, как в молекуле водорода. Иногда один атом отдает оба электрона, а второй забирает их на свою свободную орбиталь. В зависимости от этого выделяют два механизма ковалентной связи:
Обменный механизм — объединение в пару свободных электронов от взаимодействующих атомов (по одному электрону от каждого).
Донорно-акцепторный механизм — процесс, при котором атом-донор отдает два электрона, а атом-акцептор предоставляет для них орбиталь.
Химическую связь, образованную по донорно-акцепторному принципу, можно рассмотреть на примере молекулы катиона аммония. В данном случае атом азота, который содержится в аммиаке NH3, имеет неподеленную пару электронов и является донором. Он передает эти электроны на орбиталь атома водорода — акцептора. В результате такой связи образуется молекула NH4 + в форме тетраэдра, где углы представлены четырьмя атомами водорода.
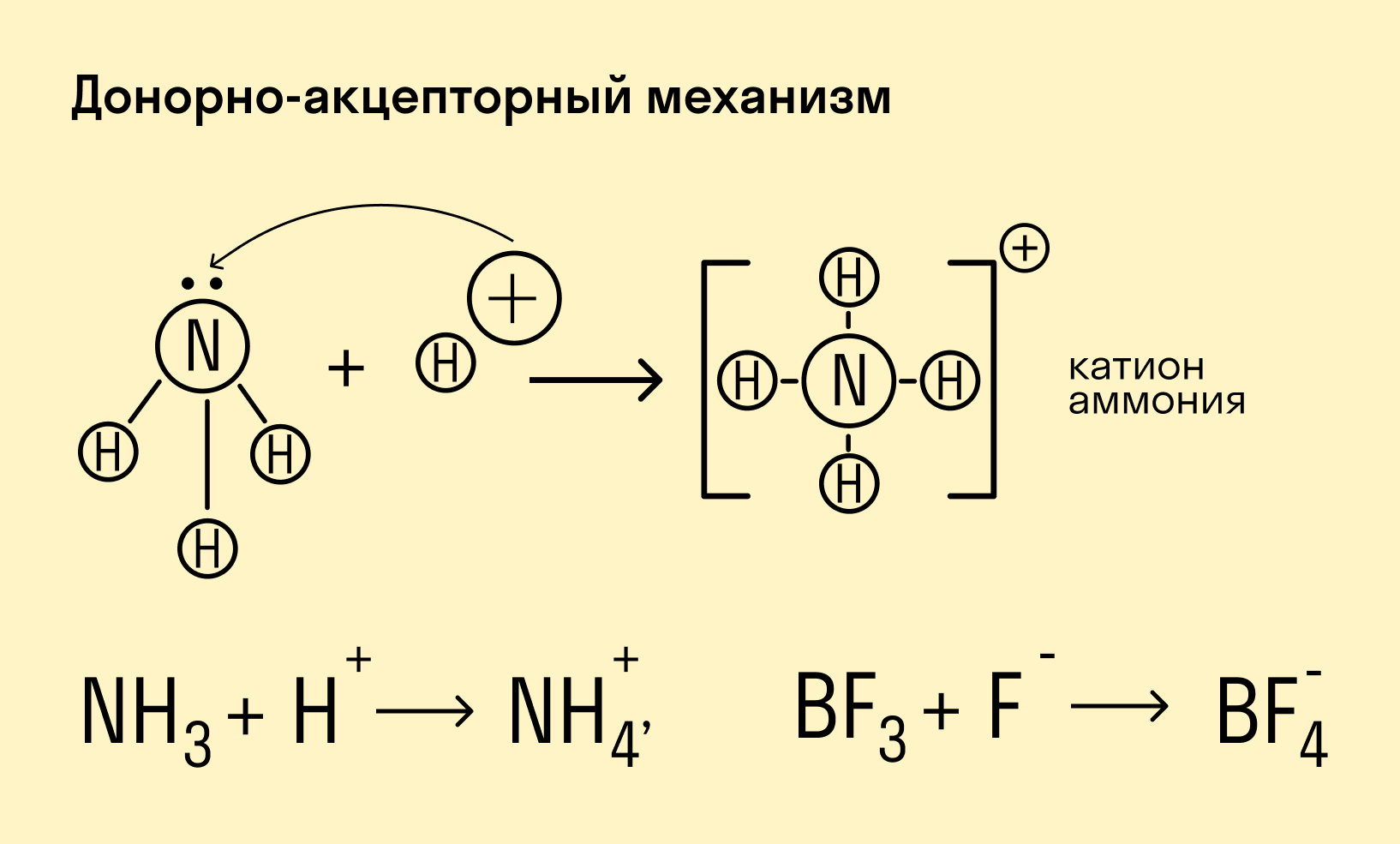
Вещества, в молекулах которых есть хотя бы одна ковалентная химическая связь, осуществляемая по донорно-акцепторному принципу:
NH4 + Cl, NH4 + Br;
Кратность ковалентной связи
Ковалентная связь может подразумевать образование как одной пары электронов, так и двух или даже трех. Исходя из того, сколько именно получилось пар, выделяют одинарные, двойные и тройные связи. В формулах они обозначаются соответствующим количество черточек.
Кратность ковалентной связи — это количество созданных общих электронных пар у двух атомов.
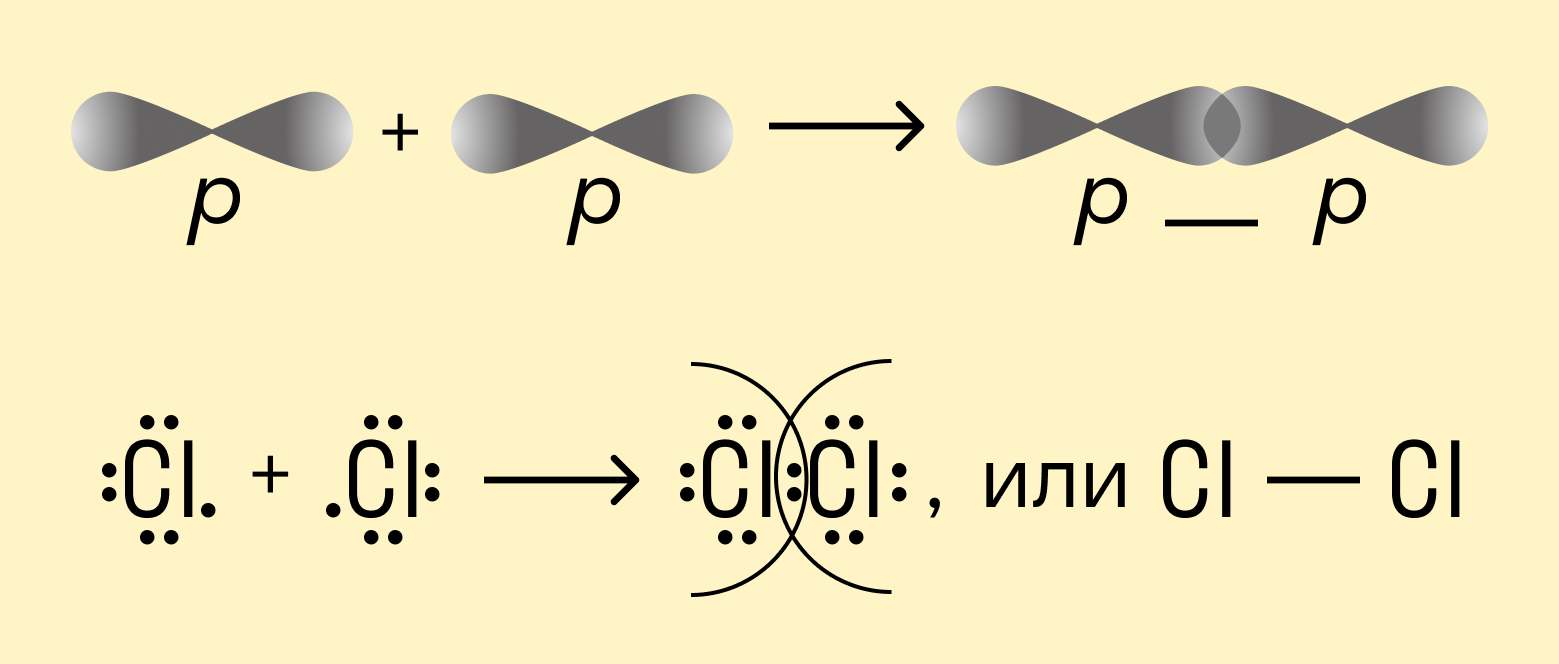
Например, в молекуле хлора Cl2 каждый атом содержит по одному валентному электрону на внешней p-орбитали. При сближении атомов происходит перекрывание орбиталей и свободные электроны соединяются в одну общую пару. Это одинарная ковалентная связь. В данном случае она будет неполярной, поскольку речь идет о простом веществе.
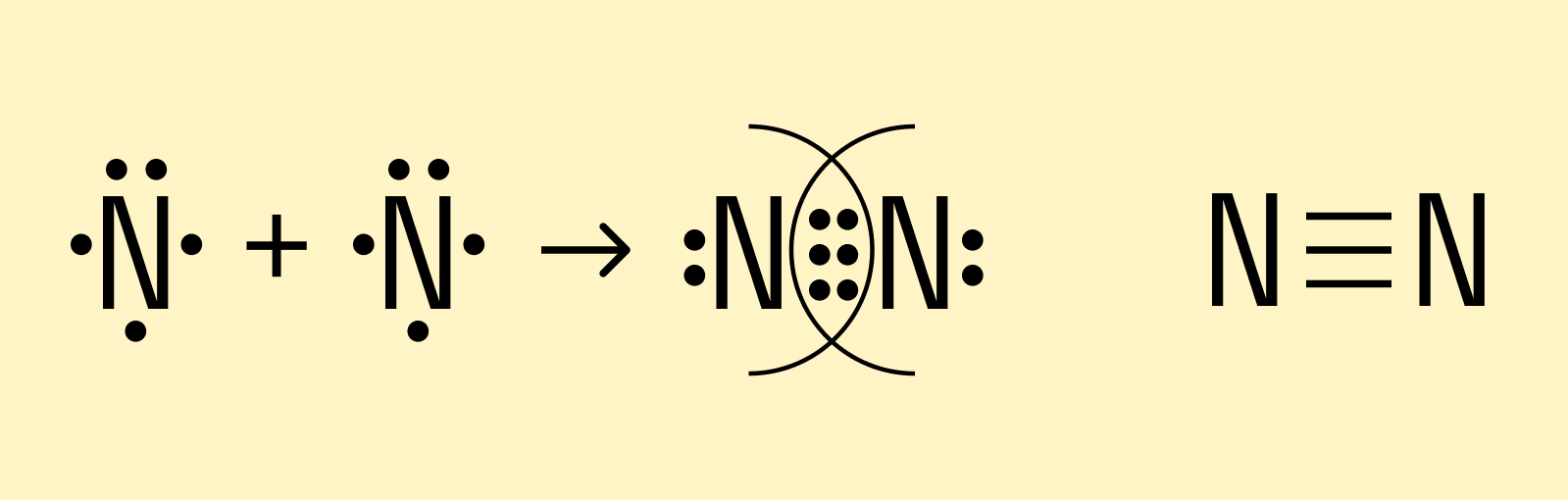
Посмотрим теперь, что происходит с атомами азота, у которых на внешней орбитали целых 5 валентных электронов. Как мы помним, все частицы стремятся приобрести устойчивую форму, которая предполагает двухэлектронную или восьмиэлектронную внешнюю оболочку. Таким образом, атомам азота нужно довести количество электронов на внешней орбитали до 8, для чего они отдают в общие пары по 3 электрона. В результате получаются 3 электронные пары, и такая химическая связь называется тройной.
Характеристики ковалентной связи
К ковалентным связям применимы те же общие закономерности, что и для других типов. Например, чем меньше длина ковалентной связи, тем она прочнее. Но есть и специфические свойства, которые появляются только при этом виде взаимодействия:
Насыщаемость ковалентной связи
Насыщаемость говорит об ограничениях по количеству взаимодействий, в которые может вступать один атом. Таких взаимодействий, т. е. химических связей, может быть ровно столько, сколько у атома неспаренных электронов. Как мы помним из примеров выше, у водорода один валентный электрон, поэтому он может образовать только одинарную ковалентную связь.
Количество свободных электронов может увеличиться, если атом перейдет в возбужденное состояние. В этом случае происходит распаривание электронов и перемещение их на свободные орбитали более высоких подуровней внешнего уровня. Эти распаренные электроны также способны вступать в химические связи.
Полярность ковалентной связи
Полярность связи — это смещение электронной плотности к одному из атомов. Чем больше выражено такое смещение, тем более полярной является связь. Напомним, что электронная плотность смещается всегда в сторону более электроотрицательного элемента. Следовательно, большая разница в ЭО между атомами обуславливает высокую полярность связи.
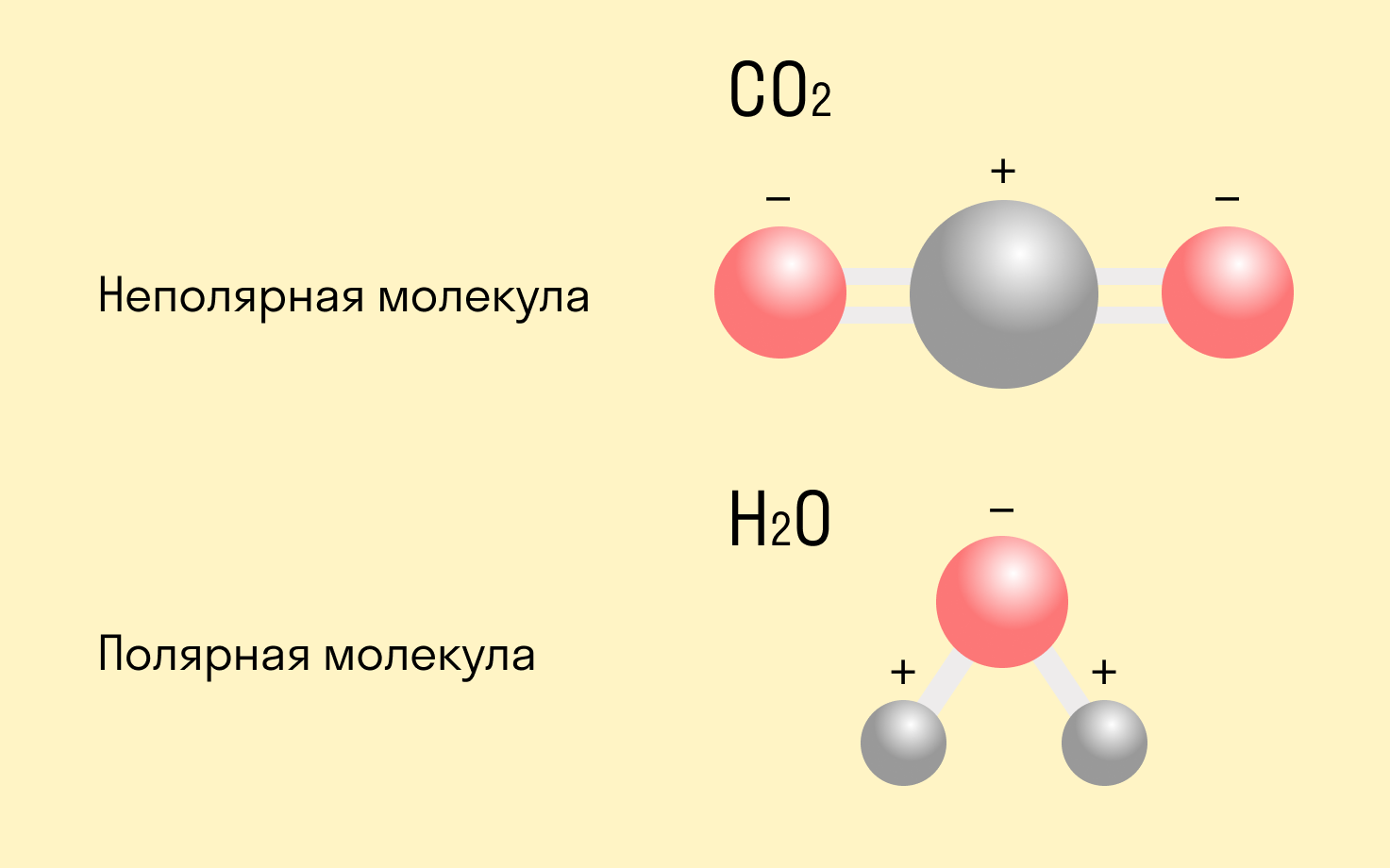
Атом, к которому смещается общая пара электронов, заряжается отрицательно. Данный заряд обозначают буквой δ - . Второй атом заряжается положительно, и этот заряд обозначают буквой δ + . Очень часто центры положительного и отрицательного зарядов разделяет некоторое расстояние. Молекулы с таким устройством называют диполями (поскольку они имеют два полюса)
Логично предположить, что ковалентная полярная химическая связь всегда ведет к образованию диполей. Но это не так. В одной молекуле часто присутствует несколько типов связи, и если один из них вызывает смещение электронной пары, то другой может это компенсировать. В таком случае получится неполярная молекула (например, CO2)
Смещение электронной плотности в сторону одного из атомов, связанных ковалентной полярной связью, в структурной формуле можно обозначить стрелкой или дугой. Стрелка используется, если перекрываемые орбитали атомов находятся на одной оси, а дуга — если они расположены под углом.
Направленность ковалентной связи
Ковалентная связь становится направленной, если в ней участвуют атомы, чьи орбитали (электронные облака) находятся под определенным углом друг к другу. Если провести воображаемые линии между связанными атомами, можно увидеть этот угол — он называется валентным. По значениям валентных углов легко определить строение молекулы вещества, ее геометрическую форму.
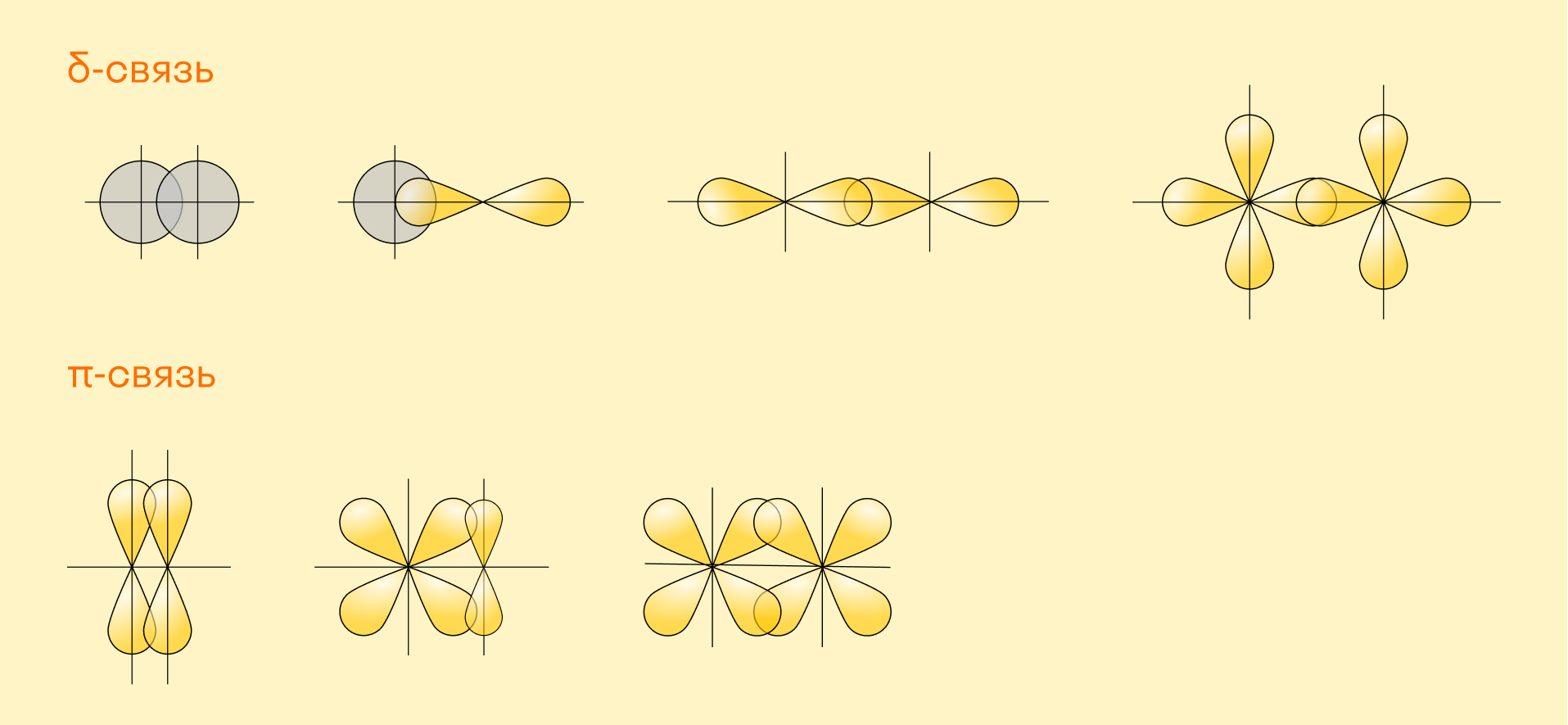
В зависимости от взаимного расположения орбиталей выделяют:
σ-связи, которые образуются, если перекрывание орбиталей идет по оси, соединяющей ядра атомов (т. е. линейно);
π-связи, которые предполагают боковое перекрывание (электронные облака находятся под углом друг к другу).
Как понятно из этих определений, два атома могут иметь только одну σ-связь, а в дополнение к этому они могут быть связаны с другими атомами π-связями.
Вопросы для самопроверки
Дайте определение ковалентной связи.
Что такое ковалентная полярная связь, чем она отличается от неполярной?
Исключите лишнее: ковалентная полярная связь характерна для H2S, O2, N2O5, SF6.
Ионная связь
В этом материале речь пойдет о том, что такое ионная связь и чем она отличается от других видов, которые изучают на уроках химии в 8 классе.
Общие сведения о химических связях
Давайте вспомним, как образуются химические связи. Для этого представим атом: он состоит из ядра с положительным зарядом и набора отрицательно заряженных электронов, которые располагаются на нескольких уровнях. Внешний уровень называется валентным, на нем располагаются валентные электроны. Они могут образовывать пары или быть свободными, т. е. неспаренными.
Во взаимодействии двух атомов участвуют свободные электроны внешней оболочки. Сколько таких электронов имеется у атома — столько химических связей он может образовать.
При этом каждый атом стремится приобрести устойчивую конфигурацию — двух- или восьмиэлектронную внешнюю оболочку, подобную той, что есть у инертного газа. Атом может достичь ее, отдавая или принимая часть электронов, а также образуя общую электронную пару с другим атомом. Если в результате получается два разноименно заряженных иона, говорят об ионном типе связи. Он характерен для взаимодействия атомов металла и неметалла.
Определение ионной связи
Рассмотрим этот тип связи на примере реакции натрия и водорода, в результате которой получается гидрид натрия. У атома натрия Na есть один свободный электрон на внешнем уровне, в то время как атому водорода H не хватает одного электрона, чтобы завершить внешнюю оболочку и принять стабильную форму. Поскольку натрий имеет более низкую электроотрицательность, чем водород, он отдает свой валентный электрон и получает отрицательный заряд. Водород принимает этот электрон и получает положительный заряд. В итоге образуется два иона — катион Na + и анион H - .
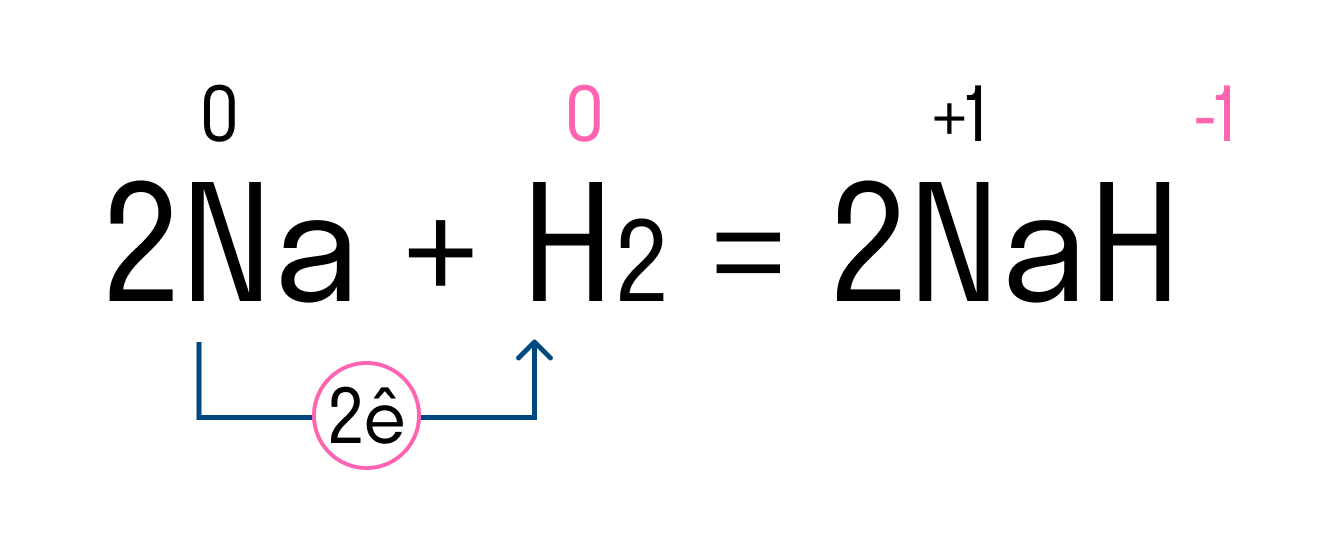
Между положительным ионом Na + и отрицательным H - возникает электростатическое притяжение, которое и удерживает их вместе. Так образуется ионная связь в гидриде натрия.
Ионная связь — это тип химической связи, характерный для разноименно заряженных ионов, которые образовались в результате отдачи и присоединения электронов атомами. В нее вступают элементы с большой разностью электроотрицательности. Обычно так взаимодействуют атомы металла и неметалла.
Чаще всего именно так связаны в соединениях щелочные и щелочноземельные металлы с галогенами. Поскольку у щелочных металлов электроотрицательность ниже, их атомы становятся катионами, а атомы галогенов — анионами.
Механизм образования ионной связи похож на донорно-акцепторный механизм ковалентной связи. Первую даже называют крайним выражением второй.
Соли аммония NH4NO3, NH4Cl, (NH4)2SO4 хоть и не являются соединениями металла и неметалла, но также образованы с помощью ионной связи.
Координационное число
Вернемся к нашему примеру с гидридом натрия и посмотрим на кристаллическую решетку, которую имеет это ионное соединение. Каждый ион Na + контактирует с шестью ионами H - . Это максимально возможное для данного иона число химических связей, оно называется координационным.
Координационное число — это количество ближайших соседей иона в ионной кристаллической решетке. По сути это количество связей, которые образует каждый ион в составе сложного вещества.
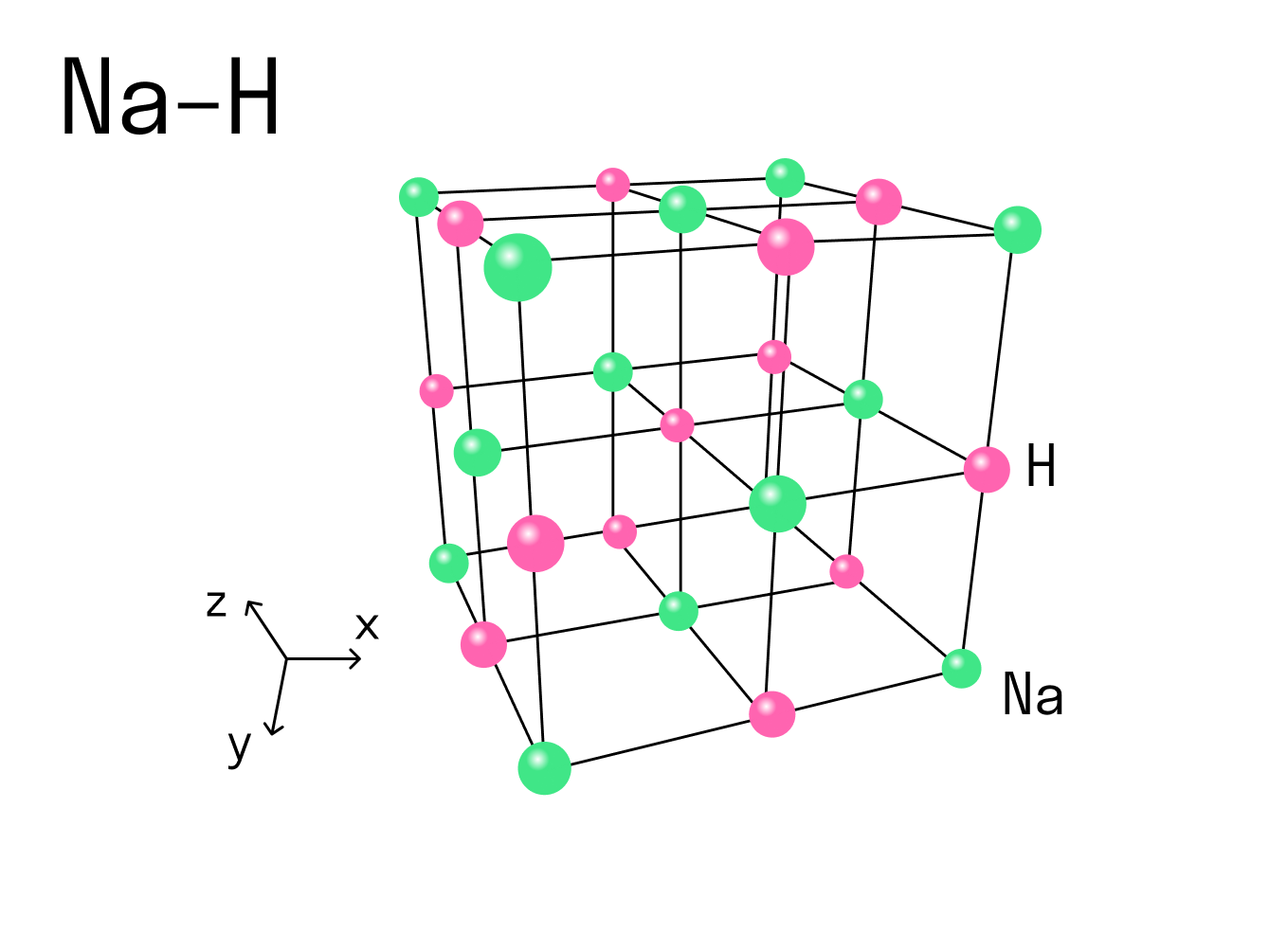
При рассмотрении ковалентной химической связи говорят о валентности — она характеризует, сколько связей есть у конкретного атома с другими атомами. Но к ионным соединениям это понятие не применяют, потому что все ионы в кристаллической решетке взаимодействуют друг с другом. Вместо этого есть координационное число, и оно отражает количество таких взаимодействий.
Примеры веществ с ионной связью
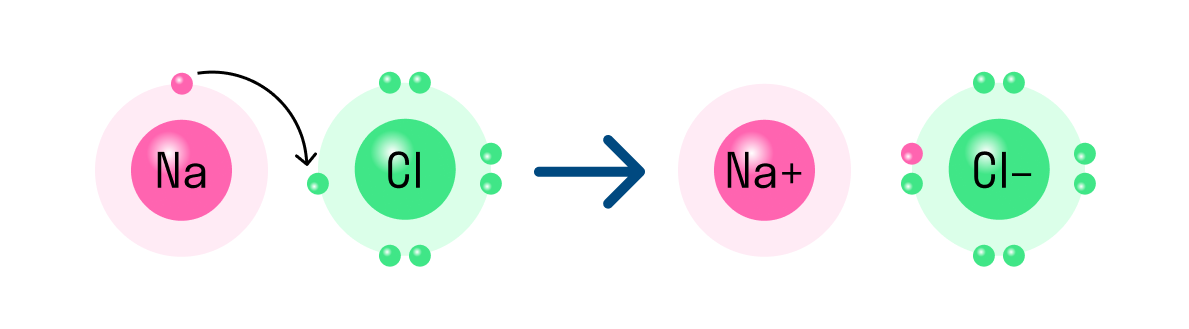
Таким же образом, как в гидриде натрия, ионы образуются и в других подобных ему соединениях. Например, в хлориде натрия NaCl атом натрия имеет один свободный электрон и отдает его атому хлора. В итоге оба завершают свой внешний уровень. Образуется ион натрия с положительным зарядом и отрицательно заряженный ион хлора.
Другой пример ионной химической связи — сульфид натрия Na2S. В данном случае у нас также есть натрий с одним свободным электроном и сера, у которой на внешнем уровне есть 2 свободных электрона из 6. Таким образом, чтобы завершить уровень и обрести стабильную форму, сере нужно 2 электрона. Поэтому в формуле сульфида серы присутствует два атома натрия.
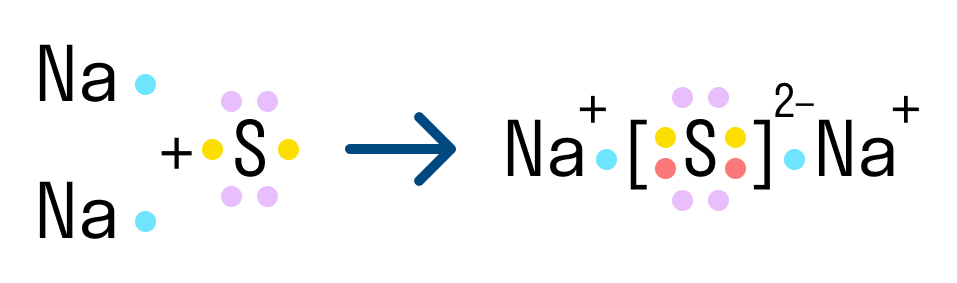
Характеристики ионной связи
Мы узнали, как образуется ионная связь, а теперь поговорим о ее характеристиках. Она существенно отличается от других типов связи между атомами.
не имеет кратности.
Разберемся в каждом пункте и начнем с направленности. Ковалентная полярная связь направлена, потому что она подразумевает смещение общей электронной пары к тому атому, который имеет большую электроотрицательность. В случае с ионами все иначе. Согласно закону Кулона притяжение между отрицательным и положительным ионом идет по прямой, соединяющей эти заряженные частицы. В кристаллической решетке все разноименно заряженные ионы взаимодействуют друг с другом и притяжение распределяется равномерно, поэтому говорят, что ионная связь не направлена.

А как насчет насыщаемости? Эта характеристика указывает на то, что атом может вступить в ограниченное количество химических связей, поскольку имеет ограниченное число неспаренных электронов. Но ионная связь — это не процесс соединения свободных электронов в пары, а взаимное притяжение ионов. Каждый ион может притягивать к себе неограниченное число ближайших соседей, поэтому нет смысла говорить о насыщаемости.
Из вышесказанного понятно, что ионная связь не имеет и кратности. Эта характеристика означает число общих электронных пар у атома, но в данном случае мы рассматриваем притяжение между ионами.

Физические свойства ионной связи
Между ионами в молекуле всегда образуется достаточно сильное притяжение, поэтому вещества с ионной связью в обычных условиях твердые и нелетучие. Такие соединения сложно разрушить при помощи тепловой энергии, что обуславливает высокую температуру кипения и плавления. При этом ионы имеют небольшой радиус взаимодействия — это придает веществам хрупкость.
Свойства ионных соединений:
растворимость в воде,
Типичным веществом с ионными связями можно считать хлорид натрия NaCl или поваренную соль. Ее кристаллы в точности соответствуют всем характеристикам.
Как определить ионную связь
Чтобы быстро понять, является ли нужное нам соединение ионным, выполните следующие действия:
Посмотрите, какие элементы входят в состав соединения. Формула вещества с ионной связью должна включать металл и неметалл. Если это щелочной металл (I группа таблицы Менделеева) и галоген (VII группа), то связь между ними точно ионная.
По шкале Полинга определите электроотрицательности обоих элементов соединения. Если разница между ними больше 1,7 — связь ионная. Это объясняется тем, что такой тип связи характерен для веществ, у которых сильно отличаются показатели электроотрицательности.
Дополнительным способом убедиться в правильности результата может стать оценка физических свойств вещества. Если оно имеет высокую температуру кипения или плавления и проводит электроток — связь скорее всего ионная.
Вопросы для самопроверки:
Опишите, как образуется ионная связь. Какие условия для этого необходимы?
Что такое координационное число элемента в ионном соединении?
Каковы основные физические свойства ионных соединений?
В чем разница между характеристиками ионной и ковалентной связей?
Как можно определить ионную связь, зная электроотрицательность элементов в соединении?
Химические связи ковалентная полярная ионная металлическая
Ключевые слова конспекта. Химическая связь: ковалентная (полярная и неполярная), ионная, металлическая.
Силы, которые удерживают атомы в молекулах, называются химическими связями.
Образование химической связи происходит в том случае, если этот процесс сопровождается выигрышем энергии. Эта энергия возникает, если каждый атом, образующий химическую связь, получает устойчивую электронную конфигурацию.
По способу образования и существования химическая связь может быть ковалентной (полярной, неполярной), ионной, металлической.
Ковалентная химическая связь
■ Ковалентная химическая связь — это связь, возникающая между атомами путем образования общих электронных пар за счет неспаренных электронов.
Внешние уровни большинства элементов периодической системы (кроме благородных газов) содержат неспаренные электроны, то есть являются незавершенными. В процессе химического взаимодействия атомы стремятся завершить свой внешний электронный уровень.
Например, электронная формула атома водорода: 1s 1 . Ее графический вариант:Таким образом, атом водорода в химических реакциях стремится завершить свой внешний 1 s-уровень одним s-электроном. При сближении двух атомов водорода происходит усиление притяжения электронов одного атома к ядру другого атома. Под действием этой силы расстояния между ядрами атомов сокращаются и в результате их электронные орбитали перекрывают друг друга, создавая общую электронную орбиталь — молекулярную. Электроны каждого из атомов водорода через область перекрывания орбиталей мигрируют от одного атома к другому, то есть образуют общую электронную пару. Ядра будут сближаться до тех пор, пока нарастающие силы отталкивания одноименных зарядов не уравновесят силы притяжения.
Переход электронов с атомной орбитали на молекулярную сопровождается снижением энергии системы (более выгодное энергетическое состояние) и образованием химической связи:

Подобным образом образуются общие электронные пары при взаимодействии атомов р-элементов. Так образуются все двухатомные молекулы простых веществ. При образовании F2 и Cl2 перекрываются по одной р-орбитали от каждого из атомов (образуется одинарная связь), а при взаимодействии атомов азота перекрываются по три р-орбитали от каждого и в молекуле азота N2 образуется тройная связь.

Электронная формула атома хлора: 1s 2 2s 2 2p 6 3s 2 3p 5 . Графическая формула:
Электронная формула атома азота: 1s 2 2s 2 2p 3 . Графическая формула:
Прочность связей в молекуле определяется количеством общих электронных пар у ее атомов. Двойная связь прочнее одинарной, тройная — прочнее двойной.
С увеличением количества связей между атомами сокращается расстояние между ядрами атомов, которое называют длиной связи, и увеличивается количество энергии, необходимое для разрыва связи, которое называется энергией связи. Например, в молекуле фтора связь одинарная, ее длина составляет 1,42 нм (1 нм = 10 –9 м), а в молекуле азота связь тройная, ее длина — 0,11 нм. Энергия связи в молекуле азота в 7 раз превышает энергию связи в молекуле фтора.

При взаимодействии атома водорода с атомом хлора оба атома будут стремиться завершить свои внешние энергетические уровни: водород — 1 s-уровень и хлор — 3р-уровень. В результате их сближения происходит перекрывание 1 s-орбитали атома водорода и 3р-орбитали атома хлора, а из соответствующих неспаренных электронов формируется общая электронная пара:

В молекулах Н2 и HCl область перекрывания орбиталей атомов водорода расположена в одной плоскости — на прямой, соединяющей центры атомных ядер. Такая связь называется σ-связью (сигма-связью):
Однако если в молекуле формируется двойная связь (с участием двух электронных орбиталей), то одна связь будет σ-связью, а вторая будет образована между орбиталями, расположенными параллельно друг другу. Параллельные орбитали перекроются с образованием двух общих участков, расположенных сверху и снизу от линии, соединяющей центры атомов.
При образовании ковалентной связи меду атомами с одинаковой электроотрицательностью (Н2, F2, O2, N2) общая электронная пара будет располагаться на одинаковом расстоянии от атомных ядер. При этом общие электронные пары принадлежат в равной степени обоим атомам одновременно, и ни на одном из атомов не будет избыточного отрицательного заряда, который несут на себе электроны. Такой вид ковалентной связи называется неполярной.
■ Ковалентная неполярная связь — вид химической связи, образующийся между атомами с одинаковой электроотрицательностью.

В случае, когда электроотрицательности элементов, вступающих во взаимодействие, не равны, но близки по значению, общая электронная пара смещается в сторону элемента с большей электроотрицательностью. При этом на нем образуется частичный отрицательный заряд (за счет отрицательно заряженных электронов):
В результате на атомах соединения образуются частичные заряды Н +0,18 и Cl –0,18 ; а в молекуле возникают два полюса — положительный и отрицательный. Такую ковалентную связь называют полярной.
■ Ковалентная полярная связь — вид ковалентной связи, образующейся при взаимодействии атомов, электроотрицательность которых отличается незначительно.
Образовавшийся частичный заряд на атомах в молекуле обозначают греческой буквой 8 (дельта), а направление смещения электронной пары — стрелкой:Ионная химическая связь
В случае химического взаимодействия между атомами, электроотрицательность которых резко отличается (например, между металлами и неметаллами), происходит почти полное смещение электронных облаков к атому с большей электроотрицательностью. При этом, поскольку заряд ядра атома имеет положительное значение, атом, который почти полностью отдал свои валентные электроны, превращается в положительно заряженную частицу — положительный ион, или катион. Атом, получивший электроны, превращается в отрицательно заряженную частицу — отрицательный ион, или анион:Ион — это одноатомная или многоатомная отрицательно либо положительно заряженная частица, в которую превращается атом в результате потери или присоединения электронов.
Между разноименно заряженными ионами при их сближении возникают силы электростатического притяжения — положительно и отрицательно заряженные ионы сближаются, образуя молекулу вещества.
■ Ионная химическая связь — это связь, образующаяся между ионами за счет сил электростатического притяжения.
Процесс присоединения электронов в ходе химических взаимодействий атомами с большей электроотрицательностью называется восстановлением, а процесс отдачи электронов атомами с меньшей электроотрицательностью — окислением.

Схему образования ионной связи между атомами натрия и хлора можно представить следующим образом:
Ионная химическая связь присутствует в оксидах, гидроксидах и гидридах щелочных и щелочноземельных металлов, в солях, а также в соединениях металлов с галогенами.
Ионы могут быть как простыми (одноатомными): Cl – , Н + , Na + , так и сложными (многоатомными): NH4 – . Заряд иона принято записывать вверху после знака химического элемента. Вначале записывается величина заряда, а затем его знак.
Между атомами металлов возникает особый вид химической связи, которая называется металлической. Образование этой связи обусловлено тремя особенностями строения атомов металлов:
- на внешнем энергетическом уровне присутствуют 1—3 электрона (исключения: атомы олова и свинца (4 электрона), атомы сурьмы и висмута (5 электронов), атом полония (6 электронов));
- атом имеет сравнительно большой радиус;
- атом имеет большое количество свободных орбиталей (например, у Na один валентный электрон располагается на 3-м энергетическом уровне, который имеет десять орбиталей (одну s-, три р- и пять d-орбиталей).
При сближении атомов металлов происходит перекрытие их свободных орбиталей, и валентные электроны получают возможность перемещаться на близкие по значениям энергии орбитали соседних атомов. Атом, теряющий электрон, превращается в ион. Таким образом, в металле формируется совокупность электронов, свободно перемещающихся между ионами. Притягиваясь к положительным ионам металла, электроны восстанавливают их, а затем снова отрываются, переходя к другим ионам. Такой процесс превращения атомов в ионы и обратно происходит в металлах непрерывно. Частицы, из которых состоят металлы, называют атом-ионами.
■ Металлическая связь — это связь, образующаяся между атом-ионами в металлах и сплавах посредством постоянного перемещения между ними валентных электронов: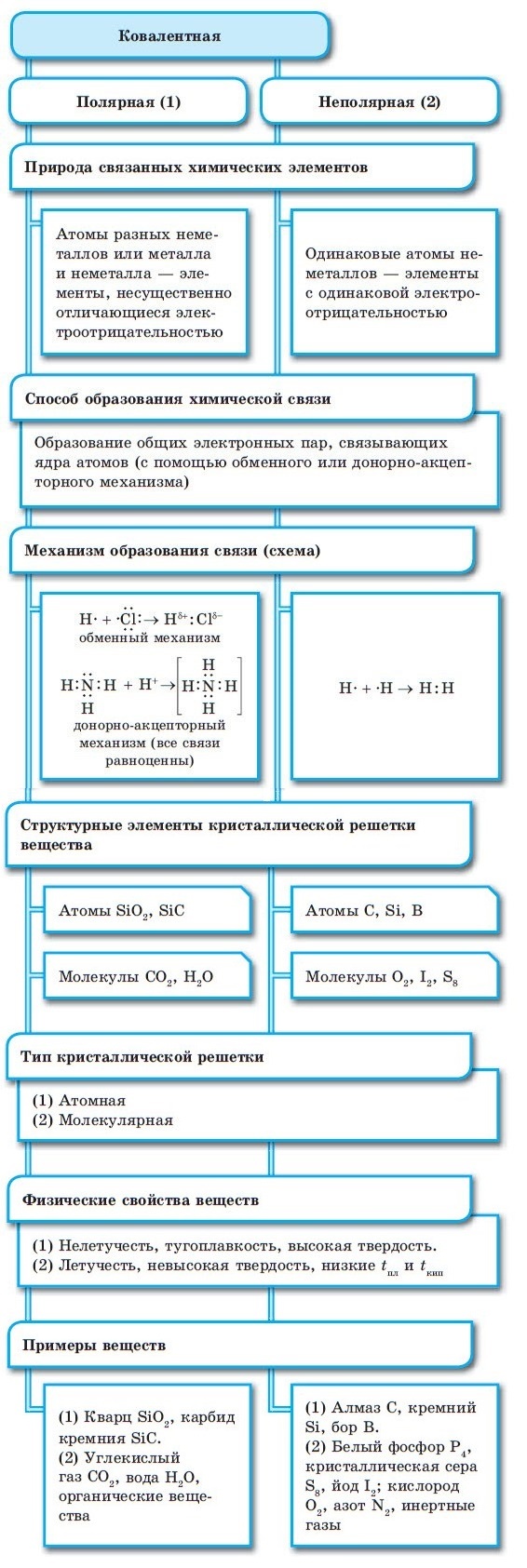

Конспект урока «Химическая связь: ковалентная, ионная, металлическая».
Читайте также:
