Химическое соединение окиси железа с окислами других металлов
Обновлено: 04.05.2024
Окси́ды желе́за — соединения железа с кислородом.
Известно 3 наиболее распространённых оксида железа:
- Fe3O4, Магнетит — распространённый минерал железа,
- FeO — вюстит (см. ниже)
- Fe2O3 — гематит (см. ниже)
Оксид железа(II)
Оксид железа FeO — чёрные кристаллы, нерастворимые в воде. Температура плавления 1420 °C
Хорошо растворимы в кислотах:
Оксид железа получают при восстановлении оксида железа (III) при +500 °C оксидом углерода(II):
Оксид железа(II) обладает основными свойствами.
Оксид железа(III)
Оксид железа Fe2O3 — красно-бурый порошок. Температура плавления 1565 °C.
Оксид железа(III) обладает слабо выраженными амфотерными свойствами:
Применение
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Окись железа" в других словарях:
ОКИСЬ ЖЕЛЕЗА — ОКИСЬ ЖЕЛЕЗА, соединение, в котором железо обладает большей ВАЛЕНТНОСТЬЮ (как правило, три), чем в ЖЕЛЕЗИСТЫХ соединениях … Научно-технический энциклопедический словарь
окись железа(III) — полуторная окись железа … Cловарь химических синонимов I
окись железа(II) — закись железа … Cловарь химических синонимов I
полуторная окись железа — окись железа(III) … Cловарь химических синонимов I
красная окись железа — geležies(III) oksidas statusas T sritis chemija formulė Fe₂O₃ atitikmenys: angl. colcothar; ferric oxide; iron minium; iron sesquioxide; ironic oxide; iron(III) oxide; Prussian red; red iron oxide; red ocher, US; red ochre, GB; Spanish oxide rus … Chemijos terminų aiškinamasis žodynas
черная окись железа — Краска под названием «Черный марс». Представляет собой окись железа, является минеральным черным пигментом. В отличие от всех черных углеродистых красок (сажи, слоновой кости и др.) хорошо высыхает в масляной живописи, но уступает по глубине… … Словарь иконописца
черная окись железа — geležies juodasis statusas T sritis chemija apibrėžtis Pigmentas. formulė FeO·Fe₂O₃ atitikmenys: angl. black iron oxide; black rouge rus. черная окись железа … Chemijos terminų aiškinamasis žodynas
коричневая окись железа — geležies rudasis statusas T sritis chemija apibrėžtis Fe₂O₃, kuriame yra 6–14% FeO, pigmentas. atitikmenys: angl. brown iron oxide rus. коричневая окись железа … Chemijos terminų aiškinamasis žodynas
железа окись — geležies(III) oksidas statusas T sritis chemija formulė Fe₂O₃ atitikmenys: angl. colcothar; ferric oxide; iron minium; iron sesquioxide; ironic oxide; iron(III) oxide; Prussian red; red iron oxide; red ocher, US; red ochre, GB; Spanish oxide rus … Chemijos terminų aiškinamasis žodynas
железа сесквиоксид — geležies(III) oksidas statusas T sritis chemija formulė Fe₂O₃ atitikmenys: angl. colcothar; ferric oxide; iron minium; iron sesquioxide; ironic oxide; iron(III) oxide; Prussian red; red iron oxide; red ocher, US; red ochre, GB; Spanish oxide rus … Chemijos terminų aiškinamasis žodynas
Окись железа
ЖЕЛЕЗА ОКСИДЫ
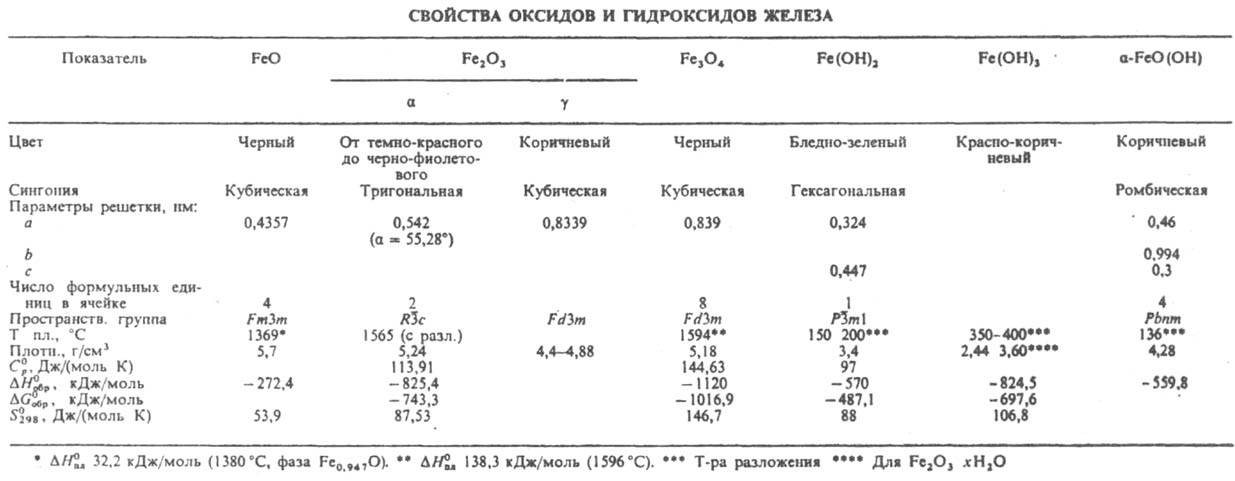
ЖЕЛЕЗА ОКСИДЫ Оксид FeO (в технике - вюстит). В кристаллич. решетке вюстита имеются вакантные узлы, и его состав отвечает ф-ле Fe x O, где х= 0,89-0,95; ур-ние температурной зависимости давления разложения: lg p(O 2 , в мм рт. ст.) = - 26730/T+ 6,43 (T > 1813 К); см. также табл. В воде практически не раств., хорошо раств. в к-тах, р-рах щелочей. Легко окисляется; пирофорeн. После прокаливания хим. активность и пирофорность FeO снижаются. В природе - чрезвычайно редкий минерал иоцит. Получают восстановлением Fe 2 O 3 водородом либо СО или при прокаливании в атмосфере N 2 2FeC 2 O 4 .3H 2 O. Сесквиоксид Fe 2 O 3 существует в трех полиморфных модификациях: наиб. устойчивая а (минерал гематит), g (маггемит, оксимагнетит) и d (с тригональной кристаллич. решеткой); т-ры перехода a : g 677°С, g : d 777°С; DH 0 перехода a : g 0,67 кДж/моль. Для модификации a-Fe 2 O 3 ур-ние температурной зависимости давления разложения: lg p(O 2 , в мм рт. ст.) = - 10291/T+ 5,751gT - 1,09.10 - 3 Т -0,75.10 5 Т - 2 - 12,33; раств. в соляной и серной к-тах, слабо - в HNO 3 ; парамагнетик, точка Нееля 953 К. Модификации g- и d-Fe 2 O 3 ферримагнитны; g-Fе 2 О 3 образуется при низкотемпературном окислении Fe 3 O 4 и Fe, d-Fe 2 O 3 м. б. получен при гидролизе и окислении р-ров солей Fe(II). Оксид Fe(II,III) - соед. ф-лы Fe 3 O 4 , или FeO.Fe 2 O 3 , Fe II (Fe III O 2 ) 2 (минерал магнетит), при нагр. разлагается; при 627 °С a-форма переходит в b; ур-ние температурной зависимости давления разложения: lgp(O 2 , в мм рт. ст.) = = - 33265/Т+ 13,37 (Т > 843 К); ферримагнетик, точка Кюри 900 К; отличается высокой электрич. проводимостью. Раств. в к-тах с образованием солей Fe(II) и Fe(III), прокаленный при 1200-1300 °С прир. магнетит практически не раств. в к-тах и их смесях. При нагр. на воздухе окисляется до Fe 2 O 3 . Получают действием водяного пара на раскаленное железо, восстановлением Fe 2 O 3 , окислением FeO. Ж. о. соответствует ряд гидроксидов. Гидроксид Fe(OH) 2 образуется при действии щелочи на водные р-ры солей Fe(II); быстро окисляется до FeO(OH). Р-римость в воде 0,00015 г в 100 г (18°С), раств. в к-тах, р-рах щелочей с образованием гидроксоферратов(II), напр. Na 2 [Fe(OH) 4 ], и р-рах NH 4 Cl. Гидроксиды Fe(III) образуют в природе ряд бурых железняков: гидрогематит Fe 2 O 3 .0,1H 2 O (твердый р-р воды в гематите), турьит 2Fe 2 O 3 .Н 2 О (тонкая мех. смесь гётита и гидрогематита), гётит a-FeO(OH), или Fe 2 O 3 .H 2 O, лепидокрокит g-FeO(OH), гидрогётит 3Fe 2 O 3 .4H 2 O, лимонит 2Fe 2 O 3 .3H 2 O, ксантосидерит Fe 2 O 3 .2H 2 O и лимнит Fe 2 O 3 .3H 2 O (твердые р-ры воды в гётите).
Лимнит совпадает по составу с искусств. гидрогелем Fe(OH) 3 , получаемым осаждением щелочью из р-ров солей Fe(III). При прокаливании гидроксиды Fe превращаются в a-Fe 2 O 3 . Гидроксид Fe(OH) 3 - очень слабое основание; амфотерен, при оглавлении со щелочами или основными оксидами образуют соли не выделенной в своб. состоянии железистой к-ты НFеО 2 - ферраты(Ш), или ферриты, напр. NaFeO 2 . При окислении Fe(OH) 3 в щелочной среде сильными окислителями образуются соли не существующей железной к-ты H 2 FeO 4 (триоксид FeO 3 также неизвестен) - ферраты(VI), напр. K 2 FeO 4 , - красно-фиолетовые кристаллы; при 120-200 °С разлагаются на Fe 2 O 3 , M 2 O и О 2 ; более сильные окислители, чем КМnО 4 . Прир. оксиды и гидроксиды Fe - сырье в произ-ве Fe, природные и синтетические - минер. пигменты (см. Железная слюдка, Железооксидные пигменты, Железный сурик, Мумия, Охры, Умбра); FeO - промежут. продукт в произ-ве Fe и ферритов, компонент керамики и термостойких эмалей; a-Fe 2 O 3 - компонент футеровочной керамики, цемента, термита, поглотит. массы для очистки газов, полирующего материала (крокуса), используют для получения ферритов; g-Fe 2 O 3 - рабочий слой магн. лент; Fe 3 O 4 - материал для электродов при электролизе хлоридов щелочных металлов, компонент активной массы щелочных аккумуляторов, цветного цемента, футеровочной керамики, термита; Fe(OH) 2 -промежут. продукт при получении Ж. о. и активной массы железоникелевых аккумуляторов; Fe(OH) 3 - компонент поглотительной массы для очистки газов, катализатор в орг. синтезе. Лит.: см. при ст. Железо. Е. Ф. Вeгман.
Химическая энциклопедия. — М.: Советская энциклопедия . Под ред. И. Л. Кнунянца . 1988 .
Смотреть что такое "ЖЕЛЕЗА ОКСИДЫ" в других словарях:
Железа оксиды — Оксиды железа соединения железа с кислородом. Известно 3 наиболее распространённых оксида железа: FeO·Fe2O3 (брутто формула Fe3O4), магнетит распространённый минерал железа, FeO вюстит (см. ниже) Fe2O3 гематит (см. ниже) Оксид железа(II) Оксид… … Википедия
ЖЕЛЕЗА ОКСИДЫ — ЖЕЛЕЗА ОКСИДЫ: FeO Fe2O3 и Fe3O4. Природные оксиды железа (гематит и магнетит) сырье для получения железа. Применяются в производстве магнитных материалов, в качестве пигментов, компонентов футеровочной керамики … Большой Энциклопедический словарь
ЖЕЛЕЗА ОКСИДЫ — ЖЕЛЕЗА ОКСИДЫ: FeO, Fe2O3 и Fe3O4. Природные оксиды железа (гематит и магнетит) сырье для получения железа. Применяются в производстве магнитных материалов, в качестве пигментов, компонентов футеровочной керамики … Энциклопедический словарь
ЖЕЛЕЗА ОКСИДЫ — не растворимые в воде соединения FeO, Fe203 и их смесь Fe304 (в природе минерал магнетит), которые применяют для производства чугуна, стали, ферритов и др … Большая политехническая энциклопедия
ЖЕЛЕЗА ОКСИДЫ — не растворимые в воде соединения железа: чёрный FeO (устар. закись железа), tnл 1368 °С; чёрный Fе2О3 (устар. закись окись железа, в природе минерал магнетит), tnл 1538 °С; жёлтый, коричневый или тёмно красный Fe3O4 (в природе минерал гематит или … Большой энциклопедический политехнический словарь
ЖЕЛЕЗА ОКСИДЫ — FeO, Fe2O3 и Fe3O4. Природные Ж. о. (гематит и магнетит) сырьё для получения железа. Применяются в произ ве маги, материалов, в качестве пигментов, компонентов футеровочиой керамики … Естествознание. Энциклопедический словарь
ЖЕЛЕЗА — ОКСИДЫ: FeO (черный, tпл 1369шC); Fe2O3 (от темно красного до черно фиолетового или коричневого цвета, tпл 1565шC; минерал гематит и др.); Fe3O4 (черный, tпл 1594шC; минерал магнетит). Природные железа оксиды сырье в производстве железа,… … Современная энциклопедия
ЖЕЛЕЗА ГИДРОКСИДЫ — см. Железа оксиды … Химическая энциклопедия
ОКСИДЫ ЖЕЛЕЗА — ОКСИДЫ ЖЕЛЕЗА, одно из трех соединений, существующих в трех состояниях: окись железа (II) (закись железа, FeO); окись железа (III) (окись железа, Fe2O3), которая встречается в природе как ГЕМАТИТ; и закисно окисное железо (Fе3О4), которое… … Научно-технический энциклопедический словарь
ФЕРРИТЫ
(от лат. ferrum — железо), в прямом смысле — хим. соединения окиси железа Fe2O3 с окислами др. металлов; в более широком понимании — сложные окислы, содержащие железо и др. элементы. Большинство Ф. являются ферримагнетиками и сочетают ферромагнитные и полупроводниковые или диэлектрич. свойства, благодаря чему они получили широкое применение как магнитные материалы в радиотехнике, радиоэлектронике, вычислит. технике.
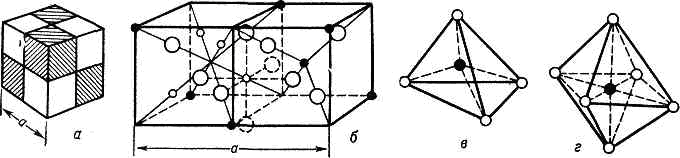
Рис. 1. Крист. структура ферритов-шпинелей: а — схематич. изображение элементарной ячейки шпинельной структуры (её удобно делить на 8 равных частей — октантов); б — расположение ионов в смежных октантах ячейки: белые кружки — ионы О2- образующие остов, чёрные — ионы металла в октаэдрич. и тетраэдрич. промежутках; в — ион металла в тетраэдрич. промежутке; г — ион металла в октаэдрич. промежутке.
В состав Ф. входят анионы кислорода О2-, образующие остов их кристаллич. решётки; в промежутках между ионами кислорода располагаются катионы Fe3+ , имеющие меньший радиус, чем анионы O2-, и катионы Меk+ металлов, к-рые могут иметь разл. ионные радиусы и разные валентности k. В результате косвенного обменного взаимодействия катионов Fe3+ и Меk+ в Ф. возникает ферримагнитное упорядочение с высокими значениями намагниченности и точек Кюри. Различают Ф.-шпинели, Ф.-гранаты, ортоферриты и гексаферриты. Ферриты-шпинели имеют структуру минерала шпинели с общей ф-лой MeOFe2O3, где Me— Ni2+ , Co2+ ,Fe2+ , Mn2+, Mg2+ , Li1+, Cu2+ . Элементарная ячейка Ф.-шпинели представляет собой куб, образуемый 8 молекулами MeOFe2O3 и состоящий из 32 анионов O2-, между к-рыми имеются 64 тетраэдрич. (А) и 32 октаэдрич. (В) позиции, частично заселённые катионами Fe3+ и Ме2+ (рис. 1). В зависимости от того, какие ионы и в каком порядке занимают позиции А и В, различают нормальные шпинели и обращённые шпинели. В обращённых шпинелях половина ионов Fe3+ находится в тетраэдрич. позициях, а в октаэдрич. позициях — 2-я половина ионов Fe3+ и ионы Ме2+ . При этом намагниченность (магн. момент) MA октаэдрич. подрешётки больше тетраэдрической МB, что приводит к возникновению ферримагнетизма.
Ферриты-гранаты элементов R3+ (Sm3+, Eu3+ , Gd3+ , Tb3+ Dy3+, Ho3+ , Er3+ , Tm3+, Yb3+, Lu3+ и Y3+ ) имеют кубич. структуру граната с общей ф-лой R3Fe5Ol2. Элементарная ячейка Ф.-гранатов содержит 8 молекул R3Fe5Ol2; в неё входят 96 ионов О2-, 24 иона R3+ и 40 ионов Fe3+ . В Ф.-гранатах имеется три типа позиций, в к-рых размещаются катионы: большая часть ионов Fe3+ занимает тетраэдрические (d), меньшая часть ионов Fe3+ — октаэдрические (а) и ионы R3+ — додекаэдрич. позиции (с). Соотношение величин и направлений намагниченностей катионов, занимающих позиции d, а, с, показано на рис. 2 .
Рис. 2. Схематич. изображение величин и направлений векторов намагниченности катионов, образующих магн. подрешётки d, а и с в ферритах-гранатах.
Ортоферритами наз. группу Ф. с орторомбической крист. структурой. Их образуют редкоземельные элементы по общей ф-ле RFeO3. Ортоферриты имеют структуру минерала перовскита. При не очень низких темп-рах в ортоферритах упорядочиваются только магн. моменты ионов железа. Ортоферриты явл. антиферромагнетиками и обладают слабым ферромагнетизмом. Только при очень низких темп-рах (порядка неск. К и ниже) в ортоферритах упорядочиваются магн. моменты редкоземельных ионов, и они становятся ферримагнетиками.
Ферриты гексагональной структуры (гексаферриты) представляют собой сложные окисные соединения, напр. PbFe12O19, Ba2Zn2Fe12O22 и др. Ячейка гексаферритов построена ив шпинельных блоков, разделённых блоками гексагональной структуры, содержащей ионы Pb2+, Ва2+ или Sr2+ .
Нек-рые гексаферриты обладают высокой коэрцитивной силой и применяются для изготовления пост. магнитов. Большинство Ф. со структурой шпинели, феррит-гранат иттрия и нек-рые гексаферриты используются как магнитно-мягкие материалы. Синтез поликрист. Ф. осуществляется по технологии изготовления керамики. Из смеси исходных окислов прессуют изделия нужной формы, к-рые подвергают затем спеканию при темп-рах от 900 до 1500°С на воздухе или в спец. газовых средах. Монокрист. Ф. выращиваются методами Чохральского, Вернейля и др. (см. МОНОКРИСТАЛЛ, КРИСТАЛЛИЗАЦИЯ). Ф. нашли широкое применение в радиотехнике — ферритовые антенны, сердечники радиочастотных контуров; в СВЧ-технике — вентили и циркуляторы, использующие принцип невзаимного распространения эл.-магн. волны в волноводе, заполненном ферродиэлектриком; в вычислительной технике — элементы оперативной памяти; в магнитофонах и видеомагнитофонах — покрытие плёнок и дисков. Ф. применяют также для изготовления небольших постоянных магнитов.
Физический энциклопедический словарь. — М.: Советская энциклопедия . Главный редактор А. М. Прохоров . 1983 .
(лат. ferrum- железо) - общее название сложных окислов, содержащих железо и др. элементы. Большинство Ф. является ферримагнетиками (см. также Антиферромагнетик, Слабый ферромагнетизм )и проявляет полупроводниковые или диэлектрич. свойства (см. Магнитные диэлектрики).
В состав Ф. входят анионы кислорода О 2- , образующие остов их кристаллич. решётки, в промежутках между анионами О 2- располагаются катионы Fe 3+ и катионы переходных металлов. Наиб. хорошо изучены свойства Ф.-шпинелей, Ф.-гранатов, ортоферритов и гексаферри-тов, различающихся по своей кристаллографич. и магнитной атомной структуре.
К Ф. также относятся Ф.- г а у с м а н и т ы (Мn 2 О 3 ), л ит и е в ы е Ф. со структурой NaCl, Ф. Са и Ва с орторомбич. структурой.
Ф.-ш п и н е л и обладают кристаллич. структурой шпинели благородной MgAl 2 O 4 и имеют общую ф-лу MeOFe 2 O 3 , где Me - двухвалентный металл (Ni, Co, Fe, Мn и др.). К ним относятся также многочисл. смешанные Ф. состава
Идеальную кристаллич. решётку шпинели можно рассматривать как одну из кубич. плотных упаковок (рис. 1).
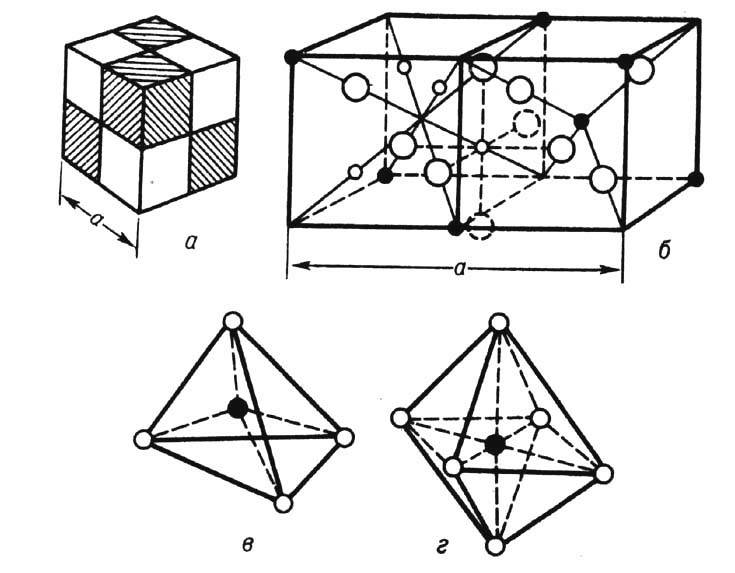
Рис. 1. Кристаллическая структура ферритов-шпинелей: а - схематическое изображение элементарной ячейки шпинельной структуры, разделённой на 8 октантов; б- расположение ионов в смежных октантах ячейки; белые кружки - анионы О 2- , образующие остов решётки, чёр ные - катионы в октаэдрических и тетраэдрических по зициях; в- катион в тетраэдрическом окружении; г- ка тион в октаэдрическом окружении.
Элементарная ячейка представляет собой куб, образуемый 8 молекулами, и состоит из 32 анионов. Вакантные узлы, занимаемые катионами, по структуре ближайшего окружения подразделяются на 64 тетраэдрич. ( А )и 32 октаэдрич. ( В )позиции. Различают н о р м а л ь н ы е, о б р а щ ё н н ы е и с м е ш а н н ы е Ф.-шпинели. В нормальных шпинелях (ZnFe 2 O 4 , CdFe 2 O 4 ) узлы В заняты ионами трёхвалентного металла. В обращённых шпинелях все катионы Me находятся в В -местах, а трёхвалентные (Fe) распределены поровну между А- и B -местами. В смешанных Ф. порядок распределения катионов произволен.
Ф. со структурой нормальной шпинели оказываются антиферромагнитными, а со структурой обращённой шпинели- ферримагнитными. Обменные взаимодействия между катионами осуществляются косвенным образом (см. Косвенное обменное взаимодействие )и, как правило, являются отрицательными. Наиб. сильными обычно являются обменные взаимодействия между катионами, находящимися в позициях с разл. кристаллографич. окружением.
В частично или полностью обращённых шпинелях катионы, находящиеся в узлах А и B, образуют две магнитные подрешётки (строго говоря, ионы Me и Fe 3+ в узлах А также образуют две подрешётки, магн. моменты к-рых ориентированы параллельно друг другу); намагниченности подрешёток А и В направлены в противоположные стороны, поэтому результирующая намагниченность обращённых шпинелей определяется магн. моментами двухвалентных ионов.
Ф.- г р а н а т ы имеют общую хим. ф-лу Me 3 Fe 5 O 12 , где Me-трёхвалентный 4f -ион либо Y, Bi, Са и др. Кристал-лич. структура Ф.-гранатов очень сложна и изоморфна структуре природного минерала граната CaAl 3 (SiO) 4 . В элементарную ячейку, представляющую собой куб, входят 8 формульных единиц. По структуре ближайшего окружения наряду с тетраэдрич. (d )и октаэдрич. ( а )местами существуют додекаэдрич. (с) места, занимаемые Ме-ионами и окружённые 8 анионами О 2- . Из 40 ионов Fe 3+ , находящихся в элемент. ячейке, 24 иона занимают d -места и 16 ионов - а -места. Ниже Кюри точки, к-рая для всех Ф.-гранатов лежит в пределах d- и 12 f -магн. подрешёток. Как и в Ф.-шпинелях, наиб. сильным является косвенное обменное взаимодействие между ионами Fe 3 + в а- и d -местах, в значит, степени определяющее значение точки Кюри. В полях до 10 2 Тл все железные подрешётки можно рассматривать как одну с результирующим магн. моментом, равным разности магн. моментов d -подрешёток. Магн. моменты f -подрешёток ориентированы антипараллельно результирующему магн. моменту d -подрешёток и образуют зонтичную структуру (кроме Ф.-граната Gd) (см. рис. 4 к ст. Ферримагнетизм). Все Ф.-гранаты, содержащие тяжёлые редкоземельные ионы, имеют точку магн. компенсации, по достижении к-рой результирующая намагниченность равна нулю. В них наблюдаются спонтанные и индуцированные внеш. магн. полем спин-переориентационные переходы (см. Магнитный фазовый переход).
О р т о ф е р р и т ы обладают кристаллич. структурой пе-ровскита СаТiO 3 . Среди большого ряда ортоферритов выделяются редкоземельные ортоферриты, ортохромиты и т. 3 , где R - Tb, Dy и т. 12 O 19 , Ba 2 Me 2 Fe 12 O 22 , BaMe 2 Fe 16 O 27 и др., где ионы Ва могут замещаться ионами Са, Rb, Sr. Элементарная ячейка гексаферритов состоит из шпинельных блоков, не содержащих Ва, разделённых блоками гексагональной структуры, имеющими эти ионы. В гексаферритах наблюдаются разл. типы магн. атомной структуры: существуют одноосные и легкоплоскостные гексаферриты, а также гексаферриты, обладающие конич. поверхностью лёгкого намагничивания.
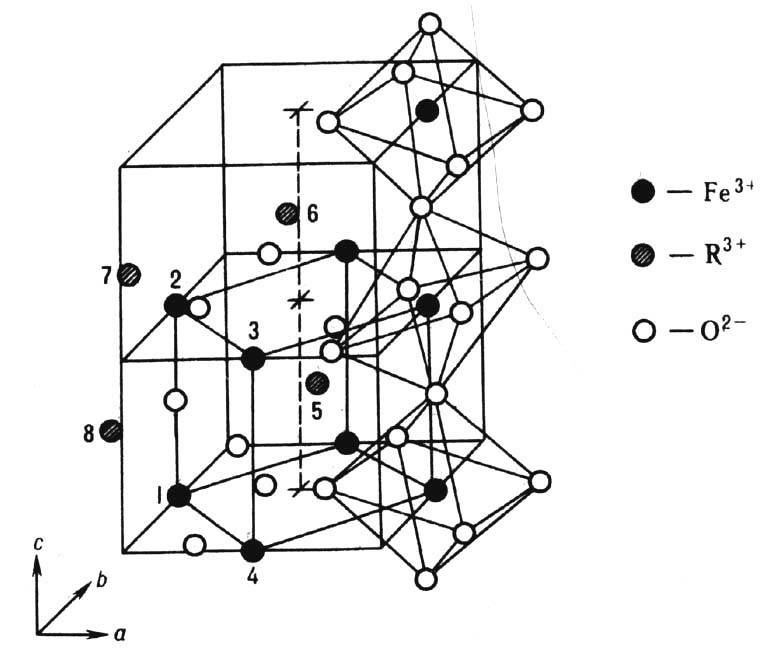
Рис. 2. Элементарная ячейка редкоземельных орто ферритов: белые кружки-анионы О 2- , чёрные - катионы железа, заштрихованные-катионы редко земельных металлов. Показана структура бли жайшего окружения катионов железа.
Ф. в качестве магнитных материалов широко применяются в технике, особенно в радиотехнике и радиоэлектронике - в антеннах, сердечниках радиочастотных контуров, в СВЧ-технике (вентили и циркуляторы). Большинство Ф.-шпинелей, Ф.-гранат иттрия (железо-иттриевый гранат, ЖИГ) и нек-рые гексаферриты используются как магнитно-мягкие материалы. Отд. гексаферриты обладают значит. коэрцитивной силой и применяются для изготовления пост. магнитов.
Многие Ф.-гранаты обладают рядом уникальных свойств; напр., в ЖИГ ширина линии магнитного резонанса составляет величину порядка 10 -2 Тл, так что добротность резонатора может достигать неск. тысяч. Эпитакси-альные плёнки Ф.-гранатов являются одним из лучших материалов для устройств с цилиндрическими магнитными доменами; нек-рые из них прозрачны и имеют большой угол фарадеевского вращения (см. Магнитооптика). При низких темп-pax Ф.-гранаты обладают большой магнитной анизотропией, обусловленной редкоземельными ионами, и значит. магнитострикцией; в них удаётся возбудить бегущие спиновые волны и наблюдать рассеяние света на спиновых волнах.
Лит.: Смит Я., Вейн Х., Ферриты, пер. с англ., М., 1962; Крупичка С, Физика ферритов и родственных им магнитных окислов, пер. с нем., т. 1, М., 1976; см. также лит. при ст. Антиферромагнетизм, Ферримагнетизм. А. К. Звездин, С. Н. Уточкин.
Физическая энциклопедия. В 5-ти томах. — М.: Советская энциклопедия . Главный редактор А. М. Прохоров . 1988 .
Читайте также:
